Method Article
דיסקציה של שחלות יתושים, מעי האמצע ובלוטות הרוק לצורך ניתוח מיקרוביום ברמת האיברים
In This Article
Summary
קהילות מיקרוביאליות ביתושים טומנות בחובן הבטחה גדולה לאסטרטגיות הדברה ביולוגית וקטורית. רוב הסימביונטים אינם ניתנים לטיפוח, ודורשים ניתוחים מטגנומיים. אנו מתארים שיטה לנתח נקבות יתושים ולהפריד בין השחלות, המעי התיכון ובלוטות הרוק למניעת זיהום צולב, להקל על מחקרי מיקרוביום ברמת האיברים, ולשפר את ההבנה של תפקידי המיקרואורגניזמים בביולוגיה של יתושים.
Abstract
הנטל העולמי של מחלות המועברות על ידי יתושים, כולל מלריה, דנגי, מערב הנילוס, זיקה, אוסוטו וקדחת צהובה, ממשיך לגדול, ומהווה איום משמעותי על בריאות הציבור. עם עליית העמידות לקוטלי חרקים והיעדר חיסונים יעילים, מתפתחות אסטרטגיות חדשות המתמקדות במיקרוביוטה של היתוש. אף על פי כן, רוב הסימביונטים נשארים עמידים לטיפוח. אפיון המגוון והתפקוד של גנומים חיידקיים בדגימות יתושים, אם כן, מסתמך על מטגנומיקה ואסטרטגיות הרכבה וקשירה עוקבות. ההשגה והניתוח של גנומים מורכבים מטא-גנום (MAGs) מאיברים מופרדים יכולים לספק מידע חשוב על התפקיד הספציפי של חיידקים הקשורים ליתושים בשחלות (איברי הרבייה), במרכז המעי (המפתח לעיכול מזון וחסינות), או בבלוטות הרוק (החיוניות להעברת מחלות המועברות על ידי וקטורים, שכן פתוגנים חייבים ליישב אותם כדי להיכנס לרוק ולהגיע לזרם הדם במהלך ארוחת דם). גנומים משוחזרים אלה יכולים לסלול את הדרך לפיתוח אסטרטגיות בקרה ביולוגית וקטוריות חדשות. לשם כך נדרש לבודד איברי יתושים תוך הימנעות מזיהום צולב ביניהם או עם מיקרואורגניזמים הנמצאים באיברי יתושים אחרים. במאמר זה אנו מתארים פרוטוקול דיסקציה ממוטב ונטול זיהומים לחקר מיקרוביום יתושים ברמת האיברים.
Introduction
יתושים מפיצים מגוון רחב של פתוגנים הגורמים למחלות ומהווים איום רציני על בריאות הציבור. בשל שכיחות מוגברת של עמידות לקוטלי חרקים בקרב אוכלוסיות יתושים ובהיעדר חיסונים יעילים נגד פתוגנים אלה, צצות שיטות הדברה ביולוגית חדשות המתמקדות במיקרוביום היתושים. בפרט, החיידק התוך-תאי וולבכיה, שיכול להפריע להעברת פתוגן ולתפעל את התרבות המארח, בולט 1,2,3. בנוסף, סימביוטים אחרים של יתושים הם מרכזיים להישרדות, התפתחות או מערכת החיסון של המארח שלהם, כמו גם בזיהום והעברה של פתוגנים, ומראים הבטחה גדולה לניצולם כדי להילחם במחלות המועברות על ידי וקטורים 4,5,6,7,8.
מיקרואורגניזמים הקשורים ליתושים משתרעים על פני כל תחומי החיים המיקרוביאליים (כולל חיידקים, איקריוטים ופטריות) המקיימים אינטראקציה אינטימית עם המארח שלהם, אך גם זה עם זה בתאי הגוף השונים 9,10. לכן, הבנה טובה יותר של המיקרוביוטה, השונות העונתית הפוטנציאלית שלה11, והמנגנונים שבאמצעותם חבריה מתקשרים ישירות ברקמות יתושים נפרדות יכולה לעזור לפתח שיטות הדברה ביולוגית ממוקדות חדשות או לשפר שיטות קיימות. עם זאת, רוב הסימביונטים נשארים עמידים לטיפוח, מה שהופך את האפיון שלהם לבלתי אפשרי.
הופעתן של שיטות ריצוף מהדור השני והשלישי, יחד עם גישות הרכבה וכריכה מתקדמות, אפשרו שחזור של גנומים מיקרוביאליים וגישה למגוון ולפוטנציאל התפקודי של מיקרובים שאינם ניתנים לטיפוח. כאן אנו מציגים שיטה לנתיחת השחלות, המעי התיכון ובלוטות הרוק של נקבות יתושים תוך מניעת זיהום צולב. פרוטוקול זה יכול להיות מלווה במיצוי DNA גנומי ולאחר מכן metabarcoding או ריצוף מטאגנומי של רובה ציד כדי לחקור את המגוון והתפקוד של מיקרוביוטה יתושים ברמת האיברים. אנו מספקים דוגמה לדיסקציה של יתושים ונתוני מיקרוביום עבור דגימות Culex spp. למרות שניתן להרחיב פרוטוקול זה לווקטורים מסוגים אחרים כגון אנופלס או Aedes.
Protocol
הערה: איור 1 מציג סכמה של השיטה המסכמת את השלבים השונים של הפרוטוקול.
1. הכנת החומר
- לפני תחילת הניסוי, הכינו תמיסת אקונומיקה עם 0.5% כלור פעיל (מומלץ על ידי ארגון הבריאות העולמי) לחיטוי הציוד ושולחן העבודה.
- ב 900 מ"ל של מים, להמיס שלוש טבליות מסיסות, כל אחד מכיל 1.5 גרם של כלור פעיל. המתינו 15 דקות עד שהטבליות יתמוססו לחלוטין, והתוצאה תהיה תמיסת אקונומיקה בשיעור 0.5%.
- הניחו את תמיסת האקונומיקה 0.5% בבקבוק תרסיס. לאחר מכן, רסס את התמיסה על כל ציוד הנתיחה, כולל שקופיות מיקרוסקופיות ושולחן עבודה.
הערה: יש להשאיר את הציוד ושולחן העבודה להתייבש למשך ~10 דקות לפני השימוש.
- כדי לשטוף את היתושים לפני כל נתיחה כדי למנוע זיהום של הדגימות עם חיידקים חיצוניים, להכין ארבעה צינורות 1.5 מ"ל מעוקרים חדשים: שניים המכילים 96% אתנול ושניים אחרים מכילים 1x PBS buffer (מלוחים חוצצים פוספט).
- הכינו את הצינורות לאחסון הדגימות לאחר נתיחת כל יתוש: ארבעה צינורות סטריליים בנפח 1.5 מ"ל, שכל אחד מהם מכיל 100 מיקרוליטר של חיץ שימור.
הערה: הכינו צינור אחד לבלוטות הרוק, צינור אחד לשחלות, צינור אחד למעי התיכון ואחד לפגר היתוש.
2. איסוף יתושים
- יש לאסוף ולשמור נקבות בוגרות בחיים (משדה או ממעבדה, 4-7 ימים) עד לעיקור פני השטח.
3. עיקור פני השטח של יתושים
הערה: נקו מלקחיים ומחטים והשתמשו בצינורות חדשים ומעוקרים בין כל איבר לאדם. אם אקונומיקה אינה זמינה, הקפידו לעקר היטב את המלקחיים והמחטים המנתחים בין הדיסקציה של כל אדם ואיבר כדי למנוע זיהום צולב של חומר ביולוגי. מכשירי הדיסקציה צריכים להיות יבשים, ללא שאריות אקונומיקה/אתנול, לפני השימוש הבא.
- כדי למנוע מנקבות לרוקן את תכולת המעיים שלהן כאשר הן נחשפות לאלכוהול, יש לקרר אותן על קרח או במקפיא בטמפרטורה של -20°C (למשך 4 דקות כדי שהרקמות והאיברים לא יקפאו).
- העבירו יתושים בודדים לתוך צינור מעוקר חדש של 1.5 מ"ל עם 1 מ"ל של 96% אתנול. מערבלים בעדינות (ידנית) במשך 30 שניות (מנערים היטב את היתוש בצינור כדי לנתק את הקשקשים והמזהמים החיידקיים הפוטנציאליים על פני השטח של החרקים). יש לשטוף פעמיים באמצעות צינורות המכילים אתנול.
- מעבירים את היתוש לתוך צינור 1.5 מ"ל מעוקר חדש עם 1 מ"ל של תמיסת PBS סטרילית 1x ומערבלים בעדינות (ידנית) במשך 30 שניות (כדי למנוע משקעים DNA עם אתנול). יש לשטוף פעמיים באמצעות צינורות המכילים 1x PBS סטרילי.
4. נתיחת יתושים
- הניחו מספר טיפות קטנות של PBS סטרילי 1x על המגלשה כדי להקל על מיקום היתוש ושטיפת איברים מנותחים.
הערה: טיפות PBS סטריליות צריכות להיות גדולות מספיק כדי להכיל את איברי היתושים. - קחו את היתוש המנקה והניחו אותו על טיפה סטרילית של PBS 1x במגלשת המיקרוסקופ.
- לנתח את בלוטות הרוק עם מלקחיים מעוקרים ומחט כמתואר להלן.
- החזיקו את בית החזה של היתוש בפינצטה כדי למנוע ממנו לזוז. לאחר מכן, הניחו מחט בצוואר, מתחת לראש, ומשכו בעדינות את ראשו של היתוש כדי להפריד אותו מבית החזה.
הערה: בלוטות הרוק ממוקמות בבית החזה העליון ומחוברות לראש על ידי צינור הרוק. במהלך הדיסקציה, חשוב מאוד לא לשבור צינור זה מכיוון שבלוטות הרוק לא יגיעו עם הראש כאשר אתה מושך אותו מבית החזה. לכן חשוב שיהיה יתוש טרי, לא קפוא. - כאשר הראש נפרד מבית החזה, שימו לב לשתי בלוטות הרוק המגיחות, שכל אחת מהן מורכבת משלוש אונות. חתכו את בלוטות הרוק בגובה צינור הרוק, שלפו אותן בעזרת מחט והכניסו אותן לטיפה חדשה של PBS סטרילי 1x כדי לשטוף אותה ולמנוע זיהומים בין איברים.
- שלפו את בלוטות הרוק באמצעות מחט והכניסו אותן לצינור מעוקר חדש המכיל 100 מיקרוליטר של חיץ שימור.
- החזיקו את בית החזה של היתוש בפינצטה כדי למנוע ממנו לזוז. לאחר מכן, הניחו מחט בצוואר, מתחת לראש, ומשכו בעדינות את ראשו של היתוש כדי להפריד אותו מבית החזה.
- לנתח את השחלות עם מלקחיים מעוקרים ומחט כדלקמן.
- הניחו את היתוש על גבו. באמצעות מלקחיים כדי להחזיק את היתוש על ידי בית החזה כדי למנוע תנועה במהלך דיסקציה, לנקב את קטע הבטן השלישי (החל מלמטה) עם מחט.
הערה: לחלופין, הסר את רגליו וכנפיו של היתוש כדי להקל על נתיחתו. - תוך כדי פירסינג בקטע הבטן השלישי, משכו מטה את הבטן כדי לפתוח אותה ולחשוף את האיברים הפנימיים. הסר את כל חתיכות שאריות השלד החיצוני של יתוש כדי להקל על שחרור האיברים.
הערה: איברים בבטן כגון המעיים, צינוריות מלפיגיות ושחלות גלויים. - שלפו את שתי השחלות במלקחיים מעוקרים והניחו אותן בטיפה חדשה של PBS סטרילי 1x על שקופית המיקרוסקופ כדי לשטוף אותן. תפוס את השחלות ומקם אותן בצינור 1.5 מ"ל עם 100 μL של חיץ שימור.
- הניחו את היתוש על גבו. באמצעות מלקחיים כדי להחזיק את היתוש על ידי בית החזה כדי למנוע תנועה במהלך דיסקציה, לנקב את קטע הבטן השלישי (החל מלמטה) עם מחט.
- כעת, כשהבטן פתוחה והאיברים חשופים, שלפו את המעי התיכון בעזרת מלקחיים ו/או מחט מעוקרים חדשים.
- להפריד את המעי האמצעי מן המעי הקדמי ואת המעי האחורי; לאחר מכן, להסיר את הצינוריות Malpighian מן midgut. תפוס את המעי התיכון באמצעות מחט סטרילית והניחו אותו על טיפה סטרילית חדשה 1x PBS כדי לשטוף אותו ולמנוע זיהומים בין איברים.
- מעבירים לטיפת PBS סטרילית חדשה 1x. פתח את המעי התיכון עם מלקחיים כדי לשחרר ולהעשיר חיידקים כמתואר בקובץ משלים 1. תפוס את המעי התיכון עם מלקחיים פיפטה כל PBS המכיל חיידקים לאחסן את כל החומר (נוזל ורקמה) בצינור מעוקר חדש 1.5 מ"ל עם 100 μL של חיץ שימור.
- הוסף שוב 5 μL של 1x PBS במקום שהיה בשימוש קודם לכן בשקופית המיקרוסקופ וישירות פיפטה חזרה PBS לאותה צינור 1.5 מ"ל כדי לאחזר חיידקים שאולי נדבקו לשקופית המיקרוסקופ.
- השתמש במלקחיים סטריליים כדי לתפוס את הפגר (הגוף שנותר) ואחסן אותו בצינור מעוקר חדש של 1.5 מ"ל עם 100 מיקרוליטר של חיץ שימור.
- אחסון החומר עד לעיבוד נוסף
- שפופרות תווית עם 'מין, איבר, תאריך, שם החוקר'.
- יש לאחסן שחלות מנותחות, מעי אמצע, בלוטות רוק ופגר בטמפרטורה של -20°C עד לעיבוד.
- עקוב בגיליון אלקטרוני אחר כל המטה-נתונים המשויכים עבור הדגימות, כולל מינים (או רמת סוג בלבד), תאריך איסוף, מדינה, מחוז, קו רוחב, קו אורך, שם האדם שביצע את הנתיחה, נקבה Gravid או לא, ארוחת דם או לא.
תוצאות
x'יתושים נתיחות
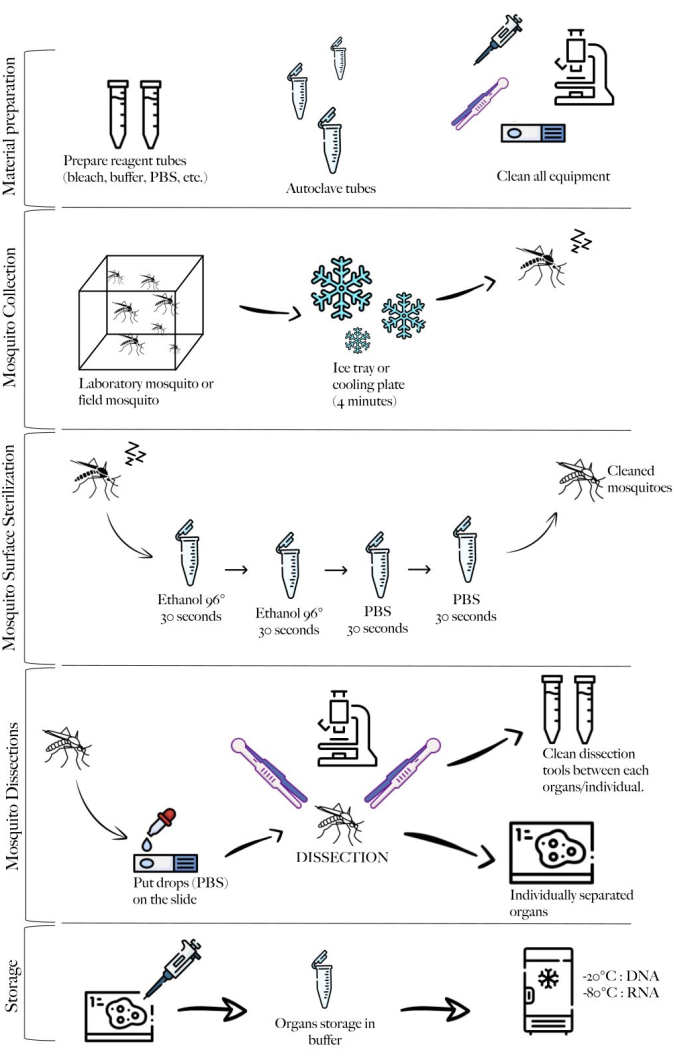
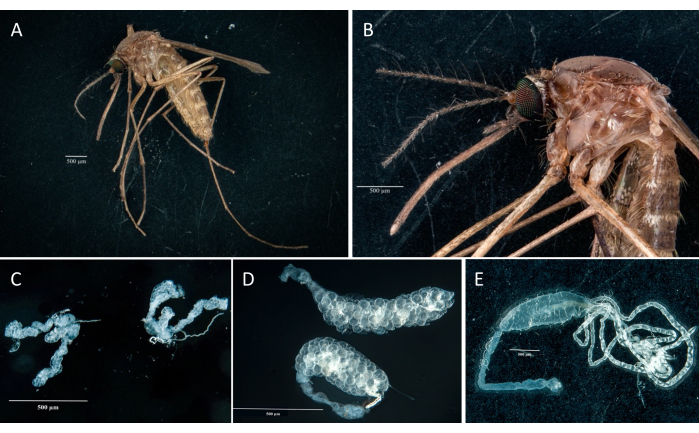
בהתאם לפרוטוקול, אספנו ובודדנו את השחלות, המעי האמצעי, בלוטות הרוק והפגר משתי דגימות Culex pipiens molestus (כולל נקבה גרבידית) ממושבת מעבדה. אישרנו נתיחות נקיות לאחר תצפית של איברים שלמים (כלומר, לא שבורים) ומבודדים היטב ללא שאריות פסולת מתחת למשקפת. כל הגוף, הראש ובית החזה, בלוטות הרוק המנותחות, השחלות ומרכז המעי של דגימת Culex pipiens molestus מוצגים באיור 2. כצפוי, בלוטות המעי האמצעי והרוק היו קטנות בסדר גודל משחלות היתושים. הביצים של דגימת קולקס גרבידית, יחד עם המעיים האמצעיים והצינוריות המלפיגיות שלה, מוצגות באיור 3. שימו לב, נתיחות מועדות יותר להיכשל כאשר החומר אינו טרי ורקמות צפויות להישבר (איור 4B,C). לכן אנו מציעים לנתח חומר מיד לאחר האיסוף (תוך פחות מ-12 שעות) כאשר הדבר אפשרי, מאחר שהרקמות עדיין אלסטיות (איור 4A). באופן דומה, ניתן לבצע דיסקציה של חומר קפוא אולם קיים סיכון גבוה הרבה יותר לכשל ולזיהום צולב בין איברים כתוצאה מרקמות שבירות (איור 4).
נתוני מיקרוביום
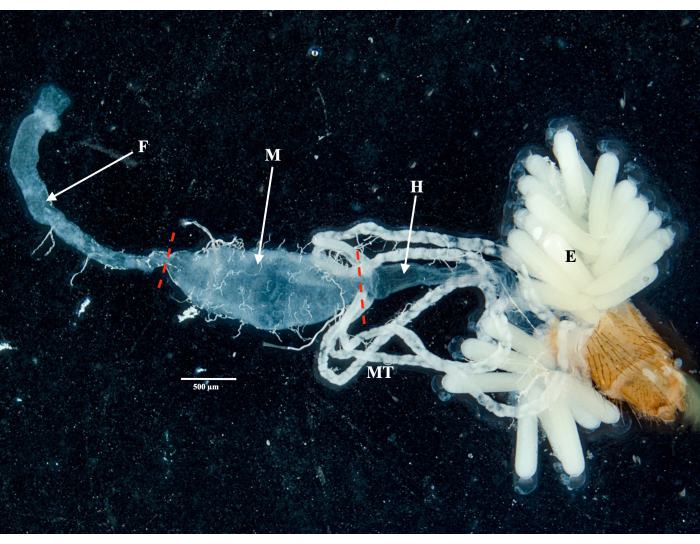
בנוסף, אספנו והפרדנו את המעיים האמצעיים והשחלות משלוש דגימות בודדות של Culex quinquefasciatus מנומאה, קלדוניה החדשה, לאחר אותו הליך. חילצנו דנ"א מכל איבר, הכנו דגימות לריצוף גנום שלם וביצענו ניתוח נתוני מיקרוביום כמפורט בקובץ משלים 1. ניתוח מגוון טקסונומי חיידקי על קריאות קצרות מסוננות באיכות לא מפורקת באמצעות PhyloFlash12 הראה טקסה דומיננטית מובהקת במעיים האמצעיים בהשוואה לשחלות (איור 5A). יש לציין כי קהילות חיידקי השחלות נשלטו על ידי וולבכיה, עם נוכחות נוספת של פילוטיפ Spirochaetaceae בשחלות של פרט 3, בעוד שקהילות המעי התיכון הציגו מגוון רחב יותר, כולל Gammaproteobacteria, Spirochaetaceae ו- Firmicutes. מאותם נתוני ריצוף שחזרנו ארבעה גנומים מורכבים מטא-גנום (MAGs) עם השלמה > 80% ויתירות <-5%, השייכים למחלקות ספירוכאטיה, אלפא וגמאפרוטאובקטריה (טבלה 1).
כצפוי, MAGs ששוחזרו כאן לא כיסו את המגוון הטקסונומי המלא שנחזה על ידי תוצאות PhyloFlash בשל החסרונות הספציפיים של שחזור גנום באמצעות קריאות קצרות מטגנומיות. הפצ"ר שהוקצה לוולבכיה (Ref. MAG 3 בטבלה 1) זוהה בכל השחלות ובשתיים מהמעיים האמצעיים, והיה בעל כיסוי גבוה יותר בשחלות (איור 5B). כמו כן, שחזרנו שני מאגים השייכים למשפחת Enterobacteriaceae , כולל הסוג Pantoea (Ref. MAG 1 ו-2 בטבלה 1), במעיים האמצעיים שהתקבלו מפרטים 2 ו-3 של Culex , שלא זוהו בשחלות התואמות (איור 5B). לבסוף, שחזרנו גם גנום חיידקי Spirochaetaceae אחד, Ref. MAG 4 (טבלה 1), שהוקצה לסוג BR149 שבודד בהצלחה מ-Culex pipiens midguts על ידי Graña-Miraglia ועמיתיו13. באופן מעניין, הפצ"ר הזה זוהה במעיים האמצעיים של אנשים 1 ו-3, כמו גם בשחלות של פרט 3 (איור 5B).
איור 1: סכמה של השיטה המסכמת את השלבים השונים. הכנת חומרים, איסוף יתושים, ניקוי יתושים, נתיחות יתושים ואחסון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 2: נקבת Culex pipiens molestus . (A) גוף שלם. (B) ראש ובית חזה. (C) בלוטות רוק מנותחות. (D) שחלות מנותחות. (E) מעיים מנותחים עם צינוריות מלפיגי. פסי קנה מידה = 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 3: בטן מנותחת של נקבת Culex pipiens molestus גרבידית. המעי הקדמי, המעי האמצעי, המעי האחורי, הצינוריות המלפיגיות והביצים של הדגימה מוצגים. מקפים אדומים מציינים היכן לחתוך כדי להפריד בין המעי הקדמי למעי האחורי. סרגל קנה מידה = 500 מיקרומטר. קיצורים: F = מעי קדמי; M = אמצע המעי; H = מעי אחורי; E = ביצים; MT = צינוריות מלפיגיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
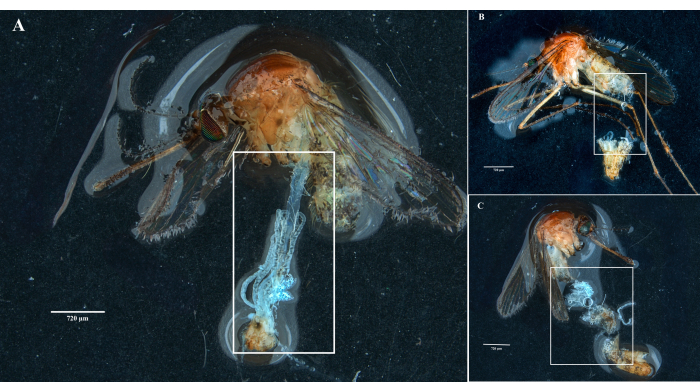
איור 4: נתיחת דגימות של יתושי קולקס טריים וקפואים. מלבנים לבנים ממחישים (A) רקמות יתושים עם איברים שלמים מדגימה שזה עתה נותחה ו-(B,C) חומר ביולוגי שבור מדגימות שהוקפאו לפני הנתיחה. פסי קנה מידה = 720 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
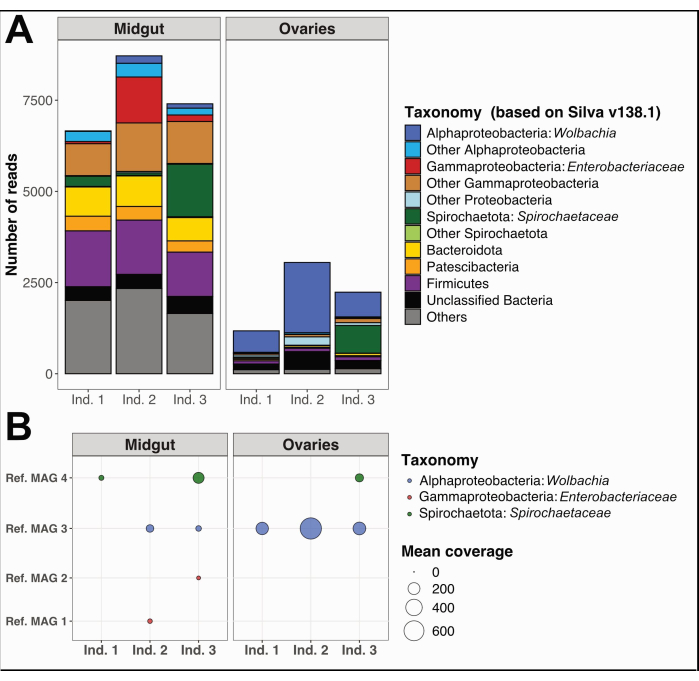
איור 5: ניתוח מיקרוביום לדוגמה על שלושה אנשים של Culex quinquefasciatus . (A) הדמיה של מגוון חיידקי המוערך באמצעות מיצוי של SSU rRNA קורא עם PhyloFlash12 באמצע המעי ובשחלות של שלוש הדגימות. (B) כיסוי ממוצע של הפצ"רים המשוחזרים על הדגימות. קיצורים: MAG = גנום מורכב מטה-גנום; Ind = יחיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מג | מספר נכס פצ"ר 4 | מספר נכס פצ"ר 2 | מספר נכס פצ"ר 1 | מספר נכס פצ"ר 3 |
| אורך (bp) | 1,287,790 | 4,910,866 | 4,751,276 | 1,298,266 |
| מספר contigs | 9 | 162 | 149 | 123 |
| GC % | 34.05 | 55.45 | 54.05 | 34.15 |
| השלמה (%) | 84.5 | 97.18 | 98.59 | 91.55 |
| יתירות (%) | 0 | 2.82 | 4.22 | 0 |
| תחום | חיידקים | חיידקים | חיידקים | חיידקים |
| פילום | ספירוצ'אטוטה | פרוטאובקטריה | פרוטאובקטריה | פרוטאובקטריה |
| מחלקה | ספירוצ'טיה | גמאפרוטאובקטריה | גמאפרוטאובקטריה | אלפאפרוטאובקטריה |
| הזמנה | WRBN01 | Enterobacterales | Enterobacterales | ריקטסיאלס |
| משפחה | WRBN01 | Enterobacteriaceae | Enterobacteriaceae | Anaplasmataceae |
| סוג | BR149 | פנטואה | - | וולבכיה |
טבלה 1: מאגים משוחזרים משלושת הפרטים של Culex quinquefasciatus . גודל הגנום, מספר הקונטיגים, שיעור ה-GC, אומדני ההשלמה והיתירות בהתבסס על אוסף גני הליבה בעותק יחיד הזמין ב-Anvi'o17 וטקסונומיה המתקבלת באמצעות GTDB18.
קובץ משלים 1: הליך מפורט לדוגמה לניתוח נתוני מיקרוביום החל מאיסוף דגימות, מיצוי DNA וריצוף גנום שלם ואחריו זרימת העבודה הביואינפורמטית לשחזור גנום והערכת פרופורציות קריאה פרוקריוטיות ואיקריוטיות אנא לחץ כאן להורדת קובץ זה.
Discussion
אנו ממליצים לשים לב במיוחד לרצף של דיסקציה איברים, החל בלוטות הרוק. ואכן, ראינו שהם חולצו בקלות רבה יותר מבית החזה של דגימות קולקס אם שלמות היתוש נשמרה. נזק לבטן או לבית החזה עלול להפחית את הלחץ בגוף היתוש, ולעכב את ההליך. עם זאת, ניתן גם לחתוך בין בית החזה לבטן ולאחר מכן לשלוף את בלוטות הרוק מהראש ובית החזה (A. B. Failloux, תקשורת אישית). בנוסף, רכישת מיומנויות ניתוח מיומנות יכולה להיות מאתגרת, ולכן אנו מציעים להתאמן על מספר מספיק של דגימות לפני הניסוי.
בידוד איברי יתושים תוך הימנעות מזיהום צולב באופן שיטתי הוא חיוני למגוון רחב של ניתוחי מיקרוביוטה של יתושים במורד הזרם. מחקר מטאגנומי מפוענח גנום בעקבות דיסקציה של שחלות בודדות מדגימות Culex pipiens בדרום צרפת איפשר את גילוי הפלסמיד הראשון של וולבכיה ב- Culex pipiens (pWCP14). באמצעות גישה דומה, חקרנו את התפלגות ותדירות pWCP בדגימות Culex pipiens ו-Culex quinquefasciatus מאזורי יבשת ואיים ברחבי העולם, בתנאי סביבה ומעבדה שונים. בסך הכל, הנתונים חשפו יסוד פלסמיד וולבכיה שמור להפליא אצל יתושי קולקס , מה שמרמז על תפקיד מכריע ליסוד נייד זה בביולוגיה אנדוסימביונטית15, המצדיק ניתוח נוסף.
במאמר זה אנו מספקים דוגמאות נוספות לניתוחי מיקרוביום של יתושים על דגימות מהמעי האמצעי והשחלות שהתקבלו באמצעות הליך שיטתי זה. ראינו הבדל ברור במיקרוביוטה בין רקמות (איור 5), עם טקסה חיידקית משותפת וספציפית לאיברים. כצפוי, נוכחות וולבכיה זוהתה בשני האיברים, עם שפע יחסי גבוה יותר (מבוסס על קריאות קצרות שלא הורכבו) וכיסוי ממוצע של MAGs בשחלות היתושים בהשוואה למעיים האמצעיים, בהתאם לתצפית כי אנדוסימביונט זה מועבר דרך השחלות ולאחר מכן מתפשט לרקמות הסומטיות. למרות שמחקר זה הוגבל לדגימות מקלדוניה החדשה, פרוטוקול זה עשוי להקל על חקירת השונות הגנומית של וולבכיה בקנה מידה עולמי, כמו גם תפקידה בפנוטיפים שונים, כולל ויסות צפיפות של עצמה והגנה נגיפית. יתר על כן, עבודה זו מדגימה כיצד הליך הדיסקציה המוצג כאן מאפשר לבחון את המגוון הטקסונומי ואת היכולות התפקודיות הפוטנציאליות של סימביוטים של יתושים בתוך דגימות אמצע המעי.
השגנו שתי טיוטות גנום אנטרובקטריאליות שהיו קיימות רק בשתי דגימות של המעי האמצעי, ואישרו את היעדר הזיהום בין איברים עבור שתי הדגימות האלה. לגבי spirochetes, שזוהו הן באמצע המעי והן בשחלות של פרט 3, ג'ומה ועמיתיו, 2020 צפו בנוכחות של חיידקים אלה על פני השטח של רפסודות ביצים. החוקרים הציעו כי קהילות החיידקים שנמצאות ברפסודות הביצים עשויות לעבור בעיקר בתורשה אימהית מהשחלות, בהתחשב בכך שרפסודות הביצים נשמרו במים נטולי חיידקים ונטולי חיידקים. עם זאת, הם לא יכלו לשלול את האפשרות של התיישבות חיידקים המתרחשת מיד לאחר oviposition והמליצו על מחקר נוסף על מיקרוביום השחלה16.
בעוד שבתחילה תוכנן עבור דגימות של קומפלקס המינים Culex pipiens , אנו צופים את היישום של פרוטוקול זה לקהילה רחבה יותר של אנטומולוגים רפואיים החוקרים וקטורים אחרים כגון אנופלס או Aedes. על ידי פעולה ברמת איברים בודדים, שיטה זו עשויה לאפשר השוואות גנומיות תוך ובין-אינדיבידואליות, ולהציע תובנות לגבי שונות גנומית סימביוטית בקנה מידה עדין, עם פוטנציאל לקידום אסטרטגיות בקרה וקטוריות. שיטה זו של דיסקציה ובידוד של בלוטות הרוק, השחלות והמעי האמצעי, המונעת זיהום צולב מיקרוביאלי, יכולה גם להיות פרוטוקול שימושי למחקרי דינמיקת זיהום נגיפי בשלושת האיברים הללו.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
אנו מודים לגילברט לגוף, שלימד את ג'ורדן טוטאגאטה כיצד לנתח בלוטות רוק מיתושים, ולג'וליאנו מוצ'י על עזרתו בתמונות של איברי היתושים. אנו מודים ל-Anna-Bella Failloux ול-Nonito Pages על הדיון המועיל על הפרוטוקול. עבודה זו נתמכה על ידי מענק ERC RosaLind Starting Grant "948135" ל- JR. אנו מודים לפלטפורמת Vectopole (IRD, מונפלייה) על מתן התמיכה הטכנית ועל הגידול והתחזוקה של אוכלוסיות היתושים.
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol 96° | Fisher scientific | 10332562 | |
| Binocular magnifier | |||
| Bleach | RAJA | 145517 | 150 tablets of 1.5 g |
| DNA prep kit | Illumina | Provided by MGX sequencing platform | Previously known as Nextera DNA Flex |
| DNA-RNA Shield (50 mL) | Zymo research | ZR1100-50 | Preservation buffer |
| DNeasy Blood and Tissue Kit | Qiagen | 69504 | DNA extraction kit |
| Filter tips 20 µL | Starlab | S1120-3810 | |
| Filter tips 200 µL | Starlab | S1120-8710 | |
| Filter tips 1000 µL | Starlab | S1122-1730-C | |
| Forceps | FST (Fine Science Tools) | 11252-20 | Dumont Forceps #5 |
| Library quantification kit | Roche | Provided by MGX sequencing platform | KAPA Library Quanitification Kits |
| Micropipettes 2-20 µL | Eppendorf | 6.291704 | |
| Micropipettes 20-200 µL | Eppendorf | 6.291703 | |
| Micropipettes 100-1000 µL | Eppendorf | 7.648488 | |
| Microscope slides | Epredia | J1800BMNZ | dimension : 75 mm x 50 mm |
| Needles | Terumo | AN*2719R1 | |
| NGS kit | Agilent | Provided by MGX sequencing platform | Fragment Analyzer Systems HS Genomic DNA 50kb Kit |
| NovaSeq 6000 | Illumina | Provided by MGX sequencing platform | Sequencer |
| PBS Phosphate Buffered Saline (Sterile) | Fisher scientific | 10212990 | |
| Permanent black marker | |||
| Sterile Eppendorf | Dutscher | 33871 | 1.5 mL |
| Support for needles | FST (Fine Science Tools) | 26016-12 | Moria MC1 Pin Holder 12 cm |
References
- Achee, N. L., et al. Alternative strategies for mosquito-borne arbovirus control. PLOS Negl Trop Dis. 13 (1), e0006822 (2019).
- Hoffmann, A. A., et al. Successful establishment of Wolbachia in Aedes populations to suppress dengue transmission. Nature. 476 (7361), 454-457 (2011).
- Porter, J., Sullivan, W. The cellular lives of Wolbachia. Nat Rev Microbiol. 21 (11), 750-766 (2023).
- Coon, K. L., Brown, M. R., Strand, M. R. Mosquitoes host communities of bacteria that are essential for development but vary greatly between local habitats. Mol Ecol. 25 (22), 5806-5826 (2016).
- Didion, E. M., et al. Microbiome reduction prevents lipid accumulation during early diapause in the northern house mosquito, Culex pipiens pipiens. J Insect Physiol. 134, 104295 (2021).
- Gabrieli, P., et al. Mosquito trilogy: Microbiota, immunity and pathogens, and their implications for the control of disease transmission. Front Microbiol. 12, 630438 (2021).
- Garrigós, M., Garrido, M., Panisse, G., Veiga, J., Martínez-de La Puente, J. Interactions between West Nile Virus and the microbiota of Culex pipiens vectors: A literature review. Pathogens. 12 (11), 1287 (2023).
- Zheng, R., et al. Holobiont perspectives on tripartite interactions among microbiota, mosquitoes, and pathogens. ISME J. 17 (8), 1143-1152 (2023).
- Flores, G. A. M., et al. Wolbachia dominance influences the Culex quinquefasciatus microbiota. Sci Rep. 13 (1), 18980 (2023).
- Hegde, S., et al. Interkingdom interactions shape the fungal microbiome of mosquitoes. Anim Microbiome. 6 (1), 11 (2024).
- Suo, P., et al. Seasonal variation of midgut bacterial diversity in Culex quinquefasciatus populations in Haikou city, Hainan province, China. Biology. 11 (8), 1166 (2022).
- Gruber-Vodicka, H. R., Seah, B. K. B., Pruesse, E. phyloFlash: Rapid small-subunit rRNA profiling and targeted assembly from metagenomes. mSystems. 5 (5), e00920-e00920 (2020).
- Graña-Miraglia, L., et al. Spirochetes isolated from arthropods constitute a novel genus Entomospira genus novum within the order Spirochaetales. Sci Rep. 10 (1), 17053 (2020).
- Reveillaud, J., et al. The Wolbachia mobilome in Culex pipiens includes a putative plasmid. Nat Commun. 10 (1), 1051 (2019).
- Ghousein, A., et al. pWCP is a widely distributed and highly conserved Wolbachia plasmid in Culex pipiens and Culex quinquefasciatus mosquitoes worldwide. ISME Commun. 3 (1), 40 (2023).
- Juma, E. O., Kim, C. -. H., Dunlap, C., Allan, B. F., Stone, C. M. Culex pipiens and Culex restuans egg rafts harbor diverse bacterial communities compared to their midgut tissues. Parasit Vectors. 13 (1), 532 (2020).
- Lee, M. D. GToTree: a user-friendly workflow for phylogenomics. Bioinformatics. 35 (20), 4162-4164 (2019).
- Parks, D. H., et al. A complete domain-to-species taxonomy for bacteria and Archaea. Nat Biotechnology. 38 (9), 1079-1086 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved