A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إجراء شاشة CRISPR بالضربة القاضية على مستوى الجينوم في المختبر في الخلايا التائية لمستقبلات المستضد الخيمري
In This Article
Summary
تصف المقالة بروتوكولا لتطبيق نموذج في المختبر للإرهاق لإكمال شاشة خروج المغلوب CRISPR على مستوى الجينوم في الخلايا التائية لمستقبلات المستضد الخيمري السليمة من المتبرع السليم.
Abstract
العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CART) هو شكل مبتكر من العلاج المناعي الموجه الذي أحدث ثورة في علاج السرطان. ومع ذلك، فإن الاستجابة الدائمة لا تزال محدودة. أظهرت الدراسات الحديثة أن المشهد اللاجيني لمنتجات خلايا كارتة التسريب قبل الحقن يمكن أن يؤثر على الاستجابة للعلاج ، وقد تم اقتراح تحرير الجينات كحل. ومع ذلك ، يجب القيام بمزيد من العمل لتحديد استراتيجية تحرير الجينات المثلى. أصبحت شاشات CRISPR على مستوى الجينوم أدوات شائعة للتحقيق في آليات المقاومة وتحسين استراتيجيات تحرير الجينات. ومع ذلك ، فإن تطبيقها على الخلايا الأولية يمثل العديد من التحديات. نصف هنا طريقة لإكمال شاشة CRISPR بالضربة القاضية على مستوى الجينوم في خلايا CART من المتبرعين الأصحاء. كنموذج لإثبات المفهوم ، صممنا هذه الطريقة للتحقيق في تطور الإرهاق في خلايا CART التي تستهدف مستضد CD19. ومع ذلك ، نعتقد أنه يمكن استخدام هذا النهج لمعالجة مجموعة متنوعة من آليات مقاومة العلاج في تركيبات CAR المختلفة ونماذج الورم.
Introduction
أظهر العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CART) نجاحا مثيرا للإعجاب في علاج الأورام الخبيثة للخلايا البائية. ومع ذلك ، فإن الاستجابة الدائمة تقتصر على 30-40٪ 1،2،3،4،5. بينما طور الباحثون واختبروا العديد من الأساليب لمعالجة آليات مقاومة العلاج بخلايا كارتة ، بما في ذلك تحسين تصميم CAR ، وتحرير الجينات ، والعلاجات المركبة ، فإن تطور المقاومة لا يزال غير معروف إلى حد كبير. في الآونة الأخيرة ، كان هناك أدلة متزايدة على أن ملف تعريف التعبير الجيني الأساسي لمنتجات خلايا CART قبل التسريب هو محدد مهم لكل من سمية وفعالية علاج CART6،7،8،9. على هذا النحو ، أصبح التحرير الجيني أثناء إنتاج خلايا عربة التسوق نهجا شائعا لتحسين نجاح العلاج بخلايا عربة الطفلة.
على سبيل المثال ، أظهر مختبرنا سابقا أن استخدام تقنية Cas9 للتكرارات المتجانسة القصيرة المتباعدة بانتظام (CRISPR) للقضاء على عامل تحفيز مستعمرة الخلايا الحبيبية والضامة الجيني (GM-CSF) يحسن نشاط خلايا العربة ويقلل من علامات السمية المرتبطة ب CART10،11،12. بالإضافة إلى ذلك ، تم اختبار العلاج الخلوي المصمم بتقنية كريسبر في التجارب السريرية وأظهر فعاليتهوسلامته 13. يشير هذا معا إلى أن تحرير الجينات باستخدام تقنية كريسبر لا يمكن أن يعزز فهمنا لبيولوجيا خلايا كارتة فحسب ، بل يمكن أيضا إنشاء منتجات خلايا عربة قابلة للترجمة.
أصبحت شاشات CRISPR بالضربة القاضية على مستوى الجينوم أدوات شائعة بشكل متزايد في أبحاث بيولوجيا السرطان لفهم آليات مقاومة العلاجات. في هذه التقنية ، يتم تسليم عشرات الآلاف من الحمض النووي الريبي الإرشادي (gRNAs) إلى مجموعات من الخلايا لتشجيع دخول gRNA واحد لكل خلية14. بعد ذلك ، تخضع الخلايا لظروف محفزة للضغط حيث تموت الخلايا المنقولة باستخدام gRNAs التي تستهدف الجينات الأساسية والخلايا المنقولة باستخدام gRNAs التي تستهدف الجينات المثبطة على قيد الحياة والتكاثر. باستخدام تسلسل الجيل التالي ، يمكننا تحديد كيفية تغير تمثيل gRNA في جميع أنحاء شاشة CRISPR14.
ومع ذلك ، فإن الحجم ووقت الاختيار المطلوبين للاضطرابات الجينية على مستوى الجينوم يمكن أن يكون من الصعب تحقيقه في الخلايا الأولية ، مثل خلايا عربة العربة. على هذا النحو ، استخدمت المجموعات شاشات كريسبر المستهدفة لفهم آليات المقاومة العلاجية بشكل أكبر15،16. غالبا ما يكون من الأسهل إكمال الشاشات المستهدفة في الخلايا الأساسية لأنها تحتوي على مكتبات أصغر تتطلب عددا أقل من الخلايا لتحقيق تمثيل مناسب للمكتبة. في حين أن هذه الدراسات قد حسنت فهمنا لآليات مقاومة العلاج بخلايا العربة ، فإن الشاشات المستهدفة تقدم تحيزا بسبب الاختيار اليدوي للأهداف الجينية. تسعى هذه المقالة إلى وصف طريقة لإكمال شاشة CRISPR بالضربة القاضية على مستوى الجينوم في المختبر في خلايا عربة التسوق من المتبرعين الأصحاء. على هذا النحو ، يسمح هذا النهج عالي الإنتاجية بتحديد فعال وغير متحيز للمسارات والجينات الرئيسية التي يمكن تحريرها لتحسين الاستجابات العلاجية17 ، 18 ، 19.
على وجه الخصوص ، تم تصميم البروتوكول الموصوف في هذه المقالة لزيادة فهم المجال لاستنفاد خلايا عربة من خلال إكمال شاشة خروج المغلوب CRISPR على مستوى الجينوم مع نموذج في المختبر للإرهاق. الإرهاق هو مصير مختل وظيفي لخلايا عربة الأطفال المتورطة في عدم الاستجابة للعلاج بخلايا كارتة20،21،22. من المعروف أن هذا المصير الخلوي منظم جينيا ، ويتميز بانخفاض في تكاثر خلايا CART ، وانخفاض في إنتاج السيتوكين المستجيب ، وزيادة التعبير عن المستقبلات المثبطة23. في الأدبيات السابقة ، كان التحرير الجيني قادرا على منع تطور الإرهاق إما عن طريق رفع أو تقليل تنظيم الجينات الرئيسية24،25،26. بالنظر إلى كل من انخفاض القدرة على التكاثر مع استنفاد خلايا عربة التسوق والدليل على أن تحرير الجينات يمكن أن يمنع حدوثه ، قمنا بنمذجة شاشة CRISPR بالضربة القاضية على مستوى الجينوم في المختبر على هذا المصير الخلوي. ومع ذلك ، يمكن تعديل هذا البروتوكول في المستقبل لاستكشاف آليات أخرى لمقاومة العلاج بخلايا كارتب.
Protocol
الأهم من ذلك ، أن البروتوكول الموضح أدناه يتبع إرشادات من مجلس المراجعة المؤسسية في Mayo Clinic (IRB 18-005745) ولجنة السلامة البيولوجية المؤسسية (IBC HIP00000252.43) وحصل على موافقة منهما. يجب تنفيذ جميع أعمال زراعة الخلايا ، بما في ذلك إنتاج الفيروسات العدسية ، في غطاء مزرعة الخلايا مع معدات الحماية الشخصية المناسبة. على وجه الخصوص ، يجب إجراء أعمال الفيروسات العدسية في ظل احتياطات السلامة البيولوجية المستوى 2 (BSL-2) ، بما في ذلك استخدام 10٪ مبيض لتطهير المواد قبل التخلص منها.
1. تضخيم مكتبة كريسبر
- قم بتضخيم مكتبة كريسبر وفقا لتوصيات الشركة المصنعة. باختصار ، قم بتقطيع مكتبة كريسبر بالكهرباء إلى أربع حصص من الخلايا ذات الكفاءة الكهربائية من خلال إكمال ما يلي:
- أضف 2 ميكرولتر من 50 نانوغرام / ميكرولتر بلازميد مكتبة كريسبر إلى 25 ميكرولتر من الخلايا ذات الكفاءة الكهربائية في كوفيت 1.0 مم.
- قم بتكليف العينات بالكهرباء باستخدام الإعدادات التالية: 10 ميكروفهرنهايت ، 600 أوم ، 1,800 فولت ، وثابت زمني بين 3.5 مللي ثانية و 4.5 مللي ثانية.
- استرجع في 975 ميكرولتر من وسائط الاسترداد وانقلها إلى أنبوب مع 1 مل إضافية من وسائط الاسترداد.
- قم بتدوير جميع الحصص عند 250 دورة في الدقيقة لمدة ساعة واحدة عند 37 درجة مئوية.
- لوحة التحولات:
- تجمع كل حصصات الخلايا الكهربائية واخلطها جيدا.
- قم بوضع جميع الخلايا المثقبة بالكهرباء عن طريق نشر 400 ميكرولتر من مزيج التحويل على ألواح مرق لوريا (LB) مسخنة مسبقا مقاس 10 سم مع 100 ميكروغرام / مل من الكربنيسيلين. ضع الطبق في حاضنة على حرارة 32 درجة مئوية لمدة 14 ساعة.
- حصاد المستعمرات:
- ماصة 1 مل من وسائط LB + 100 ميكروغرام / مل كاربينيسيلين على كل لوحة. اكشط المستعمرات من كل لوحة واجمعها في أنبوب مخروطي سعة 50 مل.
- أضف 1 مل أخرى من وسائط LB + 100 ميكروغرام / مل من الكربينسيلين إلى كل طبق للغسيل وضمان الاسترداد التام.
- قم بإجراء الإعداد الأقصى باتباع تعليمات مجموعة الإعداد القصوى.
- تجمع الحمض النووي البلازميد الناتج.
2. تسلسل الجيل التالي للتحقق من تمثيل gRNA الأساسي في مكتبة CRISPR
ملاحظة: تم تصميم بادئات NGS لمكتبة كريسبر هذه في منشور سابق27. سيؤدي استخدام برايمر عكسي مختلف لكل عينة إلى ترميز كل عينة والسماح بتجميع العينات أثناء التسلسل.
- تحضير العينات ل تفاعل البوليميراز المتسلسل بخليط التفاعل التالي (الحجم الكلي = 50 ميكرولتر): مزيج رئيسي عالي الدقة PCR ، 2x: 25 ميكرولتر ؛ الحمض النووي للقالب المجمع ، 0.5 ميكروغرام: 1 ميكرولتر ؛ التمهيدي الأمامي لمكتبة NGS ، 10 ميكرومتر: 1.25 ميكرولتر ؛ التمهيدي العكسي لمكتبة NGS ، 10 ميكرومتر: 1.25 ميكرولتر ؛ ماء خال من DNase: 21.5 ميكرولتر.
- إجراء تفاعل البوليميراز المتسلسل مع ظروف ركوب الدراجات التالية: الدورة 1: تشوه عند 98 درجة مئوية لمدة 3 دقائق ؛ الدورات 2-23: تشوه عند 98 درجة مئوية لمدة 10 ثوان ، تلدين عند 63 درجة مئوية لمدة 10 ثوان ، يمتد عند 72 درجة مئوية لمدة 25 ثانية ؛ الدورة 24: تمتد عند 72 درجة مئوية لمدة دقيقتين.
- قم بتنقية تفاعل تفاعل تفاعل البوليميراز المتسلسل عن طريق تجميع تفاعلات تفاعل البوليميراز المتسلسل لكل عينة وتنقية منتج تفاعل البوليميراز المتسلسل باستخدام مجموعة تنقية تفاعل البوليميراز المتسلسل وفقا لتعليمات الشركة المصنعة.
- قم بتشغيل 3 ميكروغرام من منتج PCR لكل عينة على جل الاغاروز بنسبة 2٪ (وزن / حجم).
- قم بإزالة منتج تفاعل البوليميراز المتسلسل (~ 260-270 نقطة أساس) من الجل عن طريق استخراج الحمض النووي من الجل باستخدام مجموعة استخراج الجل وفقا لتعليمات الشركة المصنعة. تهدف إلى ما لا يقل عن 500 نانوغرام من الحمض النووي.
- قم بتخزين العينات المستخرجة عند -20 درجة مئوية.
- قم بإجراء تسلسل الجيل التالي (NGS) مع العينات واستهدف 100 قراءة لكل gRNA27.
- قم بتحليل نتائج التسلسل باستخدام خط أنابيب MAGeCK-VISPR وتأكد من تمثيل أكثر من 99.5٪ من gRNAs في المكتبة28.
3. إنتاج مكتبة كريسبر وفيروسات العدسات تعبير CAR
- تحضير فيروس العدسات كما هو موضح سابقا10،29.
- اليوم 1: ابدأ بقوارير T175 من 80-90٪ من خلايا 293T المتجمعة التي كانت تنمو في وسائط D10 المكونة من 10٪ مصل بقري جنيني (FBS) (v / v) ، و 1٪ بنسلين - ستربتومايسين - جلوتامين (PSG) (v / v) ، ووسط النسر المعدل من Dulbecco. قبل البدء ، قم بتسخين كواشف التعداء والحمض النووي إلى درجة حرارة الغرفة وتحديد الحمض النووي.
- لكل قارورة 293T ، قم بتسمية أنبوبين مخروطيين سعة 50 مل A و B. أضف 4.5 مل من وسط المصل المختزل إلى الأنبوب A والأنبوب B.
- في أنبوب معقم للطرد المركزي الدقيق سعة 1.5 مل ، امزج الحمض النووي التالي واتركه لمدة دقيقة واحدة: 18 ميكروغرام من pCMVR8.74 (الكمامة ، pol ، tat ، و rev) ، و 7 ميكروغرام من pMD2.G (VSV-G) ، و 15 ميكروغرام من ناقل التعبير الفيروسي (ناقلات مكتبة CRISPR A أو CAR19-28ζ).
- أضف 129 ميكرولتر من كاشف الإرسال إلى الأنبوب A. امزج الأنبوب A جيدا عن طريق دوامة الإصبع.
- أضف خليط الحمض النووي إلى الأنبوب B. امزج الأنبوب B جيدا عن طريق دوامة الإصبع.
- أضف 111 ميكرولتر من الكاشف الدهني المحايد إلى الأنبوب B. امزج الأنبوب B جيدا عن طريق دوامة الإصبع.
- أضف محتويات الأنبوب A إلى الأنبوب B واخلطها جيدا عن طريق دوامة الإصبع. احتضان الأنبوب B لمدة 30 دقيقة في درجة حرارة الغرفة.
- قرب نهاية فترة الحضانة التي تبلغ 30 دقيقة ، قم بإعداد خلايا 293T عن طريق شفط الوسائط الموجودة. أضف 16 مل من وسائط R10 المكونة من 10٪ FBS (حجم/حجم) و1٪ من PSG (حجم/حجم) ومعهد روزويل بارك التذكاري (RPMI) 1640.
- بعد فترة الحضانة التي تبلغ 30 دقيقة ، أضف محتويات الأنبوب B (حوالي 9 مل) بالتنقيط إلى قارورة خلايا 293T. ضع القارورة لأسفل وقم بتدويرها برفق قبل احتضانها عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- في اليوم 2 (حوالي 24 ساعة بعد التعدي) ، اجمع فيروس العدسات على النحو التالي:
ملاحظة: قم بتبريد جميع المعدات والمواد وقم بما يلي على الجليد للحفاظ على برودة المادة الطافية الفيروسية.- انقل المادة الطافية من قوارير 293T المنقولة إلى أنابيب مخروطية مسبقة التبريد سعة 50 مل.
- أضف 30 مل من وسائط R10 المسخنة مسبقا إلى قوارير 293T.
- الحطام الخلوي الحبيبي عن طريق الطرد المركزي للأنابيب المخروطية سعة 50 مل عند 900 × جم لمدة 10 دقائق عند 4 درجات مئوية في الدوارات المغلقة.
- بعد الطرد المركزي ، قم بتصفية المادة الطافية بمرشح 0.45 ميكرومتر. قم بتدوير المرشح في جهاز طرد مركزي فائق عند 112,700 × جم عند 4 درجات مئوية لمدة ساعتين.
- بعد الدوران لمدة ساعتين ، استنشق المادة الطافية حتى يتبقى حوالي 5 مل. أعد تعليق الجسيمات الفيروسية عن طريق سحب العينة برفق لأعلى ولأسفل 10 أضعاف. قم بتخزين المعلق الفيروسي عند 4 درجات مئوية طوال الليل.
- في اليوم 3 ، اجمع فيروس العدسات وخزنه على النحو التالي:
- انقل المادة الطافية من قوارير 293T المنقولة إلى أنابيب مخروطية مسبقة التبريد سعة 50 مل.
- أضف 30 مل من المبيض بنسبة 10٪ إلى قوارير 293T.
- قم بتحبيير الحطام الخلوي في المادة الطافية عن طريق الطرد المركزي للأنابيب المخروطية سعة 50 مل عند 900 × جم لمدة 10 دقائق عند 4 درجات مئوية في الدوارات المغلقة.
- بعد الطرد المركزي ، قم بتصفية المادة الطافية بمرشح 0.45 ميكرومتر. قم بتدوير المرشح في جهاز طرد مركزي فائق عند 112,700 × جم عند 4 درجات مئوية لمدة ساعتين.
- بعد جهاز الطرد المركزي لمدة 2 ساعة ، قم بشفط المادة الطافية حتى يتبقى حوالي 2 مل ، وأعد تعليقها عن طريق سحب العينة برفق لأعلى ولأسفل 10 أضعاف. قم بتخزين المادة الطافية الفيروسية في 300-500 ميكرولتر واحتفظ بها عند -80 درجة مئوية.
4. حساب العيار الفيروسي لفيروس العدسات المعبر عن CAR
ملاحظة: تم معايرة فيروس عدسات CAR كما هو موضح سابقا10،12.
- في اليوم 1 ، قم بتنشيط الخلايا التائية ووصفيحتها.
- عزل 1 × 10 6خلايا تائية من PBMCs المانحة الأصحاء باستخدام مجموعة اختيار سلبية.
- عد الخلايا التائية.
- اغسل ما يكفي من حبات CD3 + / CD28 + لتحفيز الخلايا التائية بنسبة 3: 1 حبة: خلية. على سبيل المثال ، لتحفيز 1 × 106 خلايا تائية ، اغسل 3 × 106 خرز. للقيام بذلك ، اغسل الخرزات بإكمال 3x التالية:
- استخدم الفصل المغناطيسي لإزالة الخرز من التعليق.
- قم بإزالة المادة الطافية.
- أضف 1000 ميكرولتر من وسائط الخلايا التائية (TCM) المكونة من 10٪ مصل بشري (v / v) ، و 1٪ PSG (v / v) ، ووسط الخلايا المكونة للدم.
ملاحظة: يجب تعقيم الطب الصيني التقليدي قبل الاستخدام عن طريق الترشيح باستخدام مرشح فراغ معقم 0.45 ميكرومتر ثم باستخدام مرشح فراغ معقم 0.22 ميكرومتر. - أضف حبات إلى تعليق الخلية التائية بنسبة 3: 1 حبة: خلية.
- أعد تعليق الخلايا التائية إلى 1 × 106 خلايا / مل في الطب الصيني التقليدي.
- أضف 100 ميكرولتر من الخلايا التائية المنشطة إلى 10 آبار من صفيحة 96 بئرا. احتضان اللوحة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- في اليوم 2 ، أضف مخففا من فيروس عدسات CAR عن طريق إنشاء لوحة تخفيف على النحو التالي:
- أضف 100 ميكرولتر من الطب الصيني التقليدي إلى سبعة آبار من صفيحة سعة 96 بئرا.
- إلى البئر الأول ، أضف 50 ميكرولتر من الفيروس المعني ؛ اخلط جيدا.
- يخفف الفيروس بشكل متسلسل عن طريق إضافة 50 ميكرولتر من البئر 1 إلى البئر 2 ؛ اخلط جيدا.
- أضف 50 ميكرولتر من البئر 2 إلى البئر 3 واستمر في هذا النمط حتى البئر 7.
- بعد الخلط جيدا 7 ، قم بإزالة 50 ميكرولتر ، تأكد من أن جميع الآبار لها حجم إجمالي يبلغ 100 ميكرولتر.
- أضف 50 ميكرولتر من كل بئر من لوحة التخفيف إلى الآبار السبعة الأولى من صفيحة الخلية التائية من اليوم الأول. اخلط جيدا.
- إلى الآبار الثلاثة الأخيرة من صفيحة الخلية التائية ، أضف 50 ميكرولتر من الطب الصيني التقليدي ؛ اخلط جيدا. قم بتخزين الطبق في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- في اليوم 3 ، قم بتغذية الخلايا عن طريق إضافة 100 ميكرولتر من الطب الصيني التقليدي إلى جميع آبار صفيحة الخلية التائية. اخلط جيدا.
- في اليوم 4 ، قم بإجراء قياس التدفق الخلوي للكشف عن النسبة المئوية للخلايا التي تعبر عن CAR بجسم مضاد لسلسلة كابا ، وهو علامة بديلة لتعبير CAR ، من خلال إكمال ما يلي:
- قم بتدوير لوحة الخلية التائية عند 1,000 × جم لمدة 3 دقائق ثم صبها.
- اغسل اللوحة 3x باستخدام عازلة الأجسام المضادة لسلسلة كابا (تتكون من 4٪ ألبومين مصل البقر في PBS (وزن / حجم)) عن طريق إضافة 200 ميكرولتر من المخزن المؤقت للأجسام المضادة لسلسلة كابا ، وتدوير اللوحة عند 1,000 × جم لمدة 3 دقائق ، والصب.
- أضف جسما مضادا لسلسلة الكابا المضادة للبيوتين إلى كل بئر. احتضن لمدة 45 دقيقة على كرسي هزاز عند 4 درجات مئوية.
- اغسل اللوحة 3x باستخدام عازلة الأجسام المضادة لسلسلة الكابا كما في الخطوة 4.4.2.
- تلطيخ الخلايا لقياس التدفق الخلوي بجسم مضاد ستربتافيدين مترافق بالفلوروكروم وجسم مضاد حي / ميت. احتضان العينات لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام.
- اغسل العينات مرة واحدة في المخزن المؤقت للتدفق (يتكون من 2٪ FBS (حجم / حجم) و 1٪ أزيد الصوديوم (v / v) في PBS) عن طريق إضافة 200 ميكرولتر من المخزن المؤقت للتدفق ، والدوران لأسفل اللوحة عند 1,000 × جم لمدة 3 دقائق ، والصب.
- قم بإعادة التعليق في 100 ميكرولتر من المخزن المؤقت للتدفق وقم بتشغيله على مقياس الخلوي.
- قم بإجراء بوابات سلبية مع الآبار الثلاثة غير المحقولة.
5. حساب العيار الفيروسي لفيروس العدسات مكتبة كريسبر
ملاحظة: يصف هذا البروتوكول حدا أدنى من الخلايا التائية لمعايرة فيروس العدسات في مكتبة كريسبر ، ولكن يمكن توسيع نطاقه لاستيعاب المزيد من الخلايا التائية وبالتالي كميات أكبر من الفيروسات.
- في اليوم 0 ، قم بتنشيط الخلايا التائية عن طريق إضافة 18 × 106 حبات CD3 + / CD28 + (نسبة 3: 1 حبة: خلية) إلى 6 × 10 6خلايا تائية ورفع الحجم النهائي إلى 6 مل مع الطب الصيني التقليدي. Aliquot 0.5 مل من تعليق الخلية التائية في 12 بئرا من صفيحة 48 بئرا. يحفظ في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- بعد أربع وعشرين ساعة ، في اليوم الأول ، أضف فيروس CAR بمعدل عدوى متعدد (MOI) من 3 إلى كل بئر. تخلط جيدا عن طريق سحب العينات لأعلى ولأسفل عدة مرات. يحفظ في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- بعد ثمان وأربعين ساعة ، في اليوم الثاني ، أضف سلسلة من مجلدات فيروسات مكتبة كريسبر إلى خلايا CART المنشطة عن طريق إضافة أحد المجلدات التالية من فيروس كريسبر إلى كل بئر (0 ميكرولتر ، 0 ميكرولتر ، 6.25 ميكرولتر ، 6.25 ميكرولتر ، 12.5 ميكرولتر ، 12.5 ميكرولتر ، 25 ميكرولتر ، 25 ميكرولتر ، 50 ميكرولتر ، 50 ميكرولتر ، 100 ميكرولتر ، أو 100 ميكرولتر). تخلط جيدا عن طريق سحب العينات لأعلى ولأسفل عدة مرات. يحفظ في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- في اليوم 3 ، أضف 1 ميكروغرام من بورومايسين لكل مل من الوسائط إلى نصف الآبار ، بما في ذلك بئر واحد تلقى كل من أحجام فيروس كريسبر التالية (0 ميكرولتر ، 6.25 ميكرولتر ، 12.5 ميكرولتر ، 25 ميكرولتر ، 50 ميكرولتر ، 100 ميكرولتر). لن تتم معالجة الآبار الأخرى بالبورومايسين.
- من الأيام 4 إلى 8 ، عد الخلايا التائية يوميا واضبط كثافة الخلايا النهائية إلى 1 × 106 خلايا / مل مع 1 ميكروغرام / مل بورومايسين في الطب الصيني التقليدي للآبار المعالجة بالبورومايسين ومع الطب الصيني التقليدي للآبار غير المعالجة.
- في اليوم 8 ، احسب عدد الخلايا الحية لكل بئر واحسب وحدات التنبيغ / مل من المادة الطافية الفيروسية باستخدام المعادلة التالية:
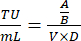
حيث أ: عدد الخلايا الحية في بئر منقولة فيروسيا. ب: عدد الخلايا الحية في التحكم في اختيار المضادات الحيوية بشكل جيد. V: حجم الفيروس المستخدم للعدوى في كل بئر ؛ د: أضعاف التخفيف. - باستخدام بئر TU/mL المحسوب من بئر يظهر كفاءة التحويل بنسبة 20٪ تقريبا ، احسب حجم الفيروس اللازم لنقل 1 × 106 خلايا بمعدل داخلي قدره 0.3 باستخدام الصيغة التالية:
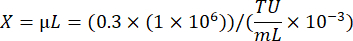
6. مرحلة إنتاج خلايا عربة التسوق لشاشة كريسبر (الأيام 0-8)
ملاحظة: يصف البروتوكول التالي إكمال شاشة كريسبر في نسخة بيولوجية واحدة. ومع ذلك ، فقد تم التحقق من صحة هذا البروتوكول سابقا بثلاثة تكرارات بيولوجية ونوصي باستخدام ما لا يقل عن ثلاثة تكرارات بيولوجية للآخرين الذين يكملون هذا البروتوكول30.
- اليوم 0: عزل وتحفيز الخلايا التائية من دم المتبرع السليم كما هو موضحسابقا 10.
- عزل خلايا الدم المحيطية أحادية النواة (PBMCs) من دم المتبرع السليم غير المحدد.
- أضف 15 مل من وسط تدرج الكثافة إلى أنبوب فصل تدرج الكثافة.
- أضف 1: 2 دم مخفف إلى الجزء العلوي من أنبوب فصل تدرج الكثافة. جهاز طرد مركزي عند 1,200 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
ملاحظة: يجب تخفيف الدم بمحلول عزل (2٪ FBS (حجم / حجم) في محلول ملحي مخزن بالفوسفات [PBS]). - ضعف الطبقة العليا في أنبوب مخروطي جديد سعة 50 مل ومضاعفة الحجم باستخدام عازل العزل. الطرد المركزي العينة عند 300 × جم لمدة 8 دقائق عند 4 درجات مئوية. شفط المادة الطافية.
- أعد تعليق حبيبات الخلية باستخدام المخزن المؤقت للعزل وعد PBMCs.
- عزل الخلايا التائية من PBMCs باستخدام مجموعة تحديد سلبية. اتبع تعليمات الشركة المصنعة للمجموعة.
ملاحظة: افترض استرداد 10-20٪ من الخلايا التائية من PBMCs. - تحفيز الخلايا التائية بخرز CD3 + / CD28 + .
- عد الخلايا التائية.
- Aliquot ما يكفي من حبات CD3 + / CD28 + لتحفيز الخلايا التائية بنسبة 3: 1 حبة: خلية. على سبيل المثال ، لتحفيز 110 × 106 خلايا تائية ، aliquot 330 × 106 خرز. اغسل الخرزات 3x عن طريق فصل الخرزات أولا عن التعليق مع الفصل المغناطيسي ثم إضافة 1,000 ميكرولتر من الطب الصيني التقليدي.
- أضف الخرزات إلى تعليق الخلية T. أعد تعليق الخلايا التائية إلى 1 × 106 خلايا / مل في الطب الصيني الصيني.
- قم بتقسيم الخلايا التائية في ألواح ذات 6 آبار للحصول على أفضل كفاءة في التحويل. أضف 5 × 10 6خلايا تائية إلى كل بئر. احتضان الخلايا عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 لمدة 24 ساعة.
- عزل خلايا الدم المحيطية أحادية النواة (PBMCs) من دم المتبرع السليم غير المحدد.
- اليوم 1: في ظل ظروف BSL-2+ ، قم بإذابة ما يكفي من فيروس عدسات CAR لنقل الخلايا التائية بعدوى متعددة تبلغ 3.0. قم بتفكيك وريدات الخلايا التائية برفق قبل إضافة الكمية المناسبة من فيروس العدسات المجمعة لنقل 5 × 10 6خلايا تائية في وزارة الداخلية 3.0. احتضان الخلايا عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2.
ملاحظة: تجمع فيروس العدسات من إنتاجات متعددة إلى أنبوب واحد قبل تحويل الخلايا التائية. هذا يضمن أن جميع الخلايا التائية تتلقى نفس العلاج. بالإضافة إلى ذلك ، يجب إذابة فيروس العدسات مرة واحدة فقط. - اليوم 2: في ظل ظروف BSL-2+ ، قم بإذابة ما يكفي من فيروس العدسات CRISPR لتحويل الخلايا التائية بمعدل داخلي قدره 0.3. قم بتفكيك وريدات الخلايا التائية برفق وإعادة تعليق الخلايا التائية قبل إضافة الكمية المناسبة من فيروس العدسات المجمع لنقل 5 × 10 6خلايا تائية بمعدل داخلي قدره 0.3. احتضان الخلايا عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2.
ملاحظة: تجمع فيروس العدسات من إنتاجات متعددة إلى أنبوب واحد قبل تحويل الخلايا التائية. هذا يضمن أن جميع الخلايا التائية تتلقى نفس العلاج. - الأيام 3 - 5: إعادة تعليق خلايا العربة لتفتيت الوريدات وعد الخلايا. ارفع التركيز النهائي للخلية إلى 1 × 106 خلايا / مل في الطب الصيني التقليدي مع 1 ميكروغرام / مل بورومايسين. احتضان الخلايا عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2.
- اليوم 6: أعد تعليق خلايا عربة التسوق لتفتيت الوريدات ، وقم بإزالة حبات CD3 + / CD28 + من خلال الفصل المغناطيسي ، وعد خلايا العربة. أضف الطب الصيني التقليدي مع 1 ميكروغرام / مل بورومايسين لرفع التركيز النهائي للخلية إلى 1 × 106 خلايا / مل واحتضان الخلايا عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2. تحديد تعبير CAR باستخدام قياس التدفق الخلوي كما هو موضح في الخطوة 4.4.
7. مرحلة اختيار gRNA لشاشة CRISPR (الأيام 8 - 22)
- اليوم 8: احتفظ بالعينات لتسلسل الجيل التالي (NGS) وابدأ الزراعة المشتركة.
- اغسل خلايا عربة التسوق 3x في الطب الصيني التقليدي عن طريق الطرد المركزي للعينات عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية ، وشفط المادة الطافية ، وإعادة تعليق العينات في 20 مل من الطب الصيني التقليدي.
- عد خلايا عربة التسوق.
- احتفظ بعينات ل NGS من خلال إكمال ما يلي:
- Aliquot ما يكفي من خلايا CART في أنبوب مخروطي سعة 50 مل للحفاظ على تمثيل gRNA ل 500 خلية لكل gRNA (على سبيل المثال ، aliquot ما يقرب من 33 × 106 خلايا عربة إذا كنت تستخدم مكتبة CRISPR مع 65,383 gRNAs). الطرد المركزي للعينة عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أعد تعليق حبيبات الخلية في 1 مل من PBS ونقلها إلى أنبوب طرد مركزي دقيق سعة 2 مل. اغسل الأنبوب المخروطي سعة 50 مل ب 1 مل من PBS وانقل الغسيل إلى أنبوب الطرد المركزي الدقيق سعة 2 مل.
- الطرد المركزي للعينات عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية. قم بتخزين كريات الخلية عند -20 درجة مئوية.
- ابدأ الزراعة المشتركة بإضافة خلايا عربة التسوق إلى خلايا CD19 + JeKo-1 بنسبة 1: 1. على سبيل المثال ، أضف 80 × 106 خلايا عربة إلى 80 × 106 خلايا JeKo-1. ارفع الحجم الإجمالي للاستزراع المشترك إلى 160 مل مع الطب الصيني التقليدي. قم بتخزين العينات في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
ملاحظة: نوصي بالبدء بما لا يقل عن 80 × 10 6خلايا عربة للاحتفاظ بتمثيل المكتبة والحصول على خلايا كافية للحفاظ على العينات في اليوم 15 واليوم 22.
- اليوم 10: لإعادة تحفيز خلايا العربة العربية ، اجمع المزارع المشتركة في أنابيب مخروطية سعة 50 مل وقم بالطرد المركزي للعينات عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق كل عينة في 80 مل من الطب الصيني التقليدي ، وأضف 80 × 106 خلايا JeKo-1 في 80 مل من الطب الصيني التقليدي. قم بتخزين العينات في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- اليومان 12 و 14: إعادة تحفيز خلايا العربة كما في الخطوة 7.2.
- اليوم 15: الحفاظ على عينات NGS وإعادة تحفيز خلايا العربة.
- اعزل خلايا العربة من الزراعة المشتركة عن طريق عد الخلايا أولا ثم الجمع بين مجموعة الاختيار الإيجابية للخلايا التائية CD4 + مع مجموعة اختيار إيجابية للخلايا التائية CD8 + لعزل الخلايا التائية من الثقافات المشتركة CART-JeKo-1. عد الخلايا التائية.
- احتفظ بعينات NGS عن طريق نقل 33 × 106 خلايا عربة في أنبوب مخروطي سعة 50 مل والطرد المركزي للعينة عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق العينة في 1 مل من PBS وانقلها إلى أنبوب طرد مركزي دقيق سعة 2 مل. اغسل الأنبوب المخروطي سعة 50 مل ب 1 مل من PBS وانقل الغسيل إلى أنبوب الطرد المركزي الدقيق سعة 2 مل. الطرد المركزي للعينات عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية ؛ إزالة المادة الطافية وتخزين كريات الخلية عند -20 درجة مئوية.
- قم بإعداد الثقافات المشتركة لمواصلة نموذج المختبر للاستنفاد عن طريق إضافة 80 × 106 خلايا عربة إلى 80 × 106 خلايا JeKo-1. بعد ذلك ، ارفع الحجم الإجمالي للزراعة المشتركة إلى 160 مل مع الطب الصيني التقليدي. قم بتخزين العينات في حاضنة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
- الأيام 17 و 19 و 21: إعادة تحفيز خلايا العربة كما في الخطوة 7.2.
- اليوم 22: الحفاظ على عينات NGS.
- اعزل خلايا عربة الأطفال عن الزراعة المشتركة عن طريق عد الخلايا أولا. بعد ذلك ، اجمع بين مجموعة الاختيار الإيجابية للخلايا التائية CD4 + مع مجموعة اختيار إيجابية للخلايا التائية CD8 + لعزل الخلايا التائية من الثقافات المشتركة CART-JeKo-1. عد الخلايا التائية.
- للحفاظ على عينات NGS، كرر الخطوة 7.4.2.
8. تحضير الحمض النووي الجيني لتسلسل الجيل التالي
ملاحظة: للحفاظ على التغطية الكافية ، يجب عزل الحمض النووي الجيني (gDNA) من 33 × 10 6خلايا عربة على الأقل. بالإضافة إلى ذلك ، يجب تحضير gDNA بالكامل من 33 × 106 خلايا عربة للتسلسل
- عزل gDNA من كريات الخلايا المجمدة باستخدام مجموعة عزل gDNA.
- تنقية gDNA من خلال ترسيب الإيثانول.
- قم بالتبريد المسبق 100٪ EtOH إلى -20 درجة مئوية.
- Aliquot الحمض النووي المملوء بالتساوي في عدة أنابيب أجهزة الطرد المركزي الدقيقة (200-250 ميكرولتر). أضف ما يلي إلى كل حصة: مجلدان من 100٪ EtOH (500 ميكرولتر لكل 250 ميكرولتر أو 400 ميكرولتر ل 200 ميكرولتر) ؛ 0.1 حجم من أسيتات الصوديوم 3 M (25 ميكرولتر لكل 250 ميكرولتر أو 20 ميكرولتر لكل 200 ميكرولتر) ؛ و 1 ميكرولتر من 20 مجم / مل جليكوجين. احتضان العينات طوال الليل عند -20 درجة مئوية.
- في اليوم الثاني ، قم بتدوير العينات عند 13,000 × جم لمدة 20 دقيقة لتبيير الحمض النووي المترسب. قم بإزالة المادة الطافية. اغسل الكريات ب 1 مل من 70٪ EtOH عن طريق الدوران عند 7,500 × جم لمدة 10 دقائق.
- قم بإزالة EtOH المتبقي تماما. اترك الكريات تجف لمدة 30-45 دقيقة.
- أعد تعليق الكريات في 50 ميكرولتر من الماء المعقم.
- تحضير gDNA ل NGS.
ملاحظة: تم تصميم بادئات NGS لمكتبة CRISPR هذه التي تضخيم gRNAs باستخدام تسلسلات محول Illumina في منشور سابق27. سيؤدي استخدام برايمر عكسي مختلف لكل عينة إلى ترميز كل عينة والسماح بتجميع العينات أثناء التسلسل.- تحضير العينات ل تفاعل البوليميراز المتسلسل بخليط التفاعل التالي (الحجم الكلي = 50 ميكرولتر): مزيج رئيسي عالي الدقة PCR ، 2x: 25 ميكرولتر ؛ الحمض النووي للقالب المجمع ، 0.5 ميكروغرام: 1 ميكرولتر ؛ التمهيدي الأمامي لمكتبة NGS ، 10 ميكرومتر: 1.25 ميكرولتر ؛ التمهيدي العكسي لمكتبة NGS ، 10 ميكرومتر: 1.25 ميكرولتر ؛ ماء خال من DNase: 21.5 ميكرولتر.
- إجراء تفاعل البوليميراز المتسلسل مع ظروف ركوب الدراجات التالية: الدورة 1: تشوه عند 98 درجة مئوية لمدة 3 دقائق ؛ الدورات 2-23: التنويذ 98 درجة مئوية لمدة 10 ثوان ، الصلب عند 63 درجة مئوية لمدة 10 ثوان ، يمتد عند 72 درجة مئوية لمدة 25 ثانية ؛ الدورة 24: تمتد عند 72 درجة مئوية لمدة دقيقتين.
- قم بتجميع تفاعلات تفاعل البوليميراز المتسلسل لكل عينة وتنقية منتج تفاعل البوليميراز المتسلسل باستخدام مجموعة تنقية تفاعل البوليميراز المتسلسل وفقا لتعليمات الشركة المصنعة.
- قم بتشغيل 3 ميكروغرام من منتج PCR لكل عينة على جل الاغاروز بنسبة 2٪ (وزن / حجم).
- قم بإزالة منتج تفاعل البوليميراز المتسلسل (~ 260-270 نقطة أساس) من الجل عن طريق استخراج الحمض النووي من الجل باستخدام مجموعة استخراج الجل وفقا لتعليمات الشركة المصنعة. قم بتخزين العينات المستخرجة عند -20 درجة مئوية.
- قم بإجراء تسلسل الجيل التالي (NGS) مع العينات. استهدف أكثر من 500 قراءة لكل gRNA في المكتبة.
9. تحليل نتائج التسلسل
- لتحليل NGS ، استخدم منصة MAGeCK-VISPR28. استخدم الإعدادات القياسية لخوارزمية تقدير الاحتمالية القصوى (MAGeCK-MLE). لإعداد ملفات الإخراج للتحليل:
- قم بتشغيل FASTQC لتقييم جودة ملف التسلسل31.
- دمج ملفات التسلسل المزدوجة لكل عينة باستخدام bbmerge32.
- قم بتحليل العينات في النظام الأساسي MAGeCK-VISPR باستخدام خوارزمية MAGeCK-MLE. بالنسبة لتحليل MAGeCK-MLE ، قم بتطبيع جميع أعداد gRNA إلى قائمة 1,000 gRNAs غير مستهدفة.
- تقييم جودة ملف التسلسل من خلال تقييم محتوى GC والجودة الأساسية وقراءات التسلسل والقراءات المعينة.
- قم بتقييم نجاح مرحلة الضغط الانتقائي لشاشة كريسبر من خلال تقييم التغييرات في مؤشر جيني ، وتجميع تحليل المكونات الرئيسية (PCA) ، والمسارات المرتبطة بقائمة الجينات المختارة سلبا32.
- استجواب أهم النتائج من خلال إجراء عمليات البحث في الأدبيات وإجراء تحليل المسار.
النتائج
لاستجواب الجينات والمسارات التي يمكن تحريرها لتحسين نشاط خلايا CART بطريقة غير متحيزة ، قمنا بتصميم شاشة خروج المغلوب CRISPR على مستوى الجينوم في المختبر (الشكل 1). تتكون هذه الشاشة من مرحلتين: مرحلة إنتاج خلايا العربة ومرحلة الضغط الانتقائي. في مرحلة إنت...
Discussion
أصبح التحرير الجيني أداة قوية في فهم آليات مقاومة العلاجات بالإضافة إلى تصميم علاجات جديدة بخلايا عربة التسوق لتحسين طول عمر ونشاط خلايا العربة16،17،26. في حين أن بعض استراتيجيات تحرير الجينات قد أظهرت تحسينات في نشاط خل?...
Disclosures
SSK هي مخترعة في مجال العلاج المناعي لمستقبلات المستويين المرخصة لشركة Novartis (من خلال اتفاقية بين Mayo Clinic وجامعة بنسلفانيا ونوفارتيس) وHumanigen (من خلال Mayo Clinic) وMettaforge (من خلال Mayo Clinic) وMustangBio (من خلال Mayo Clinic) وChymal therapeutics (من خلال Mayo Clinic). CS و CMR و SSK هم مخترعون في براءات الاختراع المرخصة لشركة Immix Biopharma. تتلقى SSK تمويلا بحثيا من Kite و Gilead و Juno و BMS و Novartis و Humanigen و MorphoSys و Tolero و Sunesis / Viracta و LifEngine Animal Health Laboratories Inc. و Lentigen. شاركت SSK في اجتماعات استشارية مع Kite / Gilead و Calibr و Luminary Therapeutics و Humanigen و Juno / BMS و Capstan Bio و Novartis. عملت SSK في مجلس سلامة البيانات والمراقبة مع Humanigen و Carisma. قامت SSK بفصل مستشار Torque و Calibr و Novartis و Capstan Bio و BMS و Carisma و Humanigen. CMS و SSK مخترعان للملكية الفكرية التي نتجت عن هذا البروتوكول.
Acknowledgements
تم تمويل هذه الدراسة جزئيا من قبل مركز Mayo Clinic للطب الفردي (SSK)، ومركز Mayo Clinic الشامل للسرطان (SSK)، ومركز Mayo Clinic للعلاجات الحيوية التجديدية (SSK)، والمعاهد الوطنية للصحة K12CA090628 (SSK) و R37CA266344-01 (SSK)، ومنح وزارة الدفاع CA201127 (SSK)، ومؤسسة بريدولين (SSK)، وشراكة مينيسوتا للتكنولوجيا الحيوية وعلم الجينوم الطبي (SSK). يتم دعم CMS من قبل كلية الدراسات العليا للعلوم الطبية الحيوية في Mayo Clinic. تم إنشاء مخطط شاشة CRISPR (الشكل 1) باستخدام BioRender.com (Siegler، L. (2022) https://BioRender.com/k71r054).
Materials
| Name | Company | Catalog Number | Comments |
| 293T cells | ATCC | CRL-3216 | Cells used for lentivirus production |
| Biotin ProteinL Antibody | GenScript | M00097 | anti-kappa chain antibody for CAR detection |
| Bovine Serum Albumin | Millipore Sigma | A7906 | |
| Carbenicillin disodium salt | Millipore Sigma | C1389-1G | Carbenicillin antibiotic |
| CD4 Isolation Beads | Miltenyi Biotec | 130-045-101 | |
| CD8 Isolation Beads | Miltenyi Biotec | 130-045-201 | |
| CTS (Cell Therapy Systems) Dynabeads CD3/CD28 | Gibco | 40203D | |
| Cytoflex | Beckman Coulter | NC2279958 | |
| DNase-Free Water | Invitrogen | AM9937 | |
| Dulbecco's modified eagle's medium (DMEM) | Corning | 10-017-CV | |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 14190-144 | |
| EasySep Human T Cell Isolation Kit | STEMCELL Technologies | 17951RF | Negative isolation kit |
| Endura Electrocompetent Cells | Biosearch Technologies | 60242-1 | Electrocompetent cells with recovery medium |
| Ethanol | Millipore Sigma | E7023 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| GeCKO v2 CRISPR Knockout Pooled Library A | AddGene | 1000000048 | CRISPR library plasmid |
| Gene Pulser II | Bio-Rad | 165-2105 | Electroporator |
| Glycogen | Millipore Sigma | 10901393001 | |
| JeKo-1 | ATCC | CRL-3006 | CD19+ target cells |
| Lipofectamine 3000 Transfection Reagent | ThermoFisher Scientific | L3000075 | Transfection reagent kit with a transfection reagent (Lipofectamine 3000 Reagent) and a neutral co-lipid reagent (p3000) |
| LIVE/DEAD Aqua | Invitrogen | L34966 | |
| Lymphoprep | STEMCELL Technologies | 7851 | Density gradient medium |
| Machery-Nagel NucleoBond Xtra Maxi Kits | ThermoFisher Scientific | 12748412 | Maxi-prep kit |
| NEBNext High-Fidelity 2X PCR MasterMix | New England BioLabs | M0541S | High fidelity PCR mastermix |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985-070 | Reduced serum medium |
| pCMVR8.74 | AddGene | 22036 | Lentiviral packaging plasmid |
| Pennicillin-streptomycin-glutamine (100X) | Life Technologies | 10378-016 | |
| pMD2.G | AddGene | 12259 | VSV-G envelope expressing plasmid |
| Pooled Human AB Serum | Innovative Research | ISERABHI | |
| Puromycin | Millipore Sigma | P8833 | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | Gek extraction kit |
| Qucik-DNA Midiprep Plus Kit | Zymo Research | D4075 | Kit used to isolate gDNA |
| RoboSep-S | STEMCELL Technologies | 21000 | Automated cell separator |
| Roswell Park Memorial Institute 1640 Medium (RPMI) | Gibco | 21870092 | |
| SepMate-50 | STEMCELL Technologies | 85450 | Density gradient separation tube |
| Sodium Acetate | Invitrogen | AM9740 | |
| Sodium Azide | Fisher Scientific | 71448-16 | |
| Streptavidin Antibody (PE) | BioLegend | 405203 | Secondary antibody used for CAR detection |
| T100 Thermal Cycler | Bio-Rad | 1861096 | |
| Ultracentrifuge (Optima XPN-80) | BeckmanCoulter | A99839 | |
| Vacuum Filter Systems, 0.22 µm | ThermoFisher Scientific | 567-0020 | |
| Vacuum Filter Systems, 0.45 µm | ThermoFisher Scientific | 165-0045 | |
| X-VIVO 15 Serum-Free Hematopoietic Cell Medium | Lonza | 04-418Q | Hematopoietic cell medium |
References
- Neelapu, S. S., et al. 5-year follow-up supports curative potential of axicabtagene ciloleucel in refractory large B-cell lymphoma (zuma-1). Blood. 141 (19), 2307-2315 (2023).
- Neelapu, S. S., et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med. 377 (26), 2531-2544 (2017).
- Locke, F. L., et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (zuma-1): A single-arm, multicentre, phase 1-2 trial. Lancet Oncol. 20 (1), 31-42 (2019).
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med. 378 (5), 439-448 (2018).
- Schuster, S. J., et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med. 380 (1), 45-56 (2018).
- Bai, Z., et al. Single-cell antigen-specific landscape of CAR T infusion product identifies determinants of CD19-positive relapse in patients with all. Sci Adv. 8 (23), eabj2820 (2022).
- Fraietta, J. A., et al. Determinants of response and resistance to CD19 chimeric antigen receptor (CAR) T cell therapy of chronic lymphocytic leukemia. Nat Med. 24, 563-571 (2018).
- Gennert, D. G., et al. Dynamic chromatin regulatory landscape of human CAR T cell exhaustion. Proc Natl Acad Sci USA. 118 (30), e2104758118 (2021).
- Deng, Q., et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas. Nat Med. 26 (12), 1878-1887 (2020).
- Sterner, R. M., Cox, M. J., Sakemura, R., Kenderian, S. S. Using CRISPR/CAS9 to knock out GM-CSF in CAR-T cells. J Vis Exp. (149), e59629 (2019).
- Sterner, R. M., et al. GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR-T cell function in xenografts. Blood. 133 (7), 697-709 (2019).
- Cox, M. J., et al. GM-CSF disruption in CART cells modulates T cell activation and enhances CART cell anti-tumor activity. Leukemia. 36 (6), 1635-1645 (2022).
- Ottaviano, G., et al. Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia. Sci Transl Med. 14 (668), eabq3010 (2022).
- Joung, J., et al. Genome-scale CRISPR-CAS9 knockout and transcriptional activation screening. Nat Protoc. 12, 828-863 (2017).
- Mccutcheon, S. R., et al. Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens. Nat Genet. 55, 2211-2223 (2023).
- Zhu, W., Kelly, C., Dagur, P., Dunbar, C. E., Cordes, S. CRISPR activation screen to optimize chimeric antigen receptor (CAR) T cell immunophenotype. Blood. 142 (Supplement 1), 4820-4820 (2023).
- Wang, D., et al. CRISPR screening of CAR T cells and cancer stem cells reveals critical dependencies for cell-based therapies. Cancer Discov. 11 (5), 1192-1211 (2021).
- Shifrut, E., et al. Genome-wide CRISPR screens in primary human T cells reveal key regulators of immune function. Cell. 175 (7), 1958-1971.e15 (2018).
- Belk, J. A., et al. Genome-wide crispr screens of T cell exhaustion identify chromatin remodeling factors that limit T cell persistence. Cancer Cell. 40 (7), 768-786.e7 (2022).
- Jiang, P., et al. Single-cell ATAC-seq maps the comprehensive and dynamic chromatin accessibility landscape of CAR-T cell dysfunction. Leukemia. 36 (11), 2656-2668 (2022).
- Rossi, J., et al. Preinfusion polyfunctional anti-CD19 chimeric antigen receptor T cells are associated with clinical outcomes in NHL. Blood. 132 (8), 804-814 (2018).
- Beider, K., et al. Molecular and functional signatures associated with CAR T cell exhaustion and impaired clinical response in patients with B cell malignancies. Cells. 11 (7), 1140 (2022).
- Wherry, E. J. T. cell exhaustion. Nat Immunol. 12, 492-499 (2011).
- Prinzing, B., et al. Deleting DNMT3A in CAR T cells prevents exhaustion and enhances antitumor activity. Sci Transl Med. 13, eabh0272 (2021).
- Lynn, R. C., et al. C-jun overexpression in CAR T cells induces exhaustion resistance. Nature. 576, 293-300 (2019).
- Tang, N., et al. TGF-beta inhibition via CRISPR promotes the long-term efficacy of CAR T cells against solid tumors. JCI Insight. 5 (4), e133977 (2020).
- Joung, J., et al. Genome-scale CRISPR-CAS9 knockout and transcriptional activation screening. Nat Protoc. 12 (4), 828-863 (2017).
- Li, W., et al. Quality control, modeling, and visualization of CRISPR screens with MAGeCK-VISPR. Genome Biol. 16, 281 (2015).
- Sakemura, R., et al. Targeting cancer-associated fibroblasts in the bone marrow prevents resistance to CART-cell therapy in multiple myeloma. Blood. 139 (26), 3708-3721 (2022).
- Stewart, C. M., et al. IL-4 drives exhaustion of CD8+ CART cells. Nat Commun. 15 (1), 7921 (2024).
- . FastQC: A quality control tool for high throughput sequence data Available from: https://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2010)
- . Bbmerge Available from: https://github.com/BioInfoTools/BBMap/blob/master/sh/bbmerge.sh (2019)
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed CAS9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-CAS9-mediated gene inactivation. Nat Biotechnol. 32 (12), 1262-1267 (2014).
- Dong, M. B., et al. Systematic immunotherapy target discovery using genome-scale in vivo CRISPR screens in CD8 T cells. Cell. 178 (5), 1189-1204.e23 (2019).
- Zhou, P., et al. Single-cell CRISPR screens in vivo map T cell fate regulomes in cancer. Nature. 624 (7990), 154-163 (2023).
- Sutra Del Galy, A., et al. In vivo genome-wide CRISPR screens identify SOCS1 as intrinsic checkpoint of CD4+ TH1 cell response. Sci Immunol. 6 (66), eabe8219 (2021).
- Ramos, A., et al. Leukemia-intrinsic determinants of CAR-T response revealed by iterative in vivo genome-wide CRISPR screening. Nat Commun. 14 (1), 8048 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved