A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عضيات معوية خنزير ثنائية الأبعاد تعكس الخصائص الفسيولوجية للأمعاء الأصلية
In This Article
Summary
تحدد هذه الدراسة بروتوكولا لتوليد طبقات أحادية ثنائية الأبعاد من عضيات الخنازير المشتقة من الأمعاء الدقيقة والغليظة. يتميز نمو هذه الطبقات الأحادية بزيادة قيم TEER ، مما يشير إلى سلامة ظهارية قوية. بالإضافة إلى ذلك, هذه أحادية الطبقات يعرض الاستجابات الإفرازية الفسيولوجية في تجارب غرفة أوسينج بعد تطبيق فورسكولين.
Abstract
يعمل الجهاز الهضمي (GIT) في هضم الطعام وامتصاص العناصر الغذائية ولكن أيضا كحاجز وقائي ضد مسببات الأمراض. تقليديا ، اعتمدت الأبحاث في هذا المجال على التجارب على ، ولكن هناك طلب متزايد على الطرق البديلة التي تلتزم بمبادئ 3R - استبدال وتقليلها وصقلها. ظهرت عضيات الخنازير كأداة واعدة ، حيث تقدم تكرارا أكثر دقة في المختبر للظروف في الجسم الحي من نماذج الخلايا التقليدية. أحد التحديات الرئيسية مع العضيات المعوية هو سطحها القمي المواجه للداخل والسطح القاعدي المواجه للخارج. يمكن التغلب على هذا القيد عن طريق إنشاء طبقات عضوية ثنائية الأبعاد (2D) على إدخالات عبر الويل (يشار إليها من الآن فصاعدا باسم الإدراج (الإدخالات)) ، مما يوفر الوصول إلى كلا السطحين. في هذه الدراسة ، نجحنا في تطوير ثقافات ثنائية الأبعاد من عضيات الصائم والقولون. تتضمن عملية الزراعة مرحلتين رئيسيتين: أولا ، تكوين طبقة أحادية الخلوية ، يليها تمايز الخلايا باستخدام وسائط مخصصة. يتم تتبع النمو الخلوي عن طريق قياس المقاومة الكهربائية عبر الظهارة ، والتي تستقر بحلول اليوم 8 لحضيات القولون واليوم 16 للعضيات الصائمية. بعد مرحلة التمايز لمدة يومين ، تكون الظهارة جاهزة للتحليل. لتحديد وتتبع عمليات النقل الكهربائي النشطة ، مثل إفراز الكلوريد ، نستخدم تقنية غرفة أوسينغ. تسمح هذه الطريقة بالقياس في الوقت الفعلي والتوصيف التفصيلي لعمليات النقل الظهارية. يوفر هذا النموذج المبتكر في المختبر ، جنبا إلى جنب مع التقنيات الراسخة مثل غرفة Ussing ، منصة قوية لتوصيف الجهاز الهضمي الخنازير من الناحية الفسيولوجية ضمن إطار 3R. كما أنه يفتح فرصا للتحقيق في الآليات الفيزيولوجية المرضية وتطوير استراتيجيات علاجية محتملة.
Introduction
يلعب الجهاز الهضمي دورا مركزيا في الهضم وامتصاص العناصر الغذائية وإفراز النفايات من خلال البراز1. بالإضافة إلى ذلك ، فهو يعمل كحاجز ضد مسببات الأمراض ، وهو دور مدعوم بتركيبة خلوية متنوعة ، بما في ذلك الخلايا الجذعية ، وخلايا الكأس المنتجة للمخاط ، وخلايا الغدد الصماء المعوية ، والخلايا المعوية الماصة2. يمكن أن يتعطل التوازن المعوي بسبب عوامل مختلفة ، مثل الالتهابات البكتيرية3 أو العمليات الالتهابية4 ، مما يؤدي إلى عواقب وخيمة على الكائن الحي ، مثل سوء الامتصاص أو الإسهال أو حتى الموت5. عادة ما يتم التحقيق في مثل هذه السيناريوهات الفيزيولوجية المرضية باستخدام المختبر أو ، وفقا لمبدأ 3R6 ، مزارع الخلايا المشتقة من أنواع مختلفة. يعد التنبؤ الدقيق وقابلية نقل النتائج أمرا بالغ الأهمية عند استخدام نماذج خاصة بالأنواع7. على الرغم من هذه الحاجة ، هناك نقص ملحوظ في مزارع الخلايا المشتقة من الخنازير والتي تكرر بشكل كاف تعقيد ووظائف الأمعاء.
لمواجهة هذا التحدي ، الذي يتعلق أيضا بالأنواع الأخرى ، تم تطوير عضيات ثلاثية الأبعاد (3D) في محاولة لتكرار التعقيد الفسيولوجي ل GIT8. في البداية ، تم إنشاء العضيات من أمعاء الإنسان والفئران. حتى الآن ، تم أيضا تطوير وزراعة عضيات الخنازير من الخنازير الصغيرة والبالغةبنجاح 9,10. منذ إنشائها ، تم استخدام هذه العضيات الخنازير في العديد من الدراسات ، مع التركيز بشكل أساسي على الالتهابات المعوية11،12،13،14. لا تزال الأبحاث التي تهدف إلى توصيف الخصائص الفسيولوجية ، مثل نقل المغذيات أو العمليات الإفرازية ، محدودة15. قد يكون هذا بسبب اتجاه العضيات المعوية ، حيث يكون السطح القمي متجها للداخل والجانب القاعدي للخارج ، مما يحد من إمكانية الوصول إلى السطح القمي. تمت معالجة هذا القيد من خلال زراعة عضويات الخنازير بنجاح بتنسيق ثنائيالأبعاد 16 ، وهي طريقة تم تطويرها بشكل أكبر من خلال استخدام الأنسجة المجمدة لتوليدها17.
توفر الزراعة ثنائية الأبعاد لعضويات الخنازير الوصول إلى جانبي الظهارة ، مما يتيح تطبيق طرق راسخة لدراسة عمليات النقل عبر الطبقة الظهارية. إحدى هذه الطرق هي غرفة Ussing18 ، والتي تسمح بالمراقبة في الوقت الفعلي للعمليات الممتصة والإفرازية الكهربية عبر الظهارة. يوفر الاستخدام المكثف لهذا النظام فهما شاملا لوظيفة أمعاء الخنازير في الجسم الحي ، ويغطي محور الأمعاء بأكمله. يتضمن ذلك دراسات حول نقل السكريات الأحادية أو نقل الأحماض الدهنية قصيرة السلسلة أو الاستجابات لمستقلبات النباتات الثانوية مثل الريسفيراترول التي تؤثر على خصائص النقل المعوي19،20،21،22،23،24. تسهل المجموعة الكبيرة من البيانات من هذه الدراسات إجراء مقارنات مباشرة بين الظروف المميزة جيدا في الجسم الحي والبيئة المختبرية لحضيات الخنازير ، مما يعزز فهمنا لأهميتها الفسيولوجية.
في هذه الدراسة ، نقدم بروتوكولا لتوليد وزراعة طبقات أحادية ثنائية الأبعاد من عضيات الخنازير ثلاثية الأبعاد. بالإضافة إلى ذلك ، نقوم بتفصيل النهج المنهجي لتحديد عمليات النقل المعوي باستخدام تقنية غرفة أوسينغ. يوفر البروتوكول أدوات لدراسة الخصائص الماصة والإفرازية في المختبر في عضيات الصائم والقولون ، مما يسمح بالمقارنة المباشرة مع الظروف المميزة جيدا في الجسم الحي . قد تشمل التطبيقات المستقبلية لهذا البروتوكول التحقيق في تأثيرات المواد الدوائية أو السمية ، بالإضافة إلى استكشاف التفاعلات بين الظهارة وممرضات الأمراض.
Protocol
بالنسبة لهذا البروتوكول ، تم التضحية بخنزيرين سليمين (خنزير Bentheim Blacked Pied ؛ ذكر واحد ، أنثى واحدة ؛ 4.5 أشهر ، حوالي 65 كجم) عن طريق إطلاق النار والنزيف في الأسر. وفقا لقانون حماية ، لا يتم تصنيف هذا (ذبح وإزالة الأنسجة) على أنه تجربة على ولكن يجب إبلاغ مسؤول رعاية (رقم التسجيل. TiHo-T-2023-15) من مؤسسة هانوفر بجامعة الطب البيطري.
1. طلاء الإدراج
ملاحظة: يتم تنفيذ جميع الخطوات بمواد معقمة تحت خزانة أمان. يتم تنفيذ جميع خطوات البروتوكول على الجليد إذا لم ينص على خلاف ذلك.
- قم بإذابة الغشاء القاعدي المتجمد على الجليد لمدة ساعة واحدة على الأقل في درجة حرارة الغرفة أو طوال الليل على الجليد عند 4 درجات مئوية. امزج الغشاء القاعدي 1:40 (حجم / حجم) مع محلول ملحي معقم معقم بالفوسفات (PBS) في أنبوب مخروطي الشكل.
- قم بإزالة الألواح المعقمة مع إدخالات من العبوة. أضف 200 ميكرولتر من مزيج الغشاء القاعدي إلى الحجرة القمية لكل إدخال.
- استبدل غطاء لوحة البئر واحتضنه لمدة 1.5 ساعة على الأقل عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 في حاضنة.
- استنشق المحلول بعناية قبل بذر الخلايا. تأكد من أن الطرف لا يلمس الغشاء أثناء الشفط.
2. توليد أحادي الطبقات العضوية 2D
ملاحظة: يتم إنشاء عضيات القولون الخنازير وزراعتها كما هو موضح للعضيات الصائمية الخنازير25. بعد توليد العضيات ثلاثية الأبعاد ، يجب زراعتها لمدة 3-4 أسابيع على الأقل أثناء المرور الأسبوعي لضمان نمو ثابت. عدد الخلايا داخل كل قبة تحتوي على عضيات ثلاثية الأبعاد ، والتي يتم إذابتها في الخطوات اللاحقة ، يكفي لتغطية مرشح غشاء واحد. قبل توليد أحادية الطبقة ، خضعت العضيات ثلاثية الأبعاد لمراقبة الجودة البصرية للتحقق من النمو السابق والتلوث المحتمل (الشكل 1).

الشكل 1: العضويات ثلاثية الأبعاد التمثيلية. يتم فحص عضيات القولون ثلاثية الأبعاد (أ) الصائم و (ب) بعناية تحت المجهر قبل توليد طبقات أحادية. يتم إيلاء اهتمام خاص لتقييم أنماط النمو السابقة والسلامة الهيكلية ووجود أي شوائب أو تلوث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بإزالة الوسط العضوي (الجدول 1) من الآبار باستخدام عضيات القبو ثلاثية الأبعاد. أضف 1 مل من PBS المثلج لكل بئر وقم بإذابة الغشاء القاعدي برفق عن طريق سحب العينات لأعلى ولأسفل بطرف p1000.
- اجمع جميع العضيات الذائبة في أنبوب سعة 15 مل مملوء مسبقا ب 10 مل من PBS المثلج. جهاز الطرد المركزي للأنبوب عند 250 × جم ، 10 دقائق عند 4 درجات مئوية. شفط المادة الطافية.
- أعد تعليق الحبيبات في 1 مل من التربسين الدافئ (37 درجة مئوية) 0.05٪ (حجم / حجم) التربسين / EDTA (يمكن تجميع أنبوبين في هذه المرحلة). احتضن لمدة 5 دقائق عند 37 درجة مئوية في حمام مائي وضعه مباشرة على الثلج بعد ذلك لإيقاف التفاعل.
- أعد التعليق على الثلج 20 ضعفا مع طرف p1000 ، و 15 ضعفا آخر مع طرف p1000 + طرف p200 في الأعلى. أضف 10 مل من DMEM المثلج المكمل بمصل ربلة الساق الجنينية بنسبة 10٪ (v / v).
- أنبوب الطرد المركزي عند 1,000 × جم ، 10 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسط أحادي الطبقة (الجدول 1).
- حدد عدد الخلايا الحية لكل مل باستخدام غرفة Neubauer وفقا لتعليمات الشركة المصنعة.
- قم بإزالة محلول الطلاء في هذه المرحلة من الحجرة القمية واستبدله ب 500 ميكرولتر من الوسط أحادي الطبقة الدافئ (37 درجة مئوية). أضف 3 مل من الوسط أحادي الطبقة إلى المقصورة القاعدية الجانبية.
- حدد المقاومة الفارغة (TEER) لكل إدراج بئر فارغ ، كما هو موضح بالتفصيل في الخطوة 3. يجب أن يكون الوقت الذي لا يوجد فيه وسيط في الغرفة القمية قصيرا قدر الإمكان لمنع الخلايا من الجفاف.
- قم بإزالة الوسط أحادي الطبقة القمي وأضف للثقافة الصائمية 2 × 105 خلايا ظهارية وللثقافة ثنائية الأبعاد للقولون 1.5 × 105 خلايا ظهارية في 500 ميكرولتر من الوسط أحادي الطبقة في الغرفة القمية لكل بئر.
- قم بتغيير الوسيط وقياس TEER كل 2-3 أيام. قم بقياس TEER قبل تغيير الوسيط. قم بشفط وسط المقصورة القمية والقاعدية بعناية واستبدله ب 500 ميكرولتر أو 3 مل من الوسط الطازج والدافئ (37 درجة مئوية).
- بالنسبة للعضيات الصائمية: في اليوم 16 ، بعد البذر ، قم بالتغيير من متوسط أحادي الطبقة إلى وسط التمايز (الجدول 1). بالنسبة لعضيات القولون: قم بتغيير الوسط في اليوم 7 إلى وسط التمايز.
- قم بتغيير وسيط التمايز كل يوم وقم بإجراء قياس TEER أثناء كل تغيير متوسط. في اليوم 18 (للعضيات الصائمية) أو اليوم 9 (لعضويات القولون) ، بعد البذر ، تابع التجارب الوظيفية.
3. قياس المقاومة الكهربائية عبر الظهارة (TEER)
ملاحظة: يتم إجراء جميع القياسات تحت خزانة أمان لتجنب التلوث. قبل بذر الخلايا ، يتم قياس كل بئر مغلف فارغ للحصول على قيم فارغة فردية. يخزن مقياس فولت أوم القيم على جهاز USB تم تقديمه.
- نظف قطب عود تناول الطعام بنسبة 70٪ (حجم / حجم) من الإيثانول واترك القطب يجف تماما. في هذه الأثناء ، أخرج الطبق من الحاضنة وضعه تحت الخزانة.
- أدخل الذراع القصير لقطب عيدان تناول الطعام إلى المقصورة القمية للإدخالات والذراع الطويل إلى الحجرة القاعدية الجانبية للإدخال. تجنب ملامسة الذراع القصيرة لطبقة الخلية.
- قم بقياس المقاومة الكهربائية عبر الظهارة لكل بئر. اسمح لمقياس الفولت أوم بالتوازن لضمان قياس مستقر. قم بقياس قيم TEER بالنقر فوق الزر المتجر.
- تابع الخطوتين 3.2 و 3.3 مع الآبار المتبقية. بعد الوصول إلى البئر الأخير ، يفتح مقياس فولت أوم طلبا لتخزين البيانات على جهاز USB. انقر على حفظ.
- نظف القطب بعد كل لوحة وفي نهاية القياس واتركه يجف تماما قبل التخزين.
- اطرح القيم الفارغة المحددة قبل زرع الخلايا من القيم الخلوية المقاسة.
4. دراسات النقل الفيزيولوجية الكهربية باستخدام تقنية غرفة أوسينج
ملاحظة: يتم تحديد دراسات النقل الفيزيولوجية الكهربية باستخدام غرفة Ussing التي تتكون من مقصورتين من الغرفة ، والتي يتم تقسيمها بواسطة الظهارة. هذه الغرفة متصلة بمشبك جهد بواسطة أقطاب Ag / AgCl. تسمح هذه التقنية بتتبع عمليات النقل الكهربائي النشطة للظهارة من خلال التغيرات في تيار الدائرة القصيرة (Isc) الناجم عن مشبك الجهد بالإضافة إلى مقاومة الأنسجة (Rt) المحسوبة بواسطة قانون أوم. يتم تسجيل Isc و Rt كل 6 ثوان خلال التجربة بأكملها. أثناء التجربة ، يتم تهوية الأنسجة التي تم فحصها بالكربوجين وتحضنها بمحاليل Krebs-Henseleit المعدلة لضمان ظروف قابلة للحياة. يضاف الإندوميتاسين (10 ميكرومتر) إلى المحاليل العازلة لتثبيط تخليق البروستاجلاندين26.
- تسخين المحاليل العازلة للغشاء المخاطي والمصلي إلى 37 درجة مئوية وتهويتها بالكربوجين. قم بتجميع الغرف المفردة باستخدام ملحق فارغ لكل غرفة على حدة. تأكد من أن الجوانب القمية للآبار كلها تواجه نفس الاتجاه.
- املأ جميع الغرف ب 5 مل من محلول الغشاء المخاطي الدافئ مسبقا (الجدول 2). قم بتوصيل جميع الأقطاب الكهربائية من مشبك الجهد إلى الغرف الفردية وفقا لتعليمات الشركة المصنعة. تأكد من عدم تداخل فقاعات الغاز مع الأقطاب الكهربائية لضمان القياس الصحيح.
- قم بمعايرة برنامج غرفة Ussing بهذه الشروط بالنقر فوق الزر Rf / dpI في برنامج مشبك الجهد. يجب أن تكون مقاومة جميع الإدخالات الفارغة المستخدمة متساوية (~ 70 أوم) ، ويجب أن يكون التيار حوالي 0 مللي فولت (± 5 مللي فولت). إذا لم يكن هذا هو الحال بالنسبة لبعض الغرف ، فتحقق من الوضع المناسب للأقطاب الكهربائية أو الفقاعات في النظام.
- قم بإزالة جميع الأقطاب الكهربائية وتخلص من محلول المخزن المؤقت المستخدم. افتح جميع الغرف الفردية وقم بإزالة الإدخالات الفارغة. تأكد من الحفاظ على ترتيب الغرف الفردية.
- انقل لوحة البئر مع إدخالات من الحاضنة إلى خزانة الأمان. استنشق بعناية الوسط القاعدي الوحشي والقمي.
- اغسل الخلايا بإضافة 500 ميكرولتر من المخزن المؤقت المخاطي الدافئ (37 درجة مئوية) إلى الغرفة القمية و 3 مل من المخزن المؤقت المصلي إلى الغرفة القاعدية الجانبية. استنشق المخازن المؤقتة وكرر 2x.
- قم بإزالة الإدخالات من اللوحة. قم بإزالة دعامات الإدخالات برفق. ضع الإدخالات في غرف Ussing ، وتأكد من أن اتجاه الإدخالات هو نفسه كما هو الحال أثناء مرحلة المعايرة. قم بتجميع الغرف الفردية كما هو موضح في الشكل 2.
- املأ الغرف التي تواجه الجانب القاعدي الجانبي للخلايا ب 5 مل من العازلة المصلية (الجدول 2) والغرفة المواجهة للغرفة القمية ب 5 مل من العازلة المخاطية.
- قم بتوصيل الأقطاب الكهربائية وأنابيب التهوية بكل غرفة على حدة. ابدأ القياس في برنامج Ussing. اترك التوازن لمدة 15 دقيقة.
- قم بتغيير الظروف من الدائرة المفتوحة إلى ظروف ماس كهربائى. توازن لمدة 5 دقائق إلى 10 دقائق. أضف 10 ميكرومتر من فورسكولين إلى الغرفة المصلية.
ملاحظة: يمكن استبدال إضافة فورسكولين بعوامل أخرى/مواد تبعا لقطاعات الأمعاء الفردية وأسئلة البحث. - بعد 15 دقيقة, إما إضافة المزيد من العوامل بنفس الطريقة فورسكولين أو إيقاف القياس. قم بإزالة أنابيب التهوية والأقطاب الكهربائية من الغرف الفردية. صب المحاليل العازلة لكلتا الغرفتين في وعاء.
- قم بتفكيك الغرف وإما التخلص من الإدخالات أو استخدامها لتحليل المتابعة (على سبيل المثال ، الكيمياء المناعية أو تحليل التعبير)
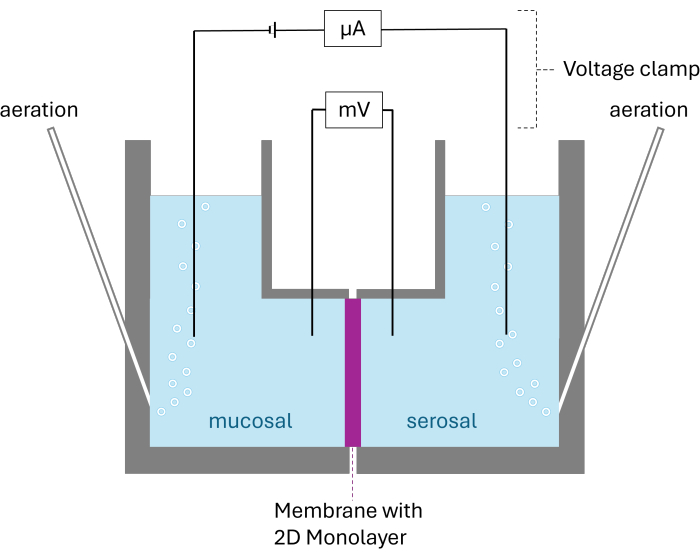
الشكل 2: الهيكل التخطيطي لغرفة Ussing. المعروضة كلتا الغرفتين مقسومة على الغشاء مع طبقة أحادية الأبعاد 2D. كلتا الغرفتين مهواة بالكربوجين. تتم مراقبة الجهد والتيار بواسطة قطبين كهربائيين لكل غرفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحليل البيانات التي تم إنشاؤها بواسطة إعداد غرفة Ussing
- قم باستيراد البيانات التي تم إنشاؤها بواسطة برنامج مشبك الجهد إلى محرر جداول بيانات مناسب.
- لتحديد القيم القاعدية Isc و Rt ، احسب متوسط 10 نقاط بيانات متتالية تم أخذها بعد 10 دقائق من تهيئة ظروف ماس كهربائى. تعمل كل غرفة فردية كتكرار تقني ، بينما يعمل كل مرور من العضيات كتكرار بيولوجي.
- لتقييم تأثيرات العوامل المطبقة ، احسب متوسط 10 نقاط بيانات متتالية قبل إضافة الوكيل مباشرة. قارن هذا المتوسط بالقيمة القصوى (أو الدنيا) التي لوحظت بعد تطبيق العامل. يتم تقديم البيانات التي تم الحصول عليها كمتوسط ± الانحراف المعياري (SD).
النتائج
يسهل هذا البروتوكول التوليد الموثوق به للطبقات الأحادية ثنائية الأبعاد من الخنازير عن طريق تصنيف العضيات ثلاثية الأبعاد المشتقة من الصائم والقولون للخنازير. على مدى فترة زراعة مدتها 16 يوما للعضيات الصائم و 9 أيام لعضويات القولون ، تتشكل طبقات أحادية سليمة. يمكن استخدام...
Discussion
يصف هذا البروتوكول طريقة لتحويل عضيات الخنازير ثلاثية الأبعاد الراسخة إلى خلايا مفردة ، والتي يتم زرعها بعد ذلك على أغشية عبر البئر لتشكيل طبقة أحادية سليمة. يمنح هذا التكوين الوصول إلى الجانب القمي للخلايا ، مما يسهل استخدام غرف Ussing لمراقبة العمليات الاستيعابية والإف?...
Disclosures
ليس لدينا أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر الوزارة الفيدرالية للأغذية والزراعة (BLE# 28N-2-071-00) على التمويل.
Materials
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
References
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved