Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğal Bağırsağın Fizyolojik Özelliklerini Yansıtan İki Boyutlu Domuz Bağırsak Organoidleri
Bu Makalede
Özet
Bu çalışma, ince ve kalın bağırsaklardan türetilen 2D tek katmanlı domuz organoidleri oluşturmak için bir protokolün ana hatlarını çizmektedir. Bu tek tabakaların büyümesi, sağlam epitel bütünlüğünü gösteren artan TEER değerleri ile işaretlenir. Ek olarak, bu tek tabakalar, forskolin uygulamasını takiben Ussing odası deneylerinde fizyolojik salgı tepkileri sergiler.
Özet
Gastrointestinal sistem (GIT) hem gıdaların sindiriminde hem de besinlerin alımında değil, aynı zamanda patojenlere karşı koruyucu bir bariyer görevi görür. Geleneksel olarak, bu alandaki araştırmalar hayvan deneylerine dayanıyordu, ancak 3R ilkelerine uyan alternatif yöntemler için artan bir talep var - değiştirme, azaltma ve iyileştirme. Domuz organoidleri, in vivo koşulların geleneksel hücre modellerinden daha doğru bir in vitro replikasyonunu sunan umut verici bir araç olarak ortaya çıkmıştır. Bağırsak organoidleri ile ilgili en büyük zorluklardan biri, içe bakan apikal yüzeyleri ve dışa bakan bazolateral yüzeyleridir. Bu sınırlama, transwell ekleri üzerinde iki boyutlu (2D) organoid katmanlar oluşturularak (bundan sonra ek(ler) olarak anılacaktır) ve her iki yüzeye de erişim sağlayarak aşılabilir. Bu çalışmada, domuz jejunum ve kolon organoidlerinin iki boyutlu kültürlerini başarıyla geliştirdik. Yetiştirme süreci iki temel aşamadan oluşur: Birincisi, hücresel bir tek tabakanın oluşumu, ardından özel ortamlar kullanılarak hücrelerin farklılaşması. Hücresel büyüme, kolon organoidleri için 8. güne ve jejunum organoidleri için 16. güne kadar stabilize olan transepitelyal elektrik direncinin ölçülmesiyle izlenir. 2 günlük bir farklılaşma aşamasından sonra epitel analize hazır hale gelir. Klorür salgılanması gibi aktif elektrojenik taşıma süreçlerini ölçmek ve izlemek için Ussing odası tekniğini kullanıyoruz. Bu yöntem, epitel taşıma süreçlerinin gerçek zamanlı ölçümüne ve ayrıntılı karakterizasyonuna izin verir. Bu yenilikçi in vitro model, Ussing odası gibi yerleşik tekniklerle birleştirildiğinde, domuz GIT'ini 3R çerçevesi içinde fizyolojik olarak karakterize etmek için sağlam bir platform sağlar. Ayrıca patofizyolojik mekanizmaların araştırılması ve potansiyel terapötik stratejilerin geliştirilmesi için fırsatlar sunar.
Giriş
GIT, sindirim, besin emilimi ve dışkı yoluyla atık atılımında merkezi bir rol oynar1. Ek olarak, kök hücreler, mukus üreten goblet hücreleri, enteroendokrin hücreler ve emici enterositler2 dahil olmak üzere çeşitli bir hücresel bileşim tarafından desteklenen bir rol olan patojenlere karşı bir bariyer görevi görür. Bağırsak homeostazı, bakteriyel enfeksiyonlar3 veya enflamatuar süreçler4 gibi çeşitli faktörler tarafından bozulabilir ve organizma için emilim bozukluğu, ishal ve hatta ölüm5 gibi ciddi sonuçlara yol açabilir. Bu tür patofizyolojik senaryoların araştırılması genellikle laboratuvar hayvanları veya 3R prensibi6'ya uygun olarak çeşitli türlerden türetilen hücre kültürleri kullanılarak yapılır. Türe özgü modeller kullanılırken sonuçların doğru tahmini ve aktarılabilirliği çok önemlidir7. Bu ihtiyaca rağmen, bağırsak sisteminin karmaşıklığını ve işlevselliğini yeterince kopyalayan domuz türevli hücre kültürlerinin kayda değer bir eksikliği vardır.
Diğer türlerle de ilgili olan bu zorluğun üstesinden gelmek için, GIT8'in fizyolojik karmaşıklığını çoğaltmak amacıyla üç boyutlu (3D) organoidler geliştirilmiştir. Başlangıçta, organoidler insan ve farelerin bağırsaklarından oluşturuldu; Bugüne kadar, genç ve yetişkin domuzlardan elde edilen domuz organoidleri de başarıyla geliştirilmiş ve yetiştirilmiştir 9,10. Başlangıcından bu yana, bu domuz organoidleri, öncelikle bağırsak enfeksiyonlarına odaklanan çeşitli çalışmalarda kullanılmıştır 11,12,13,14. Besin taşınması veya salgılama süreçleri gibi fizyolojik özellikleri karakterize etmeyi amaçlayan araştırmalar sınırlı kalmaktadır15. Bu, apikal yüzeyin içe ve bazolateral tarafın dışa baktığı ve apikal yüzeye erişilebilirliği sınırlayan bağırsak organoidlerinin oryantasyonundan kaynaklanabilir. Bu sınırlama, domuz organoidlerinin iki boyutlu bir formatta16 başarılı bir şekilde yetiştirilmesiyle ele alındı, bu da onları17 oluşturmak için donmuş doku kullanımıyla daha da geliştirilmiş bir yöntem.
Domuz organoidlerinin 2 boyutlu kültivasyonu, epitelin her iki tarafına da erişim sağlayarak, epitel tabakası boyunca taşıma süreçlerini incelemek için iyi bilinen yöntemlerin uygulanmasını sağlar. Böyle bir yöntem, epitel boyunca elektrojenik emme ve salgılama süreçlerinin gerçek zamanlı olarak gözlemlenmesine izin veren Ussing odası18'dir. Bu sistemin yaygın kullanımı, tüm bağırsak eksenini kapsayan, in vivo olarak domuz bağırsak fonksiyonunun kapsamlı bir şekilde anlaşılmasını sağlamıştır. Bu, monosakkarit taşınması veya kısa zincirli yağ asitlerinin taşınması veya bağırsak taşıma özelliklerini etkileyen resveratrol gibi ikincil bitki metabolitlerine verilen yanıtlar üzerine çalışmaları içerir 19,20,21,22,23,24. Bu çalışmalardan elde edilen önemli miktarda veri, iyi karakterize edilmiş in vivo koşullar ile domuz organoidlerinin in vitro ortamı arasında doğrudan karşılaştırmaları kolaylaştırarak, fizyolojik alaka düzeylerine ilişkin anlayışımızı geliştirir.
Bu çalışmada, 3 boyutlu domuz organoidlerinden 2 boyutlu tek tabakaların üretilmesi ve yetiştirilmesi için bir protokol sunuyoruz. Ek olarak, Ussing odası tekniğini kullanarak bağırsak taşıma süreçlerini ölçmek için metodolojik yaklaşımı detaylandırıyoruz. Protokol, emilim ve salgı özelliklerini in vitro olarak jejunum ve kolon organoidlerini incelemek için araçlar sunar ve iyi karakterize edilmiş in vivo koşullarla doğrudan karşılaştırmaya izin verir. Bu protokolün gelecekteki uygulamaları, farmakolojik veya toksikolojik maddelerin etkilerinin araştırılmasının yanı sıra epitel ve patojenler arasındaki etkileşimlerin araştırılmasını içerebilir.
Protokol
Bu protokol için iki sağlıklı domuz (Bentheim Blacked Pied domuzu; 1 erkek, 1 dişi; 4.5 aylık; yaklaşık 65 kg) tutsak cıvata atışı ve kanaması ile sakrifiye edildi. Hayvanları Koruma Kanunu'na göre, bu (dokuların kesilmesi ve alınması) bir hayvan deneyi olarak sınıflandırılmaz, ancak hayvan refahı görevlisine bildirilmesi gerekir (kayıt no. TiHo-T-2023-15) Hannover Veterinerlik Üniversitesi Vakfı'ndan.
1. Eklerin kaplanması
NOT: Tüm adımlar bir güvenlik kabini altında steril malzemelerle gerçekleştirilir. Protokolün tüm adımları, aksi belirtilmedikçe buz üzerinde gerçekleştirilir.
- Donmuş bazal membranı oda sıcaklığında en az 1 saat buz üzerinde veya gece boyunca buz üzerinde 4 °C'de çözdürün. Bazal membranı 1:40 (h/v) ile buz gibi steril fosfat tamponlu salin (PBS) ile konik bir tüpte karıştırın.
- Ekleri olan steril plakaları ambalajından çıkarın. Her bir ekin apikal bölmesine 200 μL bazal membran karışımı ekleyin.
- Kuyu plakasının kapağını değiştirin ve bir inkübatörde 37 ° C'de,% 5 CO2 'de en az 1,5 saat inkübe edin.
- Hücreleri tohumlamadan önce çözeltiyi dikkatlice aspire edin. Aspirasyon sırasında ucun zara temas etmediğinden emin olun.
2. 2D organoid tek tabakaların oluşturulması
NOT: Domuz kolon organoidleri, domuz jejunal organoidleri25 için tarif edildiği gibi üretilir ve yetiştirilir. 3D organoidlerin üretilmesinden sonra, tutarlı bir büyüme sağlamak için bunlar haftalık geçiş sırasında en az 3-4 hafta boyunca yetiştirilmelidir. Sonraki adımlarda çözünen 3D organoidler içeren her bir kubbe içindeki hücre sayısı, tek bir transmembran filtreyi kaplamak için yeterlidir. Tek tabakalı üretimden önce, 3D organoidler, önceki büyümeyi ve olası kontaminasyonu kontrol etmek için optik kalite kontrolüne tabi tutuldu (Şekil 1).

Resim 1: Temsili 3D organoidler. Üç boyutlu (A) jejunum ve (B) kolon organoidleri, tek tabakalar oluşturulmadan önce mikroskop altında dikkatlice incelenir. Önceki büyüme modellerinin, yapısal bütünlüğün ve herhangi bir safsızlık veya kontaminasyonun varlığının değerlendirilmesine özel önem verilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Organoid ortamı (Tablo 1) 3D kript organoidleri ile kuyulardan çıkarın. Oyuk başına 1 mL buz gibi soğuk PBS ekleyin ve bir p1000 ucu ile yukarı ve aşağı pipetleyerek bazal membranı nazikçe çözün.
- Tüm çözünmüş organoidleri, 10 mL buz gibi soğuk PBS ile önceden doldurulmuş 15 mL'lik bir tüpte toplayın. Tüpü 250 x g'da, 4 ° C'de 10 dakika santrifüjleyin. Süpernatanı aspire edin.
- Peleti 1 mL ılık (37 °C) %0,05 (h/h) tripsin/EDTA içinde yeniden süspanse edin (bu aşamada 2 tüp toplanabilir). Bir su banyosunda 37 ° C'de 5 dakika inkübe edin ve daha sonra reaksiyonu durdurmak için doğrudan buzun üzerine koyun.
- P20 ucu ile 1000x buz üzerinde ve üstte p15 ucu + p1000 ucu ile 200x daha tekrar askıya alın. % 10 (h / h) fetal buzağı serumu (FCS) ile desteklenmiş 10 mL buz gibi soğuk DMEM ekleyin.
- 1.000 x g'da santrifüj tüpü, 4 ° C'de 10 dakika. Süpernatanı atın ve peleti 1 mL tek katmanlı ortamda yeniden süspanse edin (Tablo 1).
- Üreticinin talimatlarına göre bir Neubauer odası kullanarak mL başına canlı hücre sayısını belirleyin.
- Bu noktada kaplama solüsyonunu apikal bölmeden çıkarın ve 500 μL ılık (37 ° C) tek katmanlı ortamla değiştirin. Basolateral bölmeye 3 mL tek katmanlı ortam ekleyin.
- Adım 3'te ayrıntılı olarak açıklandığı gibi, her bir boş transwell ekinin boş direncini (TEER) belirleyin. Apikal odada hiçbir ortamın bulunmadığı süre, hücrelerin kurumasını önlemek için mümkün olduğunca kısa olmalıdır.
- Apikal tek tabakalı ortamı çıkarın ve jejunal 2D kültür için 2 x 105 epitel hücresi ve kolonik 2D kültür için 1.5 x 105 epitel hücresi ekleyin, her transwell'in apikal odasına 500 μL tek katmanlı ortamda.
- Ortamı değiştirin ve her 2-3 günde bir TEER'i ölçün. Ortam değiştirilmeden önce TEER'i ölçün. Apikal ve bazal bölmenin ortamını dikkatlice aspire edin ve 500 μL veya 3 mL taze, ılık (37 ° C) ortamla değiştirin.
- Jejunum organoidleri için: 16. günde, tohumlamadan sonra, tek tabakalı ortamdan farklılaşma ortamına geçin (Tablo 1). Kolon organoidleri için: 7. günde ortamı farklılaşma ortamına değiştirin.
- Farklılaşma ortamını her gün değiştirin ve her ortam değişikliği sırasında TEER ölçümü yapın. 18. günde (jejunal organoidler için) veya 9. günde (kolon organoidleri için), tohumlamadan sonra fonksiyonel deneylere devam edin.
3. Transepitelyal elektrik direncinin (TEER) ölçümü
NOT: Kontaminasyonu önlemek için tüm ölçümler bir güvenlik kabini altında gerçekleştirilir. Hücreleri tohumlamadan önce, her boş kaplanmış transkuyucuk, ayrı ayrı boş değerler elde etmek için ölçülür. Volt-ohm metre, değerleri tanıtılan bir USB cihazında saklar.
- Çubuk elektrodu %70 (h/h) etanol ile temizleyin ve elektrotun tamamen kurumasını bekleyin. Bu arada, plakayı inkübatörden çıkarın ve kabinin altına yerleştirin.
- Çubuk elektrodunun kısa kolunu eklerin apikal bölmesine ve uzun kolu ek parçanın bazolateral bölmesine yerleştirin. Kısa kolun hücre tabakası ile temasından kaçının.
- Her bir transwell'in transepitelyal elektrik direncini ölçün. Kararlı bir ölçüm sağlamak için volt-ohm metrenin dengelenmesine izin verin. Mağaza düğmesine tıklayarak TEER değerlerini ölçün.
- Kalan kuyucuklarla 3.2 ve 3.3 adımlarına devam edin. Son kuyuya ulaştıktan sonra, volt-ohm metre, verileri bir USB cihazında saklamak için bir istek açar. Kaydet'i tıklayın.
- Her plakadan sonra ve ölçümün sonunda elektrodu temizleyin ve saklamadan önce tamamen kurumasını bekleyin.
- Hücreleri tohumlamadan önce belirlenen boş değerleri, ölçülen hücresel değerlerden çıkarın.
4. Ussing odası tekniği kullanılarak yapılan elektrofizyolojik transport çalışmaları
NOT: Elektrofizyolojik taşıma çalışmalarının belirlenmesi, epitel ile bölünmüş iki bölmeden oluşan bir Ussing odası kullanılarak gerçekleştirilir. Bu oda, Ag / AgCl Elektrotları ile bir voltaj kelepçesine bağlanır. Bu teknik, voltaj kelepçesi tarafından indüklenen kısa devre akımındaki (Isc) değişiklikler ve Ohm yasası ile hesaplanan doku direnci(RT) yoluyla epitelin aktif elektrojenik taşıma süreçlerinin izlenmesine izin verir. Isc ve Rt, tüm deney boyunca her 6 saniyede bir kaydedilir. Deney sırasında, incelenen doku karbojen ile havalandırılır ve uygulanabilir koşulları sağlamak için modifiye edilmiş Krebs-Henseleit çözeltileri ile inkübe edilir. Prostaglandin sentezini inhibe etmek için tampon çözeltilerine indometazin (10 μM) eklenir26.
- Mukozal ve serozal tampon çözeltilerini 37 °C'ye ısıtın ve karbojen ile havalandırın. Her bir bölme için boş bir ek kullanarak tek bölmeleri birleştirin. Transwell'lerin apikal taraflarının hepsinin aynı yöne baktığından emin olun.
- Tüm odaları 5 mL önceden ısıtılmış mukozal tampon çözeltisi ile doldurun (Tablo 2). Voltaj kelepçesinden gelen tüm elektrotları üreticinin talimatlarına göre ayrı bölmelere bağlayın. Doğru ölçümü sağlamak için elektrotlara gaz kabarcığı girmediğinden emin olun.
- Voltage-clamp yazılımındaki Rf/dpI düğmesine tıklayarak Ussing odası yazılımını bu koşullarla kalibre edin. Kullanılan tüm boş eklerin direnci eşit olmalı (~ 70 Ohm) ve akım yaklaşık 0 mV (± 5 mV) olmalıdır. Bazı odalar için durum böyle değilse, sisteme elektrotların veya kabarcıkların uygun şekilde yerleştirilip yerleştirilmediğini kontrol edin.
- Tüm elektrotları çıkarın ve kullanılmış tampon çözeltisini atın. Tüm ayrı odaları açın ve boş ekleri çıkarın. Bireysel odaların sırasının korunduğundan emin olun.
- Kuyu plakasını eklerle birlikte inkübatörden güvenlik kabinine taşıyın. Bazolateral ve apikal ortamı dikkatlice aspire edin.
- Apikal odaya 500 μL ılık (37 °C) mukozal tampon ve bazolateral odaya 3 mL serozal tampon ekleyerek hücreleri yıkayın. Tamponları aspire edin ve 2 kez tekrarlayın.
- Ekleri plakadan çıkarın. Eklerin desteklerini yavaşça çıkarın. Ekleri Ussing odalarına yerleştirin ve eklerin yönünün kalibrasyon aşamasındaki ile aynı olduğundan emin olun. Tek tek odaları Şekil 2'de gösterildiği gibi birleştirin.
- Hücrelerin bazolateral tarafına bakan odaları 5 mL serozal tampon ile doldurun (Tablo 2) ve apikal odaya bakan odayı 5 mL mukozal tampon ile doldurun.
- Elektrotları ve havalandırma tüplerini her bir odaya bağlayın. Ussing yazılımında ölçümü başlatın. 15 dakika dengeye izin verin.
- Koşulları açık devreden kısa devre koşullarına değiştirin. 5 dakika ila 10 dakika arasında dengeleyin. Serozal odaya 10 μM forskolin ekleyin.
NOT: Forskolin ilavesi, bireysel bağırsak segmentlerine ve araştırma sorularına bağlı olarak diğer ajanlar / maddeler ile değiştirilebilir. - 15 dakika sonra, forskolin ile aynı şekilde daha fazla ajan ekleyin veya ölçümü durdurun. Havalandırma tüplerini ve elektrotları ayrı odalardan çıkarın. Her iki odanın tampon çözeltilerini bir kaseye dökün.
- Odaları sökün ve ekleri atın veya takip analizi için kullanın (örn., immünohistokimya veya ekspresyon analizi)
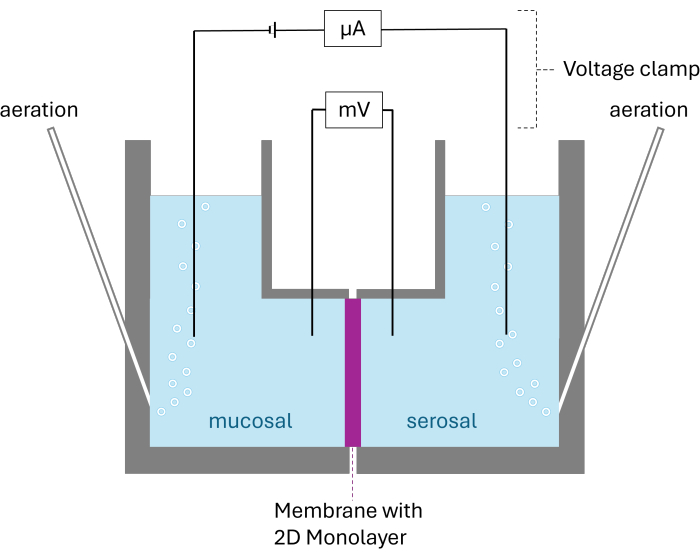
Şekil 2: Ussing odasının şematik yapısı. Görüntülenen, her iki oda, büyütülmüş 2D tek tabaka ile zar tarafından bölünmüştür. Her iki oda da karbojen ile havalandırılır; Voltaj ve akım, oda başına iki elektrot tarafından izlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Ussing odası kurulumu tarafından üretilen verilerin analizi
- Voltaj kelepçesi yazılımı tarafından oluşturulan verileri uygun bir elektronik tablo düzenleyicisine aktarın.
- Bazal I,sc ve Rt değerlerini belirlemek için, kısa devre koşullarını başlattıktan 10 dakika sonra alınan 10 ardışık veri noktasının ortalamasını hesaplayın. Her bir oda teknik bir kopya görevi görürken, organoidlerin her geçişi biyolojik bir kopya görevi görür.
- Uygulanan ajanların etkilerini değerlendirmek için, ajanın eklenmesinden hemen önce 10 ardışık veri noktasının ortalamasını hesaplayın. Bu ortalamayı, ajan uygulandıktan sonra gözlemlenen maksimum (veya minimum) değerle karşılaştırın. Elde edilen veriler ortalama ± standart sapma (SD) olarak sunulmuştur.
Sonuçlar
Bu protokol, domuzların jejunum ve kolonundan türetilen 3D organoidleri ayrıştırarak domuz 2D tek katmanlarının güvenilir bir şekilde üretilmesini kolaylaştırır. Jejunum organoidleri için 16 günlük ve kolon organoidleri için 9 günlük bir yetiştirme periyodu boyunca, sağlam tek tabakalar oluşur. Bu tek tabakalar daha sonra Ussing odası tekniği kullanılarak elektrojenik ve fizyolojik taşıma özelliklerini değerlendirmek için kullanılabilir.
Tartışmalar
Bu protokol, yerleşik domuz 3D organoidlerini tek hücrelere dönüştürmek için bir yöntemi açıklar ve bunlar daha sonra sağlam bir tek tabaka oluşturmak için transwell zarlarına ekilir. Bu konfigürasyon, hücrelerin apikal tarafına erişim sağlayarak, emici ve salgı süreçlerini izlemek için Ussing odalarının kullanımını kolaylaştırır.
Bu çok adımlı süreçteki ilk ve en önemli adım, 3D organoidlerin kesin olarak parçalanmasıd?...
Açıklamalar
Beyan edilecek herhangi bir çıkar çatışmamız yok.
Teşekkürler
Finansman için Federal Gıda ve Tarım Bakanlığı'na (BLE# 28N-2-071-00) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
Referanslar
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır