JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
토종 장의 생리학적 특성을 반영하는 2차원 돼지 장 오가노이드(Two-dimensional Porcine Intestinal Organoids)
요약
이 연구는 소장과 대장에서 유래한 돼지 오가노이드의 2D 단층을 생성하기 위한 프로토콜을 설명합니다. 이러한 단층의 성장은 TEER 값의 증가로 표시되며, 이는 견고한 상피 무결성을 나타냅니다. 게다가, 이 단층은 forskolin의 신청에 따르는 Ussing 약실 실험에 있는 생리적인 분비 반응을 전시합니다.
초록
위장관(GIT)은 음식의 소화와 영양소 흡수뿐만 아니라 병원체에 대한 보호 장벽 역할도 합니다. 전통적으로 이 분야의 연구는 동물 실험에 의존해 왔지만, 3R 원칙(대체, 감소, 개선)을 준수하는 대체 방법에 대한 수요가 증가하고 있습니다. 돼지 오가노이드는 기존 세포 모델보다 생체 내 조건의 더 정확한 체외 복제를 제공하는 유망한 도구로 부상했습니다. 장 오가노이드의 주요 문제 중 하나는 안쪽을 향하는 정점 표면과 바깥쪽을 향하는 기저측 표면입니다. 이러한 한계는 트랜스웰 인서트(이하 인서트라고 함)에 2차원(2D) 오가노이드 레이어를 생성하여 두 표면에 모두 액세스할 수 있도록 함으로써 극복할 수 있습니다. 이 연구에서는 돼지 제주눔과 결장 오가노이드의 2차원 배양을 성공적으로 개발했습니다. 배양 과정에는 두 가지 주요 단계가 포함됩니다: 첫 번째는 세포 단층의 형성이고, 그 다음에는 맞춤형 배지를 사용하여 세포를 분화하는 것입니다. 세포 성장은 경상피 전기 저항을 측정하여 추적하며, 이는 결장 오가노이드의 경우 8일째, 제주눔 오가노이드의 경우 16일째까지 안정화됩니다. 2일의 분화 단계가 끝나면 상피를 분석할 준비가 됩니다. 염화물 분비와 같은 활성 전기 전달 과정을 정량화하고 추적하기 위해 당사는 Ussing 챔버 기술을 사용합니다. 이 방법을 사용하면 상피 수송 과정의 실시간 측정 및 상세한 특성화가 가능합니다. Ussing 챔버와 같은 확립된 기술과 결합된 이 혁신적인 체외 모델은 3R 프레임워크 내에서 돼지 GIT를 생리학적으로 특성화하기 위한 강력한 플랫폼을 제공합니다. 또한 병태생리학적 메커니즘을 조사하고 잠재적인 치료 전략을 개발할 수 있는 기회를 열어줍니다.
서문
GIT는 소화, 영양소 흡수 및 대변을 통한 배설물1에 중심적인 역할을 합니다. 또한 줄기세포, 점액 생성 배상 세포, 장 내분비 세포 및 흡수성 장세포를 포함한 다양한 세포 구성에 의해 지원되는 역할인 병원체에 대한 장벽으로 기능합니다2. 장의 항상성은 세균 감염3 또는 염증 과정4과 같은 다양한 요인에 의해 방해를 받을 수 있으며, 이는 흡수 장애, 설사또는 심지어 사망5과 같은 심각한 결과를 초래할 수 있습니다. 이러한 병태생리학적 시나리오는 일반적으로 실험 동물 또는 3R 원칙6에 따라 다양한 종에서 유래한 세포 배양을 사용하여 수행됩니다. 결과의 정확한 예측과 전달 가능성은 종 특이적 모델을 사용할 때 매우 중요합니다7. 이러한 필요성에도 불구하고 장관의 복잡성과 기능을 적절하게 복제하는 돼지 유래 세포 배양이 현저히 부족합니다.
다른 종과 관련된 이 문제를 해결하기 위해 GIT8의 생리학적 복잡성을 복제하기 위해 3차원(3D) 오가노이드가 개발되었습니다. 처음에 오가노이드는 인간과 생쥐의 장에서 만들어졌습니다. 현재까지 어린 돼지와 성체 돼지의 돼지 오가노이드도 성공적으로 개발되고 배양되었습니다 9,10. 이 돼지 오가노이드는 처음 등장한 이래로 주로 장 감염에 초점을 맞춘 여러 연구에서 활용되었습니다 11,12,13,14. 영양소 수송 또는 분비 과정과 같은 생리학적 특성을 규명하기 위한 연구는 여전히 제한적이다15. 이는 장 오가노이드(intestinal organoids)의 방향이 정점 표면이 안쪽을 향하고 기저측 면이 바깥쪽을 향하여 정점 표면에 대한 접근을 제한하기 때문일 수 있습니다. 이러한 한계는 돼지 오가노이드를 2차원 형식16으로 성공적으로 배양함으로써 해결되었으며, 이는 냉동 조직을 사용하여 생성함으로써 더욱 발전된 방법입니다17.
돼지 오가노이드의 2D 배양은 상피의 양쪽에 대한 접근을 제공하여 상피층을 가로지르는 수송 과정을 연구하기 위해 잘 확립된 방법을 적용할 수 있습니다. 이러한 방법 중 하나는 Ussing 챔버18로, 이를 통해 상피 전체의 전기적 흡수 및 분비 과정을 실시간으로 관찰할 수 있습니다. 이 시스템의 광범위한 사용은 전체 장 축을 포괄하는 생체 내 돼지 장 기능에 대한 포괄적인 이해를 제공했습니다. 여기에는 단일당류 수송 또는 단쇄 지방산의 수송 또는 장 수송 특성에 영향을 미치는 레스베라트롤과 같은 2차 식물 대사 산물에 대한 반응에 대한 연구가 포함됩니다 19,20,21,22,23,24. 이러한 연구에서 얻은 방대한 양의 데이터는 돼지 오가노이드의 잘 특성화된 생체 내 조건과 체외 환경 간의 직접적인 비교를 용이하게 하여 생리학적 관련성에 대한 이해를 높입니다.
본 연구에서는 3D 돼지 오가노이드로부터 2D 단층을 생성하고 배양하기 위한 프로토콜을 제시한다. 또한 Ussing 챔버 기법을 사용하여 장 수송 과정을 정량화하는 방법론적 접근 방식에 대해 자세히 설명합니다. 이 프로토콜은 제주넘 및 결장 오가노이드의 in vitro 흡수 및 분비 특성을 연구할 수 있는 도구를 제공하여 잘 특성화된 생체 내 조건과 직접 비교할 수 있습니다. 이 프로토콜의 향후 응용 분야에는 약리학적 또는 독성학적 물질의 영향을 조사하고 상피와 병원체 간의 상호 작용을 탐색하는 것이 포함될 수 있습니다.
프로토콜
이 규약을 위해 건강한 돼지 두 마리(Bentheim Blacked Pied 돼지, 수컷 1마리, 암컷 1마리, 생후 4.5개월, 약 65kg)를 포획 화살과 출혈로 희생시켰다. 동물보호법에 따르면 이것(도축 및 조직 제거)은 동물실험으로 분류되지 않고 동물복지담당관(등록번호)에게 알려야 합니다. TiHo-T-2023-15)를 수여했습니다.
1. 인서트 코팅
알림: 모든 단계는 안전 캐비닛 아래에서 멸균 재료로 수행됩니다. 프로토콜의 모든 단계는 달리 명시되지 않은 경우 얼음 위에서 수행됩니다.
- 얼어붙은 기저막을 얼음 위에서 실온에서 최소 1시간 동안 또는 4°C의 얼음 위에서 하룻밤 동안 해동합니다. 기저막을 1:40(v/v)과 얼음처럼 차가운 멸균 인산염 완충 식염수(PBS)를 원뿔형 튜브에 혼합합니다.
- 포장에서 인서트가 있는 멸균 플레이트를 제거합니다. 200μL의 기저막 혼합물을 각 인서트의 정점 구획에 추가합니다.
- 웰 플레이트의 뚜껑을 교체하고 인큐베이터에서 37°C, 5% CO2 에서 최소 1.5시간 동안 배양합니다.
- 세포를 파종하기 전에 용액을 조심스럽게 흡인하십시오. 흡인 중에 팁이 멤브레인에 닿지 않도록 하십시오.
2. 2D 오가노이드 단층 생성
참고: 돼지 결장 오가노이드는 돼지 제주날 오가노이드25에 대해 설명된 대로 생성 및 배양됩니다. 3D 오가노이드 생성 후에는 지속적인 성장을 보장하기 위해 매주 전달하면서 최소 3-4주 동안 배양해야 합니다. 후속 단계에서 용해되는 3D 오가노이드를 포함하는 각 돔 내의 세포 수는 단일 막관통 필터를 커버하기에 충분합니다. 단층 생성 전에 3D 오가노이드는 이전 성장 및 오염 가능성을 확인하기 위해 광학 품질 관리를 받았습니다(그림 1).

그림 1: 대표적인 3D 오가노이드. 3차원 (A) 제주넘 및 (B) 결장 오가노이드는 단층을 생성하기 전에 현미경으로 주의 깊게 검사됩니다. 이전의 성장 패턴, 구조적 무결성 및 불순물이나 오염의 존재 여부를 평가하는 데 특별한 주의를 기울입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 3D crypt organoid가 있는 웰에서 오가노이드 배지(표 1)를 제거합니다. 웰당 얼음처럼 차가운 PBS 1mL를 추가하고 p1000 팁으로 위아래로 피펫팅하여 기저막을 부드럽게 용해합니다.
- 10mL의 얼음처럼 차가운 PBS가 미리 채워진 15mL 튜브에 용해된 모든 오가노이드를 수집합니다. 튜브를 250 x g에서 원심분리, 4°C에서 10분 동안 가열합니다. 상층액을 흡인합니다.
- 1mL의 따뜻한(37°C) 0.05%(v/v) 트립신/EDTA(이 단계에서 튜브 2개를 모을 수 있음)에 펠렛을 재현탁합니다. 수조에서 37 ° C에서 5 분 동안 배양하고 나중에 얼음에 직접 올려 반응을 멈 춥니 다.
- p1000 팁으로 얼음 위에 20회, p1000 팁 + p200 팁을 위에 올려 15회 다시 얼음 위에 재현합니다. 10%(v/v) 태아 송아지 혈청(FCS)이 보충된 얼음처럼 차가운 DMEM 10mL를 추가합니다.
- 1,000 x g에서 원심분리기 튜브, 4°C에서 10분. 상층액을 버리고 펠렛을 1mL의 단층 배지에 재현탁시킵니다(표 1).
- 제조업체의 지침에 따라 Neubauer 챔버를 사용하여 mL당 살아있는 세포의 수를 측정합니다.
- 이 시점에서 정점 구획에서 코팅 용액을 제거하고 500μL의 따뜻한(37°C) 단층 매체로 교체합니다. 기저측 구획에 3mL의 단층 배지를 추가합니다.
- 3단계에서 자세히 설명한 대로 각 빈 트랜스웰 인서트의 블랭크 저항(TEER)을 측정합니다. 정점 챔버에 배지가 없는 시간은 세포가 건조되는 것을 방지하기 위해 가능한 한 짧아야 합니다.
- 정점 단층 배지를 제거하고 jejunal 2D 배양 2 x 105 상피 세포 및 결장 2D 배양의 경우 각 트랜스웰의 정점 챔버에서 500 μL의 단층 배지에 1.5 x 105 상피 세포를 추가합니다.
- 매체를 변경하고 2-3일마다 TEER를 측정합니다. 매체가 변경되기 전에 TEER를 측정합니다. 정점 및 기저 구획의 배지를 조심스럽게 흡인하고 500 μL 또는 3 mL의 신선하고 따뜻한(37 °C) 배지로 교체합니다.
- 제주눔 오가노이드의 경우: 16일째에 파종 후 단층 배지에서 분화 배지로 변경합니다(표 1). 결장 오가노이드의 경우: 7일째에 배지를 분화 배지로 변경합니다.
- 매일 분화 매체를 교체하고 각 매체 변경 중에 TEER 측정을 수행합니다. 18일(jejunal 오가노이드의 경우) 또는 9일(대장 오가노이드의 경우)에 시딩 후 기능 실험을 진행합니다.
3. 경상피 전기 저항(TEER) 측정
알림: 모든 측정은 오염을 방지하기 위해 안전 캐비닛 아래에서 수행됩니다. 세포를 시딩하기 전에 코팅된 모든 빈 트랜스웰을 측정하여 개별 blank 값을 얻습니다. 볼트-옴 미터는 도입된 USB 장치에 값을 저장합니다.
- 젓가락 전극을 70%(v/v) 에탄올로 세척하고 전극을 완전히 건조시킵니다. 한편, 인큐베이터에서 플레이트를 제거하고 캐비닛 아래에 놓습니다.
- 젓가락 전극의 짧은 팔을 인서트의 정점 구획에 삽입하고 긴 팔을 인서트의 기저부 구획에 삽입합니다. 짧은 팔과 세포층의 접촉을 피하십시오.
- 각 트랜스웰의 경상피 전기 저항을 측정합니다. 안정적인 측정을 보장하기 위해 볼트-옴 미터가 평형을 이루도록 합니다. Store 버튼을 클릭하여 TEER 값을 측정합니다.
- 나머지 웰에 대해 3.2 및 3.3 단계를 계속합니다. 마지막 웰에 도달한 후 볼트-옴 미터는 USB 장치에 데이터를 저장하라는 요청을 엽니다. 저장을 클릭합니다.
- 각 플레이트 후와 측정이 끝날 때 전극을 청소하고 보관하기 전에 완전히 건조시키십시오.
- 측정된 세포 값에서 세포를 시드하기 전에 결정된 빈 값을 뺍니다.
4. Ussing 챔버 기술을 사용한 전기 생리학적 수송 연구
참고: 전기생리학적 수송 연구의 결정은 상피로 나뉘어진 두 개의 챔버 구획으로 구성된 Ussing 챔버를 사용하여 수행됩니다. 이 챔버는 Ag / AgCl 전극에 의해 전압 클램프에 연결됩니다. 이 기술은 전압 클램프에 의해 유도 된 단락 전류 (Isc)의 변화와 옴의 법칙에 의해 계산 된 조직 저항(RT)을 통해 상피의 활성 전기 전달 과정을 추적 할 수 있습니다. Isc 및RT 는 전체 실험 동안 6초마다 기록됩니다. 실험하는 동안 조사된 조직은 탄수화물로 폭기되고 실행 가능한 조건을 보장하기 위해 변형된 Krebs-Henseleit 용액으로 배양됩니다. 인도메타신(Indomethacin, 10μM)을 완충액에 첨가하여 프로스타글란딘 합성을 억제한다26.
- 점막 및 장막암 완충 용액을 37°C로 예열하고 발암물질로 폭기합니다. 각 개별 챔버에 대해 빈 인서트를 사용하여 단일 챔버를 조립합니다. 트랜스웰의 정점 면이 모두 같은 방향을 향하고 있는지 확인하십시오.
- 모든 챔버를 예열된 점막 완충 용액 5mL로 채웁니다(표 2). vol의 모든 전극을 연결하십시오.tage clamp 제조업체의 지침에 따라 개별 챔버에 연결합니다. 정확한 측정을 위해 전극을 방해하는 가스 기포가 없는지 확인하십시오.
- 전압 클램프 소프트웨어에서 Rf/dpI 버튼을 클릭하여 이러한 조건으로 Ussing 챔버 소프트웨어를 보정합니다. 사용된 모든 빈 인서트의 저항은 동일해야 하며(~ 70 Ohm) 전류는 약 0 mV(± 5 mV)여야 합니다. 일부 챔버의 경우가 그렇지 않은 경우 시스템에 전극이나 기포가 적절하게 배치되었는지 확인하십시오.
- 모든 전극을 제거하고 사용한 버퍼 용액을 폐기하십시오. 모든 개별 챔버를 열고 빈 인서트를 제거합니다. 개별 챔버의 순서가 유지되는지 확인하십시오.
- 인서트가 있는 웰 플레이트를 인큐베이터에서 안전 캐비닛으로 이동합니다. 기저측과 정점 매체를 조심스럽게 흡인합니다.
- 정점 챔버에 500μL의 따뜻한(37°C) 점막 완충액을 추가하고 기저측 챔버에 3mL의 혈청 완충액을 추가하여 세포를 세척합니다. 버퍼를 흡입하고 2회 반복합니다.
- 플레이트에서 인서트를 제거합니다. 인서트의 지지대를 부드럽게 제거합니다. 인서트를 Ussing 챔버에 놓고 인서트의 방향이 교정 단계에서와 동일한지 확인하십시오. 그림 2에 표시된 대로 개별 챔버를 조립합니다.
- 세포의 기저측 쪽을 향하는 챔버에 5mL의 혈청 완충액을 채우고(표 2), 정점 챔버를 향하는 챔버에 5mL의 점막 완충액을 채웁니다.
- 전극과 폭기 튜브를 각 개별 챔버에 연결합니다. Ussing 소프트웨어에서 측정을 시작하십시오. 15분 동안 평형을 유지합니다.
- 조건을 개방 회로에서 단락 회로 조건으로 변경합니다. 5분에서 10분 동안 평형을 유지합니다. 혈청 챔버에 10μM의 포스콜린을 추가합니다.
주: 포스콜린의 추가는 개별적인 장 세그먼트 및 연구 질문에 따라서 다른 대리인/물질에 의해 대체될지도 모릅니다. - 15 분 후에, forskolin와 동일한 방법으로 대리인을 더 추가하거나 측정을 중지하십시오. 개별 챔버에서 폭기 튜브와 전극을 제거합니다. 양쪽 챔버의 완충 용액을 그릇에 붓습니다.
- 챔버를 분해하고 인서트를 폐기하거나 후속 분석(예: 면역조직화학 또는 발현 분석)에 사용합니다.
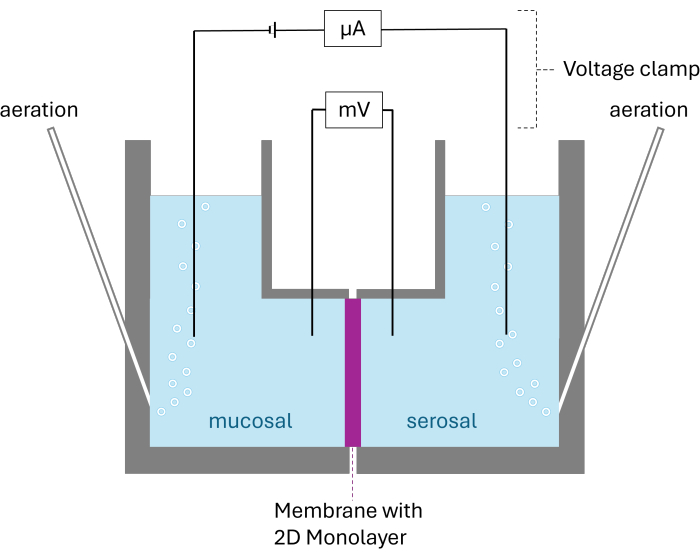
그림 2: Ussing 챔버의 개략적 구조. 성장된 2D 단층이 있는 멤브레인으로 분할된 두 챔버가 표시됩니다. 두 챔버 모두 발암원으로 폭기되어 있습니다. 전압과 전류는 챔버당 두 개의 전극으로 모니터링됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. Ussing 챔버 설정에 의해 생성된 데이터 분석
- 전압 클램프 소프트웨어에서 생성된 데이터를 적절한 스프레드시트 편집기로 가져옵니다.
- basal Isc 및 Rt 값을 결정하려면 단락 조건을 초기화한 후 10분 후에 수행된 10개의 연속 데이터 점의 평균을 계산합니다. 각 개별 챔버는 기술적 복제물 역할을 하며, 오가노이드의 모든 통로는 생물학적 복제물 역할을 합니다.
- 적용된 약제의 효과를 평가하려면 약제가 추가되기 직전에 연속된 10개의 데이터 점의 평균을 계산하십시오. 이 평균을 에이전트가 적용된 후 관찰된 최대값(또는 최소값)과 비교합니다. 얻은 데이터는 평균 ± 표준 편차(SD)로 표시됩니다.
결과
이 프로토콜은 돼지의 제주넘(jejunum)과 결장(colon)에서 유래한 3D 오가노이드(organoid)를 세분화하여 돼지 2D 단층(porcine 2D monolayer)의 안정적인 생성을 촉진합니다. 제주눔 오가노이드의 경우 16일, 결장 오가노이드의 경우 9일의 배양 기간 동안 온전한 단층이 형성됩니다. 이러한 단층은 이후에 Ussing 챔버 기술을 사용하여 전기적 및 생리학적 수송 특성을 평가하는 데 사용할 ...
토론
이 프로토콜은 확립된 돼지 3D 오가노이드를 단일 세포로 변환한 다음 트랜스웰 멤브레인에 파종하여 온전한 단층을 형성하는 방법을 설명합니다. 이 구성은 세포의 정점 쪽에 대한 접근 권한을 부여하여 흡수 및 분비 과정을 모니터링하기 위해 Ussing 챔버를 쉽게 사용할 수 있도록 합니다.
이 다단계 공정의 초기이자 중요한 단계는 3D 오가노이드를 ?...
공개
우리는 선언할 이해 상충이 없습니다.
감사의 말
연방 식량 농업부(BLE# 28N-2-071-00)에 자금을 지원해 주셔서 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
참고문헌
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유