このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
天然腸の生理学的特性を反映した二次元ブタ腸管オルガノイド
要約
この研究では、小腸と大腸に由来するブタオルガノイドの2D単層を生成するためのプロトコルを概説しています。これらの単層の成長は、TEER値の増加によって特徴付けられ、堅牢な上皮の完全性を示します。さらに、これらの単分子膜は、フォルスコリンの適用後のUssingチャンバー実験で生理学的分泌応答を示します。
要約
消化管(GIT)は、食物の消化と栄養素の摂取の両方に役立つだけでなく、病原体に対する保護バリアとしても機能します。従来、この分野の研究は動物実験に依存してきましたが、3Rの原則である「置き換える」「減らす」「洗練する」に準拠した代替方法の需要が高まっています。ブタオルガノイドは、従来の細胞モデルよりも正確なin vivo条件のin vitro複製を提供する有望なツールとして浮上しています。腸管オルガノイドの大きな課題の1つは、内向きの頂端表面と外側を向いた基底外側表面です。この制限は、トランズウェルインサート(以下、インサート)上に2次元(2D)オルガノイド層を作成し、両方の表面へのアクセスを提供することで克服できます。本研究では、ブタ空腸オルガノイドと結腸オルガノイドの二次元培養法の開発に成功しました。培養プロセスには、まず細胞単層の形成と、その後にカスタマイズされた培地を使用した細胞の分化という2つの主要な段階が含まれます。細胞増殖は、経上皮電気抵抗を測定することによって追跡され、結腸オルガノイドでは8日目までに、空腸オルガノイドでは16日目までに安定します。2日間の分化フェーズの後、上皮は分析の準備ができています。塩化物分泌などの活性電気発生輸送プロセスを定量化し、追跡するために、Ussingチャンバー技術を採用しています。この方法により、上皮輸送プロセスのリアルタイム測定と詳細な特性評価が可能になります。この革新的なin vitroモデルは、Ussingチャンバーのような確立された技術と組み合わせることで、3Rフレームワーク内でブタGITを生理学的に特徴付けるための堅牢なプラットフォームを提供します。また、病態生理学的メカニズムを調査し、潜在的な治療戦略を開発する機会も開きます。
概要
GITは、糞便1による消化、栄養吸収、老廃物の排泄において中心的な役割を果たします。さらに、幹細胞、粘液産生杯細胞、腸内分泌細胞、吸収性腸細胞2などの多様な細胞組成によって支えられた病原体に対するバリアとして機能します。腸の恒常性は、細菌感染3 や炎症過程4などのさまざまな要因によって破壊され、吸収不良、下痢、さらには死5など、生物に深刻な結果をもたらす可能性があります。このような病態生理学的シナリオの調査は、一般的に実験動物を使用するか、3Rの原則6に従って、さまざまな種に由来する細胞培養物を使用して行われます。種の特定のモデルを採用する際には、正確な予測と結果の伝達可能性が重要です7。このようなニーズにもかかわらず、腸管の複雑さと機能を適切に再現するブタ由来の細胞培養物が著しく不足しています。
この課題に対処するために、他の種にも関連する、GIT8の生理学的複雑さを再現する試みで、3次元(3D)オルガノイドが開発されました。当初、オルガノイドはヒトとマウスの腸から作られました。今日までに、幼若豚および成豚のブタオルガノイドも開発され、栽培されてきました9,10。これらのブタオルガノイドは、その誕生以来、主に腸管感染症に焦点を当てたいくつかの研究で利用されてきました11,12,13,14。栄養素の輸送や分泌プロセスなどの生理学的特性を特徴付けることを目的とした研究は、まだ限られています15。これは、腸オルガノイドの向きが原因であり、頂端面が内側を向き、基底外側側が外側を向いているため、頂端表面へのアクセスが制限されている可能性があります。この制限は、ブタオルガノイドを二次元フォーマットで成功裏に培養することによって対処された16、この方法は、凍結組織を使用してそれらを生成することによってさらに進歩した17。
ブタオルガノイドの2D培養では、上皮の両側にアクセスできるため、上皮層を横切る輸送プロセスを研究するための確立された方法を適用することができます。そのような方法の1つがUssingチャンバー18であり、これにより、上皮全体の電気発生吸収および分泌過程をリアルタイムで観察できます。このシステムを広く使用することで、ブタの腸内機能をin vivoで包括的に理解し、腸軸全体をカバーするようになりました。これには、単糖類の輸送または短鎖脂肪酸の輸送、または腸の輸送特性に影響を与えるレスベラトロールなどの二次植物代謝産物への応答に関する研究が含まれます19,20,21,22,23,24。これらの研究から得られた大量のデータにより、ブタオルガノイドの十分に特性評価されたin vivo条件とin vitro環境との直接的な比較が容易になり、その生理学的関連性についての理解が深まります。
この研究では、3Dブタオルガノイドから2D単分子膜を生成および培養するためのプロトコルを提示します。さらに、Ussing Chamber 技術を使用して腸内輸送プロセスを定量化するための方法論的アプローチについて詳しく説明します。このプロトコールは、空腸オルガノイドおよび結腸オルガノイドにおける in vitro での吸収特性および分泌特性を研究するためのツールを提供し、十分に特性評価された in vivo 条件と直接比較することができます。このプロトコルの将来のアプリケーションには、薬理学的または毒物学的物質の影響の調査、および上皮と病原体との間の相互作用の調査が含まれる可能性があります。
プロトコル
このプロトコルでは、2匹の健康なブタ(ベントハイムブラックパイドブタ、雄1匹、雌1匹、生後4.5ヶ月、約65kg)が捕獲されたボルトシュートと出血によって犠牲にされました。動物愛護法では、これ(屠殺及び組織の除去)は動物実験に該当せず、動物福祉担当官(登録番号)に告知する必要があります。TiHo-T-2023-15) ハノーバー獣医大学財団の
1.インサートのコーティング
注:すべてのステップは、安全キャビネットの下で滅菌材料を使用して実行されます。プロトコルのすべてのステップは、特に明記されていない限り、氷上で実行されます。
- 凍結した基底膜を氷上で室温で少なくとも1時間、または氷の上で4°Cで一晩解凍します。 基底膜を1:40(v / v)と氷冷滅菌リン酸緩衝生理食塩水(PBS)を円錐形のチューブで混合します。
- インサート付きの滅菌プレートをパッケージから取り出します。200 μLの基底膜ミックスを各インサートの頂端コンパートメントに加えます。
- ウェルプレートの蓋を元に戻し、インキュベーター内で37°C、5%CO2 で少なくとも1.5時間インキュベートします。
- 細胞を播種する前に、溶液を慎重に吸引してください。吸引中に先端がメンブレンに触れないようにしてください。
2. 2次元オルガノイド単分子膜の生成
注:ブタ結腸オルガノイドは、ブタ空腸オルガノイド25について記載されたように生成および培養されます。3Dオルガノイドの生成後、これらは少なくとも3〜4週間培養し、一貫した成長を確保するために毎週の継代を行う必要があります。3Dオルガノイドを含む各ドーム内の細胞の数は、後続のステップで溶解されるため、1つの膜貫通フィルターをカバーするのに十分です。単分子膜を作製する前に、3Dオルガノイドを光学的品質管理にかけ、以前の成長と汚染の可能性を確認しました(図1)。

図1:代表的な3Dオルガノイド。 三次元の(A)空腸オルガノイドと(B)結腸オルガノイドは、単層を生成する前に顕微鏡で慎重に検査されます。以前の成長パターン、構造的完全性、不純物や汚染の存在を評価することに特別な注意が払われています。 この図の拡大版を表示するには、ここをクリックしてください。
- オルガノイド培地(表1)を3D陰窩オルガノイドでウェルから取り出します。ウェルあたり1 mLの氷冷PBSを加え、p1000チップでピペッティングして基底膜を穏やかに溶解します。
- 溶解したすべてのオルガノイドを、10 mLの氷冷PBSをあらかじめ充填した15 mLのチューブに集めます。チューブを250 x gで4°Cで10分間遠心分離します。 上清を吸引します。
- ペレットを1 mLの温かい(37°C)0.05%(v / v)トリプシン/ EDTAに再懸濁します(この段階で2本のチューブをプールできます)。ウォーターバスで37°Cで5分間インキュベートし、その後直接氷の上に置いて反応を停止します。
- p1000チップで20倍、p1000チップ+p200チップを上にしてさらに15倍氷上に再懸濁します。10%(v / v)のウシ胎児血清(FCS)を添加した氷冷DMEM10mLを加えます。
- 1,000 x gでチューブを遠心分離し、4°Cで10分間。 上清を捨て、ペレットを1 mLの単層培地に再懸濁します(表1)。
- 製造元の指示に従って、ノイバウアーチャンバーを使用してmLあたりの生細胞数を決定します。
- この時点でコーティング溶液を頂端コンパートメントから取り出し、500μLの温かい(37°C)単層培地と交換します。3 mLの単層培地を基底外側コンパートメントに加えます。.
- 各空のトランズウェルインサートのブランク抵抗(TEER)を決定します(ステップ3で詳しく説明します)。細胞が乾燥するのを防ぐために、頂端チャンバー内に培地が存在しない時間はできるだけ短くする必要があります。
- 頂端単層培地を取り出し、空腸2D培養用に2 x 105 上皮細胞を、結腸2D培養用に1.5 x 105 上皮細胞を各トランズウェルの頂端チャンバー内の500 μLの単層培地に加えます。
- 培地を交換し、2〜3日ごとにTEERを測定します。媒体を交換する前にTEERを測定してください。頂端コンパートメントと基底コンパートメントの培地を慎重に吸引し、500 μLまたは3 mLの新鮮で温かい(37°C)培地と交換します。
- 空腸オルガノイドの場合:16日目に播種後、単層培地から分化培地に変更します(表1)。結腸オルガノイドの場合:7日目に培地を分化培地に変更します。
- 分化媒体を毎日交換し、媒体交換のたびにTEER測定を行います。18日目(空腸オルガノイドの場合)または9日目(結腸オルガノイドの場合)に、播種後、機能実験を進めます。
3. 経上皮電気抵抗(TEER)の測定
注意: すべての測定は、汚染を避けるために安全キャビネットの下で行われます。細胞を播種する前に、すべての空のコーティングされたトランズウェルを測定して、個々のブランク値を取得します。ボルトオームメーターは、導入されたUSBデバイスに値を保存します。
- 箸の電極を70%(v / v)エタノールで洗浄し、電極を完全に乾かします。その間、プレートをインキュベーターから取り外し、キャビネットの下に置きます。
- 箸電極の短いアームをインサートの頂端コンパートメントに、長いアームをインサートの基底外側コンパートメントに導入します。短いアームが細胞層に接触しないようにしてください。
- 各トランズウェルの経上皮電気抵抗を測定します。ボルトオーム計を平衡化させて、安定した測定を確保します。TEER 値を測定するには、[ストア] ボタンをクリックします。
- 残りのウェルでステップ 3.2 と 3.3 を続けます。最後の井戸に到達すると、ボルトオームメーターはデータをUSBデバイスに保存するためのリクエストを開きます。 「保存」をクリックします。
- 各プレートの後と測定の最後に電極を清掃し、完全に乾かしてから保管してください。
- 測定された細胞値から、細胞を播種する前に決定された空白値を減算します。
4. Ussingチャンバー法を用いた電気生理学的輸送研究
注:電気生理学的輸送研究の決定は、上皮によって分割された2つのチャンバーコンパートメントで構成されるUssingチャンバーを使用して行われます。このチャンバーは、Ag/AgCl電極によって電圧クランプに接続されています。この技術により、電圧クランプによって誘発される短絡電流(Isc)の変化と、オームの法則によって計算された組織抵抗(RT)の変化を通じて、上皮の活発な電気発生輸送プロセスを追跡できます。Isc と Rt は、実験全体を通じて 6 秒ごとに記録されます。実験中、調査した組織をカルボゲンで曝気し、修飾したKrebs-Henseleit溶液とインキュベートして、生存可能な条件を確保します。インドメタシン(10μM)を緩衝液に添加して、プロスタグランジン合成を阻害します26。
- 粘膜および漿膜緩衝液を37°Cにウォームアップし、カルボゲンで曝気します。個々のチャンバーごとに空のインサートを使用して、単一のチャンバーを組み立てます。トランズウェルの頂端側がすべて同じ方向を向いていることを確認してください。
- すべてのチャンバーに5 mLの予熱した粘膜緩衝液を満たします(表2)。電圧からのすべての電極を接続しますamp 製造元の指示に従って、個々のチャンバーに。正しい測定を確実にするために、気泡が電極に干渉していないことを確認してください。
- これらの条件でUssingチャンバーソフトウェアを校正するには、電圧クランプソフトウェアの Rf/dpi ボタンをクリックします。使用するすべての空のインサートの抵抗は等しく(~70Ω)、電流は約0mV(±5mV)である必要があります。一部のチャンバーでこれに当てはまらない場合は、システム内の電極または気泡の適切な配置を確認してください。
- すべての電極を取り外し、使用済みの緩衝液を廃棄します。すべての個々のチャンバーを開き、空のインサートを取り外します。個々のチャンバーの順序が維持されていることを確認してください。
- インサート付きのウェルプレートをインキュベーターから安全キャビネットに移動します。基底外側と頂端媒体を慎重に吸引します。
- 500 μLの温かい粘膜緩衝液(37 °C)を頂端チャンバーに、3 mLの漿液緩衝液を基底外側チャンバーに添加して細胞を洗浄します。バッファーを吸引し、2回繰り返します。
- プレートからインサートを取り外します。インサートのサポートをそっと取り外します。インサートをUssingチャンバーにセットし、インサートの向きがキャリブレーションフェーズ中と同じであることを確認します。 図2に示すように、個々のチャンバーを組み立てます。
- 細胞の基底外側側に面したチャンバーに5 mLの漿液緩衝液(表2)を充填し、頂端チャンバーに面したチャンバーに5 mLの粘膜緩衝液を充填します。
- 電極とエアレーションチューブを各チャンバーに接続します。Ussingソフトウェアで測定を開始します。15分間平衡化します。
- 条件を開回路状態から短絡状態に変更します。5分から10分間平衡化します。10 μMのフォルスコリンを漿膜チャンバーに加えます。
注:フォルスコリンの追加は、個々の腸のセグメントや研究課題に応じて、他の薬剤/物質に置き換えられる場合があります。. - 15分後、フォルスコリンと同じ方法で薬剤を追加するか、測定を停止します。エアレーションチューブと電極を個々のチャンバーから取り外します。両方のチャンバーの緩衝液をボウルに注ぎます。
- チャンバーを分解し、インサートを廃棄するか、フォローアップ分析(免疫組織化学や発現分析など)に使用します
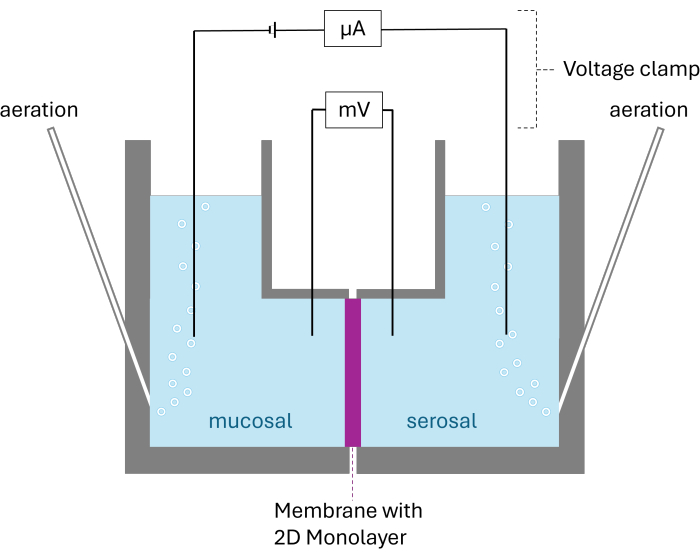
図2:Ussingチャンバーの概略図。 表示されているのは、成長した2D単分子膜を持つ膜で分割された両方のチャンバーです。両方のチャンバーはカルボゲンで曝気されています。電圧と電流は、チャンバーごとに2つの電極によって監視されます。 この図の拡大版を表示するには、ここをクリックしてください。
5. Ussingチャンバーのセットアップによって生成されたデータの分析
- 電圧クランプソフトウェアによって生成されたデータを適切なスプレッドシートエディタにインポートします。
- 基礎 Isc 値と Rt 値を決定するには、短絡条件を初期化してから 10 分後に取得した 10 個の連続データ点の平均を計算します。個々のチャンバーは技術的な複製として機能し、オルガノイドのすべての通過は生物学的複製として機能します。
- 適用されたエージェントの影響を評価するには、エージェントの追加直前に 10 個の連続するデータ ポイントの平均を計算します。この平均を、エージェントが適用された後に観測された最大値(または最小値)と比較します。得られたデータは、平均±標準偏差(SD)として表示されます。
結果
このプロトコルは、ブタの空腸および結腸に由来する3Dオルガノイドを分解することにより、ブタの2D単分子膜の信頼性の高い生成を促進します。空腸オルガノイドは16日間、結腸オルガノイドは9日間の培養期間で、無傷の単分子膜が形成されます。これらの単分子膜は、その後、Ussingチャンバー技術を使用して電気発生的および生理学的輸送特性を評価するために?...
ディスカッション
このプロトコールは、確立されたブタの3Dオルガノイドを単一細胞に変換し、それをトランスウェルメンブレン上に播種して無傷の単分子膜を形成する方法を説明しています。この構成により、細胞の頂端側へのアクセスが可能になり、Ussingチャンバーを使用して吸収プロセスと分泌プロセスをモニターすることが容易になります。
この多段階?...
開示事項
当社は、申告すべき利益相反を有しておりません。
謝辞
連邦食糧農業省(BLE#28N-2-071-00)の資金提供に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
参考文献
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved