Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Organoïdes intestinaux porcins bidimensionnels reflétant les propriétés physiologiques de l’intestin natif
Dans cet article
Résumé
Cette étude décrit un protocole pour générer des monocouches 2D d’organoïdes porcins dérivés de l’intestin grêle et du gros intestin. La croissance de ces monocouches est marquée par l’augmentation des valeurs TEER, indiquant une intégrité épithéliale robuste. De plus, ces monocouches présentent des réponses sécrétoires physiologiques dans les expériences en chambre d’Ussing après l’application de forskoline.
Résumé
Le tractus gastro-intestinal (GIT) sert à la fois à la digestion des aliments et à l’absorption des nutriments, mais aussi à servir de barrière protectrice contre les agents pathogènes. Traditionnellement, la recherche dans ce domaine s’est appuyée sur des expériences sur des animaux, mais il existe une demande croissante pour des méthodes alternatives qui adhèrent aux principes des 3R : remplacer, réduire et affiner. Les organoïdes porcins sont apparus comme un outil prometteur, offrant une réplication in vitro plus précise des conditions in vivo que les modèles cellulaires traditionnels. L’un des principaux défis des organoïdes intestinaux est leur surface apicale tournée vers l’intérieur et leur surface basolatérale tournée vers l’extérieur. Cette limitation peut être surmontée en créant des couches organoïdes bidimensionnelles (2D) sur des inserts de transpuits (ci-après dénommés inserts), permettant d’accéder aux deux surfaces. Dans cette étude, nous avons réussi à développer des cultures bidimensionnelles d’organoïdes du jéjunum porcin et du côlon. Le processus de culture comporte deux phases clés : d’abord, la formation d’une monocouche cellulaire, suivie de la différenciation des cellules à l’aide de milieux adaptés. La croissance cellulaire est suivie en mesurant la résistance électrique transépithéliale, qui se stabilise au jour 8 pour les organoïdes du côlon et au jour 16 pour les organoïdes du jéjunum. Après une phase de différenciation de 2 jours, l’épithélium est prêt pour l’analyse. Pour quantifier et suivre les processus de transport électrogénique actifs, tels que la sécrétion de chlorure, nous utilisons la technique de la chambre d’Ussing. Cette méthode permet de mesurer en temps réel et de caractériser finement les processus de transport épithélial. Ce modèle in vitro innovant, combiné à des techniques établies comme la chambre d’Ussing, fournit une plate-forme solide pour caractériser physiologiquement le GIT porcin dans le cadre des 3R. Elle ouvre également des possibilités d’étudier les mécanismes physiopathologiques et de développer des stratégies thérapeutiques potentielles.
Introduction
Le GIT joue un rôle central dans la digestion, l’absorption des nutriments et l’excrétion des déchets par les matières fécales1. De plus, il fonctionne comme une barrière contre les agents pathogènes, un rôle soutenu par une composition cellulaire diversifiée, y compris des cellules souches, des cellules caliciformes productrices de mucus, des cellules entéroendocrines et des entérocytes absorbants2. L’homéostasie intestinale peut être perturbée par divers facteurs, tels que des infections bactériennes3 ou des processus inflammatoires4, entraînant de graves conséquences pour l’organisme, telles que la malabsorption, la diarrhée ou même la mort5. L’étude de tels scénarios physiopathologiques est couramment effectuée à l’aide d’animaux de laboratoire ou, conformément au principe6R des 3R, de cultures cellulaires dérivées de diverses espèces. La prédiction précise et la transférabilité des résultats sont cruciales lors de l’utilisation de modèles spécifiques à une espèce7. Malgré ce besoin, il existe un manque notable de cultures de cellules dérivées de porcs qui reproduisent de manière adéquate la complexité et la fonctionnalité du tractus intestinal.
Pour relever ce défi, également pertinent pour d’autres espèces, des organoïdes tridimensionnels (3D) ont été développés dans le but de reproduire la complexité physiologique du GIT8. Initialement, les organoïdes ont été créés à partir d’intestins humains et de souris ; À ce jour, des organoïdes porcins provenant de porcs juvéniles et adultes ont également été développés et cultivés avec succès 9,10. Depuis leur création, ces organoïdes porcins ont été utilisés dans plusieurs études, se concentrant principalement sur les infections intestinales 11,12,13,14. Les recherches visant à caractériser les propriétés physiologiques, telles que le transport des nutriments ou les processus sécrétoires, restent limitées15. Cela peut être dû à l’orientation des organoïdes intestinaux, la face apicale tournée vers l’intérieur et la face basolatérale vers l’extérieur, limitant l’accessibilité à la surface apicale. Cette limitation a été résolue par la culture réussie d’organoïdes porcins dans un format bidimensionnel16, une méthode qui a été perfectionnée grâce à l’utilisation de tissus congelés pour les générer17.
La culture 2D d’organoïdes porcins permet d’accéder aux deux côtés de l’épithélium, ce qui permet l’application de méthodes bien établies pour étudier les processus de transport à travers la couche épithéliale. L’une de ces méthodes est la chambre d’Ussing18, qui permet d’observer en temps réel les processus d’absorption et de sécrétion électrogéniques à travers l’épithélium. L’utilisation intensive de ce système a permis une compréhension complète de la fonction intestinale porcine in vivo, couvrant l’ensemble de l’axe intestinal. Cela comprend des études sur le transport des monosaccharides ou du transport des acides gras à chaîne courte ou les réponses aux métabolites végétaux secondaires tels que le resvératrol qui influencent les caractéristiques de transport intestinal 19,20,21,22,23,24. L’ensemble substantiel de données issues de ces études facilite les comparaisons directes entre les conditions in vivo bien caractérisées et l’environnement in vitro des organoïdes porcins, améliorant ainsi notre compréhension de leur pertinence physiologique.
Dans cette étude, nous présentons un protocole de génération et de culture de monocouches 2D à partir d’organoïdes porcins 3D. De plus, nous détaillons l’approche méthodologique pour quantifier les processus de transport intestinal à l’aide de la technique de la chambre d’Ussing. Le protocole offre des outils pour étudier les caractéristiques d’absorption et de sécrétion in vitro dans les organoïdes du jéjunum et du côlon, permettant une comparaison directe avec des conditions in vivo bien caractérisées. Les applications futures de ce protocole pourraient inclure l’étude des effets de substances pharmacologiques ou toxicologiques, ainsi que l’exploration des interactions entre l’épithélium et les agents pathogènes.
Protocole
Dans le cadre de ce protocole, deux porcs en bonne santé (1 mâle, 1 femelle, 4,5 mois, environ 65 kg) ont été sacrifiés par tir à percuteur et saignage. Selon la loi sur la protection des animaux, l’abattage et le prélèvement de tissus ne sont pas considérés comme une expérience sur les animaux, mais doivent être signalés au responsable du bien-être animal (n° d’enregistrement. TiHo-T-2023-15) de la Fondation de l’Université de médecine vétérinaire de Hanovre.
1. Revêtement des inserts
REMARQUE : Toutes les étapes sont effectuées avec des matériaux stériles sous une enceinte de sécurité. Toutes les étapes du protocole sont effectuées sur la glace, sauf indication contraire.
- Décongeler la membrane basale gelée sur de la glace pendant au moins 1 h à température ambiante ou toute la nuit sur la glace à 4 °C. Mélangez la membrane basale 1:40 (v/v) avec une solution saline tamponnée au phosphate (PBS) stérile glacée dans un tube conique.
- Retirez les plaques stériles avec inserts de l’emballage. Ajouter 200 μL de mélange de membrane basale dans le compartiment apical de chaque insert.
- Replacez le couvercle de la plaque du puits et incubez pendant au moins 1,5 h à 37 °C, 5 % de CO2 dans un incubateur.
- Aspirez soigneusement la solution avant d’ensemencer les cellules. Assurez-vous que l’embout ne touche pas la membrane pendant l’aspiration.
2. Génération de monocouches organoïdes 2D
REMARQUE : Les organoïdes du côlon porcin sont générés et cultivés comme décrit pour les organoïdes jéjunaux porcins25. Après la génération d’organoïdes 3D, ceux-ci doivent être cultivés pendant au moins 3 à 4 semaines tout en passant chaque semaine pour assurer une croissance constante. Le nombre de cellules à l’intérieur de chaque dôme contenant des organoïdes 3D, qui sont dissous dans les étapes suivantes, est suffisant pour couvrir un seul filtre transmembranaire. Avant la génération de monocouches, les organoïdes 3D ont été soumis à un contrôle de qualité optique pour vérifier la croissance précédente et une éventuelle contamination (Figure 1).

Figure 1 : Organoïdes 3D représentatifs. Les organoïdes tridimensionnels du jéjunum (A) et du côlon (B) sont soigneusement examinés au microscope avant de générer des monocouches. Une attention particulière est accordée à l’évaluation des modèles de croissance antérieurs, de l’intégrité structurelle et de la présence d’impuretés ou de contamination. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Retirez le milieu organoïde (tableau 1) des puits avec des organoïdes de crypte 3D. Ajouter 1 mL de PBS glacé par puits et dissoudre doucement la membrane basale en pipetant de haut en bas avec une pointe p1000.
- Prélever tous les organoïdes dissous dans un tube de 15 mL pré-rempli de 10 mL de PBS glacé. Centrifuger le tube à 250 x g, 10 min à 4 °C. Aspirez le surnageant.
- Remettre la pastille en suspension dans 1 mL de trypsine/EDTA tiède à 0,05 % (v/v) (37 °C) (2 tubes peuvent être regroupés à ce stade). Incuber pendant 5 min à 37 °C dans un bain-marie et mettre directement sur de la glace par la suite pour arrêter la réaction.
- Resuspendez-le sur la glace 20x avec l’embout p1000, et encore 15x avec l’embout p1000 + l’embout p200 sur le dessus. Ajouter 10 ml de DMEM glacé complété par 10 % (v/v) de sérum de veau fœtal (SCA).
- Tube de centrifugation à 1 000 x g, 10 min à 4 °C. Jeter le surnageant et remettre la pastille en suspension dans 1 mL de milieu monocouche (tableau 1).
- Déterminez le nombre de cellules vivantes par ml à l’aide d’une chambre Neubauer conformément aux instructions du fabricant.
- Retirer la solution d’enrobage à ce stade du compartiment apical et la remplacer par 500 μL de milieu monocouche chaud (37 °C). Ajouter 3 mL de milieu monocouche dans le compartiment basolatéral.
- Déterminez la résistance à vide (TEER) de chaque insert de transpuits vide, comme décrit en détail à l’étape 3. Le temps pendant lequel aucun milieu n’est présent dans la chambre apicale doit être aussi court que possible pour éviter que les cellules ne se dessèchent.
- Retirer le milieu monocouche apical et ajouter pour la culture 2D jéjunale 2 x 105 cellules épithéliales et pour la culture 2D colique 1,5 x 105 cellules épithéliales dans 500 μL de milieu monocouche dans la chambre apicale de chaque puits de transwell.
- Changez de support et mesurez FEER tous les 2-3 jours. Mesurez FEER avant de changer de support. Aspirer soigneusement le milieu du compartiment apical et basal et le remplacer par 500 μL ou 3 mL de milieu frais et chaud (37 °C).
- Pour les organoïdes du jéjunum : au 16e jour, après l’ensemencement, passer d’un milieu monocouche à un milieu de différenciation (tableau 1). Pour les organoïdes du côlon : changer de milieu le jour 7 pour un milieu de différenciation.
- Changez le milieu de différenciation tous les jours et effectuez une mesure TEER à chaque changement de milieu. Le jour 18 (pour les organoïdes jéjunaux) ou le jour 9 (pour les organoïdes du côlon), après l’ensemencement, procédez aux expériences fonctionnelles.
3. Mesure de la résistance électrique transépithéliale (TEER)
REMARQUE : Toutes les mesures sont effectuées sous une enceinte de sécurité pour éviter toute contamination. Avant l’ensemencement des cellules, chaque puits enduit vide est mesuré pour obtenir des valeurs de vide individuelles. Le voltmètre-ohmmètre stocke les valeurs sur un périphérique USB introduit.
- Nettoyez l’électrode de la baguette avec de l’éthanol à 70 % (v/v) et laissez l’électrode sécher complètement. Pendant ce temps, retirez la plaque de l’incubateur et placez-la sous l’armoire.
- Introduisez le bras court de l’électrode de baguette dans le compartiment apical des inserts et le bras long dans le compartiment basolatéral de l’insert. Évitez le contact du bras court avec la couche cellulaire.
- Mesurez la résistance électrique transépithéliale de chaque transpuits. Laissez le voltmètre-ohmmètre s’équilibrer pour assurer une mesure stable. Mesurez les valeurs TEER en cliquant sur le bouton Store.
- Continuez les étapes 3.2 et 3.3 avec les puits restants. Après avoir atteint le dernier puits, le voltmètre-ohmmètre ouvre une demande de stockage des données sur un périphérique USB. Cliquez sur Enregistrer.
- Nettoyez l’électrode après chaque plaque et à la fin de la mesure et laissez-la sécher complètement avant de la ranger.
- Soustrayez les valeurs vides déterminées avant l’ensemencement des cellules des valeurs cellulaires mesurées.
4. Etudes de transport électrophysiologique à l’aide de la technique de la chambre d’Ussing
REMARQUE : La détermination des études de transport électrophysiologique est effectuée à l’aide d’une chambre d’Ussing composée de deux compartiments de chambre, qui sont divisés par l’épithélium. Cette chambre est reliée à une pince de tension par des électrodes Ag/AgCl. Cette technique permet de suivre les processus de transport électrogénique actif de l’épithélium à travers les modifications du courant de court-circuit (Isc) induites par la pince de tension ainsi que la résistance tissulaire (Rt) calculée par la loi d’Ohm. Isc et Rt sont enregistrés toutes les 6 s pendant toute la durée de l’expérience. Au cours de l’expérience, les tissus étudiés sont aérés avec du carbogène et incubés avec des solutions Krebs-Henseleit modifiées pour garantir des conditions viables. L’indométacine (10 μM) est ajoutée aux solutions tampons pour inhiber la synthèse des prostaglandines26.
- Réchauffer les solutions tampons muqueuses et séreuses à 37 °C et aérer avec du carbogène. Assemblez les chambres individuelles à l’aide d’un insert vide pour chaque chambre individuelle. Assurez-vous que les côtés apicaux des puits sont tous orientés dans la même direction.
- Remplissez toutes les chambres avec 5 mL de solution tampon muqueuse préchauffée (tableau 2). Connectez toutes les électrodes de la pince de tension aux chambres individuelles conformément aux instructions du fabricant. Assurez-vous qu’aucune bulle de gaz n’interfère avec les électrodes pour assurer une mesure correcte.
- Calibrez le logiciel de la chambre d’utilisation dans ces conditions en cliquant sur le bouton Rf/dpI dans le logiciel de pince de tension. La résistance de tous les inserts vides utilisés doit être égale (~ 70 Ohm) et le courant doit être d’environ 0 mV (± 5 mV). Si ce n’est pas le cas pour certaines chambres, vérifiez le bon placement des électrodes ou des bulles dans le système.
- Retirez toutes les électrodes et jetez la solution tampon utilisée. Ouvrez toutes les chambres individuelles et retirez les inserts vides. Assurez-vous que l’ordre des différentes chambres est maintenu.
- Déplacez la plaque de puits avec les inserts de l’incubateur vers l’armoire de sécurité. Aspirez soigneusement le milieu basolatéral et apical.
- Laver les cellules en ajoutant 500 μL de tampon muqueux chaud (37 °C) dans la chambre apicale et 3 ml de tampon sérosal, dans la chambre basolatérale. Aspirez les tampons et répétez l’opération 2 fois.
- Retirez les inserts de la plaque. Retirez délicatement les supports des inserts. Placez les inserts dans les chambres Ussing et assurez-vous que l’orientation des inserts est la même que lors de la phase d’étalonnage. Assemblez les chambres individuelles comme illustré à la figure 2.
- Remplissez les chambres faisant face à la face basolatérale des cellules avec 5 mL de tampon sérosal, (tableau 2) et la chambre faisant face à la chambre apicale avec 5 mL de tampon muqueux.
- Connectez les électrodes et les tubes d’aération à chaque chambre individuelle. Démarrez la mesure dans le logiciel Ussing. Laisser l’équilibre pendant 15 min.
- Changez les conditions d’un circuit ouvert à des conditions de court-circuit. Équilibrez pendant 5 min à 10 min. Ajouter 10 μM de forskoline dans la chambre séreuse.
REMARQUE : L’ajout de forskoline peut être remplacé par d’autres agents/substances en fonction des segments intestinaux individuels et des questions de recherche. - Après 15 minutes, ajoutez plus d’agents de la même manière que la forskoline ou arrêtez la mesure. Retirez les tubes d’aération et les électrodes des chambres individuelles. Versez les solutions tampons des deux chambres dans un bol.
- Démontez les chambres et jetez les inserts ou utilisez-les pour une analyse de suivi (p. ex., immunohistochimie ou analyse d’expression)
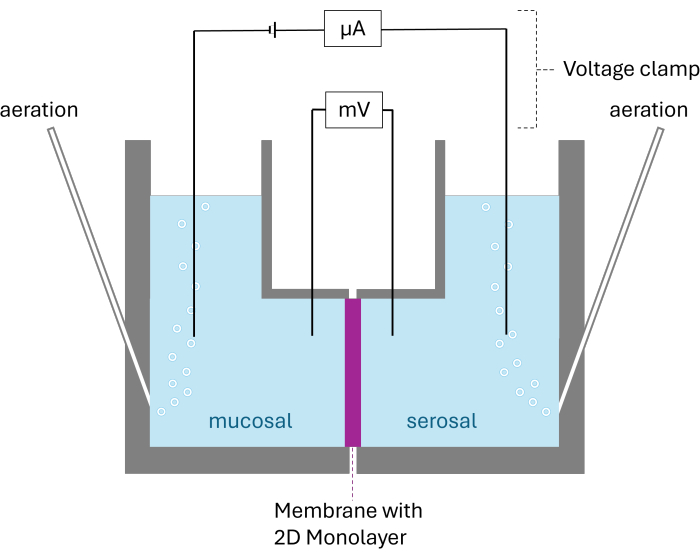
Figure 2 : Structure schématique de la chambre d’Ussing. Les deux chambres sont divisées par la membrane avec la monocouche 2D cultivée. Les deux chambres sont aérées au carbogène ; La tension et le courant sont surveillés par deux électrodes par chambre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Analyse des données générées par la configuration de la chambre Ussing
- Importez les données générées par le logiciel de pince de tension dans un éditeur de tableur approprié.
- Pour déterminer les valeurs basales Isc et Rt , calculez la moyenne de 10 points de données consécutifs pris 10 min après l’initialisation des conditions de court-circuit. Chaque chambre individuelle sert de réplique technique, tandis que chaque passage d’organoïdes sert de réplique biologique.
- Pour évaluer les effets des agents appliqués, calculez la moyenne de 10 points de données consécutifs immédiatement avant l’ajout de l’agent. Comparez cette moyenne à la valeur maximale (ou minimale) observée après l’application de l’agent. Les données obtenues sont présentées sous forme de moyenne ± d’écart-type (ET).
Résultats
Ce protocole facilite la génération fiable de monocouches 2D porcines en désagrégeant des organoïdes 3D dérivés du jéjunum et du côlon des porcs. Sur une période de culture de 16 jours pour les organoïdes du jéjunum et de 9 jours pour les organoïdes du côlon, des monocouches intactes se forment. Ces monocouches peuvent ensuite être utilisées pour évaluer les propriétés de transport électrogéniques et physiologiques à l’aide de la technique de la chambre d’Ussing...
Discussion
Ce protocole décrit une méthode pour convertir des organoïdes 3D porcins établis en cellules uniques, qui sont ensuite ensemencées sur des membranes transpuits pour former une monocouche intacte. Cette configuration permet d’accéder à la face apicale des cellules, facilitant l’utilisation des chambres d’Ussing pour surveiller les processus d’absorption et de sécrétion.
L’étape initiale et cruciale de ce processus en plusieurs étapes est la...
Déclarations de divulgation
Nous n’avons aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions le ministère fédéral de l’Alimentation et de l’Agriculture (BLE# 28N-2-071-00) pour le financement.
matériels
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
Références
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon