Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Двумерные органоиды кишечника свиньи, отражающие физиологические свойства нативного кишечника
В этой статье
Резюме
В этом исследовании изложен протокол создания двумерных монослоев органоидов свиньи, полученных из тонкого и толстого кишечника. Рост этих монослоев характеризуется увеличением значений TEER, что указывает на устойчивую целостность эпителия. Кроме того, эти монослои проявляют физиологические секреторные реакции в экспериментах в камере Уссинга после применения форсколина.
Аннотация
Желудочно-кишечный тракт (ЖКТ) служит не только для переваривания пищи и усвоения питательных веществ, но и в качестве защитного барьера от патогенов. Традиционно исследования в этой области опирались на эксперименты на животных, но растет спрос на альтернативные методы, которые придерживаются принципов 3R — замена, сокращение и совершенствование. Органоиды свиней стали многообещающим инструментом, предлагающим более точную репликацию in vitro условий in vivo , чем традиционные клеточные модели. Одной из основных проблем кишечных органоидов является их обращенная внутрь апикальная поверхность и обращенная наружу базолатеральная поверхность. Это ограничение может быть преодолено путем создания двумерных (2D) органоидных слоев на трансвелловых вставках (далее именуемых вставками)), обеспечивающих доступ к обеим поверхностям. В этом исследовании мы успешно разработали двумерные культуры органоидов тощей кишки свиньи и толстой кишки. Процесс культивирования включает в себя два ключевых этапа: во-первых, формирование клеточного монослоя с последующей дифференцировкой клеток с помощью специализированных сред. Клеточный рост отслеживается путем измерения трансэпителиального электрического сопротивления, которое стабилизируется к 8-му дню для органоидов толстой кишки и 16-му дню для органоидов тощей кишки. После 2-дневной фазы дифференцировки эпителий готов к анализу. Для количественной оценки и отслеживания активных электрогенных транспортных процессов, таких как секреция хлоридов, мы используем метод камеры Уссинга. Этот метод позволяет проводить измерения в режиме реального времени и подробно характеризовать процессы переноса эпителия. Эта инновационная модель in vitro в сочетании с признанными методами, такими как камера Уссинга, обеспечивает надежную платформу для физиологической характеристики желудочно-кишечного тракта свиньи в рамках 3R. Это также открывает возможности для исследования патофизиологических механизмов и разработки потенциальных терапевтических стратегий.
Введение
ЖКТ играет центральную роль в пищеварении, усвоении питательных веществ и выведении отходов через кал1. Кроме того, он функционирует как барьер против патогенов, и эта роль поддерживается разнообразным клеточным составом, включая стволовые клетки, бокаловидные клетки, продуцирующие слизь, энтероэндокринные клетки и абсорбционные энтероциты2. Гомеостаз кишечника может быть нарушен различными факторами, такими как бактериальные инфекции3 или воспалительные процессы4, что приводит к тяжелым последствиям для организма, таким как мальабсорбция, диарея или даже смерть5. Исследование таких патофизиологических сценариев обычно проводится с использованием лабораторных животных или, в соответствии с принципом6 3R, клеточных культур, полученных от различных видов. Точное прогнозирование и переносимость результатов имеют решающее значение при использовании видоспецифичных моделей7. Несмотря на эту потребность, существует заметная нехватка клеточных культур, полученных из свиньи, которые адекватно воспроизводят сложность и функциональность кишечного тракта.
Для решения этой проблемы, также актуальной для других видов, были разработаны трехмерные (3D) органоиды в попытке воспроизвести физиологическую сложность ЖКТ8. Первоначально органоиды создавались из кишечника человека и мышей; На сегодняшний день также успешно выведены и культивированы органоиды свиней от молоди и взрослых свиней 9,10. С момента своего создания эти свиные органоиды использовались в нескольких исследованиях, в первую очередь посвященных кишечным инфекциям 11,12,13,14. Исследования, направленные на характеристику физиологических свойств, таких как транспорт питательных веществ или секреторные процессы, остаются ограниченными15. Это может быть связано с ориентацией кишечных органоидов, при этом апикальная поверхность обращена внутрь, а базолатеральная сторона наружу, что ограничивает доступ к апикальной поверхности. Это ограничение было устранено путем успешного культивирования органоидов свиней в двумерном формате16, метод, который был усовершенствован за счет использования замороженных тканей для их получения17.
2D-культивирование органоидов свиньи обеспечивает доступ к обеим сторонам эпителия, что позволяет применять хорошо зарекомендовавшие себя методы для изучения процессов переноса через эпителиальный слой. Одним из таких методов является камераУссинга 18, которая позволяет в режиме реального времени наблюдать за электрогенными абсорбционными и секреторными процессами в эпителии. Широкое использование этой системы обеспечило всестороннее понимание функции кишечника свиньи in vivo, охватывающее всю кишечную ось. Это включает в себя исследования транспорта моносахаридов или короткоцепочечных жирных кислот или реакции на вторичные растительные метаболиты, такие как ресвератрол, которые влияют на характеристики кишечного транспорта 19,20,21,22,23,24. Значительный объем данных этих исследований позволяет проводить прямые сравнения между хорошо охарактеризованными in vivo условиями и средой in vitro свиных органоидов, улучшая наше понимание их физиологической значимости.
В этом исследовании мы представляем протокол создания и культивирования 2D-монослоев из 3D-органоидов свиней. Кроме того, мы подробно описываем методологический подход к количественной оценке процессов кишечного транспорта с использованием техники камеры Уссинга. Протокол предлагает инструменты для изучения абсорбционных и секреторных характеристик in vitro в органоидах тощей кишки и толстой кишки, что позволяет проводить прямое сравнение с хорошо охарактеризованными условиями in vivo . Будущие применения этого протокола могут включать исследование эффектов фармакологических или токсикологических веществ, а также изучение взаимодействий между эпителием и патогенами.
протокол
Для этого протокола две здоровые свиньи (черная пестрая свинья Бентхайма; 1 самец, 1 самка; возраст 4,5 месяца; около 65 кг) были принесены в жертву путем выстрела в неволю и обескровливания. Согласно Закону о защите животных, это (убой и изъятие тканей) не классифицируется как эксперимент на животных, но должно быть сообщено инспектору по защите животных (регистрационный номер. TiHo-T-2023-15) Университета ветеринарной медицины Ганноверского фонда.
1. Нанесение покрытий на вкладыши
ПРИМЕЧАНИЕ: Все этапы выполняются с использованием стерильных материалов под защитным шкафом. Все этапы протокола выполняются на льду, если не указано иное.
- Замерзшую базальную мембрану разморозьте на льду не менее 1 часа при комнатной температуре или в течение ночи на льду при температуре 4 °C. Смешайте базальную мембрану в соотношении 1:40 (v/v) с ледяным стерильным фосфатно-солевым буфером (PBS) в конической пробирке.
- Извлеките стерильные пластины со вкладышами из упаковки. Добавьте 200 мкл смеси базальной мембраны в апикальный отсек каждой вставки.
- Установите на место крышку луночного колодца и инкубируйте в инкубаторе не менее 1,5 ч при 37 °C, 5%CO2 .
- Тщательно отсадите раствор перед затравливанием клеток. Следите за тем, чтобы наконечник не касался мембраны во время аспирации.
2. Генерация монослоев 2D органоидов
ПРИМЕЧАНИЕ: Органоиды толстой кишки свиньи получают и культивируют так, как описано для органоидов тощей кишки свиней25. После получения 3D органоидов их следует культивировать в течение как минимум 3-4 недель с еженедельным пассажем для обеспечения стабильного роста. Количество ячеек внутри каждого купола, содержащих 3D-органоиды, которые растворяются на последующих стадиях, достаточно для покрытия одного трансмембранного фильтра. Перед созданием монослоя 3D-органоиды подвергали оптическому контролю качества для проверки предыдущего роста и возможного загрязнения (рис. 1).

Рисунок 1: Репрезентативные 3D-органоиды. Трехмерные органоиды (А) тощей кишки и (В) толстой кишки тщательно исследуются под микроскопом перед получением монослоев. Особое внимание уделяется оценке предыдущих моделей роста, структурной целостности, а также наличию каких-либо примесей или загрязнений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Удалите органоидную среду (табл. 1) из лунок с помощью органоидов 3D крипты. Добавьте 1 мл ледяного PBS на лунку и аккуратно растворите базальную мембрану пипетированием вверх и вниз с помощью наконечника p1000.
- Соберите все растворенные органоиды в пробирку объемом 15 мл, предварительно заполненную 10 мл ледяного PBS. Центрифугируйте пробирку при давлении 250 x g, 10 мин при 4 °C. Аспирируйте надосадочную жидкость.
- Ресуспендируйте гранулу в 1 мл теплого (37 °C) 0,05 % (v/v) трипсина/ЭДТА (на этом этапе можно объединить 2 пробирки). Выдерживать в течение 5 минут при температуре 37 °C на водяной бане, а затем положить прямо на лед, чтобы остановить реакцию.
- Подвешиваем на льду 20 раз с наконечником p1000, и еще 15 раз с наконечником p1000 + наконечником p200 сверху. Добавьте 10 мл ледяного DMEM с добавлением 10% (v/v) фетальной сыворотки теленка (FCS).
- Центрифужная пробирка при 1 000 x g, 10 мин при 4 °C. Надосадочную жидкость отбраковать и ресуспендировать гранулу в 1 мл однослойной среды (табл. 1).
- Определите количество живых клеток на мл с помощью камеры Нейбауэра в соответствии с инструкциями производителя.
- Извлеките раствор покрытия из апикального отсека и замените его 500 μL теплой (37 °C) однослойной среды. Добавьте в базолатеральный отсек 3 мл однослойной среды.
- Определите сопротивление холостым элементам (TEER) каждой пустой транслунальной вставки, как подробно описано в шаге 3. Время, в течение которого в апикальной камере отсутствует среда, должно быть как можно короче, чтобы предотвратить высыхание клеток.
- Удалите апикальную монослойную среду и добавьте для 2D-культуры тощей кишки 2 x 105 эпителиальных клеток и для 2D-культуры толстой кишки 1,5 x10 5 эпителиальных клеток в 500 мкл монослойной среды в апикальную камеру каждого трансвелла.
- Меняйте среду и измеряйте TEER каждые 2-3 дня. Измерьте TEER перед сменой среды. Осторожно отсадите среду апикального и базального отдела и замените ее 500 мкл или 3 мл свежей, теплой (37 °C) среды.
- Для органоидов тощей кишки: на 16-й день, после посева, перейти с однослойной среды на среду дифференцировки (табл. 1). Для органоидов толстой кишки: смените среду на 7-й день на среду для дифференцировки.
- Меняйте дифференциационную среду каждый день и выполняйте измерение TEER при каждой смене среды. На 18-й день (для органоидов тощей кишки) или на 9-й день (для органоидов толстой кишки), после посева, приступают к функциональным экспериментам.
3. Измерение трансэпителиального электрического сопротивления (TEER)
ПРИМЕЧАНИЕ: Все измерения проводятся в безопасном шкафу во избежание загрязнения. Перед засевом ячеек каждый пустой колодец с покрытием измеряется для получения отдельных значений заготовки. Вольт-омметр хранит значения на введенном USB-устройстве.
- Очистите электрод палочки для еды этанолом 70% (v/v) и дайте электроду полностью высохнуть. Тем временем достаньте тарелку из инкубатора и поставьте ее под шкаф.
- Введите короткий рычаг электрода палочки для еды в апикальный отсек вкладышей, а длинный рычаг - в базолатеральный отсек вкладыша. Избегайте контакта короткой руки с клеточным слоем.
- Измерьте трансэпителиальное электрическое сопротивление каждого трансвелла. Дайте вольт-омметру сбалансироваться, чтобы обеспечить стабильное измерение. Измерьте значения TEER, нажав кнопку «Сохранить».
- Продолжайте шаги 3.2 и 3.3 с оставшимися лунками. Дойдя до последней скважины, вольт-омметр открывает запрос на сохранение данных на USB-устройстве. Нажмите кнопку Сохранить.
- Очищайте электрод после каждой пластины и в конце измерения и дайте ему полностью высохнуть перед хранением.
- Вычтите из измеренных ячеек пустые значения, определенные перед затравкой ячеек.
4. Исследования электрофизиологического транспорта с использованием техники камеры Уссинга
ПРИМЕЧАНИЕ: Определение электрофизиологических транспортных исследований выполняется с помощью камеры Уссинга, состоящей из двух камерных отсеков, разделенных эпителием. Эта камера соединена с напряжением с помощью электродов Ag/AgCl. Этот метод позволяет отслеживать активные электрогенные процессы переноса эпителия по изменению тока короткого замыкания (Isc), индуцированного напряжением зажима, а также сопротивления тканей (Rt), рассчитанного по закону Ома. Isc и Rt регистрируются каждые 6 с в течение всего эксперимента. В ходе эксперимента исследуемая ткань аэрируется карбогеном и инкубируется с модифицированными растворами Кребса-Хенселеита для обеспечения жизнеспособных условий. Индометацин (10 мкМ) добавляют в буферные растворы для ингибирования синтеза простагландинов26.
- Прогреть слизистые и серозные буферные растворы до 37 °С и аэрировать карбогеном. Соберите отдельные камеры, используя пустую вставку для каждой отдельной камеры. Убедитесь, что все апикальные стороны трансвеллов обращены в одном направлении.
- Заполните все камеры 5 мл предварительно подогретого буферного раствора слизистой оболочки (табл. 2). Подключите все электроды от зажима напряжения к отдельным камерам в соответствии с инструкциями производителя. Убедитесь, что пузырьки газа не мешают электродам, чтобы обеспечить правильное измерение.
- Откалибруйте программное обеспечение камеры Ussing в соответствии с этими условиями, нажав кнопку Rf/dpI в программном обеспечении voltage-clamp. Сопротивление всех используемых пустых вставок должно быть одинаковым (~ 70 Ом), а ток должен быть около 0 мВ (± 5 мВ). Если это не относится к некоторым камерам, проверьте правильное расположение электродов или пузырьков в системе.
- Снимите все электроды и выбросьте использованный буферный раствор. Откройте все отдельные камеры и удалите пустые вставки. Следите за тем, чтобы порядок отдельных камер соблюдался.
- Переместите пластину лунки со вставками из инкубатора в защитный шкаф. Осторожно отсасывайте базолатеральную и апикальную среду.
- Промойте клетки, добавив 500 мкл теплого (37 °C) буфера слизистой оболочки в апикальную камеру и 3 мл серозального буфера в базолатеральную камеру. Отсадите буферы и повторите 2 раза.
- Снимите вставки с пластины. Аккуратно снимите опоры вставок. Поместите вставки в камеры Ussing и убедитесь, что ориентация вставок такая же, как и на этапе калибровки. Соберите отдельные камеры, как показано на рисунке 2.
- Заполните камеры, обращенные к базолатеральной стороне клеток, 5 мл серозального буфера (табл. 2), а камеру, обращенную к апикальной камере, - 5 мл буфера слизистой оболочки.
- Подсоедините электроды и аэрационные трубки к каждой отдельной камере. Начните измерение в программном обеспечении Ussing. Дайте уравновеситься в течение 15 минут.
- Измените условия с обрыва цепи на состояние короткого замыкания. Уравновесьте от 5 минут до 10 минут. Добавьте 10 мкМ форсколина в серозальную камеру.
ПРИМЕЧАНИЕ: Добавление форсколина может быть заменено другими агентами/веществами в зависимости от отдельных сегментов кишечника и исследовательских вопросов. - Через 15 минут либо добавьте больше агентов таким же образом, как и форсколин, либо прекратите измерение. Снимите аэрационные трубки и электроды с отдельных камер. Вылейте буферные растворы обеих камер в миску.
- Разберите камеры и либо выбросьте вкладыши, либо используйте их для последующего анализа (например, иммуногистохимии или анализа экспрессии)
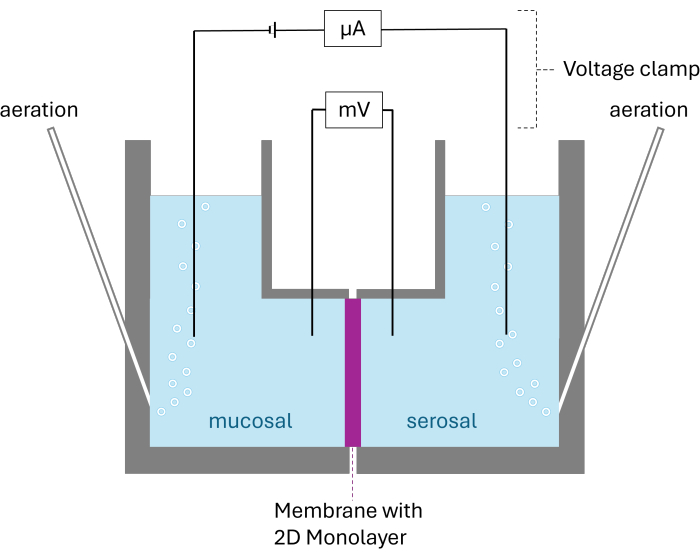
Рисунок 2: Схематическая структура камеры Уссинга. На дисплее представлены обе камеры, разделенные мембраной с выращенным 2D монослоем. Обе камеры проветриваются карбогеном; Напряжение и ток контролируются двумя электродами на камеру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Анализ данных, полученных при настройке камеры Уссинга
- Импортируйте данные, сгенерированные программным обеспечением для измерения напряжения, в подходящий редактор электронных таблиц.
- Чтобы определить базальныезначения I, sc и R, рассчитаем среднее значение 10 последовательных точек данных, полученных через 10 мин после инициализации условий короткого замыкания. Каждая отдельная камера служит технической репликацией, в то время как каждый проход органоидов служит биологической репликацией.
- Чтобы оценить эффекты применяемых агентов, вычислите среднее значение 10 последовательных точек данных непосредственно перед добавлением агента. Сравните это среднее значение с максимальным (или минимальным) значением, наблюдаемым после применения агента. Полученные данные представлены в виде среднего ± стандартного отклонения (SD).
Результаты
Этот протокол способствует надежному получению 2D-монослоев свиней путем дезагрегирования 3D-органоидов, полученных из тощей и толстой кишки свиней. В течение периода культивирования, составляющего 16 дней для органоидов тощей кишки и 9 дней для органоидов толстой кишк...
Обсуждение
Этот протокол описывает метод преобразования укоренившихся 3D-органоидов свиньи в одиночные клетки, которые затем засеваются на трансвелловые мембраны для формирования неповрежденного монослоя. Такая конфигурация обеспечивает доступ к апикальной стороне клеток, о?...
Раскрытие информации
У нас нет никаких конфликтов интересов, о которых мы могли бы заявить.
Благодарности
Мы благодарим Федеральное министерство продовольствия и сельского хозяйства (BLE# 28N-2-071-00) за финансирование.
Материалы
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
Ссылки
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены