Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Organoides intestinales porcinos bidimensionales que reflejan las propiedades fisiológicas del intestino nativo
En este artículo
Resumen
Este estudio describe un protocolo para generar monocapas 2D de organoides porcinos derivados del intestino delgado y grueso. El crecimiento de estas monocapas se caracteriza por el aumento de los valores de TEER, lo que indica una sólida integridad epitelial. Además, estas monocapas exhiben respuestas secretoras fisiológicas en experimentos en cámara de Ussing después de la aplicación de forskolina.
Resumen
El tracto gastrointestinal (TGI) sirve tanto en la digestión de los alimentos como en la absorción de nutrientes, pero también como barrera protectora contra los patógenos. Tradicionalmente, la investigación en esta área se ha basado en experimentos con animales, pero existe una creciente demanda de métodos alternativos que se adhieran a los principios de las 3R: reemplazar, reducir y refinar. Los organoides porcinos se han convertido en una herramienta prometedora, ya que ofrecen una replicación in vitro más precisa de las condiciones in vivo que los modelos celulares tradicionales. Uno de los principales desafíos con los organoides intestinales es su superficie apical orientada hacia adentro y su superficie basolateral orientada hacia afuera. Esta limitación se puede superar mediante la creación de capas de organoides bidimensionales (2D) en insertos transpocillos (en adelante, denominados insertos), proporcionando acceso a ambas superficies. En este estudio, desarrollamos con éxito cultivos bidimensionales de yeyuno porcino y organoides de colon. El proceso de cultivo implica dos fases clave: en primer lugar, la formación de una monocapa celular, seguida de la diferenciación de las células mediante medios personalizados. El crecimiento celular se rastrea midiendo la resistencia eléctrica transepitelial, que se estabiliza en el día 8 para los organoides del colon y en el día 16 para los organoides del yeyuno. Después de una fase de diferenciación de 2 días, el epitelio está listo para el análisis. Para cuantificar y rastrear los procesos activos de transporte electrogénico, como la secreción de cloruro, empleamos la técnica de la cámara de Ussing. Este método permite la medición en tiempo real y la caracterización detallada de los procesos de transporte epitelial. Este innovador modelo in vitro , combinado con técnicas establecidas como la cámara de Ussing, proporciona una plataforma robusta para caracterizar fisiológicamente el TGI porcino dentro del marco de las 3R. También abre oportunidades para investigar los mecanismos fisiopatológicos y desarrollar posibles estrategias terapéuticas.
Introducción
El TGI desempeña un papel central en la digestión, la absorción de nutrientes y la excreción de desechos a través de las heces1. Además, funciona como una barrera contra los patógenos, un papel respaldado por una composición celular diversa, que incluye células madre, células caliciformes productoras de moco, células enteroendocrinas y enterocitos absorbentes2. La homeostasis intestinal puede verse alterada por diversos factores, como infecciones bacterianas3 o procesos inflamatorios4, lo que conlleva graves consecuencias para el organismo, como malabsorción, diarrea o incluso la muerte5. La investigación de estos escenarios fisiopatológicos se realiza comúnmente utilizando animales de laboratorio o, de acuerdo con el principio de las 3R6, cultivos celulares derivados de varias especies. La predicción precisa y la transferibilidad de los resultados son cruciales cuando se emplean modelos específicos de cada especie7. A pesar de esta necesidad, existe una notable falta de cultivos celulares derivados del cerdo que reproduzcan adecuadamente la complejidad y funcionalidad del tracto intestinal.
Para hacer frente a este reto, también relevante para otras especies, se han desarrollado organoides tridimensionales (3D) en un intento de replicar la complejidad fisiológica del TGI8. Inicialmente, los organoides se crearon a partir de intestinos humanos y de ratones; Hasta la fecha, también se han desarrollado y cultivado con éxito organoides porcinos de cerdos juveniles y adultos 9,10. Desde sus inicios, estos organoides porcinos han sido utilizados en varios estudios, centrándose principalmente en las infecciones intestinales 11,12,13,14. Las investigaciones destinadas a caracterizar las propiedades fisiológicas, como el transporte de nutrientes o los procesos de secreción, siguen siendo limitadas15. Esto puede deberse a la orientación de los organoides intestinales, con la superficie apical hacia adentro y el lado basolateral hacia afuera, lo que limita la accesibilidad a la superficie apical. Esta limitación se abordó mediante el cultivo exitoso de organoides porcinos en un formato bidimensional16, un método que se ha avanzado aún más mediante el uso de tejido congelado para generarlos17.
El cultivo en 2D de organoides porcinos proporciona acceso a ambos lados del epitelio, lo que permite la aplicación de métodos bien establecidos para estudiar los procesos de transporte a través de la capa epitelial. Uno de estos métodos es la cámara de Ussing18, que permite la observación en tiempo real de los procesos electrogénicos de absorción y secreción a través del epitelio. El uso extensivo de este sistema ha proporcionado una comprensión integral de la función intestinal porcina in vivo, cubriendo todo el eje intestinal. Esto incluye estudios sobre el transporte de monosacáridos o el transporte de ácidos grasos de cadena corta o las respuestas a metabolitos secundarios de plantas como el resveratrol que influyen en las características de transporte intestinal 19,20,21,22,23,24. El considerable conjunto de datos de estos estudios facilita las comparaciones directas entre las condiciones in vivo bien caracterizadas y el entorno in vitro de los organoides porcinos, lo que mejora nuestra comprensión de su relevancia fisiológica.
En este estudio, presentamos un protocolo para la generación y cultivo de monocapas 2D a partir de organoides porcinos 3D. Además, se detalla el enfoque metodológico para cuantificar los procesos de transporte intestinal mediante la técnica de la cámara de Ussing. El protocolo ofrece herramientas para estudiar las características de absorción y secreción in vitro en organoides de yeyuno y colon, lo que permite la comparación directa con condiciones in vivo bien caracterizadas. Las aplicaciones futuras de este protocolo pueden incluir la investigación de los efectos de las sustancias farmacológicas o toxicológicas, así como la exploración de las interacciones entre el epitelio y los patógenos.
Protocolo
Para este protocolo, se sacrificaron dos cerdos sanos (cerdo Bentheim Blacked Pied; 1 macho, 1 hembra; 4,5 meses de edad; aproximadamente 65 kg) por tiro de perno cautivo y sangrado. De acuerdo con la Ley de Protección Animal, esto (sacrificio y extracción de tejidos) no se clasifica como un experimento con animales, sino que debe ser anunciado al oficial de bienestar animal (registro no. TiHo-T-2023-15) de la Fundación de la Universidad de Medicina Veterinaria de Hannover.
1. Recubrimiento de insertos
NOTA: Todos los pasos se llevan a cabo con materiales estériles bajo un gabinete de seguridad. Todos los pasos del protocolo se realizan en hielo a menos que se indique lo contrario.
- Descongele la membrana basal congelada en hielo durante al menos 1 h a temperatura ambiente o durante la noche sobre el hielo a 4 °C. Mezcle la membrana basal 1:40 (v/v) con solución salina estéril tamponada con fosfato (PBS) helada en un tubo cónico.
- Retire las placas estériles con insertos del embalaje. Añadir 200 μL de mezcla de membrana basal al compartimento apical de cada inserto.
- Vuelva a colocar la tapa de la placa de pocillos e incube durante al menos 1,5 h a 37 °C, 5% deCO2 en una incubadora.
- Aspire la solución con cuidado antes de sembrar las células. Asegúrese de que la punta no toque la membrana durante la aspiración.
2. Generación de monocapas de organoides 2D
NOTA: Los organoides del colon porcino se generan y cultivan como se describe para los organoides yeyunales porcinos25. Después de la generación de organoides 3D, estos deben cultivarse durante al menos 3-4 semanas durante el paso semanal para garantizar un crecimiento constante. El número de células dentro de cada cúpula que contienen organoides 3D, que se disuelven en los pasos siguientes, es suficiente para cubrir un solo filtro transmembrana. Antes de la generación de la monocapa, los organoides 3D se sometieron a un control óptico de calidad para comprobar el crecimiento previo y la posible contaminación (Figura 1).

Figura 1: Organoides 3D representativos. Los organoides tridimensionales (A) del yeyuno y (B) del colon se examinan cuidadosamente bajo el microscopio antes de generar monocapas. Se presta especial atención a la evaluación de los patrones de crecimiento previos, la integridad estructural y la presencia de impurezas o contaminación. Haga clic aquí para ver una versión más grande de esta figura.
- Retire el medio organoide (Tabla 1) de los pocillos con organoides de cripta 3D. Agregue 1 mL de PBS helado por pocillo y disuelva suavemente la membrana basal pipeteando hacia arriba y hacia abajo con una punta p1000.
- Recoja todos los organoides disueltos en un tubo de 15 mL precargado con 10 mL de PBS helado. Centrifugar el tubo a 250 x g, 10 min a 4 °C. Aspirar el sobrenadante.
- Vuelva a suspender el pellet en 1 mL de tripsina/EDTA tibio (37 °C) al 0,05 % (v/v) (se pueden agrupar 2 tubos en esta etapa). Incubar durante 5 minutos a 37 °C en un baño de agua y poner directamente sobre hielo después para detener la reacción.
- Vuelva a suspender en hielo 20 veces con punta p1000 y otras 15 veces con punta p1000 + punta p200 en la parte superior. Añadir 10 mL de DMEM helado suplementado con un 10% (v/v) de suero fetal para terneros (FCS).
- Tubo de centrífuga a 1.000 x g, 10 min a 4 °C. Deseche el sobrenadante y vuelva a suspender el pellet en 1 mL de medio monocapa (Tabla 1).
- Determine el número de células vivas por ml utilizando una cámara de Neubauer de acuerdo con las instrucciones del fabricante.
- Retire la solución de recubrimiento en este punto del compartimento apical y reemplácela con 500 μL de medio monocapa tibio (37 °C). Añadir 3 mL de medio monocapa al compartimento basolateral.
- Determine la resistencia de la pieza en bruto (TEER) de cada plaquita de transpocillo vacía, como se describe en detalle en el paso 3. El tiempo en el que no hay medio en la cámara apical debe ser lo más corto posible para evitar que las células se sequen.
- Retirar el medio monocapa apical y añadir para el cultivo yeyunal 2D 2 x 105 células epiteliales y para el cultivo colónico 2D 1,5 x 105 células epiteliales en 500 μL de medio monocapa en la cámara apical de cada transpocillo.
- Cambie el medio y mida el TEER cada 2-3 días. Mida el TEER antes de cambiar el medio. Aspire cuidadosamente el medio del compartimento apical y basal y sustitúyalo por 500 μL o 3 mL de medio fresco y tibio (37 °C).
- Para organoides de yeyuno: el día 16, después de la siembra, cambiar de medio monocapa a medio de diferenciación (Tabla 1). Para los organoides del colon: cambie el medio el día 7 por el medio de diferenciación.
- Cambie el medio de diferenciación todos los días y realice la medición de TEER durante cada cambio de medio. El día 18 (para los organoides yeyunales) o el día 9 (para los organoides del colon), después de la siembra, proceda con los experimentos funcionales.
3. Medición de la resistencia eléctrica transepitelial (TEER)
NOTA: Todas las mediciones se realizan bajo una cabina de seguridad para evitar la contaminación. Antes de sembrar las celdas, se mide cada pocillo transpocillo recubierto vacío para obtener valores en blanco individuales. El voltímetro-ohmio almacena los valores en un dispositivo USB introducido.
- Limpie el electrodo de palillo con etanol al 70% (v/v) y deje que el electrodo se seque por completo. Mientras tanto, retire la placa de la incubadora y colóquela debajo del gabinete.
- Introduzca el brazo corto del electrodo de palillo en el compartimento apical de los insertos y el brazo largo en el compartimento basolateral del inserto. Evite el contacto del brazo corto con la capa de células.
- Mida la resistencia eléctrica transepitelial de cada transpocillo. Permita que el voltímetro-ohmio se equilibre para garantizar una medición estable. Mida los valores de TEER haciendo clic en el botón Almacenar.
- Continúe los pasos 3.2 y 3.3 con los pozos restantes. Después de llegar al último pozo, el voltímetro-ohmio abre una solicitud para almacenar los datos en un dispositivo USB. Haga clic en Guardar.
- Limpie el electrodo después de cada placa y al final de la medición y deje que se seque completamente antes de guardarlo.
- Reste los valores en blanco determinados antes de sembrar las celdas de los valores celulares medidos.
4. Estudios electrofisiológicos de transporte mediante la técnica de la cámara de Ussing
NOTA: La determinación de los estudios de transporte electrofisiológico se realiza mediante el uso de una cámara de Ussing que consta de dos compartimentos de cámara, que están divididos por el epitelio. Esta cámara está conectada a una pinza de voltaje mediante electrodos de Ag / AgCl. Esta técnica permite el seguimiento de los procesos activos de transporte electrogénico del epitelio a través de los cambios en la corriente de cortocircuito (Isc) inducida por la pinza amperimétrica, así como la resistencia tisular (Rt) calculada por la ley de Ohm. Isc y Rt se registran cada 6 s durante todo el experimento. Durante el experimento, el tejido investigado se airea con carbógeno y se incuba con soluciones de Krebs-Henseleit modificadas para garantizar condiciones viables. La indometacina (10 μM) se añade a las soluciones tampón para inhibir la síntesis de prostaglandinas26.
- Calentar las soluciones tampón de mucosa y serosa a 37 °C y airear con carbógeno. Ensamble las cámaras individuales usando un inserto vacío para cada cámara individual. Asegúrese de que los lados apicales de los transpocillos estén todos orientados en la misma dirección.
- Llene todas las cámaras con 5 mL de solución tampón de mucosa precalentada (Tabla 2). Conecte todos los electrodos de la pinza de voltaje a las cámaras individuales de acuerdo con las instrucciones del fabricante. Asegúrese de que no haya burbujas de gas que interfieran con los electrodos para garantizar una medición correcta.
- Calibre el software de la cámara de uso con estas condiciones haciendo clic en el botón Rf/dpI en el software de la pinza de voltaje. La resistencia de todos los insertos vacíos usados debe ser igual (~ 70 ohmios) y la corriente debe estar alrededor de 0 mV (± 5 mV). Si este no es el caso de algunas cámaras, verifique la ubicación adecuada de los electrodos o burbujas en el sistema.
- Retire todos los electrodos y deseche la solución tampón usada. Abra todas las cámaras individuales y retire los insertos vacíos. Asegúrese de que se mantenga el orden de las cámaras individuales.
- Mueva la placa de pocillos con insertos de la incubadora al gabinete de seguridad. Aspirar cuidadosamente el medio basolateral y apical.
- Lave las células añadiendo 500 μL de tampón mucoso tibio (37 °C) a la cámara apical y 3 mL de tampón serosa a la cámara basolateral. Aspire los tampones y repita 2 veces.
- Retire los insertos de la placa. Retire con cuidado los soportes de los insertos. Coloque los insertos en las cámaras de uso y asegúrese de que la orientación de los insertos sea la misma que durante la fase de calibración. Ensamble las cámaras individuales como se muestra en la Figura 2.
- Llene las cámaras que miran hacia el lado basolateral de las células con 5 mL de tampón serosa (Tabla 2) y la cámara que mira hacia la cámara apical con 5 mL de tampón mucoso.
- Conecte los electrodos y los tubos de aireación a cada cámara individual. Inicie la medición en el software Ussing. Permita el equilibrio durante 15 min.
- Cambie las condiciones de circuito abierto a condiciones de cortocircuito. Equilibre durante 5 min a 10 min. Añadir 10 μM de forskolina a la cámara serosa.
NOTA: La adición de forskolina puede ser reemplazada por otros agentes/sustancias dependiendo de los segmentos intestinales individuales y las preguntas de investigación. - Después de 15 minutos, agregue más agentes de la misma manera que la forskolina o detenga la medición. Retire los tubos de aireación y los electrodos de las cámaras individuales. Vierta las soluciones tampón de ambas cámaras en un recipiente.
- Desmonte las cámaras y deseche los insertos o utilícelos para análisis de seguimiento (por ejemplo, inmunohistoquímica o análisis de expresión)
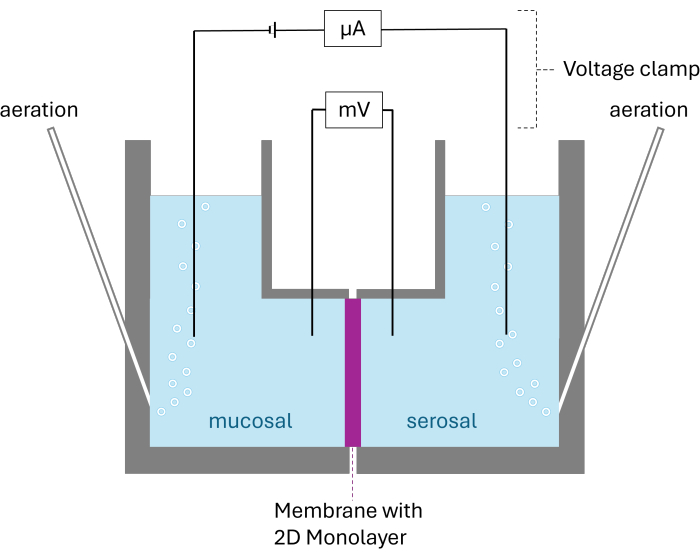
Figura 2: Estructura esquemática de la cámara de Ussing. Se muestran ambas cámaras divididas por la membrana con la monocapa 2D crecida. Ambas cámaras están aireadas con carbógeno; El voltaje y la corriente se controlan mediante dos electrodos por cámara. Haga clic aquí para ver una versión más grande de esta figura.
5. Análisis de los datos generados por la configuración de la cámara de uso
- Importe los datos generados por el software de pinza de voltaje a un editor de hojas de cálculo adecuado.
- Para determinar los valores basales de I, sc y Rt , calcule la media de 10 puntos de datos consecutivos tomados 10 minutos después de inicializar las condiciones de cortocircuito. Cada cámara individual sirve como una réplica técnica, mientras que cada paso de organoides sirve como una réplica biológica.
- Para evaluar los efectos de los agentes aplicados, calcule la media de 10 puntos de datos consecutivos inmediatamente antes de la adición del agente. Compare esta media con el valor máximo (o mínimo) observado después de aplicar el agente. Los datos obtenidos se presentan como media ± desviación estándar (DE).
Resultados
Este protocolo facilita la generación fiable de monocapas 2D porcinas mediante la disgregación de organoides 3D derivados del yeyuno y el colon de cerdos. Durante un período de cultivo de 16 días para los organoides de yeyuno y de 9 días para los organoides de colon, se forman monocapas intactas. Estas monocapas se pueden utilizar posteriormente para evaluar las propiedades de transporte electrogénico y fisiológico mediante la técnica de la cámara de Ussing.
Discusión
Este protocolo describe un método para convertir organoides 3D porcinos establecidos en células individuales, que luego se siembran en membranas transpocillas para formar una monocapa intacta. Esta configuración permite el acceso al lado apical de las células, lo que facilita el uso de las cámaras de Ussing para monitorizar los procesos de absorción y secreción.
El paso inicial y crucial en este proceso de varios pasos es la desintegración precisa de l...
Divulgaciones
No tenemos ningún conflicto de intereses que declarar.
Agradecimientos
Agradecemos al Ministerio Federal de Alimentación y Agricultura (BLE# 28N-2-071-00) por su financiación.
Materiales
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
Referencias
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados