Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zweidimensionale Organoide des Schweine-Darms, die die physiologischen Eigenschaften des nativen Darms widerspiegeln
In diesem Artikel
Zusammenfassung
Diese Studie skizziert ein Protokoll zur Erzeugung von 2D-Monolayern von Schweineorganoiden, die aus dem Dünn- und Dickdarm stammen. Das Wachstum dieser Monoschichten ist durch steigende TEER-Werte gekennzeichnet, was auf eine robuste epitheliale Integrität hinweist. Darüber hinaus zeigten diese Monoschichten physiologische sekretorische Reaktionen in Ussing-Kammerexperimenten nach der Anwendung von Forskolin.
Zusammenfassung
Der Magen-Darm-Trakt (GIT) dient sowohl bei der Verdauung der Nahrung und der Aufnahme von Nährstoffen, als auch als Schutzbarriere gegen Krankheitserreger. Traditionell stützt sich die Forschung in diesem Bereich auf Tierversuche, aber es gibt eine wachsende Nachfrage nach alternativen Methoden, die sich an die 3R-Prinzipien halten: Ersetzen, Reduzieren und Verfeinern. Schweine-Organoide haben sich als vielversprechendes Werkzeug herausgestellt, da sie eine genauere In-vitro-Replikation der In-vivo-Bedingungen bieten als herkömmliche Zellmodelle. Eine große Herausforderung bei Darmorganoiden ist ihre nach innen gerichtete apikale Oberfläche und ihre nach außen gerichtete basolaterale Oberfläche. Diese Einschränkung kann überwunden werden, indem zweidimensionale (2D) Organoidschichten auf Transwell-Inserts (im Folgenden als Insert(s) bezeichnet) erzeugt werden, die den Zugang zu beiden Oberflächen ermöglichen. In dieser Studie ist es uns gelungen, zweidimensionale Kulturen von Schweinejejunum und Dickdarmorganoiden zu entwickeln. Der Kultivierungsprozess umfasst zwei wichtige Phasen: Zuerst die Bildung einer zellulären Monoschicht, gefolgt von der Differenzierung der Zellen mit maßgeschneiderten Medien. Das zelluläre Wachstum wird durch Messung des transepithelialen elektrischen Widerstands verfolgt, der sich bei Dickdarm-Organoiden bis zum 8. Tag und bei Jejunum-Organoiden bis zum 16. Tag stabilisiert. Nach einer 2-tägigen Differenzierungsphase ist das Epithel bereit für die Analyse. Um aktive elektrogene Transportprozesse, wie z.B. die Chloridsekretion, zu quantifizieren und zu verfolgen, verwenden wir die Ussing-Kammertechnik. Diese Methode ermöglicht die Echtzeitmessung und detaillierte Charakterisierung von Epitheltransportprozessen. Dieses innovative In-vitro-Modell , kombiniert mit etablierten Techniken wie der Ussing-Kammer, bietet eine robuste Plattform für die physiologische Charakterisierung des Schweine-GIT im Rahmen des 3R-Rahmens. Es eröffnet auch Möglichkeiten, pathophysiologische Mechanismen zu untersuchen und mögliche Therapiestrategien zu entwickeln.
Einleitung
Der GIT spielt eine zentrale Rolle bei der Verdauung, der Nährstoffaufnahme und der Abfallausscheidung über den Kot1. Darüber hinaus fungiert es als Barriere gegen Krankheitserreger, eine Rolle, die durch eine vielfältige zelluläre Zusammensetzung unterstützt wird, darunter Stammzellen, schleimproduzierende Becherzellen, enteroendokrine Zellen und absorbierende Enterozyten2. Die intestinale Homöostase kann durch verschiedene Faktoren gestört werden, wie z. B. bakterielle Infektionen3 oder entzündliche Prozesse4, die zu schwerwiegenden Folgen für den Organismus führen, wie z. B. Malabsorption, Durchfall oder sogar Tod5. Die Untersuchung solcher pathophysiologischen Szenarien erfolgt üblicherweise mit Versuchstieren oder, gemäß dem 3R-Prinzip6, mit Zellkulturen, die von verschiedenen Spezies stammen. Eine genaue Vorhersage und Übertragbarkeit der Ergebnisse sind entscheidend für den Einsatz artspezifischer Modelle7. Trotz dieses Bedarfs besteht ein bemerkenswerter Mangel an aus Schweinen gewonnenen Zellkulturen, die die Komplexität und Funktionalität des Darmtrakts angemessen nachbilden.
Um dieser Herausforderung zu begegnen, die auch für andere Spezies relevant ist, wurden dreidimensionale (3D) Organoide entwickelt, um die physiologische Komplexität des GIT zu replizieren8. Ursprünglich wurden Organoide aus dem Darm von Menschen und Mäusen hergestellt; Bisher wurden auch Schweineorganoide von juvenilen und adulten Schweinen erfolgreich entwickelt und kultiviert 9,10. Seit ihrer Einführung wurden diese Schweine-Organoide in mehreren Studien verwendet, die sich hauptsächlich auf Darminfektionen konzentrierten 11,12,13,14. Die Forschung zur Charakterisierung physiologischer Eigenschaften wie Nährstofftransport oder sekretorische Prozesse ist nach wie vor begrenzt15. Dies kann auf die Ausrichtung der Darmorganoide zurückzuführen sein, wobei die apikale Oberfläche nach innen und die basolaterale Seite nach außen zeigt, was den Zugang zur apikalen Oberfläche einschränkt. Diese Einschränkung wurde durch die erfolgreiche Kultivierung von Schweineorganoiden in einem zweidimensionalen Format16 behoben, eine Methode, die durch die Verwendung von gefrorenem Gewebe zu ihrer Erzeugung weiter vorangetrieben wurde17.
Die 2D-Kultivierung von Schweine-Organoiden ermöglicht den Zugang zu beiden Seiten des Epithels und ermöglicht die Anwendung etablierter Methoden zur Untersuchung von Transportprozessen durch die Epithelschicht. Eine solche Methode ist die Ussing-Kammer18, die die Echtzeitbeobachtung elektrogener Absorptions- und Sekretionsprozesse im gesamten Epithel ermöglicht. Der umfangreiche Einsatz dieses Systems hat zu einem umfassenden Verständnis der Darmfunktion von Schweinen in vivo geführt, das die gesamte Darmachse abdeckt. Dazu gehören Studien zum Monosaccharidtransport oder Transport von kurzkettigen Fettsäuren oder Reaktionen auf sekundäre Pflanzenmetaboliten wie Resveratrol, die die Transporteigenschaften des Darms beeinflussen 19,20,21,22,23,24. Die umfangreiche Datenmenge aus diesen Studien ermöglicht direkte Vergleiche zwischen den gut charakterisierten in vivo-Bedingungen und der in vitro-Umgebung von Schweine-Organoiden und verbessert unser Verständnis ihrer physiologischen Relevanz.
In dieser Studie stellen wir ein Protokoll zur Generierung und Kultivierung von 2D-Monolayern aus 3D-Organoiden des Schweins vor. Darüber hinaus wird der methodische Ansatz zur Quantifizierung von intestinalen Transportprozessen mit Hilfe der Ussing-Kammertechnik detailliert beschrieben. Das Protokoll bietet Werkzeuge zur Untersuchung der absorbierenden und sekretorischen Eigenschaften in vitro in Jejunum- und Dickdarm-Organoiden, die einen direkten Vergleich mit gut charakterisierten in vivo-Bedingungen ermöglichen. Zukünftige Anwendungen dieses Protokolls könnten die Untersuchung der Wirkungen pharmakologischer oder toxikologischer Substanzen sowie die Erforschung von Wechselwirkungen zwischen dem Epithel und Krankheitserregern umfassen.
Protokoll
Für dieses Protokoll wurden zwei gesunde Schweine (Bentheimer Schwarzscheckenschwein; 1 Rüde, 1 Weibchen; 4,5 Monate alt; ca. 65 kg) durch Bolzenschuss und Blutungen in Gefangenschaft getötet. Nach dem Tierschutzgesetz ist dies (Schlachtung und Entnahme von Geweben) nicht als Tierversuch einzustufen, sondern muss dem Tierschutzbeauftragten (Registrierungs-Nr. TiHo-T-2023-15) der Stiftung Tierärztliche Hochschule Hannover.
1. Beschichtung von Einlegeteilen
HINWEIS: Alle Schritte werden mit sterilen Materialien unter einem Sicherheitsschrank durchgeführt. Alle Schritte des Protokolls werden, sofern nicht anders angegeben, auf Eis durchgeführt.
- Tauen Sie die gefrorene Basalmembran mindestens 1 h bei Raumtemperatur auf Eis oder über Nacht auf dem Eis bei 4 °C auf. Mischen Sie die Basalmembran 1:40 (v/v) mit eiskalter, steriler, phosphatgepufferter Kochsalzlösung (PBS) in einem konischen Röhrchen.
- Entnehmen Sie die sterilen Platten mit Einlegern aus der Verpackung. Geben Sie 200 μl Basalmembranmischung in das apikale Kompartiment jedes Einsatzes.
- Den Deckel der Well-Platte wieder aufsetzen und mindestens 1,5 h bei 37 °C, 5 % CO2 in einem Inkubator inkubieren.
- Aspirieren Sie die Lösung vorsichtig, bevor Sie die Zellen aussäen. Achten Sie darauf, dass die Spitze während der Aspiration die Membran nicht berührt.
2. Erzeugung von 2D-Organoid-Monoschichten
HINWEIS: Dickdarm-Organoide von Schweinen werden wie für jejunale Organoide von Schweinen beschrieben erzeugt und kultiviert25. Nach der Erzeugung von 3D-Organoiden sollten diese mindestens 3-4 Wochen lang während der wöchentlichen Passage kultiviert werden, um ein gleichmäßiges Wachstum zu gewährleisten. Die Anzahl der Zellen in jeder Kuppel, die 3D-Organoide enthalten, die in den nachfolgenden Schritten aufgelöst werden, reicht aus, um einen einzelnen Transmembranfilter abzudecken. Vor der Monolayer-Generierung wurden die 3D-Organoide einer optischen Qualitätskontrolle unterzogen, um das vorangegangene Wachstum und eine mögliche Kontamination zu überprüfen (Abbildung 1).

Abbildung 1: Repräsentative 3D-Organoide. Dreidimensionale (A)-Jejunum- und (B)-Dickdarm-Organoide werden vor der Erzeugung von Monolagen sorgfältig unter dem Mikroskop untersucht. Besonderes Augenmerk wird auf die Beurteilung früherer Wachstumsmuster, der strukturellen Integrität und des Vorhandenseins von Verunreinigungen oder Verunreinigungen gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Entfernen Sie das Organoid-Medium (Tabelle 1) aus den Vertiefungen mit 3D-Krypten-Organoiden. Fügen Sie 1 ml eiskaltes PBS pro Vertiefung hinzu und lösen Sie die Basalmembran vorsichtig auf, indem Sie mit einer p1000-Spitze auf und ab pipettieren.
- Sammeln Sie alle gelösten Organoide in einem 15-ml-Röhrchen, das mit 10 mL eiskaltem PBS vorgefüllt ist. Das Röhrchen bei 250 x g, 10 min bei 4 °C zentrifugieren. Aspirieren Sie den Überstand.
- Das Pellet wird in 1 ml warmem (37 °C) 0,05 % (v/v) Trypsin/EDTA resuspendiert (zu diesem Zeitpunkt können 2 Röhrchen gepoolt werden). 5 min bei 37 °C in einem Wasserbad inkubieren und danach direkt auf Eis legen, um die Reaktion zu stoppen.
- 20x mit p1000 Spitze auf Eis resuspendieren, und weitere 15x mit p1000 Spitze + p200 Spitze oben. Fügen Sie 10 ml eiskaltes DMEM hinzu, das mit 10 % (v/v) fötalem Kälberserum (FCS) ergänzt wird.
- Zentrifugenröhrchen bei 1.000 x g, 10 min bei 4 °C. Überstand verwerfen und Pellet in 1 ml Monolayer-Medium resuspendieren (Tabelle 1).
- Bestimmen Sie die Anzahl der lebenden Zellen pro mL mit einer Neubauer-Kammer gemäß den Anweisungen des Herstellers.
- Entfernen Sie die Beschichtungslösung an dieser Stelle aus dem apikalen Kompartiment und ersetzen Sie sie durch 500 μl warmes (37 °C) Monolayer-Medium. Geben Sie 3 ml Monolayer-Medium in das basolaterale Kompartiment.
- Bestimmen Sie den Rohlingswiderstand (TEER) jedes leeren Transwell-Einsatzes, wie in Schritt 3 ausführlich beschrieben. Die Zeit, in der kein Medium in der apikalen Kammer vorhanden ist, sollte so kurz wie möglich sein, um ein Austrocknen der Zellen zu verhindern.
- Das apikale Monolayer-Medium wird entfernt und für die jejunale 2D-Kultur 2 x 105 Epithelzellen und für die kolonale 2D-Kultur 1,5 x 105 Epithelzellen in 500 μl Monolayer-Medium in die apikale Kammer jedes Transwells gegeben.
- Wechseln Sie das Medium und messen Sie den TEER alle 2-3 Tage. Messen Sie TEER, bevor das Medium gewechselt wird. Saugen Sie das Medium des apikalen und basalen Kompartiments vorsichtig ab und ersetzen Sie es durch 500 μl oder 3 mL frisches, warmes (37 °C) Medium.
- Für Jejunum-Organoide: Am 16. Tag, nach der Aussaat, von Monolayer-Medium auf Differenzierungsmedium umstellen (Tabelle 1). Für Dickdarm-Organoide: Wechseln Sie das Medium am 7. Tag auf das Differenzierungsmedium.
- Wechseln Sie das Differenzierungsmedium jeden Tag und führen Sie bei jedem Medienwechsel eine TEER-Messung durch. Fahren Sie am 18. Tag (für Jejunalorganoide) oder Tag 9 (für Dickdarmorganoide) nach der Aussaat mit funktionellen Experimenten fort.
3. Messung des transepithelialen elektrischen Widerstands (TEER)
HINWEIS: Alle Messungen werden unter einem Sicherheitsschrank durchgeführt, um eine Kontamination zu vermeiden. Vor dem Aussäen der Zellen wird jeder leere beschichtete Transwell vermessen, um individuelle Blindwerte zu erhalten. Das Volt-Ohm-Messgerät speichert die Werte auf einem eingeführten USB-Gerät.
- Reinigen Sie die Essstäbchenelektrode mit 70 % (v/v) Ethanol und lassen Sie die Elektrode vollständig trocknen. Nehmen Sie in der Zwischenzeit die Platte aus dem Inkubator und stellen Sie sie unter den Schrank.
- Führen Sie den kurzen Arm der Essstäbchenelektrode in das apikale Kompartiment der Einsätze und den langen Arm in das basolaterale Kompartiment des Einsatzes ein. Vermeiden Sie den Kontakt des kurzen Arms mit der Zellschicht.
- Messen Sie den transepithelialen elektrischen Widerstand jedes Transwells. Lassen Sie das Volt-Ohm-Messgerät äquilibrieren, um eine stabile Messung zu gewährleisten. Messen Sie TEER-Werte, indem Sie auf die Schaltfläche Speichern klicken.
- Fahren Sie mit den Schritten 3.2 und 3.3 mit den verbleibenden Vertiefungen fort. Nach Erreichen der letzten Vertiefung öffnet das Volt-Ohm-Meter eine Anforderung, die Daten auf einem USB-Gerät zu speichern. Klicken Sie auf Speichern.
- Reinigen Sie die Elektrode nach jeder Platte und am Ende der Messung und lassen Sie sie vor der Lagerung vollständig trocknen.
- Subtrahieren Sie die vor dem Seeding der Zellen ermittelten Leerwerte von den gemessenen zellulären Werten.
4. Elektrophysiologische Transportuntersuchungen mit der Ussing-Kammertechnik
HINWEIS: Die Bestimmung der elektrophysiologischen Transportuntersuchungen erfolgt unter Verwendung einer Ussing-Kammer, die aus zwei Kammerkompartimenten besteht, die durch das Epithel getrennt sind. Diese Kammer ist über Ag/AgCl-Elektroden mit einer Spannungsklemme verbunden. Diese Technik ermöglicht die Verfolgung aktiver elektrogener Transportprozesse des Epithels durch die durch die Spannungsklemme induzierten Änderungen des Kurzschlussstroms (Isc) sowie des nach dem Ohmschen Gesetz berechneten Gewebewiderstands (Rt). Isc und Rt werden während des gesamten Experiments alle 6 s aufgezeichnet. Während des Experiments wird das untersuchte Gewebe mit Carbogen belüftet und mit modifizierten Krebs-Henseleit-Lösungen inkubiert, um lebensfähige Bedingungen zu gewährleisten. Indomethacin (10 μM) wird den Pufferlösungen zugesetzt, um die Prostaglandinsynthese zu hemmen26.
- Schleimhaut- und Serosalpufferlösungen auf 37 °C erwärmen und mit Carbogen belüften. Montieren Sie die einzelnen Kammern mit einem leeren Einsatz für jede einzelne Kammer. Achten Sie darauf, dass die apikalen Seiten der Querschächte alle in die gleiche Richtung zeigen.
- Füllen Sie alle Kammern mit 5 mL vorgewärmter Schleimhautpufferlösung (Tabelle 2). Verbinden Sie alle Elektroden von der Spannungszange mit den einzelnen Kammern gemäß den Anweisungen des Herstellers. Stellen Sie sicher, dass keine Gasblasen die Elektroden stören, um eine korrekte Messung zu gewährleisten.
- Kalibrieren Sie die Ussing-Kammer-Software mit diesen Bedingungen, indem Sie auf die Schaltfläche Rf/dpI in der Voltage-Clamp-Software klicken. Der Widerstand aller verwendeten leeren Einsätze sollte gleich sein (~ 70 Ohm) und der Strom sollte etwa 0 mV (± 5 mV) betragen. Wenn dies bei einigen Kammern nicht der Fall ist, überprüfen Sie, ob die Elektroden oder Blasen im System richtig platziert sind.
- Entfernen Sie alle Elektroden und entsorgen Sie die gebrauchte Pufferlösung. Öffnen Sie alle einzelnen Kammern und entfernen Sie die leeren Einsätze. Achten Sie darauf, dass die Reihenfolge der einzelnen Kammern eingehalten wird.
- Bewegen Sie die Vertiefungsplatte mit den Einsätzen aus dem Inkubator in den Sicherheitsschrank. Saugen Sie das basolaterale und apikale Medium vorsichtig an.
- Waschen Sie die Zellen, indem Sie 500 μl warmen (37 °C) Schleimhautpuffer in die apikale Kammer und 3 ml Serosalpuffer in die basolaterale Kammer geben. Aspirieren Sie die Puffer und wiederholen Sie den Vorgang 2x.
- Entfernen Sie die Einsätze von der Platte. Entfernen Sie vorsichtig die Stützen der Einsätze. Platzieren Sie die Einsätze in den Ussing-Kammern und stellen Sie sicher, dass die Ausrichtung der Einsätze die gleiche ist wie während der Kalibrierungsphase. Bauen Sie die einzelnen Kammern wie in Abbildung 2 gezeigt zusammen.
- Füllen Sie die Kammern, die der basolateralen Seite der Zellen zugewandt sind, mit 5 mL Serosalpuffer (Tabelle 2) und die Kammer, die der apikalen Kammer zugewandt ist, mit 5 mL Mukosalpuffer.
- Verbinden Sie die Elektroden und die Belüftungsrohre mit jeder einzelnen Kammer. Starten Sie die Messung in der Ussing-Software. Lassen Sie die Äquilibrierung 15 Minuten lang warten.
- Ändern Sie die Bedingungen von offenem Stromkreis in Kurzschluss. 5 min bis 10 min äquilibrieren. Geben Sie 10 μM Forskolin in die Serosalkammer.
HINWEIS: Die Zugabe von Forskolin kann je nach individuellen Darmabschnitten und Forschungsfragen durch andere Wirkstoffe/Substanzen ersetzt werden. - Nach 15 Minuten fügen Sie entweder weitere Mittel auf die gleiche Weise wie Forskolin hinzu oder stoppen Sie die Messung. Entfernen Sie Belüftungsrohre und Elektroden aus den einzelnen Kammern. Gießen Sie die Pufferlösungen beider Kammern in eine Schüssel.
- Zerlegen Sie die Kammern und verwerfen Sie entweder die Einsätze oder verwenden Sie sie für die Nachanalyse (z. B. Immunhistochemie oder Expressionsanalyse)
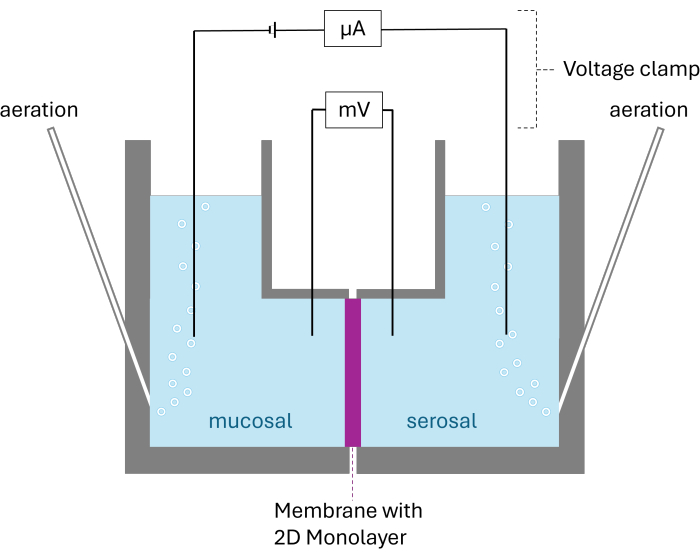
Abbildung 2: Schematischer Aufbau der Ussing-Kammer. Dargestellt sind beide Kammern, die durch die Membran mit der gewachsenen 2D-Monoschicht getrennt sind. Beide Kammern sind mit Carbogen belüftet; Spannung und Strom werden von zwei Elektroden pro Kammer überwacht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Analyse der Daten, die durch den Aufbau der Ussing-Kammer generiert werden
- Importieren Sie die von der Spannungszangen-Software generierten Daten in einen geeigneten Tabellenkalkulationseditor.
- Um die basalen Isc und Rt Werte zu bestimmen, berechnen Sie den Mittelwert von 10 aufeinanderfolgenden Datenpunkten, die 10 Minuten nach der Initialisierung der Kurzschlussbedingungen aufgenommen wurden. Jede einzelne Kammer dient als technisches Replikat, während jeder Durchgang von Organoiden als biologisches Replikat dient.
- Um die Auswirkungen der angewendeten Wirkstoffe zu bewerten, berechnen Sie den Mittelwert von 10 aufeinanderfolgenden Datenpunkten unmittelbar vor der Zugabe des Wirkstoffs. Vergleichen Sie diesen Mittelwert mit dem maximalen (oder minimalen) Wert, der nach dem Anwenden des Agents beobachtet wird. Die erhaltenen Daten werden als Mittelwert ± Standardabweichung (SD) dargestellt.
Ergebnisse
Dieses Protokoll erleichtert die zuverlässige Erzeugung von 2D-Monoschichten von Schweinen durch die Disaggregation von 3D-Organoiden, die aus dem Jejunum und dem Dickdarm von Schweinen stammen. Über einen Kultivierungszeitraum von 16 Tagen für Jejunum-Organoide und 9 Tagen für Dickdarm-Organoide bilden sich intakte Monolayer. Diese Monolagen können anschließend zur Beurteilung elektrogener und physiologischer Transporteigenschaften mit der Ussing-Kammertechnik verwendet werden.
Diskussion
Dieses Protokoll beschreibt ein Verfahren zur Umwandlung etablierter Schweine-3D-Organoide in einzelne Zellen, die dann auf Transwell-Membranen ausgesät werden, um eine intakte Monoschicht zu bilden. Diese Konfiguration ermöglicht den Zugang zur apikalen Seite der Zellen und erleichtert die Verwendung von Ussing-Kammern zur Überwachung von Absorptions- und Sekretionsprozessen.
Der erste und entscheidende Schritt in diesem mehrstufigen Prozess ist der präzi...
Offenlegungen
Wir haben keine Interessenkonflikte zu deklarieren.
Danksagungen
Wir danken dem Bundesministerium für Ernährung und Landwirtschaft (BLE# 28N-2-071-00) für die Förderung.
Materialien
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
Referenzen
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten