需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
反映天然肠道生理特性的二维猪肠道类器官
摘要
本研究概述了一种从小肠和大肠衍生的猪类器官的 2D 单层制备的方案。这些单层的生长以增加 TEER 值为标志,表明上皮完整性很强。此外,这些单层在应用毛喉素后的 Ussing 室实验中表现出生理分泌反应。
摘要
胃肠道 (GIT) 既可用于食物的消化和营养物质的吸收,也可用作抵御病原体的保护屏障。传统上,该领域的研究依赖于动物实验,但对符合 3R 原则(替换、减少和优化)的替代方法的需求不断增长。猪类器官已成为一种很有前途的工具,与传统细胞模型相比,它提供了更准确的体内条件体外复制。肠道类器官的一个主要挑战是它们向内的顶端表面和向外的基底外侧表面。可以通过在 transwell 插入片段(以下简称插入片段)上创建二维 (2D) 类器官层来克服这一限制,从而提供对两个表面的访问。在这项研究中,我们成功开发了猪空肠和结肠类器官的二维培养物。培养过程包括两个关键阶段:首先,形成细胞单层,然后使用定制培养基分化细胞。通过测量跨上皮电阻来跟踪细胞生长,结肠类器官在第 8 天和空肠类器官在第 16 天稳定。经过 2 天的分化阶段后,上皮即可进行分析。为了量化和跟踪主动的电原运输过程,例如氯化物分泌,我们采用了 Ussing 腔室技术。该方法允许实时测量和详细表征上皮转运过程。这种创新的体外模型与 Ussing 腔室等成熟技术相结合,为 3R 框架内猪 GIT 的生理特性提供了一个强大的平台。它还为研究病理生理机制和开发潜在的治疗策略提供了机会。
引言
GIT 在消化、营养吸收和通过粪便排泄废物方面起着核心作用1。此外,它还可作为抵御病原体的屏障,这一作用由多种细胞组成支持,包括干细胞、产生粘液的杯状细胞、肠内分泌细胞和吸收性肠上皮细胞2。肠道稳态会受到各种因素的破坏,例如细菌感染3 (bacterial infections) 或炎症过程4(inflammatory process),从而对生物体造成严重后果,例如吸收不良、腹泻甚至死亡5。研究此类病理生理学情景通常使用实验动物或根据 3R 原则6 来自各种物种的细胞培养物来完成。在采用物种特异性模型时,结果的准确预测和可转移性至关重要7。尽管有这种需求,但明显缺乏能够充分复制肠道复杂性和功能的猪来源细胞培养物。
为了应对这一挑战,也与其他物种相关,已经开发了三维 (3D) 类器官,试图复制 GIT8 的生理复杂性。最初,类器官是从人类和小鼠的肠道中产生的;迄今为止,来自幼猪和成年猪的猪类器官也已成功开发和培养 9,10。自成立以来,这些猪类器官已被用于多项研究,主要集中在肠道感染11、12、13、14 上。旨在表征生理特性(如营养物质运输或分泌过程)的研究仍然有限15。这可能是由于肠道类器官的方向,顶端表面朝内,基底外侧朝外,限制了对顶端表面的可及性。通过成功培养二维形式的猪类器官16 解决了这一限制,这种方法通过使用冷冻组织来生成它们17 得到了进一步发展。
猪类器官的 2D 培养提供了通往上皮两侧的通道,从而能够应用成熟的方法来研究跨上皮层的运输过程。其中一种方法是 Ussing 室18,它允许实时观察整个上皮的电吸收和分泌过程。该系统的广泛使用提供了对猪体内肠道功能的全面了解,涵盖了整个肠轴。这包括对单糖转运或短链脂肪酸转运或对影响肠道运输特性的次生植物代谢物(如白藜芦醇)的反应的研究 19,20,21,22,23,24。来自这些研究的大量数据有助于直接比较猪类器官的明确表征的体内条件和体外环境,从而增强我们对它们生理相关性的理解。
在这项研究中,我们提出了一种从 3D 猪类器官生成和培养 2D 单层的方案。此外,我们详细介绍了使用 Ussing 腔室技术量化肠道运输过程的方法。该方案提供了在 体外 研究空肠和结肠类器官吸收和分泌特性的工具,允许与充分表征的 体内 条件直接比较。该方案的未来应用可能包括研究药理学或毒理学物质的作用,以及探索上皮细胞与病原体之间的相互作用。
研究方案
对于该方案,两头健康的猪 (Bentheim Blacked Pied pig;1 只雄性,1 只雌性;4.5 个月大;约 65 公斤)通过圈养螺栓射击和出血处死。根据《动物保护法》,这(屠宰和取出组织)不属于动物实验,但必须向动物福利官员(注册号。TiHo-T-2023-15) 的 Tim-T-2023-15)。
1. 刀片涂层
注意:所有步骤均在安全柜下使用无菌材料进行。如果没有特别说明,该协议的所有步骤均在冰上进行。
- 将冷冻的基底膜在冰上在室温下解冻至少 1 小时或在 4 °C 的冰上过夜。 在锥形管中将基底膜 1:40 (v/v) 与冰冷的无菌磷酸盐缓冲盐水 (PBS) 混合。
- 从包装中取出带有插入物的无菌板。将 200 μL 基底膜混合物添加到每个插入物的顶端隔室中。
- 更换孔板的盖子,并在培养箱中于 37 °C、5% CO2 孵育至少 1.5 小时。
- 在接种细胞之前小心吸出溶液。确保吸头在吸液过程中不接触膜。
2. 生成 2D 类器官单层
注:猪结肠类器官的产生和培养方式与猪空肠类器官25 相同。生成 3D 类器官后,这些类器官应培养至少 3-4 周,同时每周传代以确保持续生长。每个圆顶内含有 3D 类器官的细胞数量(在后续步骤中溶解)足以覆盖单个跨膜过滤器。在生成单层之前,对 3D 类器官进行光学质量控制,以检查先前的生长和可能的污染(图 1)。

图 1:代表性 3D 类器官。 在生成单层之前,在显微镜下仔细检查三维 (A) 空肠和 (B) 结肠类器官。特别注意评估以前的生长模式、结构完整性以及是否存在任何杂质或污染。 请单击此处查看此图的较大版本。
- 从带有 3D 隐窝类器官的孔中取出类器官培养基(表 1)。每孔加入 1 mL 冰冷的 PBS,然后用 p1000 吸头上下吹打轻轻溶解基底膜。
- 将所有溶解的类器官收集在预装有 10 mL 冰冷 PBS 的 15 mL 试管中。将试管以 250 x g 离心,在 4 °C 下离心 10 分钟。 吸出上清液。
- 将沉淀重悬于 1 mL 温热的 (37 °C) 0.05 % (v/v) 胰蛋白酶/EDTA 中(在此阶段可以合并 2 个试管)。在 37 °C 下在水浴中孵育 5 分钟,然后直接放在冰上以终止反应。
- 用 p1000 吸头在冰上重悬 20 次,再用 p1000 吸头 + p200 吸头再重悬 15 次。加入 10 mL 冰冷的 DMEM,补充有 10% (v/v) 胎牛血清 (FCS)。
- 将管以 1,000 x g 离心,在 4 °C 下离心 10 分钟。 弃去上清液,将沉淀重悬于 1 mL 单层培养基中(表 1)。
- 根据制造商的说明,使用 Neubauer 腔室确定每 mL 的活细胞数。
- 此时从根尖隔室中取出涂层溶液,并用 500 μL 温热 (37 °C) 单层培养基代替。向基底外侧隔室中加入 3 mL 单层培养基。
- 确定每个空 transwell 插入物的空白电阻 (TEER),如步骤 3 中详细描述。顶腔中不存在培养基的时间应尽可能短,以防止细胞干燥。
- 去除顶端单层培养基,对于每个 transwell 的顶腔,在空肠 2D 培养物中加入 2 x 105 个 上皮细胞,对于结肠 2D 培养物,在 500 μL 单层培养基中加入 1.5 x 105 个上皮细胞。
- 更换培养基并每 2-3 天测量一次 TEER。在更换介质之前测量 TEER。小心吸出根尖和基底隔室的培养基,并用 500 μL 或 3 mL 新鲜、温暖 (37 °C) 的培养基替换。
- 对于空肠类器官:第 16 天,接种后,从单层培养基变为分化培养基(表 1)。对于结肠类器官:在第 7 天将培养基更换为分化培养基。
- 每天更换分化培养基,并在每次更换培养基期间进行 TEER 测量。在第 18 天(对于空肠类器官)或第 9 天(对于结肠类器官),接种后,进行功能实验。
3. 跨上皮电阻 (TEER) 的测量
注意:所有测量均在安全柜下进行,以避免污染。在接种细胞之前,测量每个空的包被 transwell 以获得单独的空白值。伏特欧姆表将值存储在引入的 USB 设备上。
- 用 70% (v/v) 乙醇清洁筷子电极,让电极完全干燥。同时,从培养箱中取出板并将其放在柜子下方。
- 将筷子电极的短臂引入插入物的顶端隔室,将长臂引入插入物的基底外侧隔室。避免短臂与细胞层接触。
- 测量每个 transwell 的跨上皮电阻。让伏特欧姆表保持平衡,以确保稳定的测量。通过单击 Store 按钮来测量 TEER 值。
- 对其余的孔继续步骤 3.2 和 3.3。到达最后一口井后,伏特欧姆表会打开一个请求,将数据存储在 USB 设备上。单击 Save (保存)。
- 在每块板之后和测量结束时清洁电极,并在存放前使其完全干燥。
- 从测量的细胞值中减去在接种细胞之前确定的空白值。
4. 使用 Ussing 腔室技术的电生理转运研究
注意:电生理转运研究的测定是通过使用由两个腔室隔室组成的 Ussing 室进行的,这两个室室被上皮细胞隔开。该腔室通过 Ag/AgCl 电极连接到电压夹。该技术允许通过电压钳引起的短路电流 (Isc) 的变化以及欧姆定律计算的组织电阻(RT) 来跟踪上皮的主动电原传输过程。在整个实验过程中,每 6 秒记录一次 Isc 和 Rt 。在实验过程中,研究的组织用碳水化合物充气并与改良的 Krebs-Henseleit 溶液一起孵育,以确保存活条件。将吲哚美辛 (10 μM) 添加到缓冲溶液中以抑制前列腺素合成26。
- 将粘膜和浆膜缓冲溶液预热至 37 °C,并用碳原充气。使用每个腔室的空插件组装单个腔室。确保 transwell 的顶端侧都面向同一方向。
- 用 5 mL 预热的粘膜缓冲溶液填充所有腔室(表 2)。根据制造商的说明,将电压夹上的所有电极连接到各个腔室。确保没有气泡干扰电极,以确保正确测量。
- 通过单击电压钳软件中的 Rf/dpI 按钮,在这些条件下校准 Ussing 腔室软件。所有使用的空插件的电阻应相等 (~ 70 Ohm),电流应在 0 mV (± 5 mV) 左右。如果某些腔室不是这种情况,请检查电极或气泡在系统中的正确放置。
- 去除所有电极并丢弃用过的缓冲溶液。打开所有单独的腔室并取出空插件。确保各个腔室的顺序保持不变。
- 将带有插件的孔板从培养箱移至安全柜。小心吸出基底外侧和顶端介质。
- 通过向顶腔中加入 500 μL 温热 (37 °C) 粘膜缓冲液,向基底外侧腔中加入 3 mL 浆膜缓冲液来洗涤细胞。吸出缓冲液并重复 2 次。
- 从板中取出插件。轻轻去除插件的支撑。将插件放入 Ussing 腔室中,并确保插件的方向与校准阶段的方向相同。如图 2 所示组装各个腔室。
- 用 5 mL 浆膜缓冲液填充面向细胞基底外侧的腔室(表 2),用 5 mL 粘膜缓冲液填充面向顶端腔的腔室。
- 将电极和曝气管连接到每个单独的腔室。在 Ussing 软件中开始测量。允许平衡 15 分钟。
- 将条件从开路条件更改为短路条件。平衡 5 分钟至 10 分钟。将 10 μM 毛喉素添加到浆膜腔中。
注意:根据个体肠道节段和研究问题,毛喉素的添加可能会被其他药物/物质替代。 - 15 分钟后,以与 forskolin 相同的方式添加更多试剂或停止测量。从各个腔室中取出曝气管和电极。将两个腔室的缓冲溶液倒入碗中。
- 拆卸腔室并丢弃插入物或将其用于后续分析(例如,免疫组织化学或表达分析)
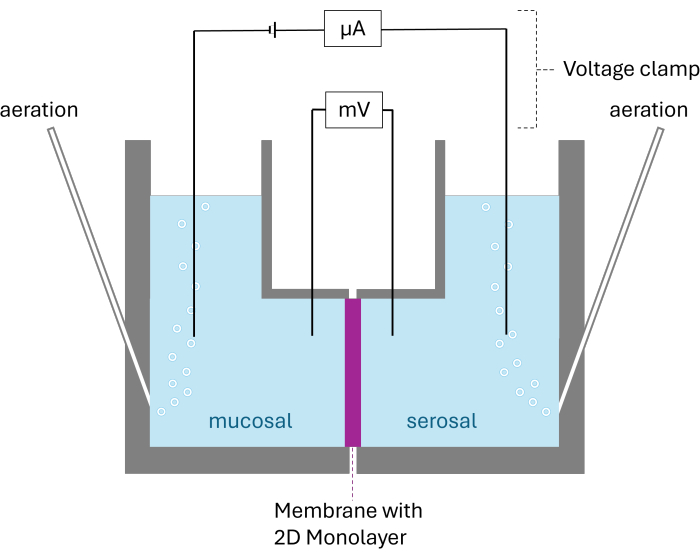
图 2:Ussing 室的示意图结构。 显示的两个腔室被膜与生长的 2D 单层隔开。两个腔室都用碳素充气;电压和电流由每个腔室的两个电极监控。 请单击此处查看此图的较大版本。
5. 分析 Ussing 腔室设置生成的数据
- 将电压钳软件生成的数据导入到合适的电子表格编辑器中。
- 要确定基础 Isc 和 Rt 值,请计算初始化短路条件后 10 分钟获取的 10 个连续数据点的平均值。每个单独的腔室都用作技术复制品,而类器官的每一次通过都用作生物复制品。
- 为了评估所应用药物的效果,请计算在添加药物之前 10 个连续数据点的平均值。将此平均值与应用代理后观察到的最大值(或最小值)进行比较。获得的数据以平均值±标准差 (SD) 表示。
结果
该方案通过解聚源自猪空肠和结肠的 3D 类器官,促进了猪 2D 单层的可靠生成。在空肠类器官 16 天和结肠类器官 9 天的培养期内,形成完整的单层。这些单层随后可用于使用 Ussing 腔室技术评估电原和生理传输特性。
分解 3D 类器官后,将单个细胞接种到包被的插入片段上。通过测量每次培养基变化期间的跨上皮电阻 (TEER) 值来监测细胞生长。这种?...
讨论
该方案描述了一种将已建立的猪 3D 类器官转化为单细胞的方法,然后将其接种到 transwell 膜上以形成完整的单层。这种配置允许进入细胞的顶端侧,便于使用 Ussing 腔室来监测吸收和分泌过程。
这个多步骤过程中的初始和关键步骤是 3D 类器官的精确分解。实现单细胞的均匀接种对于功能性单层的形成至关重要27。因此,有必要仔细?...
披露声明
我们没有任何需要申报的利益冲突。
致谢
我们感谢德国联邦食品和农业部 (BLE# 28N-2-071-00) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 24 well plate | SARSTEDT AG & Co. KG | 8,33,922 | |
| A83-01 | MedChemExpress, New Jersey, USA | HY-10432 | Store at -20 °C. Thaw when needed |
| accujet S | Brand GmbH + Co KG, Wertheim, Germany | 26351 | |
| Advanced DMEM/F12 Medium | Thermo Fisher Scientific, Waltham, USA | 12634010 | Store at 4 °C |
| B27 supplement | Thermo Fisher Scientific, Waltham, USA | 17504044 | Store at -20 °C. Thaw when needed |
| CaCl2.2 H2O | Merck KGaA, Darmstadt, Germany | C3306 | Store at room temperature |
| D(+)-Glucose (wasserfrei) | Merck KGaA, Darmstadt, Germany | 1.08337 | Store at room temperature |
| DAPT | MedChemExpress, New Jersey, USA | HY-13027 | Store at -20 °C. Thaw when needed |
| D-Mannitol | Merck KGaA, Darmstadt, Germany | M4125 | Store at room temperature |
| DMSO | Sigma-Aldrich, Schnelldorf, Germany | 154938 | Store at room temperature |
| Electrode-Set (AgCl/PtIr/Std.) | Scientific Instruments, Simmerath, Germany | #1316 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000063 | |
| Eppendorf Research plus | Eppendorf SE, Hamburg, Gemany | 3123000047 | |
| EVOM3 Manual Epithelial Volt Ohm Meter | World precision instruments, Sarasota, USA | EVM-MT-03-01 | |
| FBS | Sigma-Aldrich, Schnelldorf, Germany | F7524 | Store at -20 °C. Thaw when needed |
| Forskolin | Sigma-Aldrich, Schnelldorf, Germany | F6886 | Store at -20 °C. Thaw when needed |
| gasprofi 1 SCS micro | WLD-TEC GmbH, Arsenhausen, Germany | 60,04,000 | |
| Gastrin 1 | MedChemExpress, New Jersey, USA | HY-P1097 | Store at -20 °C. Thaw when needed |
| Glutamax | Thermo Fisher Scientific, Waltham, USA | 35050061 | Store at 4 °C. |
| HCl | Sigma-Aldrich, Schnelldorf, Germany | 1090571000 | Store at room temperature |
| HEPES | Sigma-Aldrich, Schnelldorf, Germany | H0887 | Store at 4 °C |
| Herasafe 2025 Class II Biological Safety Cabinet | Thermo Fisher Scientific, Waltham, USA | 51033316 | |
| Incubator ICO105 | Memmert GmbH + Co.KG, Schwabach, Germany | 62,20,143 | |
| Indomethacin | Merck KGaA, Darmstadt, Germany | I7378 | Store at room temperature |
| KCl | Merck KGaA, Darmstadt, Germany | 1.04936 | Store at room temperature |
| L-Glutamin | Sigma-Aldrich, Schnelldorf, Germany | G7513 | Store at -20 °C. Thaw when needed |
| LWRN Supernatant | selfmade | Store at -20 °C. Thaw when needed. LWRN supplement is produced according to Miyoshi et al. (2012) | |
| Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning Incorporated - Life Sciences | 354234 | Store at -20 °C. Thaw carefully on ice when needed |
| Megafuge 1.OR | Heraeus Instruments, Osterode, Germany | 75003060 | |
| MgCl2.6 H2O | Merck KGaA, Darmstadt, Germany | 1.05833 | Store at room temperature |
| Na2HPO4.2H2O | Merck KGaA, Darmstadt, Germany | 1.06580 | Store at room temperature |
| N-Acetyl-L-cysteine | Sigma-Aldrich, Schnelldorf, Germany | A7250 | Store at -20 °C. Thaw when needed |
| NaCl | Merck KGaA, Darmstadt, Germany | 1.06404 | Store at room temperature |
| NaH2PO4.H2O | Merck KGaA, Darmstadt, Germany | 1.06346 | Store at room temperature |
| NaHCO3 | Merck KGaA, Darmstadt, Germany | 1.06329 | Store at room temperature |
| Neubauer improved chamber | Glaswarenfabrik Karl Hecht, Sondheim vor der Rhön, Germany | 40442712 | |
| Olympus IX70 iverted Microscope | Olympus Corporation, Hamburg, Germany | ||
| Pen/Strep | Thermo Fisher Scientific, Waltham, USA | 15140122 | Store at -20 °C. Thaw when needed |
| PolymyxinB | Sigma-Aldrich, Schnelldorf, Germany | P4932-1MU | Store at -20 °C. Thaw when needed |
| Primovert microscope stand with binocular phototube | Zeiss | 415510-1101-000 | |
| rm EGF | Prepotech, New Jersey, USA | 315-09 | Store at -20 °C. Thaw when needed |
| SB202190 | MedChemExpress, New Jersey, USA | HY-10295 | Store at -20 °C. Thaw when needed |
| Snapwell 3801 | Corning Incorporated - Life Sciences | 3801 | |
| Trypsin/EDTA | Thermo Fisher Scientific, Waltham, USA | 25300054 | |
| Ussing Base System | Scientific Instruments, Simmerath, Germany | #1317 | |
| Ussing Diffusion Chamber | Scientific Instruments, Simmerath, Germany | SKU 1307 | |
| Voltage/Current Clamp VCC6 | Scientific Instruments, Simmerath, Germany | SKU 1310 | |
| Y27632 | MedChemExpress, New Jersey, USA | HY-10583 | Store at -20 °C. Thaw when needed |
参考文献
- Hornbuckle, W. E., Tennant, B. C. . Clinical Biochemistry of Domestic Animals. , 367-406 (1997).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14 (3), 141-153 (2014).
- Pham, T. A., Lawley, T. D. Emerging insights on intestinal dysbiosis during bacterial infections. Curr Opin Microbiol. 17 (100), 67-74 (2014).
- Garrett, W. S., Gordon, J. I., Glimcher, L. H. Homeostasis and inflammation in the intestine. Cell. 140 (6), 859-870 (2010).
- Ternhag, A., Torner, A., Svensson, A., Ekdahl, K., Giesecke, J. Short- and long-term effects of bacterial gastrointestinal infections. Emerg Infect Dis. 14 (1), 143-148 (2008).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
- Zietek, T., Boomgaarden, W. A. D., Rath, E. Drug screening, oral bioavailability and regulatory aspects: A need for human organoids. Pharmaceutics. 13 (8), 1280 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), e66465 (2013).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell Tissue Res. 365 (1), 123-134 (2016).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res. 375 (2), 409-424 (2019).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J Virol. 93 (5), e01682-e01718 (2019).
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Yin, L., et al. Aminopeptidase N expression, not interferon responses, determines the intestinal segmental tropism of porcine deltacoronavirus. J Virol. 94 (14), e00480-e00520 (2020).
- van der Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev Biol. 8, 375 (2020).
- van der Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res. 28, 165-171 (2018).
- Mussard, E., et al. Culture of piglet intestinal 3D organoids from cryopreserved epithelial crypts and establishment of cell monolayers. J Vis Exp. (192), e64917 (2023).
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23 (2-3), 110-127 (1951).
- Dengler, F., Kraetzig, A., Gabel, G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level. Nutrients. 13 (2), 305 (2021).
- Guschlbauer, M., et al. Trans-resveratrol and epsilon-viniferin decrease glucose absorption in porcine jejunum and ileum in vitro. Comp Biochem Physiol A Mol Integr Physiol. 165 (3), 313-318 (2013).
- Herrmann, J., Hermes, R., Breves, G. Transepithelial transport and intraepithelial metabolism of short-chain fatty acids (SCFA) in the porcine proximal colon are influenced by SCFA concentration and luminal pH. Comp Biochem Physiol A Mol Integr Physiol. 158 (1), 169-176 (2011).
- Klinger, S., Breves, G. Resveratrol inhibits porcine intestinal glucose and alanine transport: Potential roles of Na(+)/K(+)-ATPase activity, protein kinase A, AMP-activated protein kinase and the association of selected nutrient transport proteins with detergent resistant membranes. Nutrients. 10 (3), 302 (2018).
- Leonhard-Marek, S., Hempe, J., Schroeder, B., Breves, G. Electrophysiological characterization of chloride secretion across the jejunum and colon of pigs as affected by age and weaning. J Comp Physiol B. 179 (7), 883-896 (2009).
- Schroeder, B., et al. Preventive effects of the probiotic Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci. 51 (4), 724-731 (2006).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), e0256143 (2021).
- Ferreira, S. H., Moncada, S., Vane, J. R. Indomethacin and aspirin abolish prostaglandin release from the spleen. Nat New Biol. 231 (25), 237-239 (1971).
- Dykstra, G. D., Kawasaki, M., Ambrosini, Y. M. Advancements in bovine organoid technology using small and large intestinal monolayer interfaces. J Vis Exp. (208), e67010 (2024).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One. 16 (10), e0257824 (2021).
- Beduneau, A., et al. A tunable Caco-2/HT29-MTX co-culture model mimicking variable permeabilities of the human intestine obtained by an original seeding procedure. Eur J Pharm Biopharm. 87 (2), 290-298 (2014).
- Markov, A. G., Veshnyakova, A., Fromm, M., Amasheh, M., Amasheh, S. Segmental expression of claudin proteins correlates with tight junction barrier properties in rat intestine. J Comp Physiol B. 180 (4), 591-598 (2010).
- Pearce, S., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Legen, I., Salobir, M., Kerc, J. Comparison of different intestinal epithelia as models for absorption enhancement studies. Int J Pharm. 291 (1-2), 183-188 (2005).
- Moeser, A. J., et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. Am J Physiol Gastrointest Liver Physiol. 292 (1), G173-G181 (2007).
- Moeser, A. J., Ryan, K. A., Nighot, P. K., Blikslager, A. T. Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol. 293 (2), G413-G421 (2007).
- Seamon, K. B., Padgett, W., Daly, J. W. Forskolin: unique diterpene activator of adenylate cyclase in membranes and in intact cells. Proc Natl Acad Sci U S A. 78 (6), 3363-3367 (1981).
- Herrmann, J., et al. Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs. Comp Biochem Physiol A Mol Integr Physiol. 163 (1), 161-169 (2012).
- Wright, E. M., Martin, M. G., Turk, E. Intestinal absorption in health and disease--sugars. Best Pract Res Clin Gastroenterol. 17 (6), 943-956 (2003).
- Crane, R. K. Na+ -dependent transport in the intestine and other animal tissues. Fed Proc. 24 (5), 1000-1006 (1965).
- Inagaki, A., Yamaguchi, S., Ishikawa, T. Amiloride-sensitive epithelial Na+ channel currents in surface cells of rat rectal colon. Am J Physiol Cell Physiol. 286 (2), C380-C390 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。