A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن الفقاع النووي وتسرب الحمض النووي في خلايا الثدييات عن طريق التألق المناعي
In This Article
Summary
غالبا ما تؤدي اضطرابات اعتلال الصفيحة الفقرية إلى تغيرات في الغلاف النووي ، مما قد يسبب الفقاع النووي والتسرب. تقدم هذه الدراسة طريقة التألق المناعي لتصور الصفيحة النووية جنبا إلى جنب مع الحمض النووي مزدوج الشريطة (dsDNA) ، مما يوفر وسيلة لتقييم البنية النووية وسلامتها في خلايا الثدييات.
Abstract
الصفيحة النووية هي شبكة من الخيوط الكامنة وراء الغشاء النووي ، وتتكون من اللامين والبروتينات المرتبطة بالصفيحة. يلعب أدوارا حاسمة في العمارة النووية ، وتحديد المواقع النووية ، وتنظيم التعبير الجيني ، وتنظيم الكروماتين ، وتكرار الحمض النووي ، وإصلاح الحمض النووي. تؤدي الطفرات في الجينات المشاركة في التعبير عن بروتينات اللامين أو معالجتها بعد الترجمة إلى اضطرابات وراثية تعرف باسم اعتلال الصفيحة. على وجه التحديد ، يمكن أن تؤدي الطفرات في LMNA أو جينات ZMPSTE24 إلى تراكم أشكال غير معالجة بشكل كامل من lamin A والتي تحتفظ بمجموعات farnesyl و methyl ، والتي تكون غائبة في lamin A المعالجة بالكامل. تتمركز بروتينات lamin A المعالجة بشكل غير كامل في الغشاء النووي الداخلي بدلا من الصفيحة النووية ، حيث يوجد lamin A الناضج. تعمل بروتينات اللامين غير الموضعية على تعطيل الوظيفة والبنية النووية بشكل عميق ، مما يؤدي غالبا إلى الانفجار النووي. في الحالات الشديدة ، يمكن أن يحدث تمزق نووي ، مما يتسبب في فقدان التجزئة وتسرب الحمض النووي الجيني إلى العصارة الخلوية. يمكن تحديد البنية النووية غير الطبيعية وفقدان التجزئة من خلال التألق المناعي غير المباشر (IF) على الخلايا الثابتة. توضح هذه الدراسة مثل هذه الطريقة ، باستخدام أجسام مضادة محددة ضد بروتين لامين والحمض النووي مزدوج الشريطة (dsDNA) لتصور الغلاف النووي والحمض النووي في وقت واحد. يتيح هذا النهج تقييما سريعا للسلامة الهيكلية النووية والتسرب المحتمل للحمض النووي النووي إلى العصارة الخلوية.
Introduction
الصفيحة النووية هي شبكة من الخيوط التي تكمن وراء الغشاء النووي وتتكون من بروتينات تسمى اللامينات. تلعب الصفيحة النووية أدوارا أساسية في العمارة النووية ، وتحديد موقع المسام النووية ، وتنظيم التعبير الجيني ، وتنظيم الكروماتين ، وتكرار الحمض النووي ، وإصلاح الحمض النووي1،2،3. تؤدي الطفرات في الجينات التي تلعب دورا في التعبير عن بروتينات لامين إلى اضطرابات وراثية تسمى اعتلال الصفيحة3.
الاعتلال الجلدي المقيد (RD) هو اضطراب حاد في اعتلال الصفيحة الناجم في الغالب عن الطفرات المركبة غير المتجانسة التي تخلق أكواد إنهاء مبكرة في الجين ZMPSTE24 4 ، مما يؤدي إلى غياب ZMPSTE24 ميتالوبروتياز المعادن. يتميز هذا الاعتلال الصفيحي بتأخر النمو داخل الرحم ، والجلد المشدود ، والصلب ، والفم الصغير الحجم ، والشعر الرقيق ، وعيوب تمعدنالعظام 1. عادة لا يعيش مرضى RD بعد الأسبوع الأول من حياتهم بسبب القصور الرئوي1. ينطوي اثنان آخران من اضطرابات الاعتلال الصفيحي الخارقية المعروفين باسم متلازمة هاتشينسون-جيلفورد بروجيريا غير النمطية (AT-HGPS) وخلل التنسج الفكي السفلي من النوع B (MAD-B) على انخفاض التعبير ZMPSTE24 ويرتبطان بانخفاض العمر الافتراضي ويظهران أوجه تشابه مع اضطرابات الشيخوخة المبكرة5. يعد البروتياز ZMPSTE24 الذي يتأثر في هذه الاعتلالات الصفيحية أمرا حيويا في التعديل اللاحق للترجمة لللامين أ ، وهو مكون حاسم في الصفيحة النووية. ينتج عن ZMPSTE24 النقص تراكم شكل فارنسيلات غير معالج بالكامل من لامين أ ، والمعروف باسم بريلامين أ2.
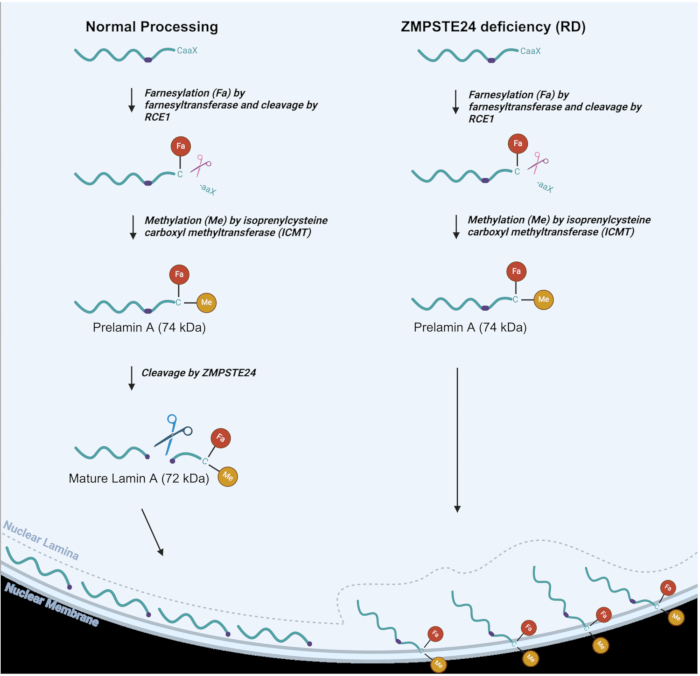
الشكل 1: معالجة Lamin A في الوضع العادي مقابل. خلايا RD. Lamin مسار معالجة في الخلايا الطبيعية (يسار) ومعالجة lamin A المتغيرة في RD ، أو الخلايا الناقصة ZMPSTE (يمين). يشار إلى مجموعات فارنسيل (Fa) والميثيل (Me). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كما هو موضح في الشكل 1 ، في معالجة lamin A العادية ، يتم إرفاق مجموعة farnesyl (الدهون) ببقايا السيستين بالقرب من الطرف C ، متبوعا بانقسام محلل للبروتين لثلاثة أحماض أمينية C-terminal3،6. ثم يتم ميثيل بقايا السيستين. يسمح هذان التعديلان باستهداف بريلامين أ للغشاء النووي الداخلي2. يقوم ZMPSTE24 بعد ذلك بإجراء تفاعل انقسام حيث تتم إزالة آخر 15 من الأحماض الأمينية الطرفية C ، جنبا إلى جنب مع مجموعات الفارنسيل والميثيل ، لإنتاج بروتين لامين أ الناضج ، والذي يتم توصيله إلى الصفيحة النووية6،7،8. في RD و AT-HGPS و MAD-B ، لا تحدث الخطوة الأخيرة من المعالجة بشكل فعال نظرا لأن البروتين المعدني ZMPSTE24 يفتقر أو لا يعمل بكاملطاقته 8،9. ينتج عن هذا تراكم بريلامين أ ، والذي يظل فارنسيلات وميثيل بشكل دائم9. تتسبب هذه المجموعات الأخيرة في التصاق الطبقة الأولية A بالغشاء النووي الداخلي بدلا من التوطين في الصفيحة النووية ، حيث يجب أن يقيم اللامين أ الناضج في النهاية ، كما هو موضح في الشكل 1. وبالتالي ، فإن نقص ZMPSTE له تأثيرات عميقة على مجموعة متنوعة من الوظائف النووية ، إلى جانب الهيكل النووي10،11،12،13،14،15. قد تشمل هذه التعديلات في التركيب النووي الفقاع النووي وحتى التمزق النووي الذي يمكن أن يؤدي إلى تسرب الحمض النووي إلى العصارة الخلوية بالإضافة إلى دخول العصارة الخلوية إلى النواة. النوى ذات الشكل الشاذ هي بالفعل سمة مميزة لاضطرابات الاعتلال الصفيحي ، إلى جانب العديد من الأنماط الظاهرية الأخرى التي تسببها معالجة بريلامين أ المعيبة16،17. تؤدي العيوب في الصفيحة النووية إلى العديد من الآثار الضارة ، بما في ذلك الخطأ في تحديد موقع مراقبة جودة البروتين النووي وبروتينات إصلاح الحمض النووي في النيوكليوبلازم ، والتي بدورها تؤدي إلى العديد من العيوب في الوظيفة النووية18. من المهم أن يكون لديك تقنية بسيطة يمكن أن تساعد في تحديد ومراقبة هذه السمات المميزة لاعتلال الصفيحة لتسهيل البحث في تطوير الأساليب العلاجية التي تهدف إلى تحسين الأنماط الظاهرية للاعتلال الصفيحي. بالنسبة للفئران المصابة باعتلال الصفيحة ، فقد ثبت أن القضاء على الفقاع النووي يرتبط بالقضاء العام على الأنماط الظاهرية للاعتلال الصفيحي16. يمكن للتقنية التي تسمح بمراقبة السلامة النووية في الخلايا البشرية أن تعزز دراسة العلاجات المحتملة للقضاء على الأنماط الظاهرية للمرض أو تحسينها بشكل كبير.
التألق المناعي غير المباشر (IF) هو تقنية حساسة ومستخدمة على نطاق واسع تستخدم كلا من الجسم المضاد الأولي غير المسمى والجسم المضاد الثانوي المسمى بالفلوروفور الذي يتعرف على الجسم المضاد الأساسي للكشف عن هدف الاهتمام19. يمكن أن توفر طرق IF وسيلة قوية لتصور مكونات وهياكل محددة داخل الخلايا. من الممكن أيضا أن يتفاعل أكثر من جزيء ثاني واحد من الجسم المضاد مع الجسم المضاد الأساسي ، مما يؤدي إلى تضخيم الإشارة19. IF غير المباشر هو تقنية متعددة الاستخدامات تسمح أيضا بالكشف عن العديد من الأجسام المضادة الأولية مع مجموعة صغيرة نسبيا من الأجسام المضادة الثانوية حيث يتم رفع الأجسام المضادة الثانوية ضد مجال Fc للجسم المضاد الأساسي ، والذي يتم الحفاظ عليه داخل النوع19.
توضح هذه المقالة طريقة غير مباشرة (IF) لتقييم الفقاع النووي وتسرب الحمض النووي في الخلايا التي تعاني من نقص في ZMPSTE24 ، باستخدام الأجسام المضادة ضد الحمض النووي مزدوج الشريطة (dsDNA) و lamin B1 للكشف عن الحمض النووي والصفيحة النووية ، على التوالي. لإثبات فائدة هذا النهج ، تم تطبيق الإجراء على خط خلية HeLa مع تعبير ZMPSTE24 مقطوع ، بالإضافة إلى خط خلية HeLa الذي يعبر عن ZMPSTE24 ، وتمت مقارنة نتائج خطي الخلية.
Protocol
تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. تحضير المواد
- الأوتوكلاف ما لا يقل عن عشرة أغطية زجاجية مربعة مقاس 22 مم × 22 مم ملقط قبل خلايا الطلاء على أغطية.
2. إعداد الحلول
- الوسائط المكملة: تحضير 500 مل من وسط النسر المعدل (DMEM) من Dulbecco مع 10٪ مصل بقري جنين (FBS) ، و 100 وحدة / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين.
- المخزن المؤقت لتخفيف الأجسام المضادة (ADB): قم بإذابة 2 جم من ألبومين مصل الأبقار (BSA) و 1 جم من جيلاتين السمك في 80 مل من محلول ملحي مخزن بالفوسفات 1x (PBS). يصل إلى 100 مل مع PBS بمجرد إذابة BSA وجيلاتين السمك.
- 1x PBS-Tween (PBS-T): تحضير 500 مل من PBS و 0.5 مل من Tween. ضعها في حمام مائي 37 درجة مئوية حتى يمكن خلط Tween بسهولة في المحلول.
3. زراعة الخلايا المرغوبة
ملاحظة: نمت خلايا HeLa في هذا البروتوكول إلى التقاء داخل قارورة T75.
- رش ستة أغطية تحتوي على 70٪ من الإيثانول واتركها تجف في الهواء على منديل خال من النسالة. ضع الغطاء في صفيحة معقمة من 6 آبار باستخدام ملقط ، غطاء واحد لكل بئر.
- أضف 2 مل من DMEM المكملة إلى كل بئر في اللوحة المكونة من 6 آبار.
- استنشق الوسائط من الخلايا واغسل الخلايا عن طريق إضافة 15 مل من PBS إلى القارورة ، مع الدوران برفق. استنشق PBS وأضف 2 مل من التربسين-EDTA (التربسين).
- قم بتغطية الخلايا بالتربسين وضع القارورة مرة أخرى في حاضنة رطبة 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة دقيقتين للسماح للخلايا بالانفصال عن القارورة.
- أضف 8 مل من DMEM المكملات إلى القارورة لجمع الخلايا المثقبة. الماصة لأعلى ولأسفل عدة مرات لفصل الخلايا المتكتلة. اجمع معلق الخلية في القارورة وضعه في أنبوب بوليسترين سعة 15 مل.
- عد الخلايا باستخدام مقياس كثافة الدم.
- أضف 500,000 خلية ، قطرة قطرة ، مباشرة على كل من الغطاءات في اللوحة المكونة من 6 آبار. اسمح للخلايا بالنمو طوال الليل عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 في حاضنة مرطبة.
4. تثبيت الخلايا ونفاذيتها
- تحضير محلول الفورمالديهايد بنسبة 4٪ طازجا قبل الاستخدام: أضف 2 مل من محلول الفورمالديهايد 37.5٪ في 18 مل من PBS. تخلط جيدا.
- تحضير محلول النفاذية طازجا قبل الاستخدام: أضف 100 ميكرولتر من Triton-X إلى 20 مل من PBS. اتركيه للاحتضان في حمام مائي 37 درجة مئوية لبضع دقائق حتى يذوب Triton-X في المحلول. تخلط جيدا.
- استنشق الوسائط في آبار اللوحة. اغسل الخلايا مرة واحدة باستخدام 2 مل من PBS. استنشق جميع PBS من الآبار.
- أضف 2 مل من محلول الفورمالديهايد 4٪ لكل بئر. اتركيه لمدة 10 دقائق في درجة حرارة الغرفة (RT). استنشق 4٪ فورمالديهايد بالكامل من الآبار.
- اغسل الخلايا 3 مرات ب 2 مل من PBS. قم بإزالة PBS تماما من الآبار بعد كل غسلة.
- أضف 2 مل من محلول النفاذية لكل بئر. اتركيه لمدة 10 دقائق في RT. محلول نفاذية الشفط تماما.
- اغسل الخلايا 3 مرات ب 2 مل من PBS. قم بشفط PBS تماما بعد أول غسلتين ، مع ترك PBS في الآبار بعد الغسيل الثالث.
ملاحظة: يمكن تخزين الخلايا في آخر غسيل PBS عند 4 درجات مئوية لبضعة أسابيع بعد هذه الخطوة ، مما يضمن إغلاق اللوحة بغشاء البارافين لتجنب تبخر السائل. إذا كان من الممكن متابعة الإجراء ، فيمكن تخطي هذه الخطوة.
5. تلطيخ التألق المناعي
- قم بإزالة جميع PBS من الآبار. قم بحظر الخلايا عن طريق إضافة 2 مل من ADB إلى كل بئر واحتضانها في RT ، مع التأرجح لمدة 30 دقيقة.
- قرب نهاية وقت الحجب البالغ 30 دقيقة ، امزج تخفيف الجسم المضاد الأساسي في ADB (تخفيف 1: 1,000 لكل من الأجسام المضادة Lamin B1 و dsDNA ، الجدول 1). هناك حاجة إلى 75 ميكرولتر لكل غطاء ، لذلك يجب خلط 600 ميكرولتر من ADB ، و 0.6 ميكرولتر من الجسم المضاد الأساسي Lamin B ، و 0.6 ميكرولتر من الجسم المضاد dsDNA لستة أغطية. دوامة تماما.
- إزالة مصرف التنمية الآسيوي من الآبار. على سطح مستو ، قم بلصق قطعة من فيلم البارافين كبيرة بما يكفي في المساحة لوضع جميع أغطية الغطاء التي تتم معالجتها.
- لكل غطاء ، أضف 75 ميكرولتر من تخفيف الأجسام المضادة الأولية إلى طبقة البارافين ، مما يضمن عدم سحب الفقاعات في ADB. بعد ذلك ، ضع جانب خلية الغطاء لأسفل على قطرة ADB باستخدام الملقط.
- قم بتغطية أغطية الحضانة بغطاء لوحة البئر واتركها تحتضن لمدة 1 ساعة في RT.
- قم بإزالة الغطاء من فيلم البارافين باستخدام الملقط وضع الغطاء مرة أخرى في اللوحة المكونة من 6 آبار ، بحيث يكون جانب الخلية متجها لأعلى.
- اغسل الغطاء 3 مرات ب 2 مل من PBS-T ، مع التأرجح لمدة 3-5 دقائق في كل مرة. قم بإزالة كل PBS-T من الآبار بعد كل غسلة.
- أثناء الغسيل الأخير ، قم بإعداد تخفيف الأجسام المضادة الثانوية (1: 1,000 لكل من الأجسام المضادة الثانوية ، الجدول 1). هناك حاجة إلى 75 ميكرولتر لكل غطاء ، لذلك يجب خلط 600 ميكرولتر من ADB و 0.6 ميكرولتر من كل من الأجسام المضادة الثانوية الموسومة ب Alexa Fluor لستة أغطية. دوامة تماما. قم بتغطية تخفيف الجسم المضاد الثانوي من الضوء قدر الإمكان.
| جسم | مصدر | شركة | مرجع | ||
| الأجسام المضادة DSDNA Marker (HYB331-01) | الماوس أحادي النسيلة | سانتا كروز | SC-58749 | ||
| الماعز المضاد للفأر IgG (H + L) الجسم المضاد الثانوي عالي الامتصاص ، Alexa Fluor Plus 488 | ماعز | ثيرموفيشر | أ32723 | ||
| الماعز المضاد للفأر IgG (H + L) الجسم المضاد الثانوي عالي الامتصاص ، Alexa Fluor Plus 405 | ماعز | إنفيتروجين | أ31553 | ||
| لامين B1 الأجسام المضادة متعددة النسيلة | أرنب | بروتينتك | 12987-1-ا ف ب | ||
| الماعز المضاد للأرانب IgG (H + L) الجسم المضاد الثانوي عالي الامتصاص ، Alexa Fluor 594 | ماعز | إنفيتروجين | أ 11037 | ||
الجدول 1: الأجسام المضادة. قائمة بجميع الأجسام المضادة المستخدمة في هذا البروتوكول.
- قم بإزالة كل PBS-T من آخر غسلة. احتضن الغطاء في تخفيف الأجسام المضادة الثانوية على غشاء البارافين ، كما في الخطوة 5 ، لمدة 30 دقيقة في RT. احم من الضوء لهذه الخطوة وجميع الخطوات المتبقية. يمكن استخدام صندوق صغير لحماية الضوء. تأكد من العمل بسرعة عند الحاجة لإضافة أو إزالة المحاليل من الآبار.
- قم بإزالة أغطية الغطاء من فيلم البارافين باستخدام الملقط وضع الغطاء مرة أخرى في اللوحة المكونة من 6 آبار ، بحيث يكون جانب الخلية لأعلى.
- اغسل الغطاء 3 مرات ب 2 مل من PBS-T. قم بإزالة كل PBS-T من الآبار بعد كل غسلة.
- جفف الشرائح بسلسلة الإيثانول (70٪ ، 90٪ ، 100٪). ابدأ بإضافة 2 مل من 70٪ من الإيثانول إلى كل بئر. اتركيه لمدة 1-2 دقيقة ، وأزيلي كل الإيثانول من الآبار. كرر مع نسب الإيثانول المتبقية.
- قم بإزالة الأغطية من الآبار باستخدام ملقط واتركها تجف في الهواء ، محمية من الضوء ، على منديل خال من النسالة.
- قم بتركيب جانب خلية الغطاء لأسفل على شرائح المجهر الزجاجي باستخدام 20 ميكرولتر من وسط التركيب لكل غطاء غطاء. اتركيه ليجف طوال الليل ، محميا من الضوء.
6. الحصول على الصور
- قبل التصوير ، قم بتغطية حواف الأغطية بطبقة رقيقة من طلاء الأظافر الشفاف (أي علامة تجارية أو نوع يكفي). اتركيه ليجف في الهواء ، محميا من الضوء.
ملاحظة: ستختلف التعليمات الخاصة باستخدام المجهر للصورة، اعتمادا على المجهر المستخدم. دقة الكاميرا على المجهر المستخدم هنا هي 1280 × 960 بكسل. يكفي دقة مماثلة أو أفضل. - قبل وضع شريحة على مرحلة المجهر ، يجب ضبط إعدادات حفظ الملفات. قم بتشغيل المجهر وأدخل محرك أقراص USB. اضبط إعدادات الحفظ داخل إعدادات المجهر وتأكد من حفظ جميع القنوات (GFP و RFP) بشكل منفصل وأن الصور ستنتقل إلى الموقع الصحيح على محرك أقراص USB.
ملاحظة: قم بإنشاء مجلد على محرك أقراص USB وامنح كل غطاء اسمه الخاص للرجوع إليه في المستقبل. - قبل التصوير ، رش منديل خال من النسالة بنسبة 70٪ من الإيثانول ونظف الجزء الخلفي من الشرائح برفق. قم بتنظيف الجزء الأمامي من الشرائح برفق ، مع ضمان ممارسة الحد الأدنى من الضغط.
- ضع شريحة نظيفة على المجهر ، مع توجيه الأغطية لأسفل. قم بتغطيتها بصندوق الدرع الخفيف.
- باستخدام عدسة موضوعية 40x ، استخدم القناة المناسبة (RFP للجسم المضاد lamin B1 المستخدم هنا) لتحديد موقع النوى على شاشة المجهر. اضبط شدة الضوء على حوالي 50٪ للبدء.
- للتحقق من وجود مناطق مفرطة التشبع، حدد خيار Color Off وتأكد من عدم وجود إشارة حمراء عبر الغطاء عبر الغطاء في الإعداد بالأبيض والأسود. إذا كان هناك الكثير من الإشارة الحمراء ، فقم بخفض شدة الضوء حتى يتم عرض الحد الأدنى من الإشارة الحمراء.
ملاحظة: تشير الإشارة الحمراء إلى التشبع الزائد. إذا بدت النوى بالكاد مرئية ، فقم بزيادة الشدة بزيادات بنسبة 10٪ حتى يتم تحقيق شدة مناسبة دون تشبع زائد. - تحقق من جميع أغطية الأغطية الأخرى بنفس الكثافة للتأكد من أنها ليست مشبعة. تحقق من جميع أغطية القناة الأخرى باستخدام نفس العملية المذكورة أعلاه (GFP للجسم المضاد dsDNA المستخدم هنا).
- سجل شدة الضوء لكل قناة. تأكد من الحفاظ على ثبات جميع شدة الضوء لكل قناة طوال عملية التصوير.
- صور كل غطاء على حدة. ابدأ بالقناة الأولى ، وركز النوى ، والتقط الصورة.
- قم بتبديل القنوات بعناية وجعل الخلايا في التركيز مرة أخرى. عند التركيز ، التقط الصورة.
- بعد التقاط الصور في القنوات الضرورية (GFP و RFP)، حدد تراكب لمراقبة الصورة المدمجة والتأكد من عدم تحرك الشريحة عند التقاط الصورة. إذا لم تتداخل القنوات، فأعد القناة الضرورية حتى تصطف الصور.
- احفظ الصورة بالنقر فوق أيقونة محرك الأقراص المحمول . انتقل إلى مكان مختلف على الغطاء لمتابعة التصوير.
ملاحظة: تأكد من تصوير منطقة مختلفة من قسيمة الغطاء في كل مرة لتجنب التقاط نفس المنطقة بشكل متكرر. يوصى ببدء التصوير في الزاوية اليسرى العليا من الغطاء والتحرك بنمط "S" لضمان التغطية الكاملة دون الازدواجية.
7. تحليل البيانات
- البيانات التي تم الحصول عليها بهذه الطريقة مرئية. افحص الصور بحثا عن علامات تسرب الحمض النووي أو الفقاع النووي. يتم عرض أمثلة على الرقيق والتسرب في قسم النتائج التمثيلية.
النتائج
تقدم هذه الدراسة طريقة IF لتصور الصفيحة النووية جنبا إلى جنب مع الحمض النووي مزدوج الشريطة (dsDNA). بمجرد إجراء IF ، يمكن فحص الصور الملتقطة بحثا عن علامات الجرع النووي وتسرب الحمض النووي.
Discussion
يحتوي البروتوكول المقدم على عدة خطوات حاسمة ، أهمها علاج الخلايا الثابتة بالأجسام المضادة الأولية والثانوية. إن ضمان استخدام جسم مضاد أولي عالي الجودة ضد الهدف محل الاهتمام بجسم مضاد ثانوي مناسب مناسب مع فلوروفورات ضمن نطاق المجهر المستخدم سيؤدي إلى نتائج مثالية
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل منح المعهد الوطني للشيخوخة R03AG064525 إلى ASW. نود أن نشكر الدكتور جيسون أ. ستيوارت على المساعدة في الإرشاد التقني ومختبر هوي تشن لتوفير المجهر المستخدم. نود أيضا أن نشكر فابيو مارتينون على خطوط خلايا HeLa المستخدمة في هذه التجارب.
Materials
| Name | Company | Catalog Number | Comments |
| 22 mm Square Glass Coverslips | Propper Manufacturing Company | M8710 | Any size or shape can be used as long as they can be fixed to a standard microscope slide. |
| 36.5% Formaldehyde | Sigma Aldrich | F8775 | Fixation Reagent. |
| 75 cm 2 Flasks | Corning | 430725U | For cell culture. |
| Bovine Serum Albinum (BSA) | Fisher Scientific | 9048-46-8 | Antibody dilution buffer. |
| DMEM with 1 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-014-CV | For cell culture. |
| Ethanol (200 Proof) | Decon Laboratories | 2701 | For dehydration of samples before mounting, diluted to make multiple concentrations. |
| EVOS FL Digital Inverted Fluorescence Microscope | Fisher Scientific | 12-563-460 | Imaging. |
| Fish Gelatin | Sigma Aldrich | G7041 | Antibody dilution buffer. |
| Fluoromount-G | Southern Biotech | 0100-01 | Mounting medium to prevent photobleaching. |
| Parafilm (4 in) | Fisher Scientific | 13-374-12 | Any size can be substituted, as long as the coverslips being used can fit. |
| Penicillin-Streptomycin | Gibco | 15-140-122 | For cell culture. |
| Phosphate Buffered Saline (PBS) | N/A | N/A | Made and sterilized in the lab for tissue culture and solutions. |
| Premium Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | For cell culture. |
| Superfrost Premium Microscope Slides | Fisher Scientific | 12-544-7 | Any standard microscope slides can be used. |
| Tissue Culture Treated 6-well Flat Bottom Plates | Falcon | 353046 | For cell culture. |
| TritonX-100 | Thermofisher Scientific | A16046.AP | For washing. |
| Trypsin-EDTA (0.5%) | Gibco | 15-400-054 | For cell culture. |
| Tween 20 | Fisher Scientific | 9005-64-5 | Cell Permeation reagent. |
References
- Navarro, C. L., et al. New ZMPSTE24 (FACE1) mutations in patients affected with restrictive dermopathy or related progeroid syndromes and mutation update. Eur J Hum Genet. 22 (8), 1002-1011 (2014).
- Dittmer, T. A., Misteli, T. The lamin protein family. Genome Biol. 12 (222), 1-16 (2011).
- Gruenbaum, Y., Margalit, A., Goldman, R. D., Shumaker, D. K., Wilson, K. L. The nuclear lamina comes of age. Nat Rev Mol Cell Biol. 6, 21-31 (2005).
- Navarro, C. L., et al. Lamin A and ZMPSTE24 (FACE-1) defects cause nuclear disorganization and identify restrictive dermopathy as a lethal neonatal laminopathy. Hum Mol Genet. 13 (20), 2493-2503 (2004).
- Barrowman, J., Wiley, P. A., Hudon-Miller, S. E., Hrycyna, C. A., Michaelis, S. Human ZMPSTE24 disease mutations: Residual proteolytic activity correlates with disease severity. Hum Mol Genet. 21 (18), 4084-4093 (2012).
- Richards, S., Muter, J., Ritchie, P., Lattanzi, G., Hutchison, C. The accumulation of un-repairable DNA damage in laminopathy progeria fibroblasts is caused by ROS generation and is prevented by treatment with N-acetyl cysteine. Hum Mol Genet. 20 (20), 3997-4004 (2011).
- Davies, B. S., Fong, L. G., Yang, S. H., Coffinier, C., Young, S. G. The post-translational processing of prelamin A and disease. Annu Rev Genomics Hum Genet. 10, 153-174 (2009).
- Barrowman, J., Hamblet, C., George, C. M., Michaelis, S. Analysis of prelamin A biogenesis reveals the nucleus to be a CaaX processing compartment. Mol Biol Cell. 19, 5398-5408 (2008).
- Young, S., Meta, M., Yang, S. H., Fong, L. G. Prelamin A farnesylation and progeroid syndromes. J Biol Chem. 281 (52), 39741-39745 (2006).
- Houthaeve, G., Robijns, J., Braeckmans, K., De Vos, W. H. Bypassing border control: Nuclear envelope rupture in disease. Physiol. 33 (1), 39-49 (2017).
- Schreiber, K. H., Kennedy, B. K. When lamins go bad: Nuclear structure and disease. Cell. 152 (6), 1365-1375 (2013).
- Fong, L. G., et al. Heterozygosity for Lmna deficiency eliminates the progeria-like phenotypes in Zmpste24-deficient mice. Proc Natl Acad Sci USA. 101 (52), 18111-18116 (2004).
- Pendas, A. M., et al. Defective prelamin A processing and muscular and adipocyte alterations in Zmpste24 metalloproteinase-deficient mice. Nat Genet. 31, 94-99 (2002).
- Goldman, R. D., et al. Accumulation of mutant lamin A causes progressive changes in nuclear architecture in Hutchinson-Gilford progeria syndrome. Proc Natl Acad Sci USA. 101, 8963-8968 (2004).
- Eriksson, M., et al. Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome. Nature. 423, 293-298 (2003).
- Young, S. G., Fong, L. G., Michaelis, S. Thematic review series: Lipid post-translational modifications. Prelamin A, Zmpste24, misshapen cell nuclei, and progeria—new evidence suggesting that protein farnesylation could be important for disease pathogenesis. J Lipid Res. 46 (12), 2531-2558 (2005).
- Worman, H. J., Michaelis, S. Prelamin A and ZMPSTE24 in premature and physiological aging. Nucleus. 14 (1), 1-17 (2023).
- Pande, S., Ghosh, D. K. Nuclear proteostasis imbalance in laminopathy-associated premature aging diseases. FASEB J. 37 (8), 1025-1035 (2023).
- Odell, I. D., Cook, D. Immunofluorescence techniques. J Invest Dermatol. 133 (4), 1-12 (2013).
- Kumar, V. Immunofluorescence and enzyme immunomicroscopy methods. J Immunoassay Immunochem. 21 (2-3), 235-253 (2000).
- Tjaden, A., Giessmann, R. T., Knapp, S., Schroder, M., Muller, S. High-content live-cell multiplex screen for chemogenomic compound annotation based on nuclear morphology. STAR Protoc. 3 (101791), 1-15 (2022).
- Gunn, A. L., Yashchenko, A. I., Dubrulle, J., Johnson, J., Hatch, E. M. A high-content screen reveals new regulators of nuclear membrane stability. Sci Rep. 14, 6013 (2024).
- Yu, L., Liu, P. Cytosolic DNA sensing by cGAS: Regulation, function, and human diseases. Nat Rev Mol Cell Biol. 6 (170), 1-14 (2021).
- Odinammadu, K. O., et al. The farnesyl transferase inhibitor (FTI) lonafarnib improves nuclear morphology in ZMPSTE24-deficient fibroblasts from patients with the progeroid disorder MAD-B. Nucleus. 14 (1), 1-14 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved