Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение ядерного блеббинга и утечки ДНК в клетках млекопитающих с помощью иммунофлюоресценции
В этой статье
Резюме
Ламинопатические расстройства часто приводят к изменениям в ядерной оболочке, что может привести к образованию ядерного пузыря и утечке. В этом исследовании представлен иммунофлуоресцентный метод визуализации ядерной пластинки вместе с двухцепочечной ДНК (дцДНК), обеспечивающий средства для оценки ядерной структуры и целостности в клетках млекопитающих.
Аннотация
Ядерная пластинка представляет собой сеть нитей, лежащих в основе ядерной мембраны, состоящую из ламинов и белков, связанных с ними. Он играет важнейшую роль в ядерной архитектуре, позиционировании ядерных пор, регуляции экспрессии генов, организации хроматина, репликации ДНК и репарации ДНК. Мутации в генах, участвующих в экспрессии или посттрансляционной обработке белков ламина, приводят к генетическим нарушениям, известным как ламинопатии. В частности, мутации в генах LMNA или ZMPSTE24 могут привести к накоплению не полностью переработанных форм ламина А, которые сохраняют фарнезиловые и метильные группы, отсутствующие в полностью переработанном ламине А. Эти не полностью обработанные белки ламина А локализуются во внутренней ядерной мембране, а не в ядерной пластинке, где находится зрелый ламин А. Неправильно локализованные ламинные белки глубоко нарушают ядерную функцию и структуру, что часто приводит к ядерному блеббингу. В тяжелых случаях может произойти разрыв ядра, вызывающий потерю компартментализации и утечку геномной ДНК в цитозоль. Аномальная структура ядра и потеря компартментализации могут быть идентифицированы с помощью непрямой иммунофлюоресценции (ИФ) на фиксированных клетках. В этом исследовании описывается такой метод, использующий специфические антитела против белка ламина и двухцепочечной ДНК (дцДНК) для одновременной визуализации ядерной оболочки и ДНК. Такой подход позволяет быстро оценить структурную целостность ядра и потенциальную утечку ядерной ДНК в цитозоль.
Введение
Ядерная пластинка представляет собой сеть нитей, которая лежит в основе ядерной мембраны и состоит из белков, называемых ламинами. Ядерная пластинка играет важную роль в ядерной архитектуре, позиционировании ядерных пор, регуляции экспрессии генов, организации хроматина, репликации ДНК и репарации ДНК 1,2,3. Мутации в генах, которые играют роль в экспрессии белков ламина, приводят к генетическим нарушениям, называемым ламинопатиями.
Рестриктивная дермопатия (РД) — это тяжелое заболевание ламинопатии, вызванное преимущественно сложными гетерозиготными мутациями, которые создают преждевременные терминирующие кодоны в генеZMPSTE24 4, что приводит к отсутствию металлопротеазы ZMPSTE24. Эта ламинопатия характеризуется задержкой внутриутробного развития, плотной, жесткой кожей, маленьким размером рта, тонкими волосами и дефектами минерализации костей1. Пациенты с ПД обычно не доживают до первой недели жизни из-за легочной недостаточности1. Два других расстройства ламинопатии, известные как атипичный синдром прогерии Хатчинсона-Гилфорда (AT-HGPS) и мандибулоакральная дисплазия типа B (MAD-B), связаны со сниженной экспрессией ZMPSTE24 и связаны с уменьшением продолжительности жизни и демонстрируют сходство с расстройствами преждевременного старения5. Протеаза ZMPSTE24, которая воздействует при этих ламинопатиях, жизненно важна для посттрансляционной модификации ламины А, которая является критическим компонентом ядерной пластинки. ZMPSTE24 дефицит приводит к накоплению не полностью переработанной фарнезилированной формы ламина А, известной как преламинА2.
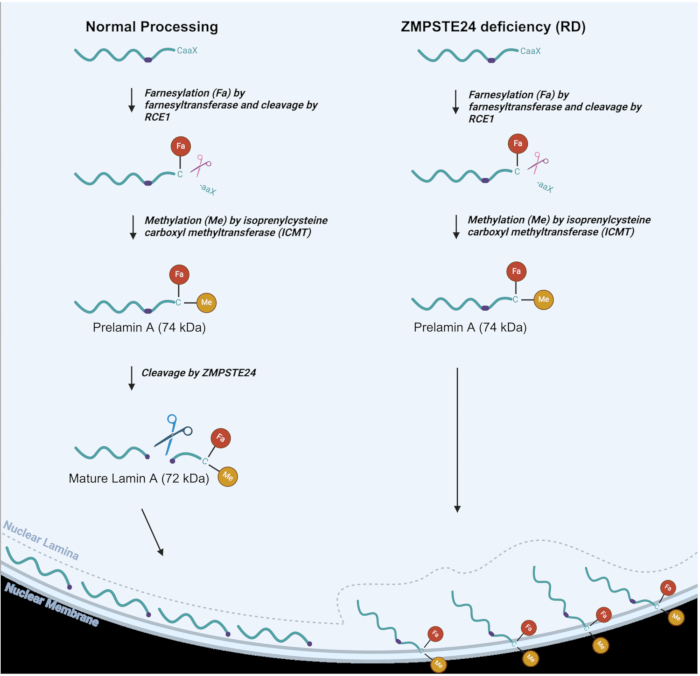
Рисунок 1: Обработка ламина А в норме и . RD-клетки. Процессинговый путь ламина А в нормальных клетках (слева) и процессинг измененного ламина А в RD, или клетки с дефицитом ZMPSTE (справа). Указаны фарнезиловые (Fa) и метильные (Me) группы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Как видно на рисунке 1, при нормальном процессинге ламина А фарнезильная (липидная) группа присоединяется к остатку цистеина вблизи С-конца, после чего происходит протеолитическое расщепление трех С-концевых аминокислот 3,6. Затем остаток цистеина метилируется. Эти две модификации позволяют нацелить преламин А на внутреннюю ядерную мембрану2. Затем ZMPSTE24 проводит реакцию расщепления, в ходе которой последние 15 С-концевых аминокислот вместе с фарнезильными и метильными группами удаляются с образованием зрелого белка Ламина А, который доставляется в ядерную пластинку 6,7,8. В RD, AT-HGPS и MAD-B заключительная стадия процессинга не происходит эффективно, поскольку ZMPSTE24 металлопротеиназа отсутствует или неполностью функциональна. Это приводит к накоплению преламина А, который остается постоянно фарнезилированным и метилированным9. Эти последние группы приводят к тому, что преламин А прилипает к внутренней ядерной мембране вместо того, чтобы локализоваться в ядерной пластинке, где в конечном итоге должен находиться зрелый ламин А, как показано на рисунке 1. Таким образом, дефицит ZMPSTE оказывает глубокое воздействие на различные ядерные функции, наряду со структурой ядра 10,11,12,13,14,15. Эти изменения в структуре ядра могут включать в себя ядерное блеббинг и даже разрыв ядра, что может привести к утечке ДНК в цитозоль, а также к проникновению цитозоля в ядро. Ядра аберрантной формы действительно являются отличительной чертой ламинопатийных расстройств, наряду со многими другими фенотипами, которые вызваны дефектным процессингом преламина А16,17. Дефекты в ядерной пластинке приводят к множеству пагубных последствий, включая неправильную локализацию контроля качества ядерных белков и белков репарации ДНК в нуклеоплазме, что, в свою очередь, приводит к многочисленным дефектам в ядерной функции. Важно иметь простую методику, которая может помочь идентифицировать и контролировать эти признаки ламинопатий, чтобы облегчить исследования по разработке терапевтических подходов, направленных на улучшение фенотипов ламинопатии. Для мышей с ламинопатиями было показано, что элиминация ядерного блеббинга коррелирует с общей элиминацией фенотипов ламинопатии16. Метод, позволяющий осуществлять мониторинг ядерной целостности в клетках человека, может улучшить изучение потенциальных методов лечения для устранения или значительного улучшения фенотипов заболеваний.
Непрямая иммунофлуоресценция (ИФ) является чувствительным и широко используемым методом, в котором используется как первичное немеченое антитело, так и меченное флуорофором вторичное антитело, которое распознает первичное антитело для обнаружения интересующеймишени 19. Методы ПЧ могут предоставить мощные средства для визуализации конкретных внутриклеточных компонентов и структур. Также возможно, что более одной молекулы вторичного антитела могут взаимодействовать с первичным антителом, что приводит к усилению сигнала19. Непрямая ПЧ является универсальным методом, который также позволяет обнаруживать множественные первичные антитела с относительно небольшим набором вторичных антител, поскольку вторичные антитела поднимаются против Fc-домена первичного антитела, который консервативен в пределах вида19.
В данной статье описывается метод косвенного (ЕСЛИ) для оценки ядерного блеббинга и утечки ДНК в клетках с дефицитом ZMPSTE24 с использованием антител против двухцепочечной ДНК (дцДНК) и ламина B1 для обнаружения ДНК и ядерной пластинки соответственно. Чтобы продемонстрировать полезность этого подхода, процедура была применена к клеточной линии HeLa с нокаутированной экспрессией ZMPSTE24, а также к клеточной линии HeLa, экспрессирующей ZMPSTE24, и результаты для двух клеточных линий были сравнены.
протокол
Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Подготовка материалов
- Автоклав не менее десяти квадратных стеклянных покровных колпачков и щипцов размером 22 мм x 22 мм перед нанесением ячеек на покровные стекла.
2. Приготовление растворов
- Дополнительные среды: Приготовьте 500 мл модифицированной орлиной среды (DMEM) от Dulbecco с 10% фетальной бычьей сывороткой (FBS), 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина.
- Буфер для разведения антител (ADB): Растворите 2 г бычьего сывороточного альбумина (BSA) и 1 г рыбьего желатина в 80 мл 1x фосфатно-солевого буфера (PBS). Доведите до 100 мл PBS после растворения BSA и рыбьего желатина.
- 1x PBS-Tween (PBS-T): Приготовьте 500 мл PBS и 0,5 мл Tween. Поместите на водяную баню при температуре 37 °C до тех пор, пока Tween не сможет легко смешаться с раствором.
3. Выращивание нужных клеток
Примечание: Клетки HeLa выращивали по этому протоколу до конфлюенции в колбе T75.
- Сбрызните шесть покровных стекол 70% этанолом и дайте им высохнуть на воздухе на безворсовой салфетке. Поместите покровные листы в стерильный 6-луночный планшет с помощью щипцов, по одному покровному листу на лунку.
- Добавьте по 2 мл дополненного DMEM в каждую лунку в 6-луночном планшете.
- Отсадите среду из клеток и промойте клетки, добавив в колбу 15 мл PBS, аккуратно взбалтывая. Аспирируйте PBS и добавьте 2 мл трипсина-ЭДТА (трипсина).
- Смажьте клетки трипсином и поместите колбу обратно в инкубатор, увлажненный при температуре 37 °C и 5%CO2 , на 2 минуты, чтобы клетки могли отсоединиться от колбы.
- Добавьте в колбу 8 мл дополненного DMEM для сбора трипсинизированных клеток. Проведите пипеткой вверх и вниз несколько раз, чтобы отделить комкующиеся ячейки. Соберите клеточную суспензию в колбу и поместите ее в полистирольную пробирку объемом 15 мл.
- Подсчитайте клетки с помощью гемоцитометра.
- Добавляйте 500 000 ячеек, капля за каплей, непосредственно на каждый из покровных стекол в 6-луночном планшете. Дайте клеткам вырасти в течение ночи при 37 °C и 5%CO2 в увлажненном инкубаторе.
4. Фиксация и пермеабилизация клеток
- Перед применением приготовьте 4% раствор формальдегида в свежем виде: Добавьте 2 мл 37,5% раствора формальдегида в 18 мл PBS. Тщательно перемешиваем.
- Приготовьте свежий раствор для пермеабилизации перед использованием: добавьте 100 μл Triton-X в 20 мл PBS. Дайте поинкубироваться на водяной бане при температуре 37 °C в течение нескольких минут, пока Triton-X не растворится в растворе. Тщательно перемешиваем.
- Отсасывайте среду в лунки пластины. Промойте ячейки один раз 2 мл PBS. Отсасывайте все PBS из лунок.
- Добавьте в каждую лунку по 2 мл 4% раствора формальдегида. Оставьте на 10 минут при комнатной температуре (RT). Полностью отасывайте 4% формальдегида из лунок.
- Промойте ячейки 3 раза 2 мл PBS. Полностью удаляйте PBS из лунок после каждой промывки.
- Добавьте по 2 мл раствора для пермеабилизации в каждую лунку. Оставьте на 10 минут на RT. Полностью аспирируйте раствор для пермеабилизации.
- Промойте ячейки 3 раза 2 мл PBS. Полностью аспирируйте PBS после первых двух промывок, оставляя PBS в лунках после третьей промывки.
ПРИМЕЧАНИЕ: Элементы можно хранить в последней промывке PBS при температуре 4 °C в течение нескольких недель после этого этапа, обеспечивая герметичность пластины парафиновой пленкой во избежание испарения жидкости. Если процедуру можно продолжить, этот шаг можно пропустить.
5. Иммунофлюоресцентное окрашивание
- Удалите все PBS из лунок. Заблокируйте ячейки, добавив 2 мл ADB в каждую лунку, и инкубируйте при RT, покачивая в течение 30 минут.
- К концу 30-минутного времени блокировки смешайте первичное разведение антител в ADB (разведение 1:1000 для антител к Lamin B1 и dsDNA, Таблица 1). Для каждого покровного стекла необходимо 75 μл, поэтому для шести покровных покрытий следует смешать 600 μл ADB, 0,6 μл первичного антитела Lamin B и 0,6 μL антитела к дцДНК. Вортекс тщательно.
- Удалите ADB из скважин. На плоскую поверхность приклейте скотчем кусок парафиновой пленки, площадь которого достаточно велика, чтобы уложить все обрабатываемые покровные стекла.
- Для каждого покровного стекла добавьте 75 мкл первичного разведения антител на парафиновую пленку, следя за тем, чтобы в ADB не образовывались пузырьки. Затем положите покровную ячейку вниз на каплю ADB с помощью щипцов.
- Накройте инкубационные крышки крышкой луночного планшета и дайте инкубироваться в течение 1 часа при RT.
- Снимите покровные стекла с парафиновой пленки с помощью щипцов и поместите их обратно в 6-луночный планшет стороной ячейки вверх.
- Промойте покровные стекла 3 раза 2 мл PBS-T, каждый раз покачиваясь в течение 3-5 минут. Удаляйте все PBS-T из лунок после каждой промывки.
- Во время последней промывки приготовьте разведение вторичных антител (1:1000 для обоих соответствующих вторичных антител, Таблица 1). Для каждого покровного стекла необходимо 75 μл, поэтому для шести покровных покрытий следует смешать 600 μл ADB и 0,6 μл обоих вторичных антител, меченных Alexa Fluor. Вортекс тщательно. Максимально прикрывайте вторичное разведение антител от света.
| Антитело | Источник | Компания | Ссылка | ||
| Антитела к маркерам дцДНК (HYB331-01) | Мышь моноклональная | Санта-Крус | СК-58749 | ||
| Козье антимышиное антитело IgG (H+L) с высокой степенью перекрестной адсорбции, Alexa Fluor Plus 488 | Коза | ТермоФишер | А32723 | ||
| Козье антимышиное антитело IgG (H+L) с высокой степенью перекрестной адсорбции, Alexa Fluor Plus 405 | Коза | Инвитроген | А31553 | ||
| Поликлональное антитело к ламину B1 | Кролик | Протеинтек | 12987-1-АП | ||
| Козье антитело против кролика IgG (H+L) с высокой степенью перекрестной адсорбции, Alexa Fluor 594 | Коза | Инвитроген | А11037 | ||
Таблица 1: Антитела. Список всех антител, используемых в этом протоколе.
- Удалите все PBS-T с последней стирки. Инкубируйте покровные стекла во вторичном разведении антител на парафиновой пленке, как на этапе 5, в течение 30 минут при RT. Защищайте от света на этом этапе и на всех остальных этапах. Для экранирования света можно использовать небольшой ящик. Убедитесь, что вы работаете быстро, когда это необходимо, чтобы добавить или удалить растворы из скважин.
- Снимите покровные стекла с парафиновой пленки с помощью щипцов и поместите их обратно в 6-луночный планшет ячейкой вверх.
- Промойте покровные стекла 3 раза 2 мл PBS-T. Удаляйте все PBS-T из лунок после каждой промывки.
- Обезвоживайте предметные стекла с помощью этанола (70%, 90%, 100%). Начните с добавления 2 мл 70% этанола в каждую лунку. Дайте постоять 1-2 минуты и удалите весь этанол из лунок. Повторите то же самое с оставшимся процентом этанола.
- Снимите покровные стекла с лунок с помощью щипцов и дайте им высохнуть на воздухе, защищенном от света, на безворсовой салфетке.
- Установите покровное стекло клеточной стороной вниз на предметное стекло микроскопа, используя 20 мкл монтажного материала на каждое покровное стекло. Дайте высохнуть в течение ночи, защищенное от света место.
6. Получение изображения
- Перед нанесением изображения покройте края покровных лаков тонким слоем прозрачного лака для ногтей (подойдет любая марка или тип). Дайте высохнуть на воздухе в защищенном от света месте.
ПРИМЕЧАНИЕ: Инструкции по использованию микроскопа для получения изображений могут различаться в зависимости от используемого микроскопа. Разрешение камеры на используемом здесь микроскопе составляет 1280 x 960 пикселей. Будет достаточно аналогичного или лучшего разрешения. - Перед тем, как поставить предметное стекло на предметный столик микроскопа, необходимо отрегулировать параметры сохранения файлов. Включите микроскоп и вставьте USB-накопитель. Отрегулируйте параметры сохранения в настройках микроскопа и убедитесь, что все каналы (GFP и RFP) будут сохраняться отдельно, а изображения будут отправляться в правильное место на USB-накопителе.
ПРИМЕЧАНИЕ: Создайте папку на USB-накопителе и присвойте каждой обложке собственное имя для дальнейшего использования. - Перед визуализацией распылите на безворсовую салфетку с 70% этанолом и аккуратно очистите обратную сторону предметных стекол. Аккуратно очистите переднюю часть слайдов, обеспечивая минимальное давление.
- Положите на микроскоп чистое предметное стекло покровными стеклами вниз. Накройте световым щитом коробку.
- Используя объектив с 40-кратным увеличением, используйте соответствующий канал (RFP для используемого здесь антитела к ламину B1) для определения местоположения ядер на экране микроскопа. Для начала отрегулируйте интенсивность света примерно до 50%.
- Чтобы проверить наличие перенасыщенных областей, выберите опцию «Выключить цвет» и убедитесь, что ни на одной области покровного стекла нет красного сигнала в черно-белом режиме. Если красного сигнала много, уменьшите интенсивность света до тех пор, пока не появится минимальный красный сигнал.
ПРИМЕЧАНИЕ: Красный сигнал указывает на перенасыщение. Если ядра кажутся едва заметными, увеличивайте интенсивность с шагом 10% до тех пор, пока не будет достигнута соответствующая интенсивность без пересыщения. - Проверьте все остальные покровные стекла с той же интенсивностью, чтобы убедиться, что они не перенасыщены. Проверьте все покровные листы с помощью другого канала, используя тот же процесс, что и выше (GFP для антител к дцДНК, используемый здесь).
- Запишите интенсивность света для каждого канала. Убедитесь, что интенсивность света для каждого канала остается постоянной на протяжении всего процесса визуализации.
- Сфотографируйте каждый покровный лист по отдельности. Начните с первого канала, сфокусируйте ядра и сделайте снимок.
- Осторожно переключайте каналы и снова сфокусируйте клетки. Когда вы сфокусированы, сделайте снимок.
- После захвата изображений в необходимых каналах (GFP и RFP) выберите Наложение , чтобы наблюдать за объединенным изображением и убедиться, что слайд не двигался во время съемки. Если каналы не перекрываются, повторяйте нужный канал до тех пор, пока изображения не выровняются.
- Сохраните изображение, нажав на иконку флешки . Перейдите в другое место на покровном листе, чтобы продолжить съемку.
ПРИМЕЧАНИЕ: Убедитесь, что каждый раз визуализируется новая область покровного стекла, чтобы избежать повторного захвата одной и той же области. Рекомендуется начинать съемку с верхнего левого угла покровного стекла и двигаться по S-образной схеме, чтобы обеспечить полное покрытие без дублирования.
7. Анализ данных
- Данные, полученные с помощью этого метода, являются визуальными. Изучите изображения на наличие признаков утечки ДНК или ядерного блекбинга. Примеры блеббинга и утечки показаны в разделе репрезентативных результатов.
Результаты
В этом исследовании представлен метод ПЧ для визуализации ядерной пластинки в сочетании с двухцепочечной ДНК (дцДНК). После проведения ПЧ полученные изображения могут быть исследованы на наличие признаков ядерного блеббинга и утечки ДНК.
Обсуждение
Представленный протокол содержит несколько критических этапов, наиболее важным из которых является лечение фиксированных клеток первичными и вторичными антителами. Обеспечение использования первичного антитела хорошего качества против исследуемой мишени с прави...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом Национального института по проблемам старения R03AG064525 ASW. Мы хотели бы поблагодарить доктора Джейсона А. Стюарта за помощь в наставничестве в области техники и лабораторию Хуэй Чен за предоставленный микроскоп. Мы также хотели бы поблагодарить Фабио Мартинона за клеточные линии HeLa, использованные в этих экспериментах.
Материалы
| Name | Company | Catalog Number | Comments |
| 22 mm Square Glass Coverslips | Propper Manufacturing Company | M8710 | Any size or shape can be used as long as they can be fixed to a standard microscope slide. |
| 36.5% Formaldehyde | Sigma Aldrich | F8775 | Fixation Reagent. |
| 75 cm 2 Flasks | Corning | 430725U | For cell culture. |
| Bovine Serum Albinum (BSA) | Fisher Scientific | 9048-46-8 | Antibody dilution buffer. |
| DMEM with 1 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-014-CV | For cell culture. |
| Ethanol (200 Proof) | Decon Laboratories | 2701 | For dehydration of samples before mounting, diluted to make multiple concentrations. |
| EVOS FL Digital Inverted Fluorescence Microscope | Fisher Scientific | 12-563-460 | Imaging. |
| Fish Gelatin | Sigma Aldrich | G7041 | Antibody dilution buffer. |
| Fluoromount-G | Southern Biotech | 0100-01 | Mounting medium to prevent photobleaching. |
| Parafilm (4 in) | Fisher Scientific | 13-374-12 | Any size can be substituted, as long as the coverslips being used can fit. |
| Penicillin-Streptomycin | Gibco | 15-140-122 | For cell culture. |
| Phosphate Buffered Saline (PBS) | N/A | N/A | Made and sterilized in the lab for tissue culture and solutions. |
| Premium Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | For cell culture. |
| Superfrost Premium Microscope Slides | Fisher Scientific | 12-544-7 | Any standard microscope slides can be used. |
| Tissue Culture Treated 6-well Flat Bottom Plates | Falcon | 353046 | For cell culture. |
| TritonX-100 | Thermofisher Scientific | A16046.AP | For washing. |
| Trypsin-EDTA (0.5%) | Gibco | 15-400-054 | For cell culture. |
| Tween 20 | Fisher Scientific | 9005-64-5 | Cell Permeation reagent. |
Ссылки
- Navarro, C. L., et al. New ZMPSTE24 (FACE1) mutations in patients affected with restrictive dermopathy or related progeroid syndromes and mutation update. Eur J Hum Genet. 22 (8), 1002-1011 (2014).
- Dittmer, T. A., Misteli, T. The lamin protein family. Genome Biol. 12 (222), 1-16 (2011).
- Gruenbaum, Y., Margalit, A., Goldman, R. D., Shumaker, D. K., Wilson, K. L. The nuclear lamina comes of age. Nat Rev Mol Cell Biol. 6, 21-31 (2005).
- Navarro, C. L., et al. Lamin A and ZMPSTE24 (FACE-1) defects cause nuclear disorganization and identify restrictive dermopathy as a lethal neonatal laminopathy. Hum Mol Genet. 13 (20), 2493-2503 (2004).
- Barrowman, J., Wiley, P. A., Hudon-Miller, S. E., Hrycyna, C. A., Michaelis, S. Human ZMPSTE24 disease mutations: Residual proteolytic activity correlates with disease severity. Hum Mol Genet. 21 (18), 4084-4093 (2012).
- Richards, S., Muter, J., Ritchie, P., Lattanzi, G., Hutchison, C. The accumulation of un-repairable DNA damage in laminopathy progeria fibroblasts is caused by ROS generation and is prevented by treatment with N-acetyl cysteine. Hum Mol Genet. 20 (20), 3997-4004 (2011).
- Davies, B. S., Fong, L. G., Yang, S. H., Coffinier, C., Young, S. G. The post-translational processing of prelamin A and disease. Annu Rev Genomics Hum Genet. 10, 153-174 (2009).
- Barrowman, J., Hamblet, C., George, C. M., Michaelis, S. Analysis of prelamin A biogenesis reveals the nucleus to be a CaaX processing compartment. Mol Biol Cell. 19, 5398-5408 (2008).
- Young, S., Meta, M., Yang, S. H., Fong, L. G. Prelamin A farnesylation and progeroid syndromes. J Biol Chem. 281 (52), 39741-39745 (2006).
- Houthaeve, G., Robijns, J., Braeckmans, K., De Vos, W. H. Bypassing border control: Nuclear envelope rupture in disease. Physiol. 33 (1), 39-49 (2017).
- Schreiber, K. H., Kennedy, B. K. When lamins go bad: Nuclear structure and disease. Cell. 152 (6), 1365-1375 (2013).
- Fong, L. G., et al. Heterozygosity for Lmna deficiency eliminates the progeria-like phenotypes in Zmpste24-deficient mice. Proc Natl Acad Sci USA. 101 (52), 18111-18116 (2004).
- Pendas, A. M., et al. Defective prelamin A processing and muscular and adipocyte alterations in Zmpste24 metalloproteinase-deficient mice. Nat Genet. 31, 94-99 (2002).
- Goldman, R. D., et al. Accumulation of mutant lamin A causes progressive changes in nuclear architecture in Hutchinson-Gilford progeria syndrome. Proc Natl Acad Sci USA. 101, 8963-8968 (2004).
- Eriksson, M., et al. Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome. Nature. 423, 293-298 (2003).
- Young, S. G., Fong, L. G., Michaelis, S. Thematic review series: Lipid post-translational modifications. Prelamin A, Zmpste24, misshapen cell nuclei, and progeria—new evidence suggesting that protein farnesylation could be important for disease pathogenesis. J Lipid Res. 46 (12), 2531-2558 (2005).
- Worman, H. J., Michaelis, S. Prelamin A and ZMPSTE24 in premature and physiological aging. Nucleus. 14 (1), 1-17 (2023).
- Pande, S., Ghosh, D. K. Nuclear proteostasis imbalance in laminopathy-associated premature aging diseases. FASEB J. 37 (8), 1025-1035 (2023).
- Odell, I. D., Cook, D. Immunofluorescence techniques. J Invest Dermatol. 133 (4), 1-12 (2013).
- Kumar, V. Immunofluorescence and enzyme immunomicroscopy methods. J Immunoassay Immunochem. 21 (2-3), 235-253 (2000).
- Tjaden, A., Giessmann, R. T., Knapp, S., Schroder, M., Muller, S. High-content live-cell multiplex screen for chemogenomic compound annotation based on nuclear morphology. STAR Protoc. 3 (101791), 1-15 (2022).
- Gunn, A. L., Yashchenko, A. I., Dubrulle, J., Johnson, J., Hatch, E. M. A high-content screen reveals new regulators of nuclear membrane stability. Sci Rep. 14, 6013 (2024).
- Yu, L., Liu, P. Cytosolic DNA sensing by cGAS: Regulation, function, and human diseases. Nat Rev Mol Cell Biol. 6 (170), 1-14 (2021).
- Odinammadu, K. O., et al. The farnesyl transferase inhibitor (FTI) lonafarnib improves nuclear morphology in ZMPSTE24-deficient fibroblasts from patients with the progeroid disorder MAD-B. Nucleus. 14 (1), 1-14 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены