A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איתור בלב גרעיני ודליפת DNA בתאי יונקים על ידי אימונופלואורסצנציה
In This Article
Summary
הפרעות למינופתיה מובילות לעתים קרובות לשינויים במעטפת הגרעין, מה שעלול לגרום לבליבינג גרעיני ודליפה. מחקר זה מציג שיטה אימונופלואורסצנטית להדמיית הלמינה הגרעינית יחד עם DNA דו-גדילי (dsDNA), המספקת אמצעי להערכת מבנה ושלמות גרעין בתאי יונקים.
Abstract
הלמינה הגרעינית היא רשת של חוטים העומדים בבסיס הממברנה הגרעינית, המורכבת מלמינים וחלבונים הקשורים ללמין. הוא ממלא תפקידים קריטיים בארכיטקטורה גרעינית, מיקום נקבוביות גרעיניות, ויסות ביטוי גנים, ארגון כרומטין, שכפול DNA ותיקון DNA. מוטציות בגנים המעורבים בביטוי או בעיבוד לאחר התרגום של חלבוני למין גורמות להפרעות גנטיות הידועות בשם למינופתיה. באופן ספציפי, מוטציות בגנים LMNA או ZMPSTE24 עלולות להוביל להצטברות של צורות לא מעובדות לחלוטין של למין A השומרות על קבוצות פרנזיל ומתיל, אשר נעדרות בלאמין A מעובד במלואו. חלבוני למין A שעובדו באופן לא מלא מתמקמים בקרום הגרעיני הפנימי במקום הלמינה הגרעינית, שם שוכן למין A בוגר. חלבוני למין שגויים משבשים באופן עמוק את התפקוד והמבנה הגרעיני, ולעתים קרובות גורמים לבלבל גרעיני. במקרים חמורים יכול להתרחש קרע גרעיני, הגורם לאובדן מידור ודליפה של DNA גנומי לציטוזול. ניתן לזהות מבנה גרעיני חריג ואובדן מידור באמצעות אימונופלואורסצנציה עקיפה (IF) על תאים קבועים. מחקר זה מתאר שיטה כזו, תוך שימוש בנוגדנים ספציפיים כנגד חלבון למין ו-DNA דו-גדילי (dsDNA) כדי לדמיין בו זמנית את המעטפת הגרעינית וה-DNA. גישה זו מאפשרת הערכה מהירה של שלמות המבנה הגרעיני ודליפה פוטנציאלית של DNA גרעיני לציטוזול.
Introduction
הלמינה הגרעינית היא רשת של חוטים העומדת בבסיס הממברנה הגרעינית ומורכבת מחלבונים הנקראים למין. הלמינה הגרעינית ממלאת תפקידים חיוניים בארכיטקטורה גרעינית, מיקום נקבוביות גרעיניות, ויסות ביטוי גנים, ארגון כרומטין, שכפול DNA ותיקון DNA 1,2,3. מוטציות בגנים הממלאים תפקיד בביטוי חלבוני הלמין מובילות להפרעות גנטיות הנקראות למינופתיות3.
דרמופתיה מגבילה (RD) היא הפרעת למינופתיה חמורה הנגרמת בעיקר על ידי מוטציות הטרוזיגוטיות מורכבות היוצרות קודוני סיום מוקדמים בגןZMPSTE24 4, מה שמוביל להיעדר ZMPSTE24 המטאלופרוטיז. למינופתיה זו מאופיינת בפיגור בצמיחה תוך רחמית, עור מתוח ונוקשה, פה קטן, שיער דק ופגמים במינרליזציה של העצם1. חולי RD בדרך כלל אינם חיים מעבר לשבוע הראשון לחייהם עקב אי ספיקת ריאות1. שתי הפרעות למינופתיה אחרות הידועות כתסמונת האצ'ינסון-גילפורד פרוגריה לא טיפוסית (AT-HGPS) ודיספלזיה מנדיבולואקרלית מסוג B (MAD-B) כרוכות בביטוי ZMPSTE24 מופחת וקשורות לירידה בתוחלת החיים ומראות דמיון להפרעות הזדקנות מוקדמות5. ZMPSTE24 הפרוטאז המושפע מהלמינופתיות הללו חיוני בשינוי שלאחר התרגום של למין A, שהוא מרכיב קריטי בלמינה הגרעינית. מחסור ZMPSTE24 גורם להצטברות של צורה לא מעובדת של פרנזיל של למין A, הידועה בשם פרלמיןA 2.
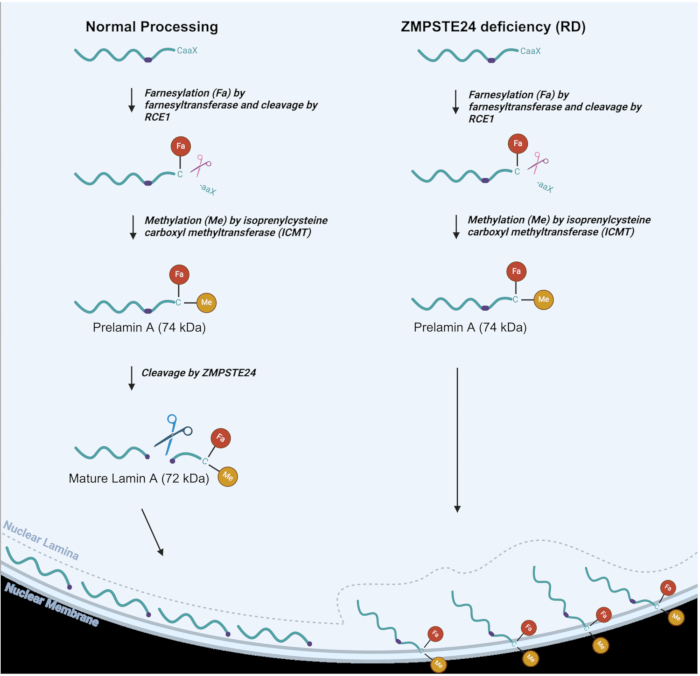
איור 1: עיבוד למין A בנורמלי לעומת תאי RD. מסלול עיבוד למין A בתאים נורמליים (משמאל) ועיבוד למין A שונה ב-RD, או תאים חסרי ZMPSTE (מימין). קבוצות Farnesyl (Fa) ו-methyl (Me) מסומנות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
כפי שניתן לראות באיור 1, בעיבוד רגיל של למין A, קבוצת פרנזיל (שומנים) מחוברת לשאריות ציסטאין ליד מסוף C, ואחריה מחשוף פרוטאוליטי של שלוש חומצות אמינו C-terminal 3,6. לאחר מכן שאריות הציסטאין עוברות מתילציה. שני שינויים אלה מאפשרים למקד פרלמין A לממברנה הגרעינית הפנימית2. לאחר מכן ZMPSTE24 מבצע תגובת מחשוף לפיה 15 חומצות האמינו האחרונות C-terminal, יחד עם קבוצות הפארנזיל והמתיל, מוסרות כדי לייצר חלבון Lamin A בוגר, המועבר ללמינה הגרעינית 6,7,8. ב-RD, AT-HGPS ו-MAD-B, השלב האחרון של העיבוד אינו מתרחש ביעילות מכיוון שהמטאלופרוטאינאז ZMPSTE24 חסר או אינו מתפקד במלואו 8,9. התוצאה היא הצטברות של פרלמין A, שנשאר פרנזילציה ומתיליציה לצמיתות9. הקבוצות האחרונות האלה גורמות לפרלמין A להיצמד לממברנה הגרעינית הפנימית במקום להתמקם בלמינה הגרעינית, שם למין A בוגר אמור לשכון בסופו של דבר, כפי שניתן לראות באיור 1. לפיכך, למחסור ב-ZMPSTE יש השפעות עמוקות על מגוון פונקציות גרעיניות, יחד עם המבנה הגרעיני 10,11,12,13,14,15. שינויים אלה במבנה הגרעיני עשויים לכלול חבטות גרעיניות ואפילו קרע גרעיני שעלול לגרום לדליפת DNA לתוך הציטוזול וכן לחדירת ציטוזול לגרעין. גרעינים בעלי צורה חריגה הם אכן סימן היכר של הפרעות למינופתיה, יחד עם פנוטיפים רבים אחרים הנגרמים על ידי עיבוד פרלמין A פגום16,17. פגמים בלמינה הגרעינית מובילים למספר רב של השפעות מזיקות, כולל מיקום שגוי של בקרת איכות חלבון גרעיני וחלבוני תיקון DNA בנוקלאופלזמה, אשר, בתורו, גורם לפגמים רבים בתפקוד הגרעיני18. חשוב שתהיה טכניקה פשוטה שיכולה לעזור לזהות ולנטר את סימני ההיכר הללו של למינופתיה כדי להקל על המחקר בפיתוח גישות טיפוליות שמטרתן לשפר את הפנוטיפים של הלמינופתיה. עבור עכברים עם למינופתיה, הוכח כי חיסול הבלבל הגרעיני נמצא בקורלציה עם חיסול כללי של פנוטיפים של למינופתיה16. טכניקה המאפשרת ניטור שלמות גרעינית בתאים אנושיים יכולה לשפר את המחקר של טיפולים פוטנציאליים לחיסול או שיפור משמעותי של פנוטיפים של מחלות.
אימונופלואורסצנציה עקיפה (IF) היא טכניקה רגישה ונמצאת בשימוש נרחב המשתמשת הן בנוגדנים ראשוניים ללא תווית והן בנוגדנים משניים המסומנים בפלואורופור המזהה את הנוגדן העיקרי כדי לזהות מטרה מעניינת19. שיטות IF יכולות לספק אמצעי רב עוצמה להמחשת רכיבים ומבנים תוך-תאיים ספציפיים. ייתכן גם שיותר ממולקולת נוגדן משנית אחת עשויה לקיים אינטראקציה עם הנוגדן הראשוני, וכתוצאה מכך להגביר את האות19. IF עקיף היא טכניקה רב-תכליתית המאפשרת גם זיהוי של נוגדנים ראשוניים מרובים עם קבוצה קטנה יחסית של נוגדנים משניים מכיוון שנוגדנים משניים מועלים כנגד תחום ה-Fc של הנוגדן הראשוני, השמור בתוך מין19.
מאמר זה מתאר שיטה עקיפה (IF) להערכת דליפה גרעינית ודליפת DNA בתאים עם מחסור ZMPSTE24, תוך שימוש בנוגדנים כנגד DNA דו-גדילי (dsDNA) ולמין B1 כדי לזהות DNA והלמינה הגרעינית, בהתאמה. כדי להדגים את התועלת של גישה זו, ההליך יושם על קו תאי HeLa עם ביטוי ZMPSTE24, כמו גם קו תאי HeLa המבטא ZMPSTE24, והתוצאות עבור שני קווי התאים הושוו.
Protocol
פרטי הריאגנטים והציוד המשמש מפורטים בטבלת החומרים.
1. הכנת חומרים
- חיטוי לפחות עשרה כיסויי זכוכית מרובעים בגודל 22 מ"מ על 22 מ"מ ומלקחיים לפני תאי הציפוי על החלקות הכיסוי.
2. הכנת הפתרונות
- מדיה משלימה: יש להכין 500 מ"ל של מדיום הנשר המותאם (DMEM) של Dulbecco עם 10% סרום בקר עוברי (FBS), 100 יחידות/מ"ל פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין.
- מאגר דילול נוגדנים (ADB): ממיסים 2 גרם של אלבומין בסרום בקר (BSA) ו-1 גרם של ג'לטין דגים ב-80 מ"ל של מי מלח עם חוצץ פוספט (PBS). הביאו ל-100 מ"ל עם PBS לאחר המסת BSA וג'לטין דגים.
- 1x PBS-Tween (PBS-T): הכן 500 מ"ל של PBS ו-0.5 מ"ל של Tween. מניחים באמבט מים של 37 מעלות צלזיוס עד שניתן לערבב בקלות את טווין בתמיסה.
3. גידול התאים הרצויים
הערה: תאי HeLa גודלו בפרוטוקול זה למפגש בתוך בקבוק T75.
- רססו שישה כיסויים עם 70% אתנול והניחו להם להתייבש באוויר על מגבון נטול מוך. הנח כיסויים בצלחת סטרילית של 6 בארות בעזרת מלקחיים, כיסוי אחד לכל באר.
- הוסף 2 מ"ל של DMEM בתוספת לכל באר בצלחת 6 הבארות.
- שאפו מדיה מהתאים ושטפו את התאים על ידי הוספת 15 מ"ל PBS לבקבוק, תוך ערבוב עדין. שאפו את ה-PBS והוסיפו 2 מ"ל של טריפסין-EDTA (טריפסין).
- מצפים את התאים בטריפסין ומניחים את הבקבוק בחזרה לאינקובטור לח של 37 מעלות צלזיוס ו-5% CO2 למשך 2 דקות כדי לאפשר לתאים להתנתק מהבקבוק.
- הוסף 8 מ"ל של DMEM בתוספת לבקבוק כדי לאסוף את התאים הטריפסיניים. פיפטה למעלה ולמטה כמה פעמים כדי להפריד בין תאים גושים. אוספים את תרחיף התאים בבקבוק ומניחים אותו בצינור פוליסטירן של 15 מ"ל.
- ספרו את התאים באמצעות המוציטומטר.
- הוסף 500,000 תאים, טיפה אחר טיפה, ישירות על כל אחד מהחלקות הכיסוי בצלחת 6 הבארות. אפשר לתאים לגדול בן לילה ב-37 מעלות צלזיוס ו-5% CO2 באינקובטור לח.
4. קיבוע תאים וחדירות
- הכן את תמיסת הפורמלדהיד 4% טרי לפני השימוש: הוסף 2 מ"ל של תמיסת פורמלדהיד 37.5% לתוך 18 מ"ל של PBS. מערבבים היטב.
- הכן את תמיסת החדירות טרייה לפני השימוש: הוסף 100 מיקרוליטר של Triton-X ל-20 מ"ל PBS. מניחים לדגור באמבט מים של 37 מעלות צלזיוס למשך מספר דקות עד שהטריטון-X מתמוסס בתמיסה. מערבבים היטב.
- שאפו את המדיה בבארות הצלחת. שטפו תאים פעם אחת עם 2 מ"ל PBS. שאפו את כל ה-PBS מהבארות.
- הוסף 2 מ"ל של תמיסת פורמלדהיד 4% לכל באר. הניחו לשבת במשך 10 דקות בטמפרטורת החדר (RT). שאפו 4% פורמלדהיד לחלוטין מהבארות.
- שטפו תאים 3 פעמים עם 2 מ"ל PBS. הסר PBS לחלוטין מהבארות לאחר כל שטיפה.
- הוסף 2 מ"ל של תמיסת חדירות לכל באר. הניחו לשבת במשך 10 דקות ב-RT. שאפו את תמיסת החדירות לחלוטין.
- שטפו תאים 3 פעמים עם 2 מ"ל PBS. שאפו PBS לחלוטין לאחר שתי השטיפות הראשונות, והשאירו את ה-PBS בבארות לאחר הכביסה השלישית.
הערה: ניתן לאחסן תאים בשטיפת ה-PBS האחרונה ב-4 מעלות צלזיוס למשך מספר שבועות לאחר שלב זה, מה שמבטיח שהצלחת אטומה בסרט פרפין כדי למנוע אידוי נוזלים. אם ניתן להמשיך בהליך, ניתן לדלג על שלב זה.
5. צביעה אימונופלואורסצנטית
- הסר את כל PBS מבארות. חסום תאים על ידי הוספת 2 מ"ל ADB לכל באר ודגירה ב- RT, מתנדנד במשך 30 דקות.
- לקראת סוף זמן החסימה של 30 דקות, ערבבו את דילול הנוגדנים העיקרי ב-ADB (דילול של 1:1,000 עבור נוגדנים למין B1 ו-dsDNA, טבלה 1). יש צורך ב-75 מיקרוליטר עבור כל כיסוי, ולכן יש לערבב 600 מיקרוליטר של ADB, 0.6 מיקרוליטר של נוגדן ראשוני Lamin B ו-0.6 מיקרוליטר של נוגדן dsDNA עבור שש תלושי כיסוי. מערבולת ביסודיות.
- הסר ADB מהבארות. על משטח ישר, הדביקו פיסת סרט פרפין גדולה מספיק בשטח כדי להניח את כל החלקות הכיסוי המעובדות.
- עבור כל כיסוי, הוסף 75 מיקרוליטר של דילול נוגדנים ראשוני על סרט הפרפין, וודא שלא ייזרקו בועות ב-ADB. לאחר מכן, הנח את צד תא ההחלקה כלפי מטה על הטיפה של ADB באמצעות מלקחיים.
- מכסים את כיסויי הדגירה במכסה צלחת הבאר ומניחים לדגור למשך שעה ב-RT.
- הסר את החלקות הכיסוי מסרט הפרפין באמצעות מלקחיים והנח את החלקות הכיסוי בחזרה לתוך צלחת 6 הבארות, כשצד התא פונה כלפי מעלה.
- שטפו את הכיסויים 3 פעמים עם 2 מ"ל PBS-T, נדנדה במשך 3-5 דקות בכל פעם. הסר את כל PBS-T מהבארות לאחר כל שטיפה.
- במהלך השטיפה האחרונה, הכן את דילול הנוגדנים המשני (1:1,000 עבור שני הנוגדנים המשניים בהתאמה, טבלה 1). יש צורך ב-75 מיקרוליטר עבור כל כיסוי, ולכן יש לערבב 600 מיקרוליטר של ADB ו-0.6 מיקרוליטר של שני הנוגדנים המשניים המתויגים Alexa Fluor עבור שישה כיסויים. מערבולת ביסודיות. כסה את דילול הנוגדנים המשני מאור ככל האפשר.
| נוגדן | מקור | חברה | הפניה | ||
| נוגדן סמן dsDNA (HYB331-01) | עכבר חד שבטי | סנטה קרוז | SC-58749 | ||
| עז נגד עכבר IgG (H+L) נוגדן משני בעל ספיחה צולבת גבוהה, Alexa Fluor Plus 488 | עז | תרמו-פישר | א32723 | ||
| עז נגד עכבר IgG (H+L) נוגדן משני בעל ספיחה צולבת גבוהה, Alexa Fluor Plus 405 | עז | Invitrogen | א31553 | ||
| נוגדן רב-שבטי Lamin B1 | ארנב | פרוטאינטק | 12987-1-AP | ||
| עיזים נגד ארנב IgG (H+L) נוגדן משני בעל ספיחה צולבת גבוהה, Alexa Fluor 594 | עז | Invitrogen | א11037 | ||
טבלה 1: נוגדנים. רשימה של כל הנוגדנים המשמשים בפרוטוקול זה.
- הסר את כל PBS-T מהכביסה האחרונה. דגרו את החלקות הכיסוי בדילול הנוגדנים המשני על סרט פרפין, כמו בשלב 5, למשך 30 דקות ב-RT. הגן מפני אור בשלב זה ובכל השלבים הנותרים. ניתן להשתמש בקופסה קטנה כדי להגן על אור. הקפד לעבוד במהירות בעת הצורך כדי להוסיף או להסיר פתרונות מהבארות.
- הסר את החלקות הכיסוי מסרט הפרפין באמצעות מלקחיים והנח את הכיסוי בחזרה לצלחת 6 הבארות, כשצד התא כלפי מעלה.
- שטפו את הכיסויים 3 פעמים עם 2 מ"ל PBS-T. הסר את כל PBS-T מהבארות לאחר כל שטיפה.
- ייבשו את השקופיות בעזרת סדרת אתנול (70%, 90%, 100%). התחל בהוספת 2 מ"ל של 70% אתנול לכל באר. הניחו לשבת במשך 1-2 דקות, והוציאו את כל האתנול מהבארות. חזור על הפעולה עם אחוזי האתנול הנותרים.
- הסר את הכיסויים מהבארות באמצעות מלקחיים ותן להם להתייבש באוויר, מוגנים מפני אור, על מגבון נטול מוך.
- התקן את צד התא של הכיסוי כלפי מטה על שקופיות מיקרוסקופ זכוכית באמצעות 20 מיקרוליטר של אמצעי הרכבה לכל כיסוי. יש להניח לייבוש למשך הלילה, מוגן מאור.
6. רכישת תמונות
- לפני ההדמיה יש לצפות את שולי הכיסויים בשכבה דקה של לק שקוף (כל מותג או סוג יספיקו). יש להניח לייבוש באוויר, מוגן מפני אור.
הערה: ההוראות לשימוש במיקרוסקופ להדמיה ישתנו, בהתאם למיקרוסקופ בו נעשה שימוש. הרזולוציה של המצלמה במיקרוסקופ המשמשת כאן היא 1280 x 960 פיקסלים. רזולוציה דומה או טובה יותר תספיק. - לפני שמציבים שקופית על במת המיקרוסקופ, יש להתאים את הגדרות שמירת הקבצים. הפעל את המיקרוסקופ והכנס כונן USB. התאם את הגדרות השמירה בהגדרות המיקרוסקופ וודא שכל הערוצים (GFP ו- RFP) יישמרו בנפרד ושהתמונות עוברות למיקום הנכון בכונן ה- USB.
הערה: צור תיקייה בכונן ה-USB ותן לכל תלוש כיסוי שם משלו לעיון עתידי. - לפני ההדמיה, רססו מגבון נטול מוך עם 70% אתנול ונקו בעדינות את החלק האחורי של השקופיות. נקו בעדינות את החלק הקדמי של המגלשות, והקפידו על הפעלת לחץ מינימלי מאוד.
- הנח שקופית נקייה על המיקרוסקופ, הכיסוי מחליק כלפי מטה. מכסים בקופסת מגן האור.
- באמצעות עדשה אובייקטיבית פי 40, השתמש בערוץ המתאים (RFP לנוגדני הלאמין B1 המשמש כאן) כדי לאתר את הגרעינים על מסך המיקרוסקופ. כוונן את עוצמת האור לסביבות 50% כדי להתחיל.
- כדי לבדוק אם יש אזורים רוויים יתר על המידה, בחר באפשרות Color Off וודא שלאף אזור על פני הכיסוי אין אות אדום בהגדרה שחור-לבן. אם יש הרבה אות אדום, הורד את עוצמת האור עד להצגת האות האדום המינימלי.
הערה: אות אדום מצביע על רוויה יתר. אם הגרעינים נראים בקושי נראים לעין, הגדילו את העוצמה במרווחים של 10% עד להשגת עוצמה מתאימה ללא רוויה יתר. - בדוק את כל שאר הכיסויים באותה עוצמה כדי לוודא שהם אינם רוויים יתר על המידה. בדוק את כל תלושי הכיסוי עם הערוץ השני באותו תהליך כמו לעיל (GFP עבור נוגדן dsDNA המשמש כאן).
- רשום עוצמות אור עבור כל ערוץ. ודא שכל עוצמות האור עבור כל ערוץ נשמרות קבועות לאורך כל תהליך ההדמיה.
- דמיין כל כריכה בנפרד. התחל עם הערוץ הראשון, מקד את הגרעינים וצלם את התמונה.
- החלף בזהירות ערוצים והביא את התאים שוב למיקוד. כאשר אתה ממוקד, צלם את התמונה.
- לאחר לכידת תמונות בערוצים הדרושים (GFP ו-RFP), בחר Overlay כדי לצפות בתמונה הממוזגת ולוודא שהשקופית לא זזה בעת צילום התמונה. אם הערוצים אינם חופפים, בצעו שוב את הערוץ הדרוש עד שהתמונות יתיישרו.
- שמור את התמונה על ידי לחיצה על סמל כונן הבזק . עבור למקום אחר על הכיסוי כדי להמשיך בהדמיה.
הערה: ודא שאזור אחר של הכיסוי מצולם בכל פעם כדי להימנע מלכידת אותו אזור שוב ושוב. מומלץ להתחיל לצלם בפינה השמאלית העליונה של הכיסוי ולנוע בתבנית "S" כדי להבטיח כיסוי מלא ללא שכפול.
7. ניתוח נתונים
- הנתונים המתקבלים בשיטה זו הם חזותיים. בדוק את התמונות לאיתור סימנים של דליפת DNA או בלבל גרעיני. דוגמאות לבלבלינג ודליפה מוצגות בסעיף התוצאות המייצגות.
תוצאות
מחקר זה מציג שיטת IF להדמיית הלמינה הגרעינית בשילוב עם DNA דו-גדילי (dsDNA). לאחר ביצוע IF, ניתן לבדוק את התמונות שצולמו לאיתור סימנים של בלבל גרעיני ודליפת DNA.
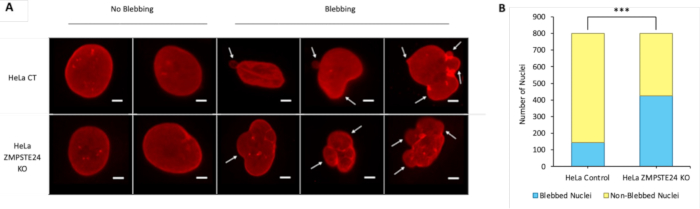
איור 2
Discussion
הפרוטוקול המוצג מכיל מספר שלבים קריטיים, החשוב ביותר הוא הטיפול בתאים הקבועים בנוגדנים ראשוניים ומשניים. הבטחת השימוש בנוגדנים ראשוניים באיכות טובה כנגד היעד המבוקש עם נוגדן משני תואם נכון עם פלואורופורים בטווח המיקרוסקופ בו נעשה שימוש תניב תוצאות מיטביות19
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק המכון הלאומי להזדקנות R03AG064525 ל-ASW. אנו רוצים להודות לד"ר ג'ייסון א. סטיוארט על העזרה בהדרכת הטכניקה, ולמעבדת הוי צ'ן על אספקת המיקרוסקופ שבו השתמשו. אנו גם רוצים להודות לפאביו מרטינון על קווי תאי HeLa ששימשו בניסויים אלה.
Materials
| Name | Company | Catalog Number | Comments |
| 22 mm Square Glass Coverslips | Propper Manufacturing Company | M8710 | Any size or shape can be used as long as they can be fixed to a standard microscope slide. |
| 36.5% Formaldehyde | Sigma Aldrich | F8775 | Fixation Reagent. |
| 75 cm 2 Flasks | Corning | 430725U | For cell culture. |
| Bovine Serum Albinum (BSA) | Fisher Scientific | 9048-46-8 | Antibody dilution buffer. |
| DMEM with 1 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-014-CV | For cell culture. |
| Ethanol (200 Proof) | Decon Laboratories | 2701 | For dehydration of samples before mounting, diluted to make multiple concentrations. |
| EVOS FL Digital Inverted Fluorescence Microscope | Fisher Scientific | 12-563-460 | Imaging. |
| Fish Gelatin | Sigma Aldrich | G7041 | Antibody dilution buffer. |
| Fluoromount-G | Southern Biotech | 0100-01 | Mounting medium to prevent photobleaching. |
| Parafilm (4 in) | Fisher Scientific | 13-374-12 | Any size can be substituted, as long as the coverslips being used can fit. |
| Penicillin-Streptomycin | Gibco | 15-140-122 | For cell culture. |
| Phosphate Buffered Saline (PBS) | N/A | N/A | Made and sterilized in the lab for tissue culture and solutions. |
| Premium Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | For cell culture. |
| Superfrost Premium Microscope Slides | Fisher Scientific | 12-544-7 | Any standard microscope slides can be used. |
| Tissue Culture Treated 6-well Flat Bottom Plates | Falcon | 353046 | For cell culture. |
| TritonX-100 | Thermofisher Scientific | A16046.AP | For washing. |
| Trypsin-EDTA (0.5%) | Gibco | 15-400-054 | For cell culture. |
| Tween 20 | Fisher Scientific | 9005-64-5 | Cell Permeation reagent. |
References
- Navarro, C. L., et al. New ZMPSTE24 (FACE1) mutations in patients affected with restrictive dermopathy or related progeroid syndromes and mutation update. Eur J Hum Genet. 22 (8), 1002-1011 (2014).
- Dittmer, T. A., Misteli, T. The lamin protein family. Genome Biol. 12 (222), 1-16 (2011).
- Gruenbaum, Y., Margalit, A., Goldman, R. D., Shumaker, D. K., Wilson, K. L. The nuclear lamina comes of age. Nat Rev Mol Cell Biol. 6, 21-31 (2005).
- Navarro, C. L., et al. Lamin A and ZMPSTE24 (FACE-1) defects cause nuclear disorganization and identify restrictive dermopathy as a lethal neonatal laminopathy. Hum Mol Genet. 13 (20), 2493-2503 (2004).
- Barrowman, J., Wiley, P. A., Hudon-Miller, S. E., Hrycyna, C. A., Michaelis, S. Human ZMPSTE24 disease mutations: Residual proteolytic activity correlates with disease severity. Hum Mol Genet. 21 (18), 4084-4093 (2012).
- Richards, S., Muter, J., Ritchie, P., Lattanzi, G., Hutchison, C. The accumulation of un-repairable DNA damage in laminopathy progeria fibroblasts is caused by ROS generation and is prevented by treatment with N-acetyl cysteine. Hum Mol Genet. 20 (20), 3997-4004 (2011).
- Davies, B. S., Fong, L. G., Yang, S. H., Coffinier, C., Young, S. G. The post-translational processing of prelamin A and disease. Annu Rev Genomics Hum Genet. 10, 153-174 (2009).
- Barrowman, J., Hamblet, C., George, C. M., Michaelis, S. Analysis of prelamin A biogenesis reveals the nucleus to be a CaaX processing compartment. Mol Biol Cell. 19, 5398-5408 (2008).
- Young, S., Meta, M., Yang, S. H., Fong, L. G. Prelamin A farnesylation and progeroid syndromes. J Biol Chem. 281 (52), 39741-39745 (2006).
- Houthaeve, G., Robijns, J., Braeckmans, K., De Vos, W. H. Bypassing border control: Nuclear envelope rupture in disease. Physiol. 33 (1), 39-49 (2017).
- Schreiber, K. H., Kennedy, B. K. When lamins go bad: Nuclear structure and disease. Cell. 152 (6), 1365-1375 (2013).
- Fong, L. G., et al. Heterozygosity for Lmna deficiency eliminates the progeria-like phenotypes in Zmpste24-deficient mice. Proc Natl Acad Sci USA. 101 (52), 18111-18116 (2004).
- Pendas, A. M., et al. Defective prelamin A processing and muscular and adipocyte alterations in Zmpste24 metalloproteinase-deficient mice. Nat Genet. 31, 94-99 (2002).
- Goldman, R. D., et al. Accumulation of mutant lamin A causes progressive changes in nuclear architecture in Hutchinson-Gilford progeria syndrome. Proc Natl Acad Sci USA. 101, 8963-8968 (2004).
- Eriksson, M., et al. Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome. Nature. 423, 293-298 (2003).
- Young, S. G., Fong, L. G., Michaelis, S. Thematic review series: Lipid post-translational modifications. Prelamin A, Zmpste24, misshapen cell nuclei, and progeria—new evidence suggesting that protein farnesylation could be important for disease pathogenesis. J Lipid Res. 46 (12), 2531-2558 (2005).
- Worman, H. J., Michaelis, S. Prelamin A and ZMPSTE24 in premature and physiological aging. Nucleus. 14 (1), 1-17 (2023).
- Pande, S., Ghosh, D. K. Nuclear proteostasis imbalance in laminopathy-associated premature aging diseases. FASEB J. 37 (8), 1025-1035 (2023).
- Odell, I. D., Cook, D. Immunofluorescence techniques. J Invest Dermatol. 133 (4), 1-12 (2013).
- Kumar, V. Immunofluorescence and enzyme immunomicroscopy methods. J Immunoassay Immunochem. 21 (2-3), 235-253 (2000).
- Tjaden, A., Giessmann, R. T., Knapp, S., Schroder, M., Muller, S. High-content live-cell multiplex screen for chemogenomic compound annotation based on nuclear morphology. STAR Protoc. 3 (101791), 1-15 (2022).
- Gunn, A. L., Yashchenko, A. I., Dubrulle, J., Johnson, J., Hatch, E. M. A high-content screen reveals new regulators of nuclear membrane stability. Sci Rep. 14, 6013 (2024).
- Yu, L., Liu, P. Cytosolic DNA sensing by cGAS: Regulation, function, and human diseases. Nat Rev Mol Cell Biol. 6 (170), 1-14 (2021).
- Odinammadu, K. O., et al. The farnesyl transferase inhibitor (FTI) lonafarnib improves nuclear morphology in ZMPSTE24-deficient fibroblasts from patients with the progeroid disorder MAD-B. Nucleus. 14 (1), 1-14 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved