Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İmmünofloresan ile Memeli Hücrelerinde Nükleer Kanama ve DNA Sızıntısının Tespiti
Bu Makalede
Özet
Laminopati bozuklukları genellikle nükleer zarfta değişikliklere yol açar ve bu da nükleer kanama ve sızıntıya neden olabilir. Bu çalışma, memeli hücrelerinde nükleer yapıyı ve bütünlüğü değerlendirmek için bir araç sağlayan, çift sarmallı DNA (dsDNA) ile birlikte nükleer laminayı görselleştirmek için bir immünofloresan yöntemi sunmaktadır.
Özet
Nükleer lamina, laminler ve lamin ile ilişkili proteinlerden oluşan, nükleer zarın altında yatan bir filament ağıdır. Nükleer mimari, nükleer gözenek konumlandırma, gen ekspresyon düzenlemesi, kromatin organizasyonu, DNA replikasyonu ve DNA onarımında kritik roller oynar. Lamin proteinlerinin ekspresyonu veya translasyon sonrası işlenmesinde yer alan genlerdeki mutasyonlar, laminopatiler olarak bilinen genetik bozukluklara neden olur. Spesifik olarak, LMNA veya ZMPSTE24 genlerindeki mutasyonlar, tamamen işlenmiş lamin A'da bulunmayan farnezil ve metil gruplarını tutan tam olarak işlenmemiş lamin A formlarının birikmesine yol açabilir. Bu eksik işlenmiş lamin A proteinleri, olgun lamin A'nın bulunduğu nükleer lamina yerine iç nükleer zara lokalize olur. Yanlış lokalize lamin proteinleri, nükleer işlevi ve yapıyı derinden bozar ve genellikle nükleer kanamaya neden olur. Ciddi vakalarda, nükleer yırtılma meydana gelebilir, bu da bölümlere ayırma kaybına ve genomik DNA'nın sitozole sızmasına neden olabilir. Anormal nükleer yapı ve bölümlendirme kaybı, sabit hücreler üzerinde dolaylı immünofloresan (IF) ile tanımlanabilir. Bu çalışma, nükleer zarfı ve DNA'yı aynı anda görselleştirmek için bir lamin proteinine ve çift sarmallı DNA'ya (dsDNA) karşı spesifik antikorlar kullanan böyle bir yöntemi özetlemektedir. Bu yaklaşım, nükleer yapısal bütünlüğün ve nükleer DNA'nın sitozole potansiyel sızıntısının hızlı bir şekilde değerlendirilmesini sağlar.
Giriş
Nükleer lamina, nükleer zarın altında yatan ve lamin adı verilen proteinlerden oluşan bir filament ağıdır. Nükleer lamina, nükleer mimaride, nükleer gözeneklerin konumlandırılmasında, gen ekspresyonunun düzenlenmesinde, kromatin organizasyonunda, DNA replikasyonunda ve DNA onarımında önemli roller oynar 1,2,3. Lamin proteinlerinin ekspresyonunda rol oynayan genlerdeki mutasyonlar laminopati adı verilen genetik bozukluklara yol açar3.
Restriktif dermopati (RD), ağırlıklı olarak ZMPSTE24 gen4'te erken sonlandırma kodonları oluşturan ve metalloprotaz ZMPSTE24 yokluğuna yol açan bileşik heterozigot mutasyonların neden olduğu ciddi bir laminopati bozukluğudur. Bu laminopati intrauterin gelişme geriliği, sıkı, sert cilt, küçük boyutlu ağız, ince kıl ve kemik mineralizasyon kusurları ile karakterizedir1. RD hastaları genellikle akciğer yetmezliği nedeniyle yaşamlarının ilk haftasını geçemezler1. Atipik Hutchinson-Gilford Progeria Sendromu (AT-HGPS) ve Mandibuloakral displazi tip B (MAD-B) olarak bilinen diğer iki laminopati bozukluğu, azalmış ZMPSTE24 ekspresyonunu içerir ve azalmış yaşam süresi ile ilişkilidir ve erken yaşlanma bozukluklarıyla benzerlikler gösterir5. Bu laminopatilerde etkilenen ZMPSTE24 proteaz, nükleer laminanın kritik bir bileşeni olan lamin A'nın translasyon sonrası modifikasyonunda hayati öneme sahiptir. ZMPSTE24 eksikliği, prelamin A2 olarak bilinen, eksik işlenmiş bir lamin A formunun birikmesine neden olur.
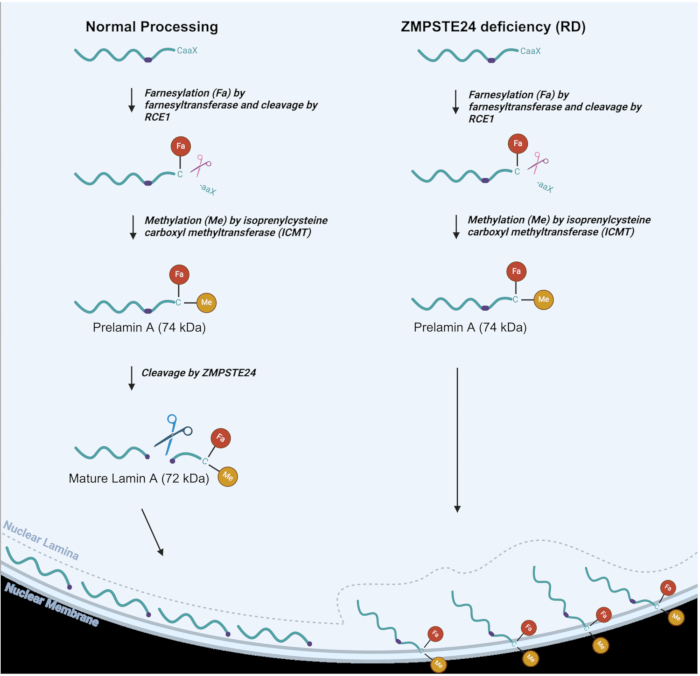
Şekil 1: Lamin A işlemi normal vs. RD hücreleri. Normal hücrelerde Lamin A işleme yolu (solda) ve RD'de değiştirilmiş lamin A işleme veya ZMPSTE eksikliği olan hücrelerde (sağda). Farnezil (Fa) ve metil (Me) grupları belirtilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 1'de görüldüğü gibi, normal lamin A işleminde, C-terminalinin yakınındaki bir sistein kalıntısına bir farnezil (lipid) grubu bağlanır, ardından üç C-terminal amino asidin 3,6 proteolitik bölünmesi gelir. Sistein kalıntısı daha sonra metillenir. Bu iki modifikasyon, prelamin A'nın iç nükleer zar2'ye hedeflenmesine izin verir. ZMPSTE24 daha sonra, son 15 C-terminal amino asidin, farnezil ve metil grupları ile birlikte, nükleer lamina 6,7,8'e iletilen olgun Lamin A proteini üretmek için uzaklaştırıldığı bir bölünme reaksiyonu gerçekleştirir. RD, AT-HGPS ve MAD-B'de, ZMPSTE24 metalloproteinaz eksik olduğundan veya tam olarak işlevsel olmadığından işlemenin son adımı etkili bir şekilde gerçekleşmez 8,9. Bu, kalıcı olarak farnesillenmiş ve metillenmiş olarak kalan prelamin A'nın birikmesine neden olur9. Bu son gruplar, prelamin A'nın, Şekil 1'de görüldüğü gibi, olgun lamin A'nın nihayetinde bulunması gereken nükleer laminaya lokalize olmak yerine iç nükleer membrana yapışmasına neden olur. Bu nedenle, ZMPSTE eksikliği, nükleer yapı10,11,12,13,14,15 ile birlikte çeşitli nükleer fonksiyonlar üzerinde derin etkilere sahiptir. Nükleer yapıdaki bu değişiklikler, DNA'nın sitozole sızmasına ve sitozolün çekirdeğe girmesine neden olabilen nükleer kanama ve hatta nükleer yırtılmayı içerebilir. Anormal şekilli çekirdekler, kusurlu prelamin A işleminin neden olduğu çok sayıda diğer fenotiple birlikte gerçekten de laminopati bozukluklarının ayırt edici bir özelliğidir16,17. Nükleer laminadaki kusurlar, nükleoplazmada nükleer protein kalite kontrolünün ve DNA onarım proteinlerinin yanlış lokalizasyonu da dahil olmak üzere çok sayıda zararlı etkiye yol açar ve bu da nükleer fonksiyonda çok sayıda kusura neden olur18. Laminopati fenotiplerini iyileştirmeyi amaçlayan terapötik yaklaşımların geliştirilmesine yönelik araştırmaları kolaylaştırmak için laminopatilerin bu ayırt edici özelliklerini tanımlamaya ve izlemeye yardımcı olabilecek basit bir tekniğe sahip olmak önemlidir. Laminopatili fareler için, nükleer kanamanın ortadan kaldırılmasının, laminopati fenotiplerinin16 genelleştirilmiş eliminasyonu ile ilişkili olduğu gösterilmiştir. İnsan hücrelerinde nükleer bütünlüğün izlenmesine izin veren bir teknik, hastalık fenotiplerini ortadan kaldırmak veya önemli ölçüde iyileştirmek için potansiyel tedavilerin çalışmasını geliştirebilir.
Dolaylı immünofloresan (IF), ilgilenilen bir hedefi tespit etmek için hem birincil etiketlenmemiş bir antikor hem de birincil antikoru tanıyan florofor etiketli bir ikincil antikor kullanan hassas ve yaygın olarak kullanılan bir tekniktir19. IF yöntemleri, belirli hücre içi bileşenleri ve yapıları görselleştirmek için güçlü bir araç sağlayabilir. Birden fazla ikincil antikor molekülünün birincil antikor ile etkileşime girmesi ve bu da sinyalin19 amplifikasyonuna neden olması da mümkündür. Dolaylı IF, ikincil antikorlar, tür19 içinde korunan birincil antikorun Fc alanına karşı yükseltildiğinden, nispeten küçük bir ikincil antikor seti ile çoklu birincil antikorun saptanmasına da izin veren çok yönlü bir tekniktir.
Bu makale, sırasıyla DNA ve nükleer laminayı tespit etmek için çift sarmallı DNA (dsDNA) ve lamin B1'e karşı antikorlar kullanarak, ZMPSTE24 eksik hücrelerde nükleer kanama ve DNA sızıntısını değerlendirmek için dolaylı (IF) bir yöntemi açıklamaktadır. Bu yaklaşımın faydasını göstermek için, prosedür, ZMPSTE24 ifade eden bir HeLa hücre hattının yanı sıra, nakavt edilmiş ZMPSTE24 ekspresyonu olan bir HeLa hücre hattına uygulandı ve iki hücre hattının sonuçları karşılaştırıldı.
Protokol
Reaktiflerin ve kullanılan ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Malzemelerin hazırlanması
- Hücreleri lamellerin üzerine kaplamadan önce en az on adet 22 mm x 22 mm kare cam lamel ve forseps otoklavlayın.
2. Çözeltilerin hazırlanması
- Takviye edilmiş ortam:% 10 fetal sığır serumu (FBS), 100 ünite / mL penisilin ve 100 μg / mL streptomisin ile 500 mL Dulbecco'nun Modifiye Eagle Medium'unu (DMEM) hazırlayın.
- Antikor seyreltme tamponu (ADB): 2 g sığır serum albüminini (BSA) ve 1 g Balık jelatinini 80 mL 1x fosfat tamponlu salin (PBS) içinde çözün. BSA ve balık jelatini çözüldükten sonra PBS ile 100 mL'ye getirin.
- 1x PBS-Tween (PBS-T): 500 mL PBS ve 0.5 mL Tween hazırlayın. Tween çözeltiye kolayca karışana kadar 37 ° C'lik bir su banyosuna koyun.
3. İstenilen hücrelerin büyütülmesi
NOT: HeLa hücreleri bu protokolde bir T75 şişesi içinde birleşecek şekilde büyütüldü.
- Altı lamel üzerine %70 etanol püskürtün ve tüy bırakmayan bir mendil üzerinde kurumaya bırakın. Lamelleri, her oyuk için bir lamel olacak şekilde forseps kullanarak steril 6 oyuklu bir plakaya yerleştirin.
- 6 oyuklu plakadaki her bir oyuğa 2 mL takviye edilmiş DMEM ekleyin.
- Hücrelerden ortamı aspire edin ve şişeye 15 mL PBS ekleyerek, hafifçe döndürerek hücreleri yıkayın. PBS'yi aspire edin ve 2 mL tripsin-EDTA (tripsin) ekleyin.
- Hücreleri tripsin ile kaplayın ve şişelerin şişeden ayrılmasını sağlamak için şişeyi 2 dakika boyunca 37 °C ve% 5 CO2 nemlendirilmiş inkübatöre geri yerleştirin.
- Tripsinli hücreleri toplamak için şişeye 8 mL takviye edilmiş DMEM ekleyin. Topaklanan hücreleri ayırmak için birkaç kez yukarı ve aşağı pipetleyin. Hücre süspansiyonunu şişede toplayın ve 15 mL'lik bir polistiren tüpe yerleştirin.
- Bir hemositometre kullanarak hücreleri sayın.
- 500.000 hücreyi, 6 oyuklu plakadaki lamellerin her birine doğrudan damla damla ekleyin. Nemlendirilmiş bir inkübatörde hücrelerin gece boyunca 37 ° C'de ve% 5 CO2'de büyümesine izin verin.
4. Hücre fiksasyonu ve geçirgenliği
- %4 formaldehit çözeltisini kullanmadan önce taze olarak hazırlayın: 18 mL PBS'ye 2 mL %37,5 formaldehit çözeltisi ekleyin. İyice karıştırın.
- Kullanmadan önce geçirgenlik solüsyonunu taze olarak hazırlayın: 20 mL PBS'ye 100 μL Triton-X ekleyin. Triton-X çözelti içinde eriyene kadar 37 ° C'lik bir su banyosunda birkaç dakika inkübe edilmesine izin verin. İyice karıştırın.
- Medyayı plakanın kuyularında aspire edin. Hücreleri 2 mL PBS ile bir kez yıkayın. Tüm PBS'yi kuyulardan aspire edin.
- Her kuyucuğa 2 mL% 4 formaldehit çözeltisi ekleyin. Oda sıcaklığında (RT) 10 dakika bekletin. Kuyucuklardan% 4 formaldehiti tamamen aspire edin.
- Hücreleri 2 mL PBS ile 3 kez yıkayın. Her yıkamadan sonra PBS'yi kuyulardan tamamen çıkarın.
- Her kuyucuğa 2 mL geçirgenlik çözeltisi ekleyin. RT'de 10 dakika bekletin. Tamamen aspire etme solüsyonu.
- Hücreleri 2 mL PBS ile 3 kez yıkayın. İlk iki yıkamadan sonra PBS'yi tamamen aspire edin, üçüncü yıkamadan sonra PBS'yi kuyucuklarda bırakın.
NOT: Hücreler, bu adımdan sonra birkaç hafta boyunca son PBS yıkamasında 4 ° C'de saklanabilir, bu da sıvı buharlaşmasını önlemek için plakanın parafin film ile kapatıldığından emin olur. Prosedüre devam edilebiliyorsa, bu adım atlanabilir.
5. İmmünofloresan boyama
- Tüm PBS'yi kuyulardan çıkarın. Her oyuğa 2 mL ADB ekleyerek hücreleri bloke edin ve RT'de inkübe edin, 30 dakika boyunca sallayın.
- 30 dakikalık bloke süresinin sonuna doğru, ADB'de birincil antikor seyreltmesini karıştırın (hem Lamin B1 hem de dsDNA antikorları için 1: 1.000 seyreltme, Tablo 1). Her lamel için 75 μL gereklidir, bu nedenle altı lamel için 600 μL ADB, 0.6 μL Lamin B primer antikoru ve 0.6 μL dsDNA antikoru karıştırılmalıdır. İyice girdap.
- ADB'yi kuyulardan çıkarın. Düz bir yüzeyde, işlenmekte olan tüm lamelleri yerleştirmek için yeterince büyük bir parafin filmi parçası bantlayın.
- Her lamel için, parafin filmin üzerine 75 μL birincil antikor seyreltmesi ekleyin ve ADB'de kabarcık pipetlenmediğinden emin olun. Ardından, lamelleri hücre tarafı aşağı bakacak şekilde forseps kullanarak ADB damlacığının üzerine yerleştirin.
- Kuluçka lamellerini kuyu plakası kapağı ile örtün ve RT'de 1 saat inkübe edilmesine izin verin.
- Lamelleri forseps kullanarak parafin filminden çıkarın ve lamelleri, hücre tarafı yukarı bakacak şekilde 6 oyuklu plakaya geri yerleştirin.
- Lamelleri 2 mL PBS-T ile 3 kez yıkayın, her seferinde 3-5 dakika sallayın. Her yıkamadan sonra tüm PBS-T'yi kuyulardan çıkarın.
- Son yıkama sırasında, ikincil antikor seyreltmesini hazırlayın (her iki ilgili ikincil antikor için 1: 1.000, Tablo 1). Her lamel için 75 μL gereklidir, bu nedenle altı lamel için 600 μL ADB ve 0.6 μL ikincil Alexa Fluor etiketli antikor karıştırılmalıdır. İyice girdap. İkincil antikor seyreltmesini mümkün olduğunca ışıktan koruyun.
| Antikor | Kaynak | Şirket | Referans | ||
| dsDNA İşaretleyici Antikoru (HYB331-01) | Fare monoklonal | Santa Cruz | SC-58749 Serisi | ||
| Keçi Anti-Fare IgG (H + L) Yüksek Çapraz Adsorbe Edilmiş İkincil Antikor, Alexa Fluor Plus 488 | Keçi | ThermoFisher (Termo Balıkçı) | A32723 Serisi | ||
| Keçi Anti-Fare IgG (H + L) Yüksek Çapraz Adsorbe Edilmiş İkincil Antikor, Alexa Fluor Plus 405 | Keçi | Canlandırıcı | A31553 Serisi | ||
| Lamin B1 Poliklonal Antikor | Tavşan | Protein teknolojisi | 12987-1-AP | ||
| Keçi Anti-Tavşan IgG (H + L) Yüksek Çapraz Adsorbe Edilmiş İkincil Antikor, Alexa Fluor 594 | Keçi | Canlandırıcı | A11037 Serisi | ||
Tablo 1: Antikorlar. Bu protokolde kullanılan tüm antikorların listesi.
- Tüm PBS-T'yi son yıkamadan çıkarın. İkincil antikor seyreltmesindeki lamelleri, 5. adımda olduğu gibi, RT'de 30 dakika boyunca parafin film üzerinde inkübe edin. Bu adım ve kalan tüm adımlar için ışıktan koruyun. Işığı korumak için küçük bir kutu kullanılabilir. Kuyucuklara çözelti eklemek veya kuyulardan çözelti çıkarmak için gerektiğinde hızlı bir şekilde çalıştığınızdan emin olun.
- Forseps kullanarak lamelleri parafin filmden çıkarın ve lamelleri hücre tarafı yukarı bakacak şekilde 6 oyuklu plakaya geri yerleştirin.
- Lamelleri 2 mL PBS-T ile 3 kez yıkayın. Her yıkamadan sonra tüm PBS-T'yi kuyulardan çıkarın.
- Slaytları bir etanol serisi ile kurutun (%70, %90, %100). Her kuyucuğa 2 mL %70 etanol ekleyerek başlayın. 1-2 dakika bekletin ve tüm etanolü kuyulardan çıkarın. Kalan etanol yüzdeleri ile tekrarlayın.
- Lamelleri forseps kullanarak kuyulardan çıkarın ve tüy bırakmayan bir mendil üzerinde ışıktan koruyarak kurumaya bırakın.
- Lamelin hücre tarafı aşağı bakacak şekilde, lamel başına 20 μL montaj ortamı kullanarak cam mikroskop slaytlarına monte edin. Işıktan koruyarak gece boyunca kurumaya bırakın.
6. Görüntü edinme
- Görüntülemeden önce, lamellerin kenarlarını ince bir tabaka şeffaf oje ile kaplayın (herhangi bir marka veya tür yeterli olacaktır). Işıktan koruyarak kurumaya bırakın.
NOT: Görüntü almak için mikroskop kullanma talimatları, kullanılan mikroskoba bağlı olarak değişecektir. Burada kullanılan mikroskop üzerindeki kameranın çözünürlüğü 1280 x 960 pikseldir. Benzer veya daha iyi çözünürlük yeterli olacaktır. - Mikroskop sahnesine bir slayt koymadan önce, dosya kaydetme ayarlarının yapılması gerekir. Mikroskobu açın ve bir USB sürücü takın. Mikroskop ayarlarında kaydetme ayarlarını yapın ve tüm kanalların (GFP ve RFP) ayrı ayrı kaydedileceğinden ve görüntülerin USB sürücüsünde doğru konuma gittiğinden emin olun.
NOT: USB sürücüsünde bir klasör oluşturun ve ileride başvurmak üzere her lamel kendi adını verin. - Görüntülemeden önce, %70 etanol ile tüy bırakmayan bir mendil püskürtün ve slaytların arkasını nazikçe temizleyin. Kızakların önünü nazikçe temizleyin ve çok az basınç uygulandığından emin olun.
- Lameller aşağı bakacak şekilde mikroskobun üzerine temiz bir slayt yerleştirin. Işık kalkanı kutusuyla örtün.
- 40x objektif lens kullanarak, mikroskop ekranında çekirdekleri bulmak için uygun kanalı (burada kullanılan lamin B1 antikoru için RFP) kullanın. Başlamak için ışık yoğunluğunu yaklaşık %50'ye ayarlayın.
- Aşırı doygun alanları kontrol etmek için Color Off (Rengi Kapalı) seçeneğini belirleyin ve lamel boyunca hiçbir alanın siyah beyaz ayarında kırmızı sinyal olmadığından emin olun. Çok fazla kırmızı sinyal varsa, minimum kırmızı sinyal gösterilene kadar ışık yoğunluğunu düşürün.
NOT: Kırmızı sinyal aşırı doygunluğu gösterir. Çekirdekler zar zor görünüyorsa, aşırı doygunluk olmadan uygun bir yoğunluk elde edilene kadar yoğunluğu %10'luk artışlarla artırın. - Aşırı doygun olmadıklarından emin olmak için diğer tüm lamelleri aynı yoğunlukta kontrol edin. Yukarıdakiyle aynı işlemi kullanarak diğer kanaldaki tüm lamelleri kontrol edin (burada kullanılan dsDNA antikoru için GFP).
- Her kanal için ışık yoğunluklarını kaydedin. Görüntüleme işlemi boyunca her kanal için tüm ışık yoğunluklarının sabit tutulduğundan emin olun.
- Her lamel ayrı ayrı görüntüleyin. İlk kanalla başlayın, çekirdekleri odaklayın ve görüntüyü yakalayın.
- Kanalları dikkatlice değiştirin ve hücreleri tekrar odak noktasına getirin. Odaklanıldığında görüntüyü yakalayın.
- Gerekli kanallarda (GFP ve RFP) görüntüleri yakaladıktan sonra, birleştirilen görüntüyü gözlemlemek ve görüntüyü çekerken slaydın hareket etmediğinden emin olmak için Kaplama'yı seçin. Kanallar üst üste gelmezse, görüntüler aynı hizaya gelene kadar gerekli kanalı yeniden yapın.
- Flash sürücü simgesine tıklayarak görüntüyü kaydedin. Görüntülemeye devam etmek için lamel üzerinde farklı bir yere gidin.
NOT: Aynı bölgenin tekrar tekrar yakalanmasını önlemek için her seferinde lamel üzerinde farklı bir alanın görüntülendiğinden emin olun. Görüntülemeye lamel sol üst köşesinden başlamanız ve çoğaltma olmadan tam kapsama sağlamak için "S" şeklinde hareket etmeniz önerilir.
7. Veri analizi
- Bu yöntem ile elde edilen veriler görseldir. DNA sızıntısı veya nükleer kanama belirtileri için görüntüleri inceleyin. Kanama ve sızıntı örnekleri temsili sonuçlar bölümünde gösterilmektedir.
Sonuçlar
Bu çalışma, çift sarmallı DNA (dsDNA) ile birlikte nükleer laminayı görselleştirmek için bir IF yöntemi sunmaktadır. IF gerçekleştirildikten sonra, yakalanan görüntüler nükleer kanama ve DNA sızıntısı belirtileri açısından incelenebilir.
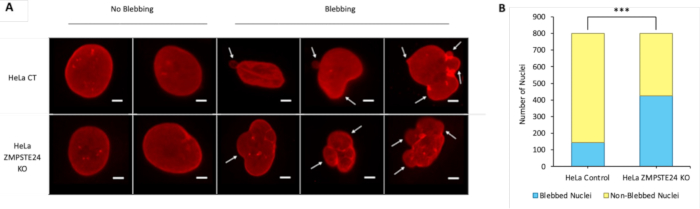
Şekil 2: He...
Tartışmalar
Sunulan protokol, en önemlisi sabit hücrelerin birincil ve ikincil antikorlarla tedavi edilmesi olan birkaç kritik adım içerir. İlgilenilen hedefe karşı kaliteli bir primer antikorun, kullanılan mikroskop aralığında floroforlu doğru karşılık gelen bir sekonder antikor ile kullanılmasının sağlanması optimal sonuçlar verecektir19. Antikorun kalitesi, bu tekniğin sonuçlarını büyük ölçüde etkileyebilir, çünkü hatalı antikorlar spesif...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, ASW'ye R03AG064525 Ulusal Yaşlanma Enstitüsü hibesi tarafından desteklenmiştir. Teknik mentorluk konusundaki yardımları için Dr. Jason A. Stewart'a ve kullanılan mikroskobu sağladığı için Hui Chen laboratuvarına teşekkür ederiz. Bu deneylerde kullanılan HeLa hücre hatları için Fabio Martinon'a da teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 22 mm Square Glass Coverslips | Propper Manufacturing Company | M8710 | Any size or shape can be used as long as they can be fixed to a standard microscope slide. |
| 36.5% Formaldehyde | Sigma Aldrich | F8775 | Fixation Reagent. |
| 75 cm 2 Flasks | Corning | 430725U | For cell culture. |
| Bovine Serum Albinum (BSA) | Fisher Scientific | 9048-46-8 | Antibody dilution buffer. |
| DMEM with 1 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-014-CV | For cell culture. |
| Ethanol (200 Proof) | Decon Laboratories | 2701 | For dehydration of samples before mounting, diluted to make multiple concentrations. |
| EVOS FL Digital Inverted Fluorescence Microscope | Fisher Scientific | 12-563-460 | Imaging. |
| Fish Gelatin | Sigma Aldrich | G7041 | Antibody dilution buffer. |
| Fluoromount-G | Southern Biotech | 0100-01 | Mounting medium to prevent photobleaching. |
| Parafilm (4 in) | Fisher Scientific | 13-374-12 | Any size can be substituted, as long as the coverslips being used can fit. |
| Penicillin-Streptomycin | Gibco | 15-140-122 | For cell culture. |
| Phosphate Buffered Saline (PBS) | N/A | N/A | Made and sterilized in the lab for tissue culture and solutions. |
| Premium Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | For cell culture. |
| Superfrost Premium Microscope Slides | Fisher Scientific | 12-544-7 | Any standard microscope slides can be used. |
| Tissue Culture Treated 6-well Flat Bottom Plates | Falcon | 353046 | For cell culture. |
| TritonX-100 | Thermofisher Scientific | A16046.AP | For washing. |
| Trypsin-EDTA (0.5%) | Gibco | 15-400-054 | For cell culture. |
| Tween 20 | Fisher Scientific | 9005-64-5 | Cell Permeation reagent. |
Referanslar
- Navarro, C. L., et al. New ZMPSTE24 (FACE1) mutations in patients affected with restrictive dermopathy or related progeroid syndromes and mutation update. Eur J Hum Genet. 22 (8), 1002-1011 (2014).
- Dittmer, T. A., Misteli, T. The lamin protein family. Genome Biol. 12 (222), 1-16 (2011).
- Gruenbaum, Y., Margalit, A., Goldman, R. D., Shumaker, D. K., Wilson, K. L. The nuclear lamina comes of age. Nat Rev Mol Cell Biol. 6, 21-31 (2005).
- Navarro, C. L., et al. Lamin A and ZMPSTE24 (FACE-1) defects cause nuclear disorganization and identify restrictive dermopathy as a lethal neonatal laminopathy. Hum Mol Genet. 13 (20), 2493-2503 (2004).
- Barrowman, J., Wiley, P. A., Hudon-Miller, S. E., Hrycyna, C. A., Michaelis, S. Human ZMPSTE24 disease mutations: Residual proteolytic activity correlates with disease severity. Hum Mol Genet. 21 (18), 4084-4093 (2012).
- Richards, S., Muter, J., Ritchie, P., Lattanzi, G., Hutchison, C. The accumulation of un-repairable DNA damage in laminopathy progeria fibroblasts is caused by ROS generation and is prevented by treatment with N-acetyl cysteine. Hum Mol Genet. 20 (20), 3997-4004 (2011).
- Davies, B. S., Fong, L. G., Yang, S. H., Coffinier, C., Young, S. G. The post-translational processing of prelamin A and disease. Annu Rev Genomics Hum Genet. 10, 153-174 (2009).
- Barrowman, J., Hamblet, C., George, C. M., Michaelis, S. Analysis of prelamin A biogenesis reveals the nucleus to be a CaaX processing compartment. Mol Biol Cell. 19, 5398-5408 (2008).
- Young, S., Meta, M., Yang, S. H., Fong, L. G. Prelamin A farnesylation and progeroid syndromes. J Biol Chem. 281 (52), 39741-39745 (2006).
- Houthaeve, G., Robijns, J., Braeckmans, K., De Vos, W. H. Bypassing border control: Nuclear envelope rupture in disease. Physiol. 33 (1), 39-49 (2017).
- Schreiber, K. H., Kennedy, B. K. When lamins go bad: Nuclear structure and disease. Cell. 152 (6), 1365-1375 (2013).
- Fong, L. G., et al. Heterozygosity for Lmna deficiency eliminates the progeria-like phenotypes in Zmpste24-deficient mice. Proc Natl Acad Sci USA. 101 (52), 18111-18116 (2004).
- Pendas, A. M., et al. Defective prelamin A processing and muscular and adipocyte alterations in Zmpste24 metalloproteinase-deficient mice. Nat Genet. 31, 94-99 (2002).
- Goldman, R. D., et al. Accumulation of mutant lamin A causes progressive changes in nuclear architecture in Hutchinson-Gilford progeria syndrome. Proc Natl Acad Sci USA. 101, 8963-8968 (2004).
- Eriksson, M., et al. Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome. Nature. 423, 293-298 (2003).
- Young, S. G., Fong, L. G., Michaelis, S. Thematic review series: Lipid post-translational modifications. Prelamin A, Zmpste24, misshapen cell nuclei, and progeria—new evidence suggesting that protein farnesylation could be important for disease pathogenesis. J Lipid Res. 46 (12), 2531-2558 (2005).
- Worman, H. J., Michaelis, S. Prelamin A and ZMPSTE24 in premature and physiological aging. Nucleus. 14 (1), 1-17 (2023).
- Pande, S., Ghosh, D. K. Nuclear proteostasis imbalance in laminopathy-associated premature aging diseases. FASEB J. 37 (8), 1025-1035 (2023).
- Odell, I. D., Cook, D. Immunofluorescence techniques. J Invest Dermatol. 133 (4), 1-12 (2013).
- Kumar, V. Immunofluorescence and enzyme immunomicroscopy methods. J Immunoassay Immunochem. 21 (2-3), 235-253 (2000).
- Tjaden, A., Giessmann, R. T., Knapp, S., Schroder, M., Muller, S. High-content live-cell multiplex screen for chemogenomic compound annotation based on nuclear morphology. STAR Protoc. 3 (101791), 1-15 (2022).
- Gunn, A. L., Yashchenko, A. I., Dubrulle, J., Johnson, J., Hatch, E. M. A high-content screen reveals new regulators of nuclear membrane stability. Sci Rep. 14, 6013 (2024).
- Yu, L., Liu, P. Cytosolic DNA sensing by cGAS: Regulation, function, and human diseases. Nat Rev Mol Cell Biol. 6 (170), 1-14 (2021).
- Odinammadu, K. O., et al. The farnesyl transferase inhibitor (FTI) lonafarnib improves nuclear morphology in ZMPSTE24-deficient fibroblasts from patients with the progeroid disorder MAD-B. Nucleus. 14 (1), 1-14 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır