A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحسين تقنيات التعديل الضوئي العصبي لتقييم دور الثنائيات الباعثة للضوء الأخضر في إدارة الألم
* These authors contributed equally
In This Article
Summary
تسلط التطورات الحديثة في أبحاث الألم الضوء على إمكانات التعديل العصبي الضوئي باستخدام الثنائيات الباعثة للضوء الأخضر (GLED) كعلاج غير دوائي. يعدل GLED مسارات الألم ، مما يوفر تخفيفا فعالا للألم. تهدف هذه المقالة إلى توحيد وتحسين بروتوكولات التعرض ل GLED ، وتحسين الاتساق عبر الدراسات وتعزيز التطبيق السريري لهذا العلاج.
Abstract
على الرغم من البحث المكثف وتحديد العديد من الأهداف المسكنة ، إلا أن مجموعة العلاجات الدوائية المتاحة للألم لا تزال محدودة. ومع ذلك ، يمكن أن يؤدي التحول النموذجي المحتمل إلى تقديم موجة جديدة من علاجات الألم غير الدوائية بأمان وفعالية وقدرة تحمل ملحوظة. أحد مجالات التحقيق الواعدة هو التعديل العصبي الضوئي باستخدام الثنائيات الباعثة للضوء الأخضر (GLED ، 525 نانومتر) ، والتي أظهرت إمكانات في تخفيف الألم في كل من الحالات الحادة والمزمنة ، مما أدى إلى العديد من الدراسات قبل السريرية والسريرية التي تستكشف فعالية هذا العلاج. أظهرت هذه المشاريع البحثية كيف أن التعرض ل GLED يعزز نشاط نظام المواد الأفيونية الذاتية في الدماغ والحبل الشوكي بعد تنشيط M-cone في شبكية العين. تشير النتائج إلى أن GLED قد يخفف الألم عن طريق تعديل مسار الألم الهابط. في ضوء التأثيرات المقنعة ل GLED ، يؤكد انتشار تحقيقات التعديل العصبي الضوئي على أهمية تحقيق الاتساق في بروتوكولات التعرض المحددة والموحدة جيدا للتجارب قبل السريرية والسريرية. في الدراسات قبل السريرية ، لوحظت تأثيرات مفيدة بعد ما لا يقل عن يومين من التعرض ، مع بروتوكولات تتضمن 8 ساعات من الضوء عند 100 لوكس خلال مرحلة الضوء لمدة 12 ساعة. في التجارب السريرية ، يتم تصميم بروتوكولات التعرض وفقا لعلم الأمراض المحدد قيد التحقيق. أثبت التعرض لمدة 15 دقيقة أنه موات في تعديل الألم الحاد بعد الجراحة. لتعديل الألم المزمن ، يطلب من المرضى استخدام GLED في المنزل لمدة 1 إلى 2 ساعة يوميا على مدار 10 أسابيع. توضح هذه المقالة بالتفصيل البروتوكولات قبل السريرية والسريرية لتحسين قابلية التكاثر والاتساق في الدراسات المختلفة التي تقيم فوائد التعديل الضوئي العصبي. من خلال إنشاء هذه البروتوكولات الموحدة ، يهدف هذا العمل إلى تطوير الترجمة السريرية للعلاج الضوئي GLED كعلاج غير دوائي قابل للتطبيق للألم.
Introduction
لا يزال يتم الاعتماد بشكل كبير على العلاجات الدوائية ، وخاصة المواد الأفيونية ، لإدارة حالات الألم الحاد والمزمن1. يمكن أن تتأثر فعالية إدارة الألم بشكل كبير بتواتر وشدة الآثار الجانبية المرتبطة بتعاطي الموادالأفيونية 2. لهذا السبب ، فإن عددا كبيرا من المرضى الذين يخضعون للعلاج الأفيوني لا يحققون إدارة الألمالناجحة 3. ومن ثم ، فإن أطباء الألم ومجتمع المرضى يبحثون بشكل متزايد عن علاجات غير دوائية تتجنب الآثار الجانبية المرتبطة بمسكنات الألم التقليدية. ظهر التعديل العصبي الضوئي كحل واعد وعلاج آمن لإدارة الألم.
التعديل الضوئي العصبي (PNM) هو تقنية غير جراحية تستخدم الثنائيات الباعثة للضوء (LED) لتنظيم العملياتالبيولوجية 4. تم إنشاء العلاج بالضوء منذ آلاف السنين باستخدام ضوء الشمس ، أو العلاج بالشمس ، لعلاج الأمراض الجلدية5. بعد ذلك ، اتسع مفهوم الضوء الذي يؤثر على الأنسجة البيولوجية ، مما أدى إلى تطوير مصطلح التعديل العصبي الضوئي. تتوسع أبحاث PNM الآن في جميع أنحاء العالم وأظهرت فعاليتها في مجموعة متنوعة من التطبيقات السريرية ، بما في ذلك إدارة الألم6،7،8،9 ، وتحسين جودة النوم لدى مرضى الزهايمر10 ، والسيطرة على الاكتئاب11.
هناك تركيز متزايد على البحوث قبل السريرية والتجارب السريرية التي تهدف إلى التحقيق في الآليات والإمكانات العلاجية للتعديل العصبي الضوئي لإدارة الألم. من بين هذه الأساليب ، أظهر العلاج بالصمام الثنائي الباعث للضوء الأخضر (GLED) ، باستخدام تحفيز الطول الموجي 525 نانومتر ، فعالية واعدة في تقليل أنواع مختلفة من الألم ، بما في ذلك الصداع النصفي والألم العضلي الليفي وألم ما بعد الجراحة12،13،14،15،16. أظهرت التجارب السريرية أن العلاج بالضوء الأخضر يفيد باستمرار المرضى الذين يعانون من الصداع النصفي عبر دراسات متعددة12،17،18 ، عن طريق تقليل كل من آلام الصداع وشدة رهاب الضوء أثناء نوبات الصداع النصفيالنشطة 19 ، بالإضافة إلى تقليل تواتر ومدة نوبات الصداع النصفي12. أظهرت الدراسات قبل السريرية أيضا أن التعرض ل GLED يمكن أن يعكس فرط الحساسية الحرارية والميكانيكية في نموذج إصابة الأعصاب لألم الأعصاب20. علاوة على ذلك ، استكشفت الدراسات قبل السريرية الآليات التي يؤثر من خلالها GLED على إدراك الألم والعتبات الحسية13،21،22،23،24. تسلط هذه الدراسات الضوء على تورط المخاريط M والتعديل اللاحق للنواة الرركبية الجانبية البطنية (vLGN) ، مما يزيد من نشاط الخلايا العصبية enkephalinergic التي تسقط على نواة الراف الظهرية (DRN)22. أكدت الأبحاث الإضافية أيضا على الدور الحاسم للنخاع البطني المنقاري (RVM) 21 ، وهو منظم رئيسي لتعديل الألم التنازلي. بشكل جماعي ، تشير هذه النتائج إلى أن GLED يغير إدراك الألم عن طريق تعديل الدوائر البصرية التي تعمل على مسارات الألم الهابطة20،25. ومع ذلك ، هناك حاجة إلى مزيد من البحث لتسهيل ترجمته إلى الاستخدام السريري.
في هذه المقالة ، نقوم بتفصيل منهجية شاملة لتنفيذ PNM المستند إلى GLED ، بهدف توفير إطار عمل قابل للتكرار لكل من الاستخدام التجريبي والسريري. نصف تصميم وتشغيل التعرض ل GLED ، ونحدد بروتوكولات التطبيق الموحدة ، ونناقش الاعتبارات الرئيسية لضمان الفعالية والتكرار. بالإضافة إلى ذلك ، نقدم بروتوكولا مفصلا لتقييم نشاط كل من مسارات الألم الصاعدة والهابطة ، مما يتيح تحقيقا أعمق في أدوارها في تعديل التسكين الناجم عن GLED. من خلال مشاركة هذا النهج ، نهدف إلى تطوير البحث في إدارة الألم غير الدوائية والمساهمة في تطوير علاجات يمكن الوصول إليها وفعالة وأكثر أمانا.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل اللجنة المؤسسية لرعاية واستخدامه بجامعة أريزونا وتتوافق مع المبادئ التوجيهية لاستخدام المختبر الخاصة بالمعاهد الوطنية للصحة. تم إيواء فئران Sprague Dawley البالغة الخالية من مسببات الأمراض (الوزن عند الاختبار: 275-330 جم) في أقفاص الفئران القياسية (3 فئران لكل قفص) في غرف يتم التحكم فيها بالمناخ في دورة إضاءة / ظلام مدتها 12 ساعة وسمح لها بالوصول إلى الطعام والماء. تم إجراء جميع التجارب السلوكية من قبل المجربين الذين أعمى عن ظروف العلاج. حصلت جميع الإجراءات البشرية على موافقة مجلس المراجعة المؤسسية بجامعة أريزونا (IRB) بموجب البروتوكول رقم (STUDY00000370). تم تسجيل هذه الدراسة لدى ClinicalTrials.gov تحت NCT05295225.
1. بروتوكول التعرض للضوء في
- تحسين التعرض للضوء وإعداد مساكن
- احصل على شرائط مرنة من الثنائيات الباعثة للضوء الطيف المرئي (LED) بالخصائص التالية: (ط) مصابيح LED الخضراء (جدول المواد) ، الطول الموجي 525 نانومتر ، قوة 8 واط ، الجهد 120 فولت ، وزاوية شعاع 120 درجة. (ثانيا) مصابيح LED بيضاء (جدول المواد) ، قوة 9.6 واط ، جهد 120 فولت ، وزاوية شعاع 120 درجة.
- تأكد من دقة طيف الضوء باستخدام مقياس الطيف (في هذه الدراسة ، استخدمنا خدمة النماذج الأولية للأجهزة الطبية الحيوية من معهد BIO5 في جامعة أريزونا).
ملاحظة: يجب أن يكون لمؤشر LED الأخضر طول موجي مركزي يبلغ 525 ± 10 نانومتر (ألمع نقطة انبعاث) ، ونصف عرض كامل (FWHM) يمتد على أقل من 40 نانومتر ، وانخفاض شدة الرقم القياسي (حيث تنخفض شدة الضوء إلى 50٪ من الحد الأقصى) والذي يجب أن يكون عند 500 ± 5 نانومتر و 530 ± 5 نانومتر21. يجب أن يمتد LED الأبيض FWHM لأكثر من 90 نانومتر. يمكن استخدام مصادر متعددة للضوء الأبيض. يجب على المجربين التأكد من كثافة منخفضة تبلغ 525 نانومتر وامتداد كبير من الطيف ، يغطي أطوال موجية متعددة21. - استخدم مقياس لوكس (جدول المواد) لقياس شدة الضوء وتحسينها. قم بتغطية مصابيح LED بشريط أسود (جدول المواد) حسب الحاجة للحصول على الكثافة المطلوبة.
ملاحظة: من الأهمية بمكان قياس شدة الضوء والتحقق من صحتها ، حيث يمكن أن تؤثر الشدة المختلفة على العتبات الحسية بطرق مختلفة (الشكل 1). إذا كانت الشدة غير دقيقة ، فقم بتغطية أو الكشف عن بعض مصابيح LED حتى يتم الوصول إلى الكثافة المطلوبة. - قم بتثبيت شرائط LED على الحواف العلوية للأرفف السلكية في غرفة مظلمة (جدول المواد) للتأكد من أن كل رف مجهز بمصدر مخصص للتعرض للضوء. ضع مؤقتات (جدول المواد) على شرائط LED لكشف الأقفاص لمدة 8 ساعات يوميا من الساعة 6 صباحا حتى 2 ظهرا.
- قم بتثبيت أقفاص ثابتة شفافة على الرفوف. قم بإحاطة الأرفف بالكامل بأوراق داكنة من جميع الجوانب (جدول المواد) لتحسين التعرض مع تقليل تداخل الضوء.
- استخدم مقياس لوكس للحصول على التحسين النهائي لشدة الضوء داخل القفص عن طريق تغطية أو الكشف عن بعض مصابيح LED (100 لوكس في وسط كل قفص) (الشكل التكميلي 1).
- الالتزام بالسلوك الحسي الأساسي وبدء التعرض
- عند الوصول ، اسمح للفئران بالتأقلم مع منشأة لمدة أسبوع واحد. بعد فترة التأقلم هذه ، اعتاد الفئران على التعامل مع المجرب لمدة 7 أيام على الأقل.
- صنف إلى ثلاث مجموعات تجريبية بناء على ظروف العلاج الخاصة بهم: (1) التعرض للضوء الأخضر (GLED) جنبا إلى جنب مع التدخل الجراحي ، (2) التعرض للضوء الأبيض (WLED) جنبا إلى جنب مع التدخل الجراحي ، و (3) مجموعة التحكم WLED مع الجراحة الصورية.
- تأقلم الفئران في صناديق زجاج شبكي شفافة على شبكة سلكية (جدول المواد) لمدة ساعة واحدة قبل الاختبار ، في نفس غرفة منطقة الاختبار ، ويفضل أن يكون المجرب موجودا.
- لتقييم عتبات ما قبل الجراحة ، قم بقياس عتبات سحب المخلب باستخدام طريقة ديكسون لأعلى ولأسفل مع خيوط فون فراي26 على المخلب الخلفي الأيسر (جدول المواد) ، بدءا من الفتيل 4.31 (19.6 mN) لتحديد عتبة انسحاب المخلب الأساسية.
ملاحظة: يجب تقييم الحساسية الميكانيكية باستخدام طريقة "صعودا وهبوطا" من خلال تحديد عتبة السحب. إذا لم يستجب للفتيل 4.31 (19.6 mN) ، فاستخدم الفتيل السميك 4.56 (39.2 mN) (تتم ملاحظة الاستجابة بصريا على أنها انسحاب أو اهتزاز أو لعق المخلب المصاب). إذا استجاب للخيوط 4.31 ، فاستخدم خيوط أرق 4.08 (9.8 ملي نيوتن).- ضع كل خيوط عموديا على السطح الأخمصي للمخلب الخلفي بينما يتم وضع في أقفاص شبكية سلكية معلقة.
- اضبط ضغط الفتيل ، إما زيادة أو نقصان ، بناء على حجم الفتيل السابق.
- استمر في استخدام خيوط أكثر سمكا أو أرق تدريجيا ، اعتمادا على ما إذا كان لدى استجابات لاحقة إيجابية أو سلبية ، على التوالي.
- سجل كل من الردود السلبية والإيجابية في ورقة البيانات الواردة في الجدول التكميلي 1.
ملاحظة: يجب تطبيق كل خيوط واحدة تلو الأخرى بطريقة متسلسلة. بعد الاستجابة الإيجابية الأولى ، اختبر نفس المخلب 4 مرات أخرى باستخدام خيوط مختلفة. لضمان نتائج موثوقة عبر جميع ، يجب على المجرب تجنب تطبيق الفتيل على وسادات القدمين.
- تأقلم الفئران في صناديق زجاجية شفافة على جهاز Hargreaves (جدول المواد) لمدة ساعة واحدة قبل الاختبار في نفس غرفة منطقة الاختبار لقياس خط الأساس للحساسية الحرارية باستخدام اختبار Hargreaves.
ملاحظة: يتطلب اختبار هارجريفز أن تظل الفئران ثابتة لبضع ثوان. إذا كانت الفئران لا تزال نشطة بشكل مفرط بعد فترة التعود الأولية التي تبلغ 1 ساعة ، فقم بتمديد وقت التأقلم حسب الحاجة. تأكد من أن الفئران هادئة وثابتة ولكنها متيقظة بما يكفي لتجنب النوم. قبل إجراء اختبار هارجريفز (جدول المواد) ، من الضروري ضبط شدة ضوء الأشعة تحت الحمراء لإنشاء خط أساس لقياس حساسية الألم. الهدف هو أن يبلغ متوسط زمن انتقال الانسحاب حوالي 20 ثانية لخط الأساس ، مما يوفر حساسية كافية للكشف عن التغيرات في استجابة الألم ، مثل فرط / نقص الألم. عند سحب المخلب ، يوقف كاشف الحركة كلا من المنبه والمؤقت. لمنع تلف الأنسجة ، يتم تطبيق حد أقصى يبلغ 33.5 ثانية. - لتقييم العتبات السلوكية قبل الجراحة ، ضع ليزر الأشعة تحت الحمراء تحت مركز المخلب الخلفي الأيسر للحيوان (باستخدام الخطوط التوجيهية لباعث الأشعة تحت الحمراء).
- ابدأ التحفيز الحراري لقياس الوقت الذي يستغرقه لسحب مخلبه استجابة للحرارة (زمن انتقال الانسحاب).
ملاحظة: إذا كان متوسط زمن انتقال السحب لا يقترب من 20 ثانية، فاضبط الشدة وكرر الاختبار حتى يتم تحديد المتوسط المطلوب. ثم يتم الحفاظ على الشدة ثابتة لبقية التجربة. في هذه الدراسة ، استخدمنا شدة التحفيز 30 (50 واط). إذا احتاج الاختبار إلى التكرار ، فاترك فترات 5 دقائق قبل تكرار الاختبار على نفس. - سجل زمن انتقال السحب في ورقة البيانات المتوفرة في الجدول التكميلي 2.
ملاحظة: لتجنب التأثير على درجة حرارة المنبه الحراري ، قم بتنظيف أي بول أثناء التجارب.
- ابدأ التحفيز الحراري لقياس الوقت الذي يستغرقه لسحب مخلبه استجابة للحرارة (زمن انتقال الانسحاب).
- بعد اكتساب السلوكيات الحسية الأساسية ، قم بإيواء في أقفاص ثابتة للتعرض للضوء مع الوصول المستمر إلى الطعام والماء لمدة 4 أيام قبل الجراحة (8 ساعات في اليوم ، من الساعة 6 صباحا حتى 2 ظهرا).
- تحريض نموذج الألم وتقييم العتبات الحسية بعد الجراحة
- بعد انتهاء التعرض في الساعة 2 مساء في اليوم 4 ، قم بإجراء جراحة شق باتباع نموذج برينان على المخلب الخلفي الأيسر للحث على ألم ما بعد الجراحة27،28.
- استمر في التعرض في اليوم 5. بعد انتهاء التعرض في الساعة 2 ظهرا في اليوم 5 ، قم بإجراء اختبارات فون فراي وهارجريفز ، كما هو موضح سابقا ، لتقييم فرط الحساسية الحرارية والميكانيكية بعد يوم واحد من الجراحة.
- استمر في التعرض في اليوم 6. بعد انتهاء التعرض في الساعة 2 ظهرا في اليوم 6 ، قم بإجراء اختبارات فون فراي وهارجريفز ، كما هو موضح سابقا ، لتقييم فرط الحساسية الحرارية والميكانيكية بعد يومين من الجراحة.
ملاحظة: استبعاد أي من الدراسة إذا وصل إلى معايير نقطة النهاية التي وضعتها اللجنة المؤسسية لرعاية واستخدامه. - إجراء القتل الرحيم على باتباع البروتوكولات التي حددتها اللجنة المؤسسية لرعاية واستخدامه بعد الانتهاء من الاختبار السلوكي.
- تحليل البيانات الحيوانية
- أدخل أنماط الانسحاب الميكانيكية للإجابات في برنامج Allodynia (National Instruments ، LabView 2015) لتقييم العتبات الحسية الميكانيكية29.
ملاحظة: يستخدم البرنامج طريقة ديكسون غير المعلمية ، كما هو مفصل بواسطة Chaplan et al.30. - أبلغ عن زمن انتقال السحب في جدول بيانات للتحليل الإحصائي اللاحق للألودينيا الحرارية.
- قم بإنشاء مخطط يعرض متوسط الحساسية (العتبات أو زمن الانتقال) كدالة للوقت.
- أدخل أنماط الانسحاب الميكانيكية للإجابات في برنامج Allodynia (National Instruments ، LabView 2015) لتقييم العتبات الحسية الميكانيكية29.
2. بروتوكول التعرض للضوء عند البشر
- إعداد غرفة التعرض لتقييم الموضوع البشري
- ابدأ بإعداد غرفة التعريض الضوئي ، وتأكد من خلوها تماما من أي مصادر إضاءة خارجية للتخلص من التداخل المحتمل.
ملاحظة: هذه الخطوة ضرورية لعزل تأثيرات مصابيح LED. - ضع مصابيح LED على مسافة 3-6 أقدام من كرسي الأهداف.
ملاحظة: يعتمد هذا النطاق على التجارب السريرية السابقة لضمان شدة الضوء المتسقة والتعرض الفعال. - قم بتثبيت شرائط LED بطول 2 متر ، مما يضمن نطاق شدة الضوء المطلوب من 90-100 لوكس باستخدام مقياس لوكس (جدول المواد والشكل التكميلي 2).
- قم بتحسين شدة الضوء عن طريق إعادة وضع شرائط الإضاءة أو تغطية بعض مصابيح LED ، مما يضمن حصول الأشخاص على 90-100 لوكس في المنطقة الأساسية التي يجلسون فيها.
- ابدأ بإعداد غرفة التعريض الضوئي ، وتأكد من خلوها تماما من أي مصادر إضاءة خارجية للتخلص من التداخل المحتمل.
- خطوات التعريف لاختبار تقييم الجمع الزمني الميكانيكي
- قبل إجراء أي تقييم ، تأكد من نظافة اليدين المناسبة عن طريق غسل اليدين جيدا ، متبوعا بارتداء القفازات.
- قم بتنظيف وتعقيم خيوط فون فراي المعايرة (6.65 ملي نيوتن ، أي ما يعادل 300 غرام من القوة) لضمان التعقيم قبل تقييم الحساسية الميكانيكية.
- اطلب الإذن لكشف العضلة شبه المنحرفة للتقييم القادم.
- أبلغ المريض أنه سيتم تطبيق خيوط فون فراي على الجانب غير المهيمن من العضلة شبه المنحرفة حتى ينحني الفتيل.
- اطلب من المريض تقييم آلامه على مقياس من 0 إلى 10 ، حيث لا يمثل 0 أي ألم ، ويمثل 10 أسوأ ألم يمكن تخيله مباشرة بعد أن يقول المشغل "الآن".
ملاحظة: تأكد من أن المريض يقدم استجابة سريعة ودقيقة عندما يقول المشغل "الآن". - ضع الفتيل 3 مرات في ثلاث نقاط مختلفة (1 بوصة على حدة) على العضلة شبه المنحرفة غير المهيمنة ، مما يسمح بفاصل زمني 5 ثوان بين كل تطبيق.
- أبلغ الموضوع أنه سيتم تطبيق خيوط فون فراي 10 مرات في نفس المكان مرة واحدة كل 1 ثانية واطلب من الشخص تقييم ألم التطبيق الأخير.
ملاحظة: استخدم نفس البقعة على العضلة شبه المنحرفة لجميع التطبيقات العشرة. - قم بقياس تأثير الجمع الزمني عن طريق تطبيق الفتيل 10 مرات على شبه المنحرف غير المهيمن واطلب من الشخص تقييم الألم في نهاية المحفزات.
- اختبار الجمع الزمني الميكانيكي
- بعد خطوات التعارف ، اترك استراحة لمدة 3 دقائق وأبلغ المريض أنه سيتم تطبيق خيوط فون فراي على الجانب المهيمن من العضلة شبه المنحرفة.
- قم بتنظيف وتعقيم خيوط فون فراي المعايرة.
- اطلب من المريض تقييم آلامه على مقياس من 0 إلى 10 مباشرة بعد أن يقول المشغل "الآن".
- ضع الفتيل 3 مرات في 3 نقاط مختلفة (1 بوصة على حدة) على العضلة شبه المنحرفة المهيمنة ، مما يسمح بفاصل زمني 5 ثوان بين كل تطبيق. سجل استجابة المريض في ورقة السجل (الجدول التكميلي 3).
- أبلغ الموضوع أنه سيتم تطبيق خيوط فون فراي 10 مرات في نفس المكان مرة واحدة كل 1 ثانية واطلب من الموضوع تقييم ألم التطبيق الأخير.
- قم بقياس تأثير الجمع الزمني عن طريق تطبيق الفتيل 10 مرات على شبه المنحرف السائد. سجل رد الموضوع في ورقة السجل (الجدول التكميلي 3).
- كرر العملية مرتين بفاصل 3 دقائق وسجل ردود الأشخاص في ورقة السجل (الجدول التكميلي 3).
- خطوات التعريف لتقييم تعديل الألم المشروط
- قم بإعداد حمام ماء بارد 12 درجة مئوية (الشكل التكميلي 3).
ملاحظة: تحقق من درجة الحرارة قبل الاختبار باستخدام مقياس الحرارة (جدول المواد). تناول ثلجا إضافيا إذا لزم الأمر لضبط درجة الحرارة خلال فترة الاختبار. - نظف وقم بتعقيم مقياس التقلم.
- استخدم برنامج Medoc لتقييم CPM (جدول المواد).
- حدد خيار AlgoMed (الشكل التكميلي 4). على الشاشة الرئيسية ، ابحث عن جهاز Algometer وانقر فوقه لتنشيطه.
- حدد المريض الصحيح من القائمة واختر برنامج الاختبار.
- حدد الموقع لتطبيق الجهاز. لخطوة التعارف هذه ، اختر العضلة شبه المنحرفة غير المهيمنة من مخطط الجسم (الشكل التكميلي 5).
ملاحظة: بعد النقر فوق الانتقال إلى الاختبار ، سيتم توجيه المرء إلى شاشة الاختبار. قبل تطبيق أي ضغط ، سيتطلب البرنامج من المرء إجراء اختبار مسبق ، حيث لا يمارس الجهاز ضغطا بعد. يجب إكمال هذا الاختبار المسبق في كل مرة يتم فيها بدء اختبار جديد. - ابدأ اختبارا ومهلة 5 ثوان.
- أبلغ المريض أن الجهاز يقيس مقدار الضغط المطبق ، وسيتم استخدامه للضغط على الجانب غير المهيمن من العضلة شبه المنحرفة. اطلب من المريض أن يقول "توقف" بمجرد أن يبدأ في الشعور بأي ألم.
- انقر فوق ابدأ. سيفرض النظام انتظارا لمدة 5 ثوان قبل البدء في تطبيق الجهاز.
- قم بتطبيق مقياس اللاجورمية على شبه المنحرف عن طريق زيادة القوة بمعدل 30 كيلو باسكال / ثانية (الشكل التكميلي 6).
- سجل استجابة المريض في ورقة السجل (الجدول التكميلي 3).
ملاحظة: بالنسبة لهذه الدراسة ، الحد الأقصى للضغط المطبق هو 650 كيلو باسكال. تقيم هذه الدراسة على وجه التحديد ظهور الألم ، وليس تقييم تحمل الألم. - أبلغ المشاركين أنهم سيستخدمون حمام ماء مثلج للتقييم.
- تحقق من درجة حرارة الماء باستخدام مقياس الحرارة (جدول المواد) لتكون حوالي 12 درجة مئوية. اضبط مؤقتا لمدة 10 ثوان.
- اطلب من المشارك غمر يده المهيمنة في الماء حتى الرسغ ، مع ضمان استرخاء اليد وانتشار الأصابع.
- اطلب من المشارك تقييم ألمه على مقياس من 0 إلى 10 عندما يقول المشغل "الآن" بنهاية 10 ث.
- اسأل عن تصنيف الألم في نهاية 10 ثوان وسجل استجابة المريض في ورقة السجل (الجدول التكميلي 3).
- قم بإعداد حمام ماء بارد 12 درجة مئوية (الشكل التكميلي 3).
- اختبار تعديل الألم المشروط
- تحقق من درجة حرارة الماء باستخدام مقياس الحرارة (جدول المواد).
- نظف وقم بتعقيم مقياس التقلم.
- بعد استراحة لمدة 3 دقائق ، ابدأ تقييم تعديل الألم المشروط (CPM) عن طريق طلب الإذن لكشف العضلة شبه المنحرفة المهيمنة للتقييم القادم.
- اطلب من المريض أن يقول "توقف" بمجرد أن يبدأ في الشعور بأي ألم. انقر فوق ابدأ على البرنامج.
- قم بتطبيق مقياس اللوميتر على شبه المنحرف عن طريق زيادة القوة بمعدل 30 كيلو باسكال / ثانية وسجل استجابة المريض في ورقة السجل (الجدول التكميلي 3).
- كرر التطبيق مرتين أخريين في مواقع مختلفة من العضلة شبه المنحرفة المهيمنة ، مع فاصل زمني 3 دقائق بين كل منهما.
- تأكد من تنظيف وتعقيم مقياس اللومترية جيدا قبل كل تطبيق لمنع الانزلاق الناجم عن تراكم زيوت البشرة من الأشخاص.
- سجل استجابة المريض في ورقة السجل (الجدول التكميلي 3). انتظر 5 دقائق قبل الانتقال إلى اختبار التحفيز المشروط.
- انقر فوق ابدأ. سيفرض النظام انتظارا لمدة 5 ثوان قبل البدء في تطبيق الجهاز.
- نظف وقم بتعقيم مقياس التقلم.
- اطلب من المريض غمر يده غير المهيمنة حتى الرسغ في حمام الماء المثلج.
- قم بتطبيق مقياس اللوميتر على شبه المنحرف عن طريق زيادة القوة بمعدل 30 كيلو باسكال / ثانية وسجل استجابة المريض في ورقة السجل (الجدول التكميلي 3).
- كرر التطبيق مرتين أخريين في مواقع مختلفة من العضلة شبه المنحرفة ، مع فاصل زمني مدته 5 دقائق بين كل منهما.
ملاحظة: قم بإيقاف الدراسة إذا تم تحديد حالة طبية لم يتم اكتشافها سابقا بعد الفحص الأولي ، خاصة إذا كانت الحالة لديها القدرة على التداخل مع الدراسة. - بعد الحصول على قيم خط الأساس قبل التعرض ، ابدأ في تعريض المريض لحالة الضوء المخصصة له.
- اطلب من المتطوعين تجنب التحديق مباشرة في مصدر الضوء.
ملاحظة: بدلا من ذلك ، يجب أن يسمحوا للضوء بالدخول إلى رؤيتهم المحيطية كما يفعلون مع أي مصدر إضاءة محيط في منزلهم (الشكل التكميلي 7). - تعريض الأهداف لضوء LED لمدة 1.5 ساعة.
ملاحظة: للعلاج بالضوء لفترات طويلة ، يقوم الأشخاص بإدارة التعرض الذاتي في المنزل لمدة تصل إلى 10 أسابيع. يمكن استخدام الاستطلاعات ، مثل استبيان تأثير الألم العضلي الليفي (FIQ) ، و HIT-6 (اختبار تأثير الصداع) ، و PSQI (مؤشر جودة النوم في بيتسبرغ) ، و EQ-5D-5L (لتقييم الصحة العامة) ، جنبا إلى جنب مع استبيانات الألم ، لمراقبة آثار العلاج بمرور الوقت. - أثناء التعرض ، شجع المتطوعين على الانخراط في الأنشطة التي لا تتطلب مصادر إضاءة إضافية ، مثل القراءة أو الكتابة.
ملاحظة: توفر شدة 4-100 لوكس إضاءة كافية. - لا تشجع على النوم أثناء فترة التعرض لضمان الالتزام الكامل بالبروتوكول.
- بعد العلاج بالتعرض للضوء ، كرر جميع القياسات المكتملة عند خط الأساس.
- تحليل البيانات البشرية
- بالنسبة للجمع الزمني الميكانيكي ، احسب متوسط 3 مقاييس أساسية ومتوسط 3 محفزات متكررة.
- احسب النسبة المئوية للجمع الزمني الميكانيكي بقسمة متوسط تصنيف الألم بعد المحفزات المتكررة على متوسط معدل الألم الأساسي وضرب النتيجة في 100 للتعبير عنها كنسبة مئوية.
ملاحظة: تشير النسبة المئوية الأكبر من 100٪ إلى زيادة في إدراك الألم مع المحفزات المتكررة ، مما يشير إلى وجود الجمع الزمني. - لتعديل الألم المشروط الميكانيكي (CPM) ، احسب متوسط آخر عتبات ألم أساسية (بالكيلو باسكال) تم الحصول عليها أثناء المحفزات غير المشروطة (بدون حمام بارد).
- احسب متوسط آخر قيمتين من قيم عتبة الألم (بالكيلو باسكال) أثناء حافز التكييف.
- استخدم المعادلة التالية لحساب التكلفة لكل ألف ظهور:
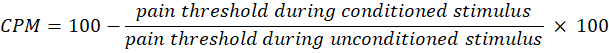
ملاحظة: تشير قيمة CPM 0 إلى عدم وجود تغيير في إدراك الألم ، وتشير القيمة السلبية إلى تثبيط حسي للألم أثناء التحفيز المشروط ، وتشير القيمة الإيجابية إلى تسهيل الألم أثناء التحفيز المشروط. - تقييم التغييرات في كل من الجمع الزمني و CPM قبل وبعد التعرض للضوء لتقييم كيفية تأثير العلاج على نشاط مسارات الألم الصاعدة والهابطة ، على التوالي.
النتائج
يزيد التعرض للضوء الأخضر من زمن انتقال انسحاب المخلب بطريقة تعتمد على الجرعة
يوضح الشكل 1 أ أن التعرض للصمامات الثنائية الباعثة للضوء الأخضر (GLED) بكثافة مختلفة (4 و 50 و 100 و 200 لوكس) زاد بشكل كبير من زمن انتقال سحب المخلب في نموذج...
Discussion
استكشفت الدراسات الحديثة الآليات الكامنة وراء تسكين الضوء الأخضر (GLED)13،21،22،23،24. ومع ذلك، هناك حاجة إلى مزيد من توحيد المنهجية لتعزيز ترجمتها إلى ممارسة سريرية. تسلط التأثيرات المض...
Disclosures
كشف الدكتور إبراهيم عن اهتمام خارجي ب Luxxon Therapeutics لجامعة أريزونا. تتم إدارة تضارب المصالح الناتج عن هذه المصلحة من قبل جامعة أريزونا وفقا لسياساتها. جميع المؤلفين الآخرين ليس لديهم تضارب في المصالح للإبلاغ عنهم. لم يتلق أي من مؤلفي المخطوطة أي مكافأة أو تعويض أو مكافأة بأي طريقة أخرى. لا ينتمي المؤلفون إلى أي بائع أو شركة أدوية مرتبطة بهذه الدراسة. لم يتم تقديم أي من هذه الأبحاث أو المخطوطات أو الملخصات من قبل ولا يتم النظر في نشرها من قبل أي مجلة أخرى.
Acknowledgements
تم دعم هذا البحث من قبل المركز الشامل للألم والإدمان - جامعة أريزونا (M.M.I. ، L.F.M.) ، وقسم التخدير في جامعة أريزونا (L.F.M.) ، وبرنامج تدريب العلماء الطبيين (MSTP) في جامعة أريزونا ، كلية الطب ، توكسون.
Materials
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
References
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved