É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Otimizando técnicas de fotoneuromodulação para avaliar o papel dos diodos emissores de luz verde no controle da dor
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Desenvolvimentos recentes na pesquisa da dor destacam o potencial da fotoneuromodulação usando diodos emissores de luz verde (GLED) como tratamento não farmacológico. O GLED modula as vias da dor, oferecendo alívio eficaz da dor. Este artigo tem como objetivo padronizar e refinar os protocolos de exposição ao GLED, melhorando a consistência entre os estudos e avançando na aplicação clínica dessa terapia.
Resumo
Apesar de extensas pesquisas e da identificação de vários alvos analgésicos, a gama de tratamentos farmacológicos disponíveis para a dor permanece limitada. No entanto, uma possível mudança de paradigma poderia introduzir uma nova onda de tratamentos não farmacológicos para a dor com notável segurança, eficácia e tolerabilidade. Uma área promissora de investigação é a fotoneuromodulação usando diodos emissores de luz verde (GLED, 525 nm), que mostraram potencial no alívio da dor em condições agudas e crônicas, levando a vários estudos pré-clínicos e clínicos explorando a eficácia dessa terapia. Esses projetos de pesquisa demonstraram como a exposição ao GLED aumenta a atividade do sistema opióide endógeno no cérebro e na medula espinhal após a ativação do cone M na retina. Os resultados sugerem que o GLED pode aliviar a dor modulando a via descendente da dor. À luz dos efeitos convincentes do GLED, a proliferação de investigações de fotoneuromodulação ressalta a importância de estabelecer consistência em protocolos de exposição bem definidos e padronizados para ensaios pré-clínicos e clínicos. Em estudos pré-clínicos, foram observados efeitos benéficos após um mínimo de 2 dias de exposição, com protocolos envolvendo 8 h de luz a 100 lux durante a fase de luz de 12 h. Em ensaios clínicos, os protocolos de exposição são adaptados à patologia específica sob investigação. A exposição por 15 min tem se mostrado favorável na modulação da dor aguda pós-cirúrgica. Para modulação da dor crônica, os pacientes são instruídos a usar o GLED em casa por 1 a 2 horas por dia durante 10 semanas. Este artigo detalha protocolos pré-clínicos e clínicos para melhorar a reprodutibilidade e consistência nos diferentes estudos que avaliam os benefícios da fotoneuromodulação. Ao estabelecer esses protocolos padronizados, este trabalho visa avançar na tradução clínica da fototerapia GLED como um tratamento não farmacológico viável para a dor.
Introdução
Os tratamentos farmacológicos, particularmente os opioides, continuam a ser fortemente utilizados para o tratamento de condições de dor aguda e crônica1. A eficácia do controle da dor pode ser significativamente afetada pela frequência e gravidade dos efeitos colaterais associados ao uso de opioides2. Por esse motivo, uma quantidade substancial de pacientes em tratamento com opioides não alcança o controle bem-sucedido da dor3. Assim, os médicos da dor e a comunidade de pacientes estão cada vez mais buscando tratamentos não farmacológicos que evitem os efeitos colaterais associados aos analgésicos tradicionais. A fotoneuromodulação surgiu como uma solução promissora e uma terapia segura para o controle da dor.
A fotoneuromodulação (PNM) é uma técnica não invasiva que utiliza diodos emissores de luz (LED) para regular processos biológicos4. A fototerapia foi estabelecida há milhares de anos usando a luz solar, ou helioterapia, para tratar doenças da pele5. Posteriormente, o conceito de luz influenciando os tecidos biológicos se ampliou, levando ao desenvolvimento do termo fotoneuromodulação. A pesquisa da PNM está se expandindo em todo o mundo e mostrou sua eficácia em uma variedade de aplicações clínicas, incluindo o controle da dor 6,7,8,9, melhorando a qualidade do sono em pacientes com doença de Alzheimer 10 e controlando a depressão11.
Há uma ênfase crescente na pesquisa pré-clínica e nos ensaios clínicos destinados a investigar os mecanismos e o potencial terapêutico da fotoneuromodulação para o controle da dor. Dentre essas abordagens, a terapia com diodo emissor de luz verde (GLED), usando uma estimulação de comprimento de onda de 525 nm, mostrou eficácia promissora na redução de vários tipos de dor, incluindo enxaqueca, fibromialgia e dor pós-cirúrgica 12,13,14,15,16. Ensaios clínicos demonstraram que a terapia de luz verde beneficia consistentemente pacientes que sofrem de enxaqueca em vários estudos 12,17,18, reduzindo a dor de cabeça e a intensidade da fotofobia durante ataques ativos de enxaqueca 19, bem como diminuindo a frequência e a duração dos episódios de enxaqueca12. Estudos pré-clínicos também demonstraram que a exposição ao GLED pode reverter a hipersensibilidade térmica e mecânica em um modelo de lesão nervosa de dor neuropática20. Além disso, estudos pré-clínicos exploraram os mecanismos pelos quais o GLED influencia a percepção da dor e os limiares sensoriais 13,21,22,23,24. Esses estudos destacam o envolvimento dos cones M e a subsequente modulação do núcleo geniculado lateral ventral (vLGN), o que aumenta a atividade dos neurônios encefalinérgicos que se projetam para o núcleo dorsal da rafe (DRN)22. Pesquisas adicionais também enfatizaram o papel crítico da medula ventromedial rostral (RVM)21, um regulador chave da modulação descendente da dor. Coletivamente, esses achados sugerem que o GLED altera a percepção da dor modulando os circuitos visuais que atuam nas vias descendentes da dor20,25. No entanto, mais pesquisas são necessárias para facilitar sua tradução em uso clínico.
Neste artigo, detalhamos uma metodologia abrangente para implementar o PNM baseado em GLED, com o objetivo de fornecer uma estrutura reprodutível para uso experimental e clínico. Descrevemos o projeto e a operação da exposição ao GLED, delineamos protocolos de aplicação padronizados e discutimos as principais considerações para garantir a eficácia e a reprodutibilidade. Além disso, fornecemos um protocolo detalhado para avaliar a atividade das vias de dor ascendentes e descendentes, permitindo uma investigação mais profunda de seus papéis na modulação da analgesia induzida por GLED. Ao compartilhar essa abordagem, pretendemos avançar na pesquisa no tratamento não farmacológico da dor e contribuir para o desenvolvimento de terapias acessíveis, eficazes e seguras.
Protocolo
Todos os procedimentos em animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Arizona e estão em conformidade com as diretrizes para o uso de animais de laboratório dos Institutos Nacionais de Saúde. Ratos Sprague Dawley adultos livres de patógenos (peso no teste: 275-330 g) foram alojados em gaiolas de biotério padrão (3 ratos por gaiola) em salas climatizadas em um ciclo claro/escuro de 12 horas e tiveram acesso improvisado a comida e água. Todos os experimentos comportamentais foram conduzidos por experimentadores cegos para as condições de tratamento. Todos os procedimentos humanos receberam aprovação do Conselho de Revisão Institucional (IRB) da Universidade do Arizona sob o número de protocolo (STUDY00000370). Este estudo está registrado no ClinicalTrials.gov sob NCT05295225.
1. Protocolo de exposição à luz em animais
- Otimizando a exposição à luz e preparando o alojamento dos animais
- Obtenha tiras flexíveis de diodos emissores de luz (LED) de espectro visível com as seguintes características: (i) LEDs verdes (Tabela de Materiais), comprimento de onda de 525 nm, potência de 8 W, tensão de 120 V e ângulo de feixe de 120°. (ii) LEDs brancos (Tabela de Materiais), potência de 9,6 W, tensão de 120 V e ângulo de feixe de 120°.
- Garanta a precisão do espectro de luz com um espectrômetro (para este estudo, usamos o Serviço de Prototipagem de Dispositivos Biomédicos do Instituto BIO5 da Universidade do Arizona).
NOTA: O LED verde deve ter um comprimento de onda central de 525 ± 10 nm (o ponto mais brilhante de emissão), um meio máximo de largura total (FWHM) que se estende por menos de 40 nm e uma queda de intensidade de registro (onde a intensidade da luz cai para 50% do máximo) que deve ser de 500 ± 5 nm e 530 ± 5 nm21. O LED branco FWHM deve abranger mais de 90 nm. Várias fontes de luz branca podem ser usadas. Os experimentadores devem garantir a baixa intensidade do comprimento de onda de 525 nm e uma grande amplitude do espectro, cobrindo vários comprimentos de onda21. - Use um luxímetro (Tabela de Materiais) para medir e otimizar a intensidade da luz. Cubra os LEDs com fita preta (Tabela de Materiais) conforme necessário para obter a intensidade desejada.
NOTA: É crucial medir e validar a intensidade da luz, pois diferentes intensidades podem afetar os limiares sensoriais de maneiras variadas (Figura 1). Se a intensidade não for precisa, cubra ou descubra alguns dos LEDs até que a intensidade desejada seja atingida. - Prenda as tiras de LED nas bordas superiores das prateleiras de arame em uma sala escura (Tabela de Materiais) para garantir que cada prateleira esteja equipada com uma fonte de exposição à luz dedicada. Coloque temporizadores (Tabela de Materiais) nas tiras de LED para expor as gaiolas por 8 h por dia, das 6h às 2h.
- Instale gaiolas estáticas transparentes nas prateleiras. Envolva totalmente as prateleiras com lençóis escuros em todos os lados (Tabela de Materiais) para otimizar a exposição e minimizar a interferência da luz.
- Use um medidor de lux para obter a otimização final da intensidade da luz dentro da gaiola, cobrindo ou descobrindo alguns dos LEDs (100 lux no centro de cada gaiola) (Figura Suplementar 1).
- Obtenção do comportamento sensorial basal e início da exposição
- Na chegada, deixe os ratos se aclimatarem ao biotério por 1 semana. Após este período de aclimatação, habituar os ratos ao manuseamento do experimentador durante pelo menos 7 dias.
- Categorize os animais em três grupos experimentais com base em suas condições de tratamento: (1) exposição à luz verde (GLED) combinada com intervenção cirúrgica, (2) exposição à luz branca (WLED) combinada com intervenção cirúrgica e (3) grupo controle WLED com cirurgia simulada.
- Aclimatar os ratos em caixas de plexiglass transparente em uma tela de arame (Tabela de Materiais) por 1 h antes do teste, na mesma sala da área de teste, com o experimentador preferencialmente presente.
- Para avaliar os limiares pré-operatórios, medir os limiares de retirada da pata usando o método Dixon up-and-down com filamentos de von Frey26 na pata traseira esquerda (Tabela de Materiais), começando com o filamento 4,31 (19,6 mN) para estabelecer o limiar de retirada da pata basal.
NOTA: A sensibilidade mecânica deve ser avaliada usando o método "para cima e para baixo", determinando o limite de retirada. Se o animal não responder ao filamento 4,31 (19,6 mN), use o filamento 4,56 mais grosso (39,2 mN) (uma resposta é notada visualmente como retirada, sacudida ou lambida da pata afetada). Se o animal responder ao filamento 4.31, use o filamento 4.08 (9.8 mN) mais fino.- Aplicar cada filamento perpendicularmente à superfície plantar da pata traseira enquanto os animais estão posicionados em gaiolas suspensas de rede metálica.
- Ajuste a pressão do filamento, aumentando ou diminuindo, com base no tamanho do filamento anterior.
- Continue usando filamentos progressivamente mais grossos ou mais finos, dependendo se o animal teve respostas subsequentes positivas ou negativas, respectivamente.
- Registre as respostas negativas e positivas na folha de dados fornecida na Tabela Suplementar 1.
NOTA: Cada filamento deve ser aplicado um de cada vez de forma sequencial. Após a primeira resposta positiva, teste a mesma pata mais 4 vezes com filamentos diferentes. Para garantir resultados confiáveis em todos os animais, o experimentador deve evitar aplicar o filamento nas patas.
- Aclimatar os ratos em caixas de plexiglass transparente no aparelho de Hargreaves (Tabela de Materiais) por 1 h antes do teste na mesma sala que a área de teste para medir a sensibilidade térmica da linha de base usando o teste de Hargreaves.
NOTA: O teste de Hargreaves exige que os ratos permaneçam imóveis por alguns segundos. Se os ratos ainda estiverem excessivamente ativos após o período inicial de habituação de 1 h, estenda o tempo de aclimatação conforme necessário. Certifique-se de que os ratos estejam calmos e parados, mas alertas o suficiente para evitar adormecer. Antes de realizar o teste de Hargreaves (Tabela de Materiais), é crucial definir a intensidade da luz infravermelha para estabelecer uma linha de base para medir a sensibilidade à dor. O objetivo é que a latência de abstinência seja em média de 20 s para a linha de base, o que fornece sensibilidade suficiente para detectar alterações na resposta à dor, como hiper/hipoalgesia. Após a retirada da pata, um detector de movimento interrompe o estímulo e o cronômetro. Para evitar danos aos tecidos, um corte máximo de 33,5 s é aplicado. - Para avaliar os limiares comportamentais pré-operatórios, coloque o laser infravermelho sob o centro da pata traseira esquerda do animal (usando as linhas de orientação do emissor infravermelho).
- Inicie o estímulo de calor para medir o tempo que o animal leva para retirar a pata em resposta ao calor (latência de retirada).
NOTA: Se a latência média de retirada não for próxima de 20 s, ajuste a intensidade e repita o teste até que a média desejada seja determinada. A intensidade é então mantida constante pelo restante do experimento. Neste estudo, utilizou-se uma intensidade de estímulo de 30 (50 W). Se o teste precisar ser repetido, aguarde intervalos de 5 minutos antes de repetir o teste no mesmo animal. - Registre a latência de retirada na folha de dados fornecida na Tabela Suplementar 2.
NOTA: Para evitar afetar a temperatura do estímulo de calor, limpe qualquer urina durante os testes.
- Inicie o estímulo de calor para medir o tempo que o animal leva para retirar a pata em resposta ao calor (latência de retirada).
- Após a aquisição dos comportamentos sensoriais basais, alojar os animais em gaiolas estáticas para exposição à luz com acesso contínuo a comida e água por 4 dias antes da cirurgia (8 h por dia, das 6h às 14h).
- Modelo de indução da dor e avaliação pós-cirúrgica dos limiares sensoriais
- Após a conclusão da exposição às 14h do dia 4, realizar uma cirurgia de incisão seguindo o modelo de Brennan na pata traseira esquerda para induzir dor pós-operatória27,28.
- Continue a exposição no dia 5. Após a conclusão da exposição às 14h do dia 5, realize os testes de von Frey e Hargreaves, conforme descrito anteriormente, para avaliar a hipersensibilidade térmica e mecânica 1 dia após a cirurgia.
- Continue a exposição no dia 6. Após a conclusão da exposição às 14h do dia 6, realize os testes de von Frey e Hargreaves, conforme descrito anteriormente, para avaliar a hipersensibilidade térmica e mecânica 2 dias após a cirurgia.
NOTA: Exclua qualquer animal do estudo se ele atingir os critérios de desfecho estabelecidos pelo Comitê Institucional de Cuidados e Uso de Animais. - Realizar a eutanásia nos animais seguindo os protocolos descritos pelo Comitê Institucional de Cuidados e Uso de Animais após a conclusão do teste comportamental.
- Análise de dados em animais
- Insira os padrões de retirada mecânica das respostas no Allodynia Software (National Instruments, LabView 2015) para avaliar os limiares sensoriais mecânicos29.
NOTA: O software utiliza o método não paramétrico Dixon, conforme detalhado por Chaplan et al.30. - Relate as latências de retirada em uma planilha para análise estatística subsequente da alodinia térmica.
- Gere um gráfico exibindo a sensibilidade média (limites ou latências) em função do tempo.
- Insira os padrões de retirada mecânica das respostas no Allodynia Software (National Instruments, LabView 2015) para avaliar os limiares sensoriais mecânicos29.
2. Protocolo de exposição à luz em humanos
- Configurando a sala de exposição para avaliação de seres humanos
- Comece preparando a sala de exposição, garantindo que ela esteja completamente livre de quaisquer fontes de luz externas para eliminar possíveis interferências.
NOTA: Esta etapa é essencial para isolar os efeitos das luzes LED. - Posicione as luzes LED a uma distância de 3-6 pés da cadeira do sujeito.
NOTA: Esta faixa é baseada em ensaios clínicos anteriores para garantir intensidade de luz consistente e exposição eficaz. - Instale as fitas de LED de 2 m, garantindo a faixa de intensidade de luz desejada de 90-100 lux usando um luxímetro (Tabela de Materiais e Figura Suplementar 2).
- Otimize a intensidade da luz reposicionando as faixas de luz ou cobrindo alguns dos LEDs, garantindo que os sujeitos recebam 90-100 lux na área principal onde estão sentados.
- Comece preparando a sala de exposição, garantindo que ela esteja completamente livre de quaisquer fontes de luz externas para eliminar possíveis interferências.
- Etapas de familiarização para testar a avaliação da soma temporal mecânica
- Antes de realizar qualquer avaliação, certifique-se de uma higiene adequada das mãos, lavando bem as mãos, seguida de colocar as luvas.
- Limpe e higienize o filamento de von Frey calibrado (6,65 mN, equivalente a 300 g de força) para garantir a esterilidade antes de avaliar a sensibilidade mecânica.
- Solicite permissão para expor o músculo trapézio para a próxima avaliação.
- Informe ao paciente que o filamento de von Frey será aplicado no lado não dominante do músculo trapézio até que o filamento se dobre.
- Instrua o paciente a classificar sua dor em uma escala de 0 a 10, onde 0 representa nenhuma dor e 10 representa a pior dor imaginável imediatamente após o operador dizer "Agora".
NOTA: Certifique-se de que o paciente forneça uma resposta rápida e precisa quando o operador disser "agora". - Aplique o filamento 3 vezes em três pontos diferentes (1 polegada de distância) no músculo trapézio não dominante, permitindo um intervalo de 5 s entre cada aplicação.
- Informe ao sujeito que o filamento de von Frey será aplicado 10 vezes no mesmo local uma vez a cada 1 s e peça ao sujeito para avaliar a dor da última aplicação.
NOTA: Use o mesmo ponto no músculo trapézio para todas as 10 aplicações. - Meça o efeito da soma temporal aplicando o filamento 10 vezes no trapézio não dominante e peça ao sujeito para avaliar a dor no final dos estímulos.
- Ensaio de soma temporal mecânica
- Após as etapas de familiarização, deixe um intervalo de 3 minutos e informe ao paciente que o filamento de von Frey será aplicado no lado dominante do músculo trapézio.
- Limpe e higienize o filamento von Frey calibrado.
- Instrua o paciente a classificar sua dor em uma escala de 0 a 10 imediatamente após o operador dizer "Agora".
- Aplique o filamento 3 vezes em 3 pontos diferentes (1 polegada de distância) no músculo trapézio dominante, permitindo um intervalo de 5 s entre cada aplicação. Registre a resposta do paciente na folha de registro (Tabela Suplementar 3).
- Informe ao sujeito que o filamento de von Frey será aplicado 10 vezes no mesmo local uma vez a cada 1 s e peça ao sujeito que avalie a dor da última aplicação.
- Meça o efeito da soma temporal aplicando o filamento 10 vezes no trapézio dominante. Registre a resposta do sujeito na folha de registro (Tabela Suplementar 3).
- Repita o processo duas vezes com intervalos de 3 minutos e registre as respostas dos sujeitos na folha de registro (Tabela Suplementar 3).
- Etapas de familiarização para avaliação da modulação condicionada da dor
- Preparar banho-maria a 12 °C (figura suplementar 3).
NOTA: Verifique a temperatura antes do teste usando o termômetro (Tabela de Materiais). Tenha gelo extra, se necessário, para ajustar a temperatura durante o período de teste. - Limpe e higienize o algômetro.
- Utilize o software Medoc para avaliação do CPM (Tabela de Materiais).
- Selecione a opção AlgoMed (Figura Suplementar 4). Na tela inicial, localize e clique no Dispositivo Algômetro para ativá-lo.
- Selecione o paciente correto na lista e escolha o programa de teste.
- Selecione o site para aplicar o dispositivo. Para esta etapa de familiarização, escolha o músculo trapézio não dominante no diagrama corporal (Figura Suplementar 5).
NOTA: Após clicar em ir para teste, será direcionado para a tela de teste. Antes de aplicar qualquer pressão, o software exigirá a realização de um pré-teste, onde o dispositivo ainda não está aplicando pressão. Esse pré-teste deve ser concluído sempre que um novo teste for iniciado. - Inicie um teste e um tempo limite de 5 s.
- Informe ao paciente que o dispositivo mede a quantidade de pressão aplicada e será usado para aplicar pressão no lado não dominante do músculo trapézio. Peça ao paciente para dizer "pare" assim que começar a sentir qualquer dor.
- Clique em iniciar. O sistema imporá uma espera de 5 s antes de começar a aplicar o dispositivo.
- Aplique o algómetro no trapézio aumentando a força a uma taxa de 30 kPa/s (Figura 6 suplementar).
- Registre a resposta do paciente na folha de registro (Tabela Suplementar 3).
NOTA: Para este estudo, a pressão máxima aplicada é de 650 kPa. Este estudo avalia especificamente o início da dor, não avalia a tolerância à dor. - Informe aos participantes que eles usarão um banho de água gelada para a avaliação.
- Verifique a temperatura da água usando o termômetro (Tabela de Materiais) em torno de 12 °C. Defina um cronômetro para 10 s.
- Instrua o participante a mergulhar a mão dominante na água até o pulso, garantindo que a mão esteja relaxada e os dedos separados.
- Peça ao participante para avaliar sua dor em uma escala de 0 a 10 quando o operador disser "agora" ao final de 10 s.
- Peça a classificação da dor ao final dos 10 s e registre a resposta do paciente na folha de registro (Tabela Suplementar 3).
- Preparar banho-maria a 12 °C (figura suplementar 3).
- Teste de modulação condicionada da dor
- Verifique a temperatura da água usando o termômetro (Tabela de Materiais).
- Limpe e higienize o algômetro.
- Após um intervalo de 3 minutos, inicie a avaliação da modulação condicionada da dor (CPM) solicitando permissão para expor o músculo trapézio dominante para a próxima avaliação.
- Peça ao paciente para dizer "pare" assim que começar a sentir qualquer dor. Clique em Iniciar no software.
- Aplique o algômetro no trapézio aumentando a força a uma taxa de 30 kPa/s e registre a resposta do paciente na folha de registro (Tabela Suplementar 3).
- Repita a aplicação mais 2 vezes em diferentes locais do músculo trapézio dominante, com intervalo de 3 min entre cada um.
- Certifique-se de que o algômetro esteja completamente limpo e higienizado antes de cada aplicação para evitar escorregões causados pelo acúmulo de oleosidade da pele dos sujeitos.
- Registre a resposta do paciente na folha de registro (Tabela Suplementar 3). Aguarde 5 minutos antes de passar para o teste de estímulo condicionado.
- Clique em iniciar. O sistema imporá uma espera de 5 s antes de começar a aplicar o dispositivo.
- Limpe e higienize o algômetro.
- Instrua o paciente a mergulhar a mão não dominante até o pulso no banho de água gelada.
- Aplique o algômetro no trapézio aumentando a força a uma taxa de 30 kPa/s e registre a resposta do paciente na folha de registro (Tabela Suplementar 3).
- Repita a aplicação mais duas vezes em diferentes locais do músculo trapézio, com intervalo de 5 min entre cada uma.
NOTA: Interrompa o estudo se uma condição médica não descoberta anteriormente for identificada após a triagem inicial, principalmente se a condição tiver o potencial de interferir no estudo. - Após a aquisição dos valores de pré-exposição basais, comece a expor o paciente à condição de luz atribuída a ele.
- Instrua os voluntários a evitar olhar diretamente para a fonte de luz.
NOTA: Em vez disso, eles devem permitir que a luz entre em sua visão periférica como fariam com qualquer fonte de luz ambiente em sua casa (Figura Suplementar 7). - Exponha os motivos à luz LED durante 1,5 h.
NOTA: Para tratamento prolongado com luz, os indivíduos autoadministram a exposição em casa por até 10 semanas. Pesquisas, como o Questionário de Impacto da Fibromialgia (FIQ), o HIT-6 (Teste de Impacto da Dor de Cabeça), o PSQI (Índice de Qualidade do Sono de Pittsburgh) e o EQ-5D-5L (para avaliar a saúde geral), juntamente com questionários de dor, podem ser usados para monitorar os efeitos do tratamento ao longo do tempo. - Durante a exposição, incentive os voluntários a se envolverem em atividades que não exijam fontes de luz adicionais, como leitura ou escrita.
NOTA: Intensidades de 4-100 lux fornecem iluminação suficiente. - Desencoraje dormir durante o período de exposição para garantir a adesão total ao protocolo.
- Após a terapia de exposição à luz, repita todas as medições concluídas na linha de base.
- Análise de dados humanos
- Para a soma temporal mecânica, calcule a média das 3 medidas basais e a média dos 3 estímulos repetidos.
- Calcule a porcentagem de soma temporal mecânica dividindo a classificação média de dor após os estímulos repetitivos pela classificação média de dor basal e multiplicando o resultado por 100 para expressá-lo como uma porcentagem.
NOTA: Um percentual maior que 100% indica um aumento na percepção da dor com estímulos repetidos, sugerindo a presença de soma temporal. - Para modulação da dor condicionada mecânica (CPM), calcule a média dos 2 últimos limiares de dor basais (em kPa) obtidos durante os estímulos não condicionados (sem banho frio).
- Calcule a média dos últimos 2 valores do limiar de dor (em kPa) durante o estímulo condicionante.
- Use a seguinte equação para calcular o CPM:
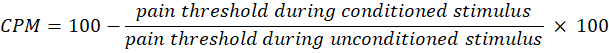
NOTA: Um valor de CPM de 0 indica nenhuma mudança na percepção da dor, um valor negativo indica inibição sensorial da dor durante o estímulo condicionado e um valor positivo indica facilitação da dor durante o estímulo condicionado. - Avalie as mudanças na soma temporal e no CPM antes e depois da exposição à luz para avaliar como a terapia afeta a atividade das vias ascendentes e descendentes da dor, respectivamente.
Resultados
A exposição à luz verde aumenta as latências de retirada da pata de maneira dose-dependente
A Figura 1A demonstra que a exposição a diodos emissores de luz verde (GLED) em várias intensidades (4, 50, 100 e 200 lux) aumentou significativamente as latências de retirada da pata em um modelo de rato ingênuo durante um período de exposição de 7 dias, indicando um efeito antinociceptivo do GLED. As ...
Discussão
Estudos recentes exploraram os mecanismos subjacentes à analgesia de luz verde (GLED) 13,21,22,23,24. No entanto, é necessária uma maior padronização da metodologia para melhorar sua tradução na prática clínica. Os efeitos antinociceptivos dose-dependentes observados em modelos pré-clínicos destacam a importância d...
Divulgações
O Dr. Ibrahim revelou um interesse externo na Luxxon Therapeutics para a Universidade do Arizona. Os conflitos de interesse resultantes desse interesse estão sendo gerenciados pela Universidade do Arizona de acordo com suas políticas. Todos os outros autores não têm conflito de interesse a relatar. Nenhum dos autores do manuscrito recebeu qualquer remuneração, reembolso ou honorário de qualquer outra forma. Os autores não são afiliados a nenhum fornecedor ou empresa farmacêutica associada a este estudo. Nenhuma dessas pesquisas, manuscritos ou resumos foi apresentada anteriormente e não está sendo considerada para publicação por nenhum outro periódico.
Agradecimentos
Esta pesquisa foi apoiada pelo Centro Abrangente de Dor e Dependência da Universidade do Arizona (M.M.I., L.F.M.), pelo Departamento de Anestesiologia da Universidade do Arizona (LFM) e pelo Programa de Treinamento de Cientistas Médicos (MSTP) da Universidade do Arizona, Faculdade de Medicina, Tucson.
Materiais
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Referências
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados