Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Optimización de las técnicas de fotoneuromodulación para evaluar el papel de los diodos emisores de luz verde en el tratamiento del dolor
* Estos autores han contribuido por igual
En este artículo
Resumen
Los avances recientes en la investigación del dolor destacan el potencial de la fotoneuromodulación utilizando diodos emisores de luz verde (GLED) como tratamiento no farmacológico. GLED modula las vías del dolor, ofreciendo un alivio eficaz del dolor. Este artículo tiene como objetivo estandarizar y refinar los protocolos de exposición a GLED, mejorando la consistencia entre estudios y avanzando en la aplicación clínica de esta terapia.
Resumen
A pesar de la amplia investigación y la identificación de numerosas dianas analgésicas, la gama de tratamientos farmacológicos disponibles para el dolor sigue siendo limitada. Sin embargo, un posible cambio de paradigma podría introducir una nueva ola de tratamientos no farmacológicos para el dolor con una seguridad, eficacia y tolerabilidad notables. Un área de investigación prometedora es la fotoneuromodulación mediante diodos emisores de luz verde (GLED, 525 nm), que han demostrado su potencial para aliviar el dolor tanto en enfermedades agudas como crónicas, lo que ha dado lugar a numerosos estudios preclínicos y clínicos que exploran la eficacia de esta terapia. Estos proyectos de investigación han demostrado cómo la exposición a GLED aumenta la actividad del sistema opioide endógeno en el cerebro y la médula espinal después de la activación del cono M en la retina. Los hallazgos sugieren que GLED puede aliviar el dolor mediante la modulación de la vía descendente del dolor. A la luz de los efectos convincentes de GLED, la proliferación de investigaciones sobre fotoneuromodulación subraya la importancia de establecer la coherencia en protocolos de exposición bien definidos y estandarizados para los ensayos preclínicos y clínicos. En estudios preclínicos, se han observado efectos beneficiosos después de un mínimo de 2 días de exposición, con protocolos que involucran 8 h de luz a 100 lux durante la fase de luz de 12 h. En los ensayos clínicos, los protocolos de exposición se adaptan a la patología específica que se está investigando. La exposición durante 15 min ha demostrado ser favorable en la modulación del dolor agudo postquirúrgico. Para la modulación del dolor crónico, se indica a los pacientes que usen GLED en casa durante 1 a 2 horas al día durante 10 semanas. En este artículo se detallan los protocolos preclínicos y clínicos para mejorar la reproducibilidad y consistencia en los diferentes estudios que evalúan los beneficios de la fotoneuromodulación. Mediante el establecimiento de estos protocolos estandarizados, este trabajo pretende avanzar en la traslación clínica de la fototerapia GLED como un tratamiento no farmacológico viable para el dolor.
Introducción
Los tratamientos farmacológicos, en particular los opioides, siguen dependiendo en gran medida para el tratamiento de las afecciones de dolor agudo y crónico1. La eficacia del tratamiento del dolor puede verse afectada significativamente por la frecuencia y la gravedad de los efectos secundarios asociados con el consumo de opioides2. Por esta razón, una cantidad sustancial de pacientes bajo tratamiento con opioides no logran un manejo exitoso del dolor3. Por lo tanto, los médicos del dolor y la comunidad de pacientes buscan cada vez más tratamientos no farmacológicos que eviten los efectos secundarios asociados con los analgésicos tradicionales. La fotoneuromodulación se ha convertido en una solución prometedora y una terapia segura para controlar el dolor.
La fotoneuromodulación (PNM) es una técnica no invasiva que utiliza diodos emisores de luz (LED) para regular los procesos biológicos4. La fototerapia se estableció hace miles de años utilizando la luz solar, o helioterapia, para tratar las afecciones de la piel5. Posteriormente, el concepto de luz que influye en los tejidos biológicos se ha ampliado, lo que ha llevado al desarrollo del término fotoneuromodulación. La investigación de PNM ahora se está expandiendo a todo el mundo y ha demostrado su efectividad en una variedad de aplicaciones clínicas, incluido el manejo del dolor 6,7,8,9, la mejora de la calidad del sueño en pacientes con enfermedad de Alzheimer 10 y el control de la depresión11.
Existe un énfasis creciente en la investigación preclínica y los ensayos clínicos destinados a investigar los mecanismos y el potencial terapéutico de la fotoneuromodulación para el tratamiento del dolor. Entre estos enfoques, la terapia con diodos emisores de luz verde (GLED), que utiliza una estimulación de longitud de onda de 525 nm, ha demostrado una eficacia prometedora en la reducción de varios tipos de dolor, incluidas las migrañas, la fibromialgia y el dolor posquirúrgico 12,13,14,15,16. Los ensayos clínicos han demostrado que la terapia con luz verde beneficia sistemáticamente a los pacientes que sufren de migraña en múltiples estudios 12,17,18, al reducir tanto el dolor de cabeza como la intensidad de la fotofobia durante los ataques activos de migraña19, así como al disminuir la frecuencia y la duración de los episodios de migraña12. Los estudios preclínicos también demostraron que la exposición a GLED puede revertir la hipersensibilidad térmica y mecánica en un modelo de lesión nerviosa de dolor neuropático20. Además, los estudios preclínicos han explorado los mecanismos a través de los cuales GLED influye en la percepción del dolor y los umbrales sensoriales 13,21,22,23,24. Estos estudios destacan la afectación de los conos M y la posterior modulación del núcleo geniculado lateral ventral (vLGN), lo que aumenta la actividad de las neuronas encefalinérgicas proyectándose hacia el núcleo dorsal del rafe (DRN)22. Investigaciones adicionales también han enfatizado el papel crítico de la médula ventromedal rostral (RVM)21, un regulador clave de la modulación del dolor descendente. En conjunto, estos hallazgos sugieren que el GLED altera la percepción del dolor mediante la modulación de los circuitos visuales que actúan sobre las vías descendentes del dolor20,25. Sin embargo, se requiere más investigación para facilitar su traducción al uso clínico.
En este artículo, detallamos una metodología integral para la implementación de PNM basada en GLED, con el objetivo de proporcionar un marco reproducible para uso experimental y clínico. Describimos el diseño y el funcionamiento de la exposición a GLED, describimos protocolos de aplicación estandarizados y discutimos las consideraciones clave para garantizar la eficacia y la reproducibilidad. Además, proporcionamos un protocolo detallado para evaluar la actividad de las vías de dolor ascendentes y descendentes, lo que permite una investigación más profunda de sus funciones en la modulación de la analgesia inducida por GLED. Al compartir este enfoque, nuestro objetivo es avanzar en la investigación en el tratamiento del dolor no farmacológico y contribuir al desarrollo de terapias accesibles, eficaces y seguras.
Protocolo
Todos los procedimientos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Arizona y se ajustan a las pautas para el uso de animales de laboratorio de los Institutos Nacionales de Salud. Las ratas Sprague Dawley adultas libres de patógenos (peso en el momento de la prueba: 275-330 g) se alojaron en jaulas estándar para ratas de vivero (3 ratas por jaula) en habitaciones climatizadas en un ciclo de luz/oscuridad de 12 horas y se les permitió el acceso improvisado a alimentos y agua. Todos los experimentos conductuales fueron realizados por experimentadores ciegos a las condiciones del tratamiento. Todos los procedimientos humanos recibieron la aprobación de la Junta de Revisión Institucional (IRB) de la Universidad de Arizona bajo el número de protocolo (STUDY00000370). Este estudio está registrado en ClinicalTrials.gov menores de NCT05295225.
1. Protocolo de exposición a la luz en animales
- Optimización de la exposición a la luz y preparación del alojamiento de los animales
- Obtener tiras flexibles de diodos emisores de luz (LED) de espectro visible con las siguientes características: (i) LEDs verdes (Tabla de Materiales), longitud de onda de 525 nm, potencia de 8 W, voltaje de 120 V y un ángulo de haz de 120°. (ii) LED blancos (Tabla de Materiales), potencia de 9,6 W, voltaje de 120 V y un ángulo de haz de 120°.
- Asegurar la precisión del espectro de luz con un espectrómetro (para este estudio, utilizamos el Servicio de Prototipado de Dispositivos Biomédicos del Instituto BIO5 de la Universidad de Arizona).
NOTA: El LED verde debe tener una longitud de onda central de 525 ± 10 nm (el punto de emisión más brillante), un medio máximo de ancho completo (FWHM) que abarque menos de 40 nm y una caída de intensidad récord (donde la intensidad de la luz cae al 50% del máximo) que debe estar a 500 ± 5 nm y 530 ± 5nm 21. El LED blanco FWHM debe abarcar más de 90 nm. Se pueden utilizar múltiples fuentes de luz blanca. Los experimentadores deben garantizar la baja intensidad de la longitud de onda de 525 nm y una gran extensión del espectro, que cubra múltiples longitudes de onda21. - Utilice un luxómetro (Tabla de materiales) para medir y optimizar la intensidad de la luz. Cubra los LED con cinta adhesiva negra (Tabla de materiales) según sea necesario para obtener la intensidad deseada.
NOTA: Es crucial medir y validar la intensidad de la luz, ya que diferentes intensidades pueden afectar los umbrales sensoriales de diversas maneras (Figura 1). Si la intensidad no es precisa, cubra o descubra algunos de los LED hasta alcanzar la intensidad deseada. - Asegure las tiras de LED a los bordes superiores de los estantes de alambre en una habitación oscura (Tabla de materiales) para asegurarse de que cada estante esté equipado con una fuente de exposición a la luz dedicada. Coloque temporizadores (Tabla de Materiales) en las tiras de LED para exponer las jaulas durante 8 h al día de 6 am a 2 pm.
- Instale jaulas estáticas transparentes en los estantes. Cierre completamente los estantes con láminas oscuras en todos los lados (Tabla de materiales) para optimizar la exposición y minimizar la interferencia de la luz.
- Utilice un luxómetro para obtener la optimización final de la intensidad de la luz dentro de la jaula cubriendo o destapando algunos de los LED (100 lux en el centro de cada jaula) (Figura complementaria 1).
- Obtención del comportamiento sensorial basal e inicio de la exposición
- A su llegada, permita que las ratas se aclimaten a las instalaciones para animales durante 1 semana. Después de este período de aclimatación, habitúe a las ratas a la manipulación del experimentador durante al menos 7 días.
- Clasifique a los animales en tres grupos experimentales en función de sus condiciones de tratamiento: (1) exposición a la luz verde (GLED) combinada con intervención quirúrgica, (2) exposición a la luz blanca (WLED) combinada con intervención quirúrgica y (3) grupo de control WLED con cirugía simulada.
- Aclimatar a las ratas en cajas de plexiglás transparente sobre una malla de alambre (Tabla de Materiales) durante 1 h antes de la prueba, en la misma habitación que el área de prueba, con el experimentador preferiblemente presente.
- Para evaluar los umbrales preoperatorios, se miden los umbrales de retirada de las patas utilizando el método de Dixon hacia arriba y hacia abajo con filamentos de von Frey26 en la pata trasera izquierda (Tabla de Materiales), comenzando con el filamento 4,31 (19,6 mN) para establecer el umbral basal de retirada de las patas.
NOTA: La sensibilidad mecánica debe evaluarse utilizando el método de "arriba y abajo" determinando el umbral de retirada. Si el animal no responde al filamento 4,31 (19,6 mN), utilice el filamento 4,56 más grueso (39,2 mN) (una respuesta se nota visualmente como retirada, sacudida o lamido de la pata afectada). Si el animal responde al filamento 4.31, use el filamento 4.08 (9.8 mN) más delgado.- Aplique cada filamento perpendicular a la superficie plantar de la pata trasera mientras los animales se colocan en jaulas de malla de alambre suspendidas.
- Ajuste la presión del filamento, ya sea aumentando o disminuyendo, en función del tamaño del filamento anterior.
- Continúe utilizando filamentos progresivamente más gruesos o más delgados, dependiendo de si el animal tuvo respuestas posteriores positivas o negativas, respectivamente.
- Registre las respuestas negativas y positivas en la hoja de datos proporcionada en la Tabla Suplementaria 1.
NOTA: Cada filamento debe aplicarse de uno en uno de forma secuencial. Después de la primera respuesta positiva, pruebe la misma pata 4 veces más con diferentes filamentos. Para garantizar resultados fiables en todos los animales, el experimentador debe evitar aplicar el filamento a las almohadillas de las patas.
- Aclimatar a las ratas en cajas de plexiglás transparente en el aparato de Hargreaves (Tabla de Materiales) durante 1 h antes de la prueba en la misma sala que el área de prueba para medir la sensibilidad térmica de base utilizando la prueba de Hargreaves.
NOTA: La prueba de Hargreaves requiere que las ratas permanezcan quietas durante unos segundos. Si las ratas todavía están demasiado activas después del período inicial de habituación de 1 hora, extienda el tiempo de aclimatación según sea necesario. Asegúrate de que las ratas estén tranquilas e inmóviles, pero lo suficientemente alerta como para evitar quedarse dormidas. Antes de realizar la prueba de Hargreaves (Tabla de Materiales), es crucial establecer la intensidad de la luz infrarroja para establecer una línea de base para medir la sensibilidad al dolor. El objetivo es que la latencia de retirada promedie alrededor de 20 s para el valor basal, lo que proporciona suficiente sensibilidad para detectar cambios en la respuesta al dolor, como hiper/hipoalgesia. Al retirar la pata, un detector de movimiento detiene tanto el estímulo como el temporizador. Para evitar el daño tisular, se aplica un corte máximo de 33,5 s. - Para evaluar los umbrales de comportamiento preoperatorios, coloque el láser infrarrojo debajo del centro de la pata trasera izquierda del animal (utilizando las líneas guía del emisor infrarrojo).
- Inicie el estímulo de calor para medir el tiempo que tarda el animal en retirar la pata en respuesta al calor (latencia de retirada).
NOTA: Si la latencia promedio de retiro no está cerca de 20 s, ajuste la intensidad y repita la prueba hasta que se determine el promedio deseado. La intensidad se mantiene constante durante el resto del experimento. En este estudio, se utilizó una intensidad de estímulo de 30 (50 W). Si es necesario repetir la prueba, espere intervalos de 5 minutos antes de repetir la prueba en el mismo animal. - Registre la latencia de retiro en la hoja de datos proporcionada en la Tabla complementaria 2.
NOTA: Para evitar afectar la temperatura del estímulo de calor, limpie la orina durante los ensayos.
- Inicie el estímulo de calor para medir el tiempo que tarda el animal en retirar la pata en respuesta al calor (latencia de retirada).
- Después de la adquisición de las conductas sensoriales basales, aloje a los animales en jaulas estáticas para la exposición a la luz con acceso continuo a comida y agua durante 4 días antes de la cirugía (8 h por día, de 6 am a 2 pm).
- Modelo de inducción del dolor y evaluación postquirúrgica de los umbrales sensoriales
- Una vez concluida la exposición a las 14 horas del día 4, realizar una cirugía de incisión siguiendo el modelo de Brennan en la pata trasera izquierda para inducir dolor postoperatorio27,28.
- Continúe la exposición el día 5. Después de que la exposición concluya a las 2 pm del día 5, realice las pruebas de von Frey y Hargreaves, como se describió anteriormente, para evaluar la hipersensibilidad térmica y mecánica 1 día después de la cirugía.
- Continúe la exposición el día 6. Después de que la exposición concluya a las 2 pm del día 6, realice las pruebas de von Frey y Hargreaves, como se describió anteriormente, para evaluar la hipersensibilidad térmica y mecánica 2 días después de la cirugía.
NOTA: Excluir cualquier animal del estudio si alcanza los criterios de valoración establecidos por el Comité Institucional de Cuidado y Uso de Animales. - Realizar la eutanasia a los animales siguiendo los protocolos trazados por el Comité Institucional de Cuidado y Uso de Animales después de completar las pruebas de comportamiento.
- Análisis de datos animales
- Introducir los patrones de retirada mecánica de las respuestas en el software Allodynia (National Instruments, LabView 2015) para evaluar los umbrales sensoriales mecánicos29.
NOTA: El software utiliza el método no paramétrico de Dixon, según lo detallado por Chaplan et al.30. - Informar de las latencias de extracción en una hoja de cálculo para su posterior análisis estadístico de la alodinia térmica.
- Genere una gráfica que muestre la sensibilidad media (umbrales o latencias) en función del tiempo.
- Introducir los patrones de retirada mecánica de las respuestas en el software Allodynia (National Instruments, LabView 2015) para evaluar los umbrales sensoriales mecánicos29.
2. Protocolo de exposición a la luz en humanos
- Configuración de la sala de exposición para la evaluación de sujetos humanos
- Comience por preparar la sala de exposición, asegurándose de que esté completamente libre de fuentes de luz externas para eliminar posibles interferencias.
NOTA: Este paso es esencial para aislar los efectos de las luces LED. - Coloque las luces LED a una distancia de 3 a 6 pies de la silla del sujeto.
NOTA: Esta gama se basa en ensayos clínicos previos para garantizar una intensidad de luz constante y una exposición efectiva. - Instale las tiras de LED de 2 m, asegurando el rango de intensidad de luz deseado de 90-100 lux con un luxómetro (Tabla de materiales y figura complementaria 2).
- Optimice la intensidad de la luz reposicionando las tiras de luz o cubriendo algunos de los LED, asegurándose de que los sujetos reciban entre 90 y 100 lux en la zona principal donde están sentados.
- Comience por preparar la sala de exposición, asegurándose de que esté completamente libre de fuentes de luz externas para eliminar posibles interferencias.
- Pasos de familiarización para probar la evaluación mecánica de suma temporal
- Antes de realizar cualquier evaluación, asegúrese de que las manos estén bien lavadas y luego se pongan guantes.
- Limpiar e higienizar el filamento von Frey calibrado (6,65 mN, equivalente a 300 g de fuerza) para asegurar la esterilidad antes de evaluar la sensibilidad mecánica.
- Solicite permiso para exponer el músculo trapecio para la próxima evaluación.
- Informe al paciente que el filamento de von Frey se aplicará en el lado no dominante del músculo trapecio hasta que el filamento se doble.
- Indique al paciente que califique su dolor en una escala de 0 a 10, donde 0 representa ningún dolor y 10 representa el peor dolor imaginable inmediatamente después de que el operador diga "Ahora".
NOTA: Asegúrese de que el paciente brinde una respuesta rápida y precisa cuando el operador diga "ahora". - Aplique el filamento 3 veces en tres puntos diferentes (a 1 pulgada de distancia) en el músculo trapecio no dominante, dejando un intervalo de 5 s entre cada aplicación.
- Informe al sujeto que el filamento de von Frey se aplicará 10 veces en el mismo lugar una vez cada 1 s y pídale al sujeto que califique el dolor de la última aplicación.
NOTA: Use el mismo lugar en el músculo trapecio para las 10 aplicaciones. - Mida el efecto de la suma temporal aplicando el filamento 10 veces en el trapecio no dominante y pida al sujeto que califique el dolor al final de los estímulos.
- Pruebas de suma temporal mecánica
- Después de los pasos de familiarización, permita un descanso de 3 minutos e informe al paciente que el filamento de von Frey se aplicará en el lado dominante del músculo trapecio.
- Limpie y desinfecte el filamento von Frey calibrado.
- Indique al paciente que califique su dolor en una escala de 0 a 10 inmediatamente después de que el operador diga "Ahora".
- Aplique el filamento 3 veces en 3 puntos diferentes (a 1 pulgada de distancia) en el músculo trapecio dominante, dejando un intervalo de 5 s entre cada aplicación. Registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3).
- Informe al sujeto que el filamento von Frey se aplicará 10 veces en el mismo lugar una vez cada 1 s y pídale al sujeto que califique el dolor de la última aplicación.
- Mide el efecto de suma temporal aplicando el filamento 10 veces en el trapecio dominante. Registre la respuesta del sujeto en la hoja de registro (Tabla complementaria 3).
- Repita el proceso dos veces con intervalos de 3 minutos y registre las respuestas de los sujetos en la hoja de registro (Tabla complementaria 3).
- Pasos de familiarización para la evaluación de la modulación condicionada del dolor
- Prepare un baño de agua fría a 12 °C (Figura complementaria 3).
NOTA: Verifique la temperatura antes de la prueba utilizando el termómetro (Tabla de Materiales). Tenga hielo adicional si es necesario para ajustar la temperatura durante el período de prueba. - Limpie y desinfecte el algómetro.
- Utilice el software Medoc para la evaluación de CPM (Tabla de Materiales).
- Seleccione la opción AlgoMed (Figura complementaria 4). En la pantalla de inicio, busque y haga clic en el dispositivo Algometer para activarlo.
- Seleccione el paciente correcto de la lista y elija el programa de pruebas.
- Seleccione el sitio para aplicar el dispositivo. Para este paso de familiarización, elija el músculo trapecio no dominante del diagrama corporal (Figura complementaria 5).
NOTA: Después de hacer clic en ir a la prueba, se le dirigirá a la pantalla de prueba. Antes de aplicar cualquier presión, el software requerirá que se realice una prueba previa, en la que el dispositivo aún no está aplicando presión. Esta prueba previa debe completarse cada vez que se inicia una nueva prueba. - Inicie una prueba y se agote el tiempo de espera de 5 s.
- Informe al paciente que el dispositivo mide la cantidad de presión aplicada y que se utilizará para aplicar presión en el lado no dominante del músculo trapecio. Pídale al paciente que diga "alto" tan pronto como comience a sentir dolor.
- Haga clic en Inicio. El sistema impondrá una espera de 5 s antes de comenzar a aplicar el dispositivo.
- Aplique el algómetro sobre el trapecio aumentando la fuerza a una velocidad de 30 kPa/s (Figura complementaria 6).
- Registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3).
NOTA: Para este estudio, la presión máxima aplicada es de 650 kPa. Este estudio evalúa específicamente la aparición del dolor, no evalúa la tolerancia al dolor. - Informe a los participantes que utilizarán un baño de agua helada para la evaluación.
- Compruebe con el termómetro (Tabla de Materiales) que la temperatura del agua esté en torno a los 12 °C. Configure un temporizador para 10 s.
- Indique al participante que sumerja su mano dominante en el agua hasta la muñeca, asegurándose de que la mano esté relajada y los dedos separados.
- Pida al participante que califique su dolor en una escala de 0 a 10 cuando el operador diga "ahora" al final de los 10 segundos.
- Solicite la calificación del dolor al final de los 10 s y registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3).
- Prepare un baño de agua fría a 12 °C (Figura complementaria 3).
- Pruebas de modulación condicionada del dolor
- Verifique la temperatura del agua usando el termómetro (Tabla de Materiales).
- Limpie y desinfecte el algómetro.
- Después de un descanso de 3 minutos, comience la evaluación de la modulación condicionada del dolor (CPM) solicitando permiso para exponer el músculo trapecio dominante para la próxima evaluación.
- Pídale al paciente que diga "alto" tan pronto como comience a sentir dolor. Haga clic en iniciar en el software.
- Aplique el algómetro en el trapecio aumentando la fuerza a una velocidad de 30 kPa/s y registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3).
- Repita la aplicación 2 veces más en diferentes sitios del músculo trapecio dominante, con un intervalo de 3 minutos entre cada uno.
- Asegúrese de que el algómetro se limpie y desinfecte a fondo antes de cada aplicación para evitar deslizamientos causados por la acumulación de aceites de la piel de los sujetos.
- Registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3). Espere 5 minutos antes de pasar a la prueba de estímulo condicionado.
- Haga clic en Inicio. El sistema impondrá una espera de 5 s antes de comenzar a aplicar el dispositivo.
- Limpie y desinfecte el algómetro.
- Indique al paciente que sumerja su mano no dominante hasta la muñeca en el baño de agua helada.
- Aplique el algómetro en el trapecio aumentando la fuerza a una velocidad de 30 kPa/s y registre la respuesta del paciente en la hoja de registro (Tabla complementaria 3).
- Repita la aplicación dos veces más en diferentes sitios del músculo trapecio, con un intervalo de 5 minutos entre cada uno.
NOTA: Suspenda el estudio si se identifica una afección médica no descubierta previamente después de la evaluación inicial, especialmente si la afección tiene el potencial de interferir con el estudio. - Después de la adquisición de los valores basales de preexposición, comience a exponer al paciente a la condición de luz que se le asignó.
- Indique a los voluntarios que eviten mirar directamente a la fuente de luz.
NOTA: En cambio, deben permitir que la luz ingrese a su visión periférica como lo harían con cualquier fuente de luz ambiental en su hogar (Figura complementaria 7). - Exponga los sujetos a la luz LED durante 1,5 h.
NOTA: Para un tratamiento de luz prolongado, los sujetos se autoadministran la exposición en casa durante un máximo de 10 semanas. Las encuestas, como el Cuestionario de Impacto de la Fibromialgia (FIQ), el HIT-6 (Prueba de Impacto del Dolor de Cabeza), el PSQI (Índice de Calidad del Sueño de Pittsburgh) y el EQ-5D-5L (para evaluar la salud general), junto con los cuestionarios de dolor, se pueden utilizar para monitorear los efectos del tratamiento a lo largo del tiempo. - Durante la exposición, anime a los voluntarios a participar en actividades que no requieran fuentes de luz adicionales, como leer o escribir.
NOTA: Las intensidades de 4-100 lux proporcionan suficiente iluminación. - Desaconseje dormir durante el período de exposición para garantizar el pleno cumplimiento del protocolo.
- Después de la terapia de exposición a la luz, repita todas las mediciones completadas en la línea de base.
- Análisis de datos humanos
- Para la suma temporal mecánica, calcule el promedio de las 3 medidas de referencia y el promedio de los 3 estímulos repetidos.
- Calcule el porcentaje de suma temporal mecánica dividiendo la calificación de dolor promedio después de los estímulos repetitivos por la calificación de dolor de referencia promedio y multiplicando el resultado por 100 para expresarlo como un porcentaje.
NOTA: Un porcentaje superior al 100% indica un aumento en la percepción del dolor con estímulos repetidos, lo que sugiere la presencia de suma temporal. - Para la modulación mecánica del dolor condicionada (CPM), calcular el promedio de los 2 últimos umbrales de dolor basal (en kPa) obtenidos durante los estímulos incondicionados (sin baño frío).
- Calcular el promedio de los 2 últimos valores del umbral de dolor (en kPa) durante el estímulo condicionante.
- Utilice la siguiente ecuación para calcular el CPM:
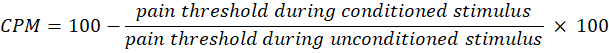
NOTA: Un valor de CPM de 0 indica que no hay cambios en la percepción del dolor, un valor negativo indica inhibición sensorial del dolor durante el estímulo condicionado y un valor positivo indica facilitación del dolor durante el estímulo condicionado. - Evaluar los cambios tanto en la suma temporal como en la CPM antes y después de la exposición a la luz para evaluar cómo la terapia afecta la actividad de las vías ascendentes y descendentes del dolor, respectivamente.
Resultados
La exposición a la luz verde aumenta las latencias de retirada de las patas de forma dependiente de la dosis
La Figura 1A demuestra que la exposición a diodos emisores de luz verde (GLED) a varias intensidades (4, 50, 100 y 200 lux) aumentó significativamente las latencias de retirada de las patas en un modelo de rata ingenua durante un período de exposición de 7 días, lo que indica un efecto antino...
Discusión
Estudios recientes han explorado los mecanismos subyacentes a la analgesia con luz verde (GLED) 13,21,22,23,24. Sin embargo, se necesita una mayor estandarización de la metodología para mejorar su traducción a la práctica clínica. Los efectos antinociceptivos dependientes de la dosis observados en modelos preclínicos pon...
Divulgaciones
El Dr. Ibrahim ha revelado un interés externo en Luxxon Therapeutics a la Universidad de Arizona. Los conflictos de intereses que resulten de este interés están siendo gestionados por la Universidad de Arizona de acuerdo con sus políticas. Todos los demás autores no tienen ningún conflicto de intereses que informar. Ninguno de los autores del manuscrito recibió remuneración, reembolso u honorarios de ninguna otra manera. Los autores no están afiliados a ningún proveedor o compañía farmacéutica asociada con este estudio. Ninguna de estas investigaciones, manuscritos o resúmenes ha sido presentada previamente y no está siendo considerada para su publicación por ninguna otra revista.
Agradecimientos
Esta investigación fue apoyada por el Centro Integral para el Dolor y la Adicción de la Universidad de Arizona (M.M.I., L.F.M.), el Departamento de Anestesiología de la Universidad de Arizona (L.F.M.) y el Programa de Capacitación de Científicos Médicos (MSTP) de la Facultad de Medicina de la Universidad de Arizona, Tucson.
Materiales
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Referencias
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados