需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
优化光神经调节技术以评估绿光发光二极管在疼痛管理中的作用
* 这些作者具有相同的贡献
摘要
疼痛研究的最新进展强调了使用绿光发光二极管 (GLED) 作为非药物治疗的光神经调节的潜力。GLED 调节疼痛通路,提供有效的疼痛缓解。本文旨在标准化和完善 GLED 暴露方案,提高研究之间的一致性并推进该疗法的临床应用。
摘要
尽管进行了广泛的研究并确定了许多镇痛靶点,但可用于疼痛的药物治疗范围仍然有限。然而,潜在的范式转变可能会引入新一波具有显着安全性、有效性和耐受性的非药物疼痛治疗。一个有前途的研究领域是使用绿光发光二极管 (GLED, 525 nm) 的光神经调节,它已显示出缓解急性和慢性疼痛的潜力,导致许多临床前和临床研究探索这种疗法的疗效。这些研究项目已经证明,在视网膜中的 M 锥激活后,暴露于 GLED 如何增强大脑和脊髓中内源性阿片类药物系统的活性。研究结果表明,GLED 可能通过调节下行疼痛通路来缓解疼痛。鉴于 GLED 的令人信服的效果,光神经调节研究的激增强调了在临床前和临床试验中建立明确和标准化暴露方案一致性的重要性。在临床前研究中,在暴露至少 2 天后观察到有益效果,方案涉及在 12 小时光照阶段在 100 勒克斯下光照 8 小时。在临床试验中,暴露方案是根据所调查的特定病理量身定制的。暴露 15 分钟已被证明对调节术后急性疼痛有利。为了调节慢性疼痛,指导患者在 10 周内在家中每天使用 GLED 1 至 2 小时。本文详细介绍了临床前和临床方案,以提高评估光神经调节益处的不同研究的可重复性和一致性。通过建立这些标准化方案,这项工作旨在推进 GLED 光疗作为一种可行的疼痛非药物治疗的临床转化。
引言
药物治疗,尤其是阿片类药物,仍然严重依赖药物治疗来控制急性和慢性疼痛状况1。与阿片类药物使用相关的副作用的频率和严重程度会显着影响疼痛管理的有效性 2。出于这个原因,大量接受阿片类药物治疗的患者没有成功进行疼痛管理3。因此,疼痛医生和患者群体越来越多地寻求避免与传统止痛药相关的副作用的非药物治疗。光神经调节已成为一种很有前途的解决方案和治疗疼痛的安全疗法。
光神经调节 (PNM) 是一种非侵入性技术,它使用发光二极管 (LED) 来调节生物过程4。光疗是在几千年前建立的,使用阳光或日光疗法来治疗皮肤病5。随后,光影响生物组织的概念扩大了,导致了光神经调节术语的发展。PNM 研究现在正在世界范围内扩展,并已在各种临床应用中显示出其有效性,包括疼痛管理 6,7,8,9、改善阿尔茨海默病患者的睡眠质量 10 和控制抑郁症11。
旨在研究光神经调节对疼痛管理的机制和治疗潜力的临床前研究和临床试验越来越重视。在这些方法中,使用 525 nm 波长刺激的绿光发光二极管疗法 (GLED) 在减轻各种类型的疼痛方面显示出有希望的疗效,包括偏头痛、纤维肌痛和术后疼痛 12,13,14,15,16。临床试验表明,在多项研究中,绿光疗法始终有益于偏头痛患者 12,17,18,通过减少活动性偏头痛发作期间的头痛和畏光强度19,以及减少偏头痛发作的频率和持续时间 12.临床前研究还表明,暴露于 GLED 可以逆转神经性疼痛神经损伤模型中的热和机械超敏反应20。此外,临床前研究探讨了 GLED 影响疼痛感知和感觉阈值的机制 13,21,22,23,24。这些研究强调了 M 视锥细胞的参与和随后对腹侧外侧膝状核 (vLGN) 的调节,这增加了投射到中缝背核 (DRN) 的脑啡肽能神经元的活性22。其他研究还强调了喙腹内侧延髓 (RVM) 的关键作用21,这是下行疼痛调节的关键调节因子。总的来说,这些发现表明 GLED 通过调节作用于下行疼痛通路的视觉回路来改变疼痛感知20,25。然而,需要进一步的研究来促进其转化为临床应用。
在本文中,我们详细介绍了一种实施基于 GLED 的 PNM 的综合方法,旨在为实验和临床使用提供一个可重复的框架。我们描述了 GLED 暴露的设计和作,概述了标准化的应用方案,并讨论了确保疗效和可重复性的关键考虑因素。此外,我们提供了一个详细的方案来评估上行和下行疼痛通路的活动,从而能够更深入地研究它们在调节 GLED 诱导的镇痛中的作用。通过分享这种方法,我们的目标是推进非药物疼痛管理的研究,并为开发可及、有效和安全的疗法做出贡献。
研究方案
所有动物程序均已获得亚利桑那大学机构动物护理和使用委员会的批准,并符合美国国立卫生研究院使用实验动物的指南。将无病原体的成年 Sprague Dawley 大鼠 (测试体重:275-330 g) 饲养在气候控制室的标准饲养箱大鼠笼子(每个笼 3 只大鼠)中,进行 12 小时的光照/黑暗循环,并允许随意获取食物和水。所有行为实验均由对治疗条件不知情的实验者进行。所有人工程序均已获得亚利桑那大学机构审查委员会 (IRB) 的批准,方案编号 (STUDY00000370)。这项研究在 ClinicalTrials.gov 下注册NCT05295225。
1. 动物的光照方案
- 优化光照和准备动物住房
- 获得具有以下特性的可见光谱发光二极管 (LED) 柔性灯带:(i) 绿色 LED(材料表),波长 525 nm,功率 8 W,电压 120 V,光束角 120°。(ii) 白光 LED(材料表),功率 9.6 W,电压 120 V,光束角 120°。
- 使用光谱仪确保光谱的准确性(在这项研究中,我们使用了亚利桑那大学 BIO5 研究所的生物医学设备原型设计服务)。
注意:绿色 LED 的中心波长应为 525 ± 10 nm(最亮点),全宽半高 (FWHM) 跨度小于 40 nm,创纪录的强度下降(光强度下降到最大值的 50%)应为 500 ± 5 nm 和 530 ± 5 nm21。白光 LED FWHM 的波长应超过 90 nm。可以使用多个白光源。实验人员必须确保 525 nm 波长的低强度和大光谱跨度,覆盖多个波长21。 - 使用照度计(材料表)测量和优化光强度。根据需要用黑色胶带(材料表)覆盖 LED,以获得所需的强度。
注意:测量和验证光强度至关重要,因为不同的强度会以不同的方式影响感觉阈值(图 1)。如果强度不准确,请盖住或揭开一些 LED,直到达到所需的强度。 - 将 LED 灯条固定在暗室中金属丝架的上边缘(材料表),以确保每个架子都配备了专用的曝光源。将计时器(材料表)放在 LED 灯条上,每天从早上 6 点到下午 2 点将笼子暴露 8 小时。
- 在搁板上安装透明的防静电笼。用深色板材(材料表)完全封闭搁板,以优化曝光,同时最大限度地减少光线干扰。
- 使用照度计通过覆盖或揭开一些 LED(每个笼子中心 100 勒克斯)来获得笼内光强度的最终优化(补充图 1)。
- 基线感觉行为的获得和暴露的开始
- 到达后,让大鼠适应动物设施 1 周。在此适应期之后,使大鼠适应实验者的处理至少 7 天。
- 根据动物的治疗条件将动物分为三个实验组:(1) 绿光暴露 (GLED) 联合手术干预,(2) 白光暴露 (WLED) 联合手术干预,以及 (3) WLED 对照组假手术。
- 测试前,将大鼠在金属丝网(材料表)上的透明有机玻璃盒中适应 1 小时,在与测试区域相同的房间内,最好有实验者在场。
- 为了评估术前阈值,使用 Dixon 上下方法测量爪子退出阈值,左后爪上的 von Frey 细丝26 (材料表),从 4.31 细丝 (19.6 mN) 开始建立基线爪退出阈值。
注意:应使用“上下”方法通过确定撤离阈值来评估机械灵敏度。如果动物对 4.31 细丝 (19.6 mN) 没有反应,请使用较粗的 4.56 细丝 (39.2 mN)(反应在视觉上表现为受影响的爪子退出、摇晃或舔舐)。如果动物对 4.31 细丝有反应,请使用较细的 4.08 (9.8 mN) 细丝。- 将每根细丝垂直于后爪的足底表面涂抹,同时将动物放置在悬挂的金属丝网笼中。
- 根据之前的细丝尺寸调整细丝压力,增加或减少。
- 继续使用逐渐变粗或变细的细丝,具体取决于动物的后续反应是阳性还是阴性。
- 在 补充表 1 中提供的数据表上记录否定和积极响应。
注意:每根细丝应按顺序一次应用一根。在第一个阳性反应后,用不同的细丝再测试同一个爪子 4 次。为确保所有动物的可靠结果,实验者必须避免将细丝涂抹在脚垫上。
- 将大鼠在哈格里夫斯装置(材料表)上的透明有机玻璃盒中适应 1 小时,然后在与测试区域相同的房间中进行测试,以使用 Hargreaves 测试测量热敏感性基线。
注意:Hargreaves 测试要求大鼠保持静止几秒钟。如果大鼠在最初的 1 小时适应期后仍然过度活跃,请根据需要延长驯化时间。确保老鼠平静和静止,但要足够警觉以避免睡着。在进行 Hargreaves 测试(材料表)之前,设置红外光强度以建立测量疼痛敏感性的基线至关重要。目标是使基线戒断潜伏期平均约为 20 秒,这提供了足够的灵敏度来检测疼痛反应的变化,例如痛觉过敏/痛觉减退。在爪子抽出时,运动检测器会停止刺激和计时器。为防止组织损伤,最大截止时间为 33.5 秒。 - 为了评估术前行为阈值,将红外激光放在动物左后爪的中心下方(使用红外发射器的引导线)。
- 启动热刺激以测量动物响应热量而收回爪子所需的时间(撤退潜伏期)。
注意:如果平均撤退潜伏期不接近 20 秒,请调整强度并重复测试,直到确定所需的平均值。然后在实验的剩余时间内保持强度恒定。在这项研究中,我们使用了 30 (50 W) 的刺激强度。如果需要重复测试,请间隔 5 分钟,然后再对同一只动物重复测试。 - 在 补充表 2 中提供的数据表上记录提款延迟。
注意:为避免影响热刺激的温度,请在试验期间清理所有尿液。
- 启动热刺激以测量动物响应热量而收回爪子所需的时间(撤退潜伏期)。
- 获得基线感觉行为后,将动物关在静态笼子中进行光照,并在手术前 4 天(每天 8 小时,从早上 6 点到下午 2 点)持续摄入食物和水。
- 疼痛模型的诱导和感觉阈值的术后评估
- 暴露于第 4 天 2 点结束后,按照 Brennan 模型对左后爪进行切口手术,以诱发术后疼痛27,28。
- 第 5 天继续暴露。暴露于第 5 天下午 2 点结束后,如前所述进行 von Frey 和 Hargreaves 测试,以评估术后 1 天的热和机械超敏反应。
- 在第 6 天继续暴露。暴露于第 6 天下午 2 点结束后,如前所述进行 von Frey 和 Hargreaves 测试,以评估术后 2 天的热和机械超敏反应。
注意:如果任何动物达到机构动物护理和使用委员会制定的终点标准,则将其排除在研究之外。 - 完成行为测试后,按照机构动物护理和使用委员会概述的协议对动物实施安乐死。
- 动物数据分析
- 将答案的机械退出模式输入到 Allodynia 软件(National Instruments,LabView 2015)中,以评估机械感觉阈值29。
注意:该软件使用非参数 Dixon 方法,如 Chaplan 等人 30 所述。 - 在电子表格中报告撤药延迟,以便对热异常性疼痛进行后续统计分析。
- 生成一个图,显示平均敏感度(阈值或延迟)作为时间的函数。
- 将答案的机械退出模式输入到 Allodynia 软件(National Instruments,LabView 2015)中,以评估机械感觉阈值29。
2. 人体光照方案
- 设置用于人体被测体评估的曝光室
- 首先准备曝光室,确保它完全没有任何外部光源,以消除潜在的干扰。
注意: 此步骤对于隔离 LED 灯的影响至关重要。 - 将 LED 灯放置在距离受试者椅子 3-6 英尺的地方。
注意:此范围基于以前的临床试验,以确保一致的光强度和有效曝光。 - 安装 2 m LED 灯条,使用照度计确保所需的光强度范围为 90-100 勒克斯(材料表 和 补充图 2)。
- 通过重新定位灯带或覆盖一些 LED 来优化光强度,确保拍摄对象在他们所坐的主要区域接收到 90-100 勒克斯。
- 首先准备曝光室,确保它完全没有任何外部光源,以消除潜在的干扰。
- 测试机械时间求和评估的熟悉步骤
- 在进行任何评估之前,应彻底洗手,然后戴上手套,确保适当的手部卫生。
- 在评估机械灵敏度之前,对校准的 von Frey 细丝(6.65 mN,相当于 300 g 的力)进行清洁和消毒,以确保无菌。
- 请求允许为即将到来的评估暴露斜方肌。
- 告诉患者,von Frey 细丝将应用于斜方肌的非优势侧,直到细丝弯曲。
- 指导患者以 0 到 10 的等级对他们的疼痛进行评分,其中 0 表示没有疼痛,10 表示在作员说“现在”后立即可以想象到的最严重的疼痛。
注意:确保当接线员说“现在”时,患者提供及时准确的回答。 - 将细丝在非优势斜方肌的三个不同点(相距 1 英寸)涂抹 3 次,每次应用之间间隔 5 秒。
- 告诉受试者 von Frey 细丝将在同一部位涂抹 10 次,每 1 秒一次,并要求受试者评价最后一次涂抹的疼痛。
注意:在所有 10 次应用中,在斜方肌上使用相同的位置。 - 通过在非优势斜方肌上涂抹细丝 10 次来测量时间求和效应,并要求受试者对刺激结束时的疼痛进行评分。
- 机械时间求和测试
- 熟悉步骤后,休息 3 分钟,并告知患者 von Frey 细丝将应用于斜方肌的优势侧。
- 清洁和消毒校准的 von Frey 细丝。
- 指示患者在作员说“现在”后立即以 0 到 10 的等级对他们的疼痛进行评分。
- 将细丝在 3 个不同的点(相距 1 英寸)涂抹在优势斜方肌上 3 次,每次应用之间间隔 5 秒。在记录表上记录患者的回答(补充表 3)。
- 告诉受试者 von Frey 细丝将在同一部位涂抹 10 次,每 1 秒一次,并要求受试者评价最后一次涂抹的疼痛。
- 通过在占主导地位的斜方肌上涂抹细丝 10 次来测量时间求和效应。在记录表上记录受试者的回答(补充表 3)。
- 以 3 分钟的间隔重复该过程两次,并将受试者的回答记录在记录表上(补充表 3)。
- 条件性疼痛调节评估的熟悉步骤
- 准备 12 °C 冷水浴(补充图 3)。
注意:测试前使用温度计验证温度(材料表)。如果需要,请在测试期间准备额外的冰块以调节温度。 - 清洁和消毒海藻计。
- 使用 Medoc 软件评估 CPM(材料表)。
- 选择 AlgoMed 选项(补充图 4)。在主屏幕上,找到并单击 Algometer 设备以激活它。
- 从列表中选择正确的患者并选择测试程序。
- 选择应用设备的站点。对于这个熟悉步骤,从身体图中选择非优势斜方肌(补充图 5)。
注意:单击 “转到测试”后,将定向到测试屏幕。在施加任何压力之前,软件将要求执行预测试,此时设备尚未施加压力。每次启动新测试时,都必须完成此预测试。 - 开始测试,超时 5 秒。
- 告诉患者,该设备测量施加的压力量,它将用于对斜方肌的非优势侧施加压力。要求患者在开始感到任何疼痛时立即说“停止”。
- 单击 start。系统将等待 5 秒,然后开始应用设备。
- 以 30 kPa/s 的速率增加力,将海藻计应用于斜方肌(补充图 6)。
- 在记录表上记录患者的回答(补充表 3)。
注:在本研究中,施加的最大压力为 650 kPa。本研究专门评估疼痛的发作,而不是评估疼痛耐受性。 - 告诉参与者他们将使用冰水浴进行评估。
- 使用温度计(材料表)检查水温约为 12 °C。 将计时器设置为 10 秒。
- 指导参与者将惯用手浸入水中直至手腕,确保手放松且手指分开。
- 当作员在 10 秒结束时说“现在”时,让参与者以 0 到 10 的等级对他们的疼痛进行评分。
- 在 10 秒结束时询问疼痛等级,并将患者的反应记录在记录表上(补充表 3)。
- 准备 12 °C 冷水浴(补充图 3)。
- 测试条件性疼痛调节
- 使用温度计检查水温(材料表)。
- 清洁和消毒海藻计。
- 休息 3 分钟后,通过请求允许暴露优势斜方肌以进行即将到来的评估,开始评估条件性疼痛调节 (CPM)。
- 要求患者在开始感到任何疼痛时立即说“停止”。点击 Start 开始 在软件上。
- 以 30 kPa/s 的速率增加力,将海藻计应用于斜方肌,并将患者反应记录在记录表上(补充表 3)。
- 在优势斜方肌的不同部位再重复应用 2 次,每次间隔 3 分钟。
- 确保在每次使用前彻底清洁和消毒海藻计,以防止因受试者皮肤油脂的积累而导致滑倒。
- 在记录表上记录患者的回答(补充表 3)。等待 5 分钟,然后进行条件刺激测试。
- 单击 start。系统将等待 5 秒,然后开始应用设备。
- 清洁和消毒海藻计。
- 指导患者将非惯用手浸入冰水浴中,直至手腕。
- 以 30 kPa/s 的速率增加力,将海藻计应用于斜方肌,并将患者反应记录在记录表上(补充表 3)。
- 在斜方肌的不同部位再重复应用两次,每次间隔 5 分钟。
注意:如果在初步筛选后发现以前未发现的医疗状况,特别是如果该状况有可能干扰研究,请停止研究。 - 在获取基线曝光前值后,开始将患者暴露在分配给他们的光照条件下。
- 指导志愿者避免直视光源。
注意:相反,他们应该让光线进入他们的周边视觉,就像他们在家中使用任何环境光源一样(补充图 7)。 - 将受试者暴露在 LED 灯下 1.5 小时。
注意:对于长时间的光治疗,受试者在家中自行暴露长达 10 周。纤维肌痛影响问卷 (FIQ)、HIT-6(头痛影响测试)、PSQI(匹兹堡睡眠质量指数)和 EQ-5D-5L(评估整体健康状况)等调查,以及疼痛问卷,可用于监测治疗效果随时间的变化。 - 在曝光期间,鼓励志愿者进行不需要额外光源的活动,例如阅读或写作。
注意: 4-100 lux 的强度可提供足够的照明。 - 不鼓励在暴露期间睡觉,以确保完全遵守协议。
- 曝光治疗后,重复在基线处完成的所有测量。
- 人体数据分析
- 对于机械时间求和,计算 3 个基线测量的平均值和 3 个重复刺激的平均值。
- 通过将重复刺激后的平均疼痛等级除以平均基线疼痛等级,然后将结果乘以 100 以将其表示为百分比来计算机械时间总和百分比。
注意:大于 100% 的百分比表示重复刺激时疼痛感知增加,表明存在时间求和。 - 对于机械条件疼痛调节 (CPM),计算在无条件刺激(无冷水浴)期间获得的最后 2 个基线疼痛阈值(以 kPa 为单位)的平均值。
- 计算调节刺激期间最后 2 个疼痛阈值(以 kPa 为单位)的平均值。
- 使用以下公式计算 CPM:
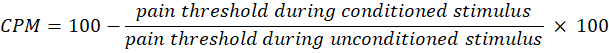
注意:CPM 值为 0 表示疼痛感知没有变化,负值表示条件刺激期间的疼痛感觉抑制,正值表示条件刺激期间的疼痛促进。 - 评估光照前后时间总和 CPM 的变化,以分别评估治疗如何影响上行和下行疼痛通路的活动。
结果
绿光照射以剂量依赖性方式增加爪子撤出潜伏期
图 1A 表明,在 7 天的暴露期内,暴露于不同强度(4、50、100 和 200 勒克斯)的绿光发光二极管 (GLED) 显着增加了幼稚大鼠模型的爪子撤出潜伏期,表明 GLED 具有抗伤害作用。两组之间曝光前的基线潜伏期相当。从第 1 天开始,与白光发光二极管 (WLED) 对照?...
讨论
最近的研究探讨了绿光 (GLED) 镇痛的机制 13,21,22,23,24。然而,需要进一步标准化该方法以加强其在临床实践中的转化。在临床前模型中观察到的剂量依赖性抗伤害作用强调了优化暴露参数以最大限度地提高治疗结果的重要性。然而,在啮齿动物模?...
披露声明
Ibrahim 博士已向亚利桑那大学披露了对 Luxxon Therapeutics 的外部兴趣。由此利益导致的利益冲突由亚利桑那大学根据其政策进行管理。所有其他作者没有需要报告的利益冲突。手稿的作者均未以任何其他方式获得任何报酬、报销或酬金。作者不隶属于与本研究相关的任何供应商或制药公司。这些研究、手稿或摘要之前都没有发表过,也没有被任何其他期刊考虑发表。
致谢
这项研究得到了亚利桑那大学疼痛和成瘾综合中心 (M.M.I., L.F.M.)、亚利桑那大学麻醉学系 (LFM) 和亚利桑那大学图森医学院医学科学家培训计划 (MSTP) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
参考文献
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。