Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yeşil Işık Yayan Diyotların Ağrı Yönetimindeki Rolünü Değerlendirmek için Fotonöromodülasyon Tekniklerinin Optimize Edilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Ağrı araştırmalarındaki son gelişmeler, farmakolojik olmayan bir tedavi olarak yeşil ışık yayan diyotların (GLED) kullanılmasının potansiyelini vurgulamaktadır. GLED ağrı yollarını modüle ederek etkili ağrı kesici sağlar. Bu makale, GLED maruziyet protokollerini standartlaştırmayı ve iyileştirmeyi, çalışmalar arasında tutarlılığı artırmayı ve bu tedavinin klinik uygulamasını ilerletmeyi amaçlamaktadır.
Özet
Kapsamlı araştırmalara ve çok sayıda analjezik hedefin tanımlanmasına rağmen, ağrı için mevcut farmakolojik tedavilerin kapsamı sınırlı kalmaktadır. Bununla birlikte, potansiyel bir paradigma kayması, dikkate değer güvenlik, etkinlik ve tolere edilebilirlik ile yeni bir farmakolojik olmayan ağrı tedavileri dalgası getirebilir. Umut verici bir araştırma alanı, hem akut hem de kronik durumlarda ağrıyı hafifletme potansiyeli gösteren yeşil ışık yayan diyotlar (GLED, 525 nm) kullanılarak yapılan fotonöromodülasyondur ve bu tedavinin etkinliğini araştıran çok sayıda klinik öncesi ve klinik çalışmaya yol açmıştır. Bu araştırma projeleri, GLED'e maruz kalmanın, retinadaki M-koni aktivasyonundan sonra beyin ve omurilikteki endojen opioid sistemin aktivitesini nasıl arttırdığını göstermiştir. Bulgular, GLED'in inen ağrı yolunu modüle ederek ağrıyı hafifletebileceğini düşündürmektedir. GLED'in zorlayıcı etkileri ışığında, fotonöromodülasyon araştırmalarının çoğalması, klinik öncesi ve klinik çalışmalar için iyi tanımlanmış ve standartlaştırılmış maruziyet protokollerinde tutarlılık sağlamanın önemini vurgulamaktadır. Klinik öncesi çalışmalarda, 12 saatlik ışık fazı sırasında 100 lux'te 8 saatlik ışık içeren protokollerle en az 2 günlük maruziyetin ardından faydalı etkiler gözlenmiştir. Klinik çalışmalarda, maruziyet protokolleri araştırılan spesifik patolojiye göre uyarlanır. 15 dakika boyunca maruz kalmanın, akut cerrahi sonrası ağrının modülasyonunda olumlu olduğu kanıtlanmıştır. Kronik ağrının modülasyonu için, hastalara 10 hafta boyunca günde 1 ila 2 saat boyunca evde GLED kullanmaları talimatı verilir. Bu makale, fotonöromodülasyonun faydalarını değerlendiren farklı çalışmalarda tekrarlanabilirliği ve tutarlılığı artırmak için klinik öncesi ve klinik protokolleri detaylandırmaktadır. Bu standardize protokolleri oluşturarak, bu çalışma, GLED fototerapisinin ağrı için uygulanabilir bir farmakolojik olmayan tedavi olarak klinik çevirisini ilerletmeyi amaçlamaktadır.
Giriş
Farmakolojik tedaviler, özellikle opioidler, hem akut hem de kronik ağrı durumlarını yönetmek için büyük ölçüde güvenilmeye devam etmektedir1. Ağrı yönetiminin etkinliği, opioid kullanımıyla ilişkili yan etkilerin sıklığı ve ciddiyetinden önemli ölçüde etkilenebilir2. Bu nedenle, opioid tedavisi altındaki hastaların önemli bir kısmı başarılı bir ağrı yönetimi elde edememektedir3. Bu nedenle, ağrı hekimleri ve hasta topluluğu, geleneksel ağrı kesici ilaçlarla ilişkili yan etkilerden kaçınan farmakolojik olmayan tedavileri giderek daha fazla aramaktadır. Fotonöromodülasyon, ağrıyı yönetmek için umut verici bir çözüm ve güvenli bir tedavi olarak ortaya çıkmıştır.
Fotonöromodülasyon (PNM), biyolojik süreçleri düzenlemek için ışık yayan diyotlar (LED) kullanan, invaziv olmayan bir tekniktir4. Fototerapi, cilt rahatsızlıklarını tedavi etmek için güneş ışığı veya helioterapi kullanılarak binlerce yıl önce kurulmuştur5. Daha sonra, biyolojik dokuları etkileyen ışık kavramı genişledi ve fotonöromodülasyon teriminin gelişmesine yol açtı. PNM araştırması şu anda dünya çapında genişlemektedir ve ağrı yönetimi 6,7,8,9, Alzheimer hastalığı olan hastalarda uyku kalitesini iyileştirme 10 ve depresyonu kontrol etme 11 dahil olmak üzere çeşitli klinik uygulamalarda etkinliğini göstermiştir.
Ağrı yönetimi için fotonöromodülasyonun mekanizmalarını ve terapötik potansiyelini araştırmayı amaçlayan klinik öncesi araştırmalara ve klinik çalışmalara artan bir vurgu vardır. Bu yaklaşımlar arasında, 525 nm dalga boyu stimülasyonu kullanan yeşil ışık yayan diyot tedavisi (GLED), migren, fibromiyalji ve cerrahi sonrası ağrı dahil olmak üzere çeşitli ağrı türlerini azaltmada umut verici bir etkinlik göstermiştir 12,13,14,15,16. Klinik çalışmalar, yeşil ışık tedavisinin, aktif migrenatakları 19 sırasında hem baş ağrısı ağrısını hem de fotofobi yoğunluğunu azaltarak ve migren ataklarının sıklığını ve süresini azaltarak12,17,18 birçok çalışmada migrenden muzdarip hastalara sürekli olarak fayda sağladığını göstermiştir 12. Klinik öncesi çalışmalar ayrıca GLED'e maruz kalmanın, nöropatik ağrının sinir yaralanması modelinde termal ve mekanik aşırı duyarlılığı tersine çevirebileceğini göstermiştir20. Ayrıca, klinik öncesi çalışmalar, GLED'in ağrı algısını ve duyusal eşikleri etkilediği mekanizmaları araştırmıştır 13,21,22,23,24. Bu çalışmalar, M-konilerin katılımını ve dorsal raphe çekirdeğine (DRN) çıkıntı yapan enkefalinerjik nöronların aktivitesini artıran ventral lateral genikülat çekirdeğin (vLGN) müteakip modülasyonunu vurgulamaktadır22. Ek araştırmalar, azalan ağrı modülasyonunun önemli bir düzenleyicisi olan rostral ventromedial medullanın (RVM)21 kritik rolünü de vurgulamıştır. Toplu olarak, bu bulgular GLED'in azalan ağrı yollarına etki eden görsel devreleri modüle ederek ağrı algısını değiştirdiğini göstermektedir20,25. Bununla birlikte, klinik kullanıma çevrilmesini kolaylaştırmak için daha fazla araştırmaya ihtiyaç vardır.
Bu makalede, hem deneysel hem de klinik kullanım için tekrarlanabilir bir çerçeve sağlamayı amaçlayan GLED tabanlı PNM'yi uygulamak için kapsamlı bir metodolojiyi detaylandırıyoruz. GLED maruziyetinin tasarımını ve işleyişini açıklıyoruz, standartlaştırılmış uygulama protokollerini özetliyoruz ve etkinlik ve tekrarlanabilirliği sağlamak için temel hususları tartışıyoruz. Ek olarak, hem artan hem de azalan ağrı yollarının aktivitesini değerlendirmek için ayrıntılı bir protokol sağlayarak, GLED'in neden olduğu analjeziyi modüle etmedeki rolleri hakkında daha derin bir araştırma yapılmasını sağlıyoruz. Bu yaklaşımı paylaşarak, farmakolojik olmayan ağrı yönetimi alanındaki araştırmaları ilerletmeyi ve erişilebilir, etkili ve daha güvenli tedavilerin geliştirilmesine katkıda bulunmayı amaçlıyoruz.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm hayvan prosedürleri, Arizona Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır ve Ulusal Sağlık Enstitüleri'nin laboratuvar hayvanlarının kullanımına ilişkin yönergelere uygundur. Patojen içermeyen, yetişkin Sprague Dawley sıçanları (testteki ağırlık: 275-330 g), 12 saatlik bir aydınlık / karanlık döngüsünde iklim kontrollü odalarda standart vivaryum sıçan kafeslerinde (kafes başına 3 sıçan) barındırıldı ve yiyecek ve suya serbestçe erişim izni verildi. Tüm davranışsal deneyler, tedavi koşullarına kör olan deneyciler tarafından yapıldı. Tüm insan prosedürleri, protokol numarası (STUDY00000370) altında Arizona Üniversitesi Kurumsal İnceleme Kurulu'ndan (IRB) onay aldı. Bu çalışma NCT05295225 altındaki ClinicalTrials.gov tarafından tescil edilmiştir.
1. Hayvanlarda ışığa maruz kalma protokolü
- Işığa maruz kalmanın optimize edilmesi ve hayvan barınaklarının hazırlanması
- Aşağıdaki özelliklere sahip görünür spektrumlu ışık yayan diyotlar (LED) esnek şeritler elde edin: (i) Yeşil LED'ler (Malzeme Tablosu), 525 nm dalga boyu, 8 W güç, 120 V voltaj ve 120° ışın açısı. (ii) Beyaz LED'ler (Malzeme Tablosu), 9,6 W güç, 120 V voltaj ve 120° ışın açısı.
- Bir spektrometre ile ışık spektrumunun doğruluğunu sağlayın (bu çalışma için Arizona Üniversitesi'ndeki BIO5 Enstitüsü'nden Biyomedikal Cihaz Prototipleme Hizmetini kullandık).
NOT: Yeşil LED'in Merkez Dalga Boyu 525 ± 10 nm (emisyonun en parlak noktası), 40 nm'den daha az yayılan Tam Genişlikte Yarım Maksimum (FWHM) ve 500 ± 5 nm ve 530 ± 5 nm21'de olması gereken bir Rekor Yoğunluk Düşüşü (ışık yoğunluğunun maksimumun %50'sine düştüğü yer) olmalıdır. Beyaz LED FWHM 90 nm'den fazla yayılmalıdır. Birden fazla beyaz ışık kaynağı kullanılabilir. Deneyciler, 525 nm dalga boyunun düşük yoğunluğunu ve birden fazla dalga boyunu kapsayan geniş bir spektrum aralığını sağlamalıdır21. - Işık yoğunluğunu ölçmek ve optimize etmek için bir lüks ölçer (Malzeme Tablosu) kullanın. İstenilen yoğunluğu elde etmek için LED'leri gerektiği gibi siyah bantla (Malzeme Tablosu) kapatın.
NOT: Farklı yoğunluklar duyusal eşikleri çeşitli şekillerde etkileyebileceğinden, ışık yoğunluğunu ölçmek ve doğrulamak çok önemlidir (Şekil 1). Yoğunluk doğru değilse, istenen yoğunluğa ulaşılana kadar bazı LED'leri kapatın veya açın. - Her rafın özel bir ışığa maruz kalma kaynağı ile donatıldığından emin olmak için LED şeritleri karanlık bir odada (Malzeme Tablosu) tel rafların üst kenarlarına sabitleyin. Kafesleri sabah 8'dan akşam 6'ya kadar günde 2 saat açığa çıkarmak için LED şeritlerin üzerine zamanlayıcılar (Malzeme Tablosu) yerleştirin.
- Raflara şeffaf statik kafesler takın. Işık girişimini en aza indirirken pozlamayı optimize etmek için rafları her tarafta koyu renkli çarşaflarla (Malzeme Tablosu) tamamen kapatın.
- Bazı LED'leri kaplayarak veya ortaya çıkararak (her kafesin merkezinde 100 lüks) kafes içindeki ışık yoğunluğunun nihai optimizasyonunu elde etmek için bir lüks ölçer kullanın (Ek Şekil 1).
- Temel duyusal davranışın elde edilmesi ve maruziyetin başlaması
- Varışta, farelerin 1 hafta boyunca hayvan tesisine alışmasına izin verin. Bu alışma döneminden sonra, fareleri en az 7 gün boyunca deneycinin kullanımına alıştırın.
- Hayvanları tedavi koşullarına göre üç deney grubuna ayırın: (1) cerrahi müdahale ile birlikte yeşil ışığa maruz kalma (GLED), (2) cerrahi müdahale ile birlikte beyaz ışığa maruz kalma (WLED) ve (3) sahte cerrahi ile WLED kontrol grubu.
- Sıçanları, testten 1 saat önce, test alanıyla aynı odada, tercihen deneyci ile birlikte, bir tel örgü (Malzeme Tablosu) üzerindeki şeffaf pleksiglas kutulara alıştırın.
- Ameliyat öncesi eşikleri değerlendirmek için, temel pençe çekme eşiğini belirlemek için 4.31 filamentten (19.6 mN) başlayarak, sol arka pençede von Frey filamentleri26 ile Dixon yukarı ve aşağı yöntemini kullanarak pençe çekme eşiklerini ölçün (Malzeme Tablosu).
NOT: Mekanik hassasiyet, geri çekilme eşiği belirlenerek "yukarı ve aşağı" yöntemi kullanılarak değerlendirilmelidir. Hayvan 4.31 filamente (19.6 mN) yanıt vermezse, daha kalın olan 4.56 filamenti (39.2 mN) kullanın (bir yanıt, etkilenen pençenin geri çekilmesi, sallanması veya yalanması olarak görsel olarak not edilir). Hayvan 4.31 filamente yanıt verirse, daha ince olan 4.08 (9.8 mN) filamenti kullanın.- Hayvanlar asılı tel örgü kafeslere yerleştirilirken her bir filamenti arka pençenin plantar yüzeyine dik olarak uygulayın.
- Önceki filament boyutuna bağlı olarak artan veya azalan filament basıncını ayarlayın.
- Hayvanın sırasıyla pozitif veya negatif müteakip tepkileri olup olmadığına bağlı olarak, giderek daha kalın veya daha ince filamentler kullanmaya devam edin.
- Hem olumsuz hem de olumlu yanıtları Ek Tablo 1'de sağlanan veri sayfasına kaydedin.
NOT: Her filament sıralı bir şekilde teker teker uygulanmalıdır. İlk olumlu yanıttan sonra, aynı pençeyi farklı filamentlerle 4 kez daha test edin. Tüm hayvanlarda güvenilir sonuçlar elde etmek için, deneyi yapan kişi filamenti ayak tabanlarına uygulamaktan kaçınmalıdır.
- Hargreaves testini kullanarak termal hassasiyet taban çizgisini ölçmek için test alanıyla aynı odada testten önce fareleri 1 saat boyunca Hargreaves aparatı (Malzeme Tablosu) üzerindeki şeffaf pleksiglas kutulara alıştırın.
NOT: Hargreaves testi, farelerin birkaç saniye hareketsiz kalmasını gerektirir. Sıçanlar ilk 1 saatlik alışma süresinden sonra hala aşırı aktifse, alışma süresini gerektiği kadar uzatın. Farelerin sakin ve hareketsiz olduklarından, ancak uykuya dalmaktan kaçınmak için yeterince uyanık olduklarından emin olun. Hargreaves testini (Malzeme Tablosu) gerçekleştirmeden önce, ağrı hassasiyetini ölçmek için bir temel oluşturmak üzere kızılötesi ışık yoğunluğunu ayarlamak çok önemlidir. Amaç, geri çekilme gecikmesinin taban çizgisi için ortalama 20 s civarında olmasıdır, bu da hiper / hipoaljezi gibi ağrı yanıtındaki değişiklikleri tespit etmek için yeterli hassasiyet sağlar. Pençe çekildikten sonra, bir hareket dedektörü hem uyaranı hem de zamanlayıcıyı durdurur. Doku hasarını önlemek için maksimum 33,5 s'lik bir kesme uygulanır. - Ameliyat öncesi davranış eşiklerini değerlendirmek için, kızılötesi lazeri hayvanın sol arka pençesinin ortasına yerleştirin (Kızılötesi yayıcının kılavuz çizgilerini kullanarak).
- Hayvanın sıcağa tepki olarak pençesini geri çekmesi için geçen süreyi ölçmek için ısı uyaranını başlatın (geri çekilme gecikmesi).
NOT: Ortalama para çekme gecikmesi 20 saniyeye yakın değilse, yoğunluğu ayarlayın ve istenen ortalama belirlenene kadar testi tekrarlayın. Yoğunluk daha sonra deneyin geri kalanı için sabit tutulur. Bu çalışmada 30 (50 W) uyaran yoğunluğu kullanılmıştır. Testin tekrarlanması gerekiyorsa, testi aynı hayvan üzerinde tekrarlamadan önce 5 dakika ara verin. - Para çekme gecikmesini Ek Tablo 2'de sağlanan veri sayfasına kaydedin.
NOT: Isı uyaranının sıcaklığını etkilemekten kaçınmak için, denemeler sırasında idrarı temizleyin.
- Hayvanın sıcağa tepki olarak pençesini geri çekmesi için geçen süreyi ölçmek için ısı uyaranını başlatın (geri çekilme gecikmesi).
- Temel duyusal davranışların kazanılmasının ardından, ameliyattan önceki 4 gün boyunca (günde 8 saat, sabah 6'dan akşam 2'ye kadar) sürekli yiyecek ve suya erişim ile hayvanları ışığa maruz kalma için statik kafeslerde barındırın.
- Ağrı modelinin indüksiyonu ve duyusal eşiklerin cerrahi sonrası değerlendirilmesi
- Maruziyet 2. günde öğleden sonra 4'de sona erdikten sonra, postoperatif ağrıyı indüklemek için sol arka pençede Brennan modelini takip ederek bir insizyon ameliyatı yapın27,28.
- 5. günde maruziyete devam edin. Maruziyet 5. gün saat 2'de sona erdikten sonra, ameliyattan 1 gün sonra termal ve mekanik aşırı duyarlılığı değerlendirmek için daha önce açıklandığı gibi von Frey ve Hargreaves testlerini yapın.
- 6. günde maruziyete devam edin. Maruziyet 6. gün öğleden sonra 2'de sona erdikten sonra, ameliyattan 2 gün sonra termal ve mekanik aşırı duyarlılığı değerlendirmek için daha önce açıklandığı gibi von Frey ve Hargreaves testlerini yapın.
NOT: Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirlenen son nokta kriterlerine ulaşan herhangi bir hayvanı çalışmadan çıkarın. - Davranış testlerini tamamladıktan sonra Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirtilen protokolleri izleyerek hayvanlara ötenazi yapın.
- Hayvan veri analizi
- Mekanik duyusal eşikleri değerlendirmek için cevapların mekanik çekilme modellerini Allodynia Yazılımına (National Instruments, LabView2015) girin 29.
NOT: Yazılım, Chaplan ve ark.30 tarafından detaylandırıldığı gibi parametrik olmayan Dixon yöntemini kullanır. - Termal allodinin daha sonraki istatistiksel analizi için geri çekilme gecikmelerini bir elektronik tabloda bildirin.
- Zamanın bir fonksiyonu olarak ortalama duyarlılığı (eşikler veya gecikmeler) gösteren bir çizim oluşturun.
- Mekanik duyusal eşikleri değerlendirmek için cevapların mekanik çekilme modellerini Allodynia Yazılımına (National Instruments, LabView2015) girin 29.
2. İnsanlarda ışığa maruz kalma protokolü
- İnsan denek değerlendirmesi için pozlama odasının kurulması
- Potansiyel paraziti ortadan kaldırmak için herhangi bir harici ışık kaynağından tamamen arınmış olduğundan emin olarak pozlama odasını hazırlamakla başlayın.
NOT: Bu adım, LED ışıkların etkilerini izole etmek için gereklidir. - LED ışıkları deneklerin sandalyesinden 3-6 fit uzağa yerleştirin.
NOT: Bu aralık, tutarlı ışık yoğunluğu ve etkili maruz kalma sağlamak için önceki klinik çalışmalara dayanmaktadır. - Bir lüksmetre kullanarak istenen 90-100 lüks ışık yoğunluğu aralığını sağlayacak şekilde 2 m'lik LED şeritleri takın ( Malzeme Tablosu ve Ek Şekil 2).
- Işık şeritlerini yeniden konumlandırarak veya bazı LED'leri kaplayarak ışık yoğunluğunu optimize edin, böylece deneklerin oturdukları birincil alanda 90-100 lux almasını sağlayın.
- Potansiyel paraziti ortadan kaldırmak için herhangi bir harici ışık kaynağından tamamen arınmış olduğundan emin olarak pozlama odasını hazırlamakla başlayın.
- Mekanik zamansal toplama değerlendirmesini test etmek için alıştırma adımları
- Herhangi bir değerlendirme yapmadan önce, ellerinizi iyice yıkayarak ve ardından eldiven giyerek uygun el hijyenini sağlayın.
- Mekanik hassasiyeti değerlendirmeden önce steriliteyi sağlamak için kalibre edilmiş von Frey filamentini (6,65 mN, 300 g kuvvete eşdeğer) temizleyin ve sterilize edin.
- Yaklaşan değerlendirme için trapez kasını açığa çıkarmak için izin isteyin.
- Hastaya, von Frey filamentinin, filament bükülene kadar trapez kasının baskın olmayan tarafına uygulanacağını bildirin.
- Hastaya ağrılarını 0 ile 10 arasında bir ölçekte derecelendirmesini söyleyin, burada 0 ağrı olmadığını ve 10, operatör "Şimdi" dedikten hemen sonra hayal edilebilecek en kötü ağrıyı temsil eder.
NOT: Operatör "şimdi" dediğinde hastanın hızlı ve doğru bir yanıt verdiğinden emin olun. - Filamenti, baskın olmayan trapez kası üzerinde üç farklı noktada (1 inç aralıklarla) 3 kez uygulayın ve her uygulama arasında 5 sn ara verin.
- Deneğe von Frey filamentinin 1 saniyede bir aynı noktaya 10 kez uygulanacağını bildirin ve denekten son uygulamanın acısını değerlendirmesini isteyin.
NOT: 10 uygulamanın tümü için trapez kasında aynı noktayı kullanın. - Filamenti baskın olmayan trapezius üzerine 10 kez uygulayarak zamansal toplama etkisini ölçün ve denekten uyaranların sonundaki ağrıyı derecelendirmesini isteyin.
- Mekanik zamansal toplama için test
- Alıştırma adımlarından sonra 3 dakikalık bir ara verin ve hastaya von Frey filamentinin trapez kasının baskın tarafına uygulanacağını bildirin.
- Kalibre edilmiş von Frey filamentini temizleyin ve sterilize edin.
- Operatör "Şimdi" dedikten hemen sonra hastaya ağrısını 0 ile 10 arasında derecelendirmesini söyleyin.
- Filamenti baskın trapez kası üzerinde 3 farklı noktada (1 inç aralıklarla) 3 kez uygulayın ve her uygulama arasında 5 sn ara verin. Hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
- Deneğe von Frey filamentinin 1 saniyede bir aynı noktaya 10 kez uygulanacağını bildirin ve denekten son uygulamanın acısını derecelendirmesini isteyin.
- Filamenti baskın trapezius üzerine 10 kez uygulayarak zamansal toplama etkisini ölçün. Deneğin yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
- İşlemi 3 dakikalık aralıklarla iki kez tekrarlayın ve deneklerin yanıtlarını kayıt sayfasına kaydedin (Ek Tablo 3).
- Şartlandırılmış ağrı modülasyonu değerlendirmesi için alıştırma adımları
- 12 °C soğuk su banyosu hazırlayın (Ek Şekil 3).
NOT: Termometreyi kullanarak testten önce sıcaklığı doğrulayın (Malzeme Tablosu). Test süresi boyunca sıcaklığı ayarlamak için gerekirse fazladan buz bulundurun. - Algometreyi temizleyin ve sterilize edin.
- CPM'nin (Malzeme Tablosu) değerlendirilmesi için Medoc yazılımını kullanın.
- AlgoMed seçeneğini seçin (Ek Şekil 4). Ana ekranda, etkinleştirmek için Algometer Cihazını bulun ve tıklayın.
- Listeden doğru hastayı seçin ve test programını seçin.
- Cihazın uygulanacağı siteyi seçin. Bu alıştırma adımı için, vücut diyagramından baskın olmayan trapez kasını seçin (Ek Şekil 5).
NOT: Teste git'e tıkladıktan sonra, test ekranına yönlendirilecektir. Herhangi bir basınç uygulamadan önce, yazılım, cihazın henüz basınç uygulamadığı bir ön test gerçekleştirmesini gerektirecektir. Bu ön test, her yeni test başlatıldığında tamamlanmalıdır. - Bir test başlatın ve 5 sn zaman aşımı.
- Hastaya, cihazın uygulanan basınç miktarını ölçtüğünü ve trapezius kasının baskın olmayan tarafına basınç uygulamak için kullanılacağını bildirin. Hastadan herhangi bir ağrı hissetmeye başlar başlamaz "dur" demesini isteyin.
- Başlat'a tıklayın. Sistem, cihazı uygulamaya başlamadan önce 5 saniye bekleyecektir.
- Algometreyi trapez üzerine 30 kPa/s hızında kuvveti artırarak uygulayın (Ek Şekil 6).
- Hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
NOT: Bu çalışma için uygulanan maksimum basınç 650 kPa'dır. Bu çalışma özellikle ağrı toleransını değerlendirmez, ağrının başlangıcını değerlendirir. - Katılımcılara değerlendirme için buzlu su banyosu kullanacaklarını bildirin.
- Termometreyi (Malzeme Tablosu) kullanarak su sıcaklığının yaklaşık 12 °C olduğunu kontrol edin. 10 sn için bir zamanlayıcı ayarlayın.
- Katılımcıya, baskın elini bileğine kadar suya daldırmasını, elin gevşediğinden ve parmakların birbirinden ayrıldığından emin olmasını söyleyin.
- Operatör, 10 saniyenin sonunda "şimdi" dediğinde katılımcıdan ağrılarını 0 ile 10 arasında bir ölçekte derecelendirmesini isteyin.
- 10 saniyenin sonunda ağrı derecesini isteyin ve hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
- 12 °C soğuk su banyosu hazırlayın (Ek Şekil 3).
- Koşullu ağrı modülasyonunun test edilmesi
- Termometreyi kullanarak su sıcaklığını kontrol edin (Malzeme Tablosu).
- Algometreyi temizleyin ve sterilize edin.
- 3 dakikalık bir aradan sonra, yaklaşan değerlendirme için baskın trapezius kasını açığa çıkarmak için izin isteyerek koşullu ağrı modülasyonunun (CPM) değerlendirmesine başlayın.
- Hastadan herhangi bir ağrı hissetmeye başlar başlamaz "dur" demesini isteyin. Yazılımda başlat'a tıklayın.
- Kuvveti 30 kPa/s oranında artırarak algometreyi trapez üzerine uygulayın ve hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
- Baskın trapezius kasının farklı bölgelerinde, her biri arasında 3 dakika ara ile uygulamayı 2 kez daha tekrarlayın.
- Deneklerden cilt yağlarının birikmesinden kaynaklanan kaymayı önlemek için her uygulamadan önce algometrenin iyice temizlendiğinden ve sterilize edildiğinden emin olun.
- Hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3). Koşullu uyaran testine geçmeden önce 5 dakika bekleyin.
- Başlat'a tıklayın. Sistem, cihazı uygulamaya başlamadan önce 5 saniye bekleyecektir.
- Algometreyi temizleyin ve sterilize edin.
- Hastaya, baskın olmayan elini bileğine kadar buzlu su banyosuna daldırmasını söyleyin.
- Kuvveti 30 kPa/s oranında artırarak algometreyi trapez üzerine uygulayın ve hasta yanıtını kayıt sayfasına kaydedin (Ek Tablo 3).
- Trapezius kasının farklı bölgelerinde, her biri arasında 5 dakika ara ile uygulamayı iki kez daha tekrarlayın.
NOT: İlk taramadan sonra daha önce keşfedilmemiş bir tıbbi durum tespit edilirse, özellikle de durumun çalışmaya müdahale etme potansiyeli varsa, çalışmayı durdurun. - Temel ön maruziyet değerlerinin elde edilmesinin ardından, hastayı kendilerine atanan ışık durumuna maruz bırakmaya başlayın.
- Gönüllülere doğrudan ışık kaynağına bakmaktan kaçınmalarını söyleyin.
NOT: Bunun yerine, evlerindeki herhangi bir ortam ışığı kaynağında olduğu gibi ışığın çevresel görüşlerine girmesine izin vermelidirler (Ek Şekil 7). - Nesneleri 1,5 saat boyunca LED ışığına maruz bırakın.
NOT: Uzun süreli ışık tedavisi için, denekler 10 haftaya kadar evde maruziyeti kendi kendilerine uygularlar. Fibromiyalji Etki Anketi (FIQ), HIT-6 (Baş Ağrısı Etki Testi), PSQI (Pittsburgh Uyku Kalitesi İndeksi) ve EQ-5D-5L (genel sağlığı değerlendirmek için) gibi anketler, ağrı anketleri ile birlikte tedavinin zaman içindeki etkilerini izlemek için kullanılabilir. - Maruz kalma sırasında, gönüllüleri okuma veya yazma gibi ek ışık kaynakları gerektirmeyen faaliyetlerde bulunmaya teşvik edin.
NOT: 4-100 lux arasındaki yoğunluklar yeterli aydınlatma sağlar. - Protokole tam olarak uyulmasını sağlamak için maruz kalma süresi boyunca uyumaktan vazgeçin.
- Işığa maruz kalma terapisinden sonra, başlangıçta tamamlanan tüm ölçümleri tekrarlayın.
- İnsan veri analizi
- Mekanik zamansal toplama için, 3 temel ölçünün ortalamasını ve tekrarlanan 3 uyaranın ortalamasını hesaplayın.
- Tekrarlayan uyaranlardan sonraki ortalama ağrı derecesini ortalama başlangıç ağrı derecesine bölerek ve sonucu yüzde olarak ifade etmek için 100 ile çarparak mekanik zamansal toplama yüzdesini hesaplayın.
NOT: % 100'den büyük bir yüzde, tekrarlanan uyaranlarla ağrı algısında bir artışı gösterir ve zamansal toplamın varlığını düşündürür. - Mekanik koşullu ağrı modülasyonu (CPM) için, koşulsuz uyaranlar (soğuk banyo olmadan) sırasında elde edilen son 2 temel ağrı eşiğinin (kPa cinsinden) ortalamasını hesaplayın.
- Koşullandırma uyaranı sırasında son 2 ağrı eşiği değerinin ortalamasını (kPa cinsinden) hesaplayın.
- BGBM'yi hesaplamak için aşağıdaki denklemi kullanın:
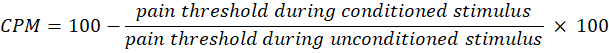
NOT: 0 CPM değeri, ağrı algısında bir değişiklik olmadığını, negatif bir değer, koşullu uyaran sırasında ağrı duyusal inhibisyonunu ve pozitif bir değer, koşullu uyaran sırasında ağrının kolaylaştığını gösterir. - Tedavinin sırasıyla artan ve azalan ağrı yollarının aktivitesini nasıl etkilediğini değerlendirmek için ışığa maruz kalmadan önce ve sonra hem zamansal toplama hem de CPM'deki değişiklikleri değerlendirin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yeşil ışığa maruz kalma, doza bağlı bir şekilde pençe çekme gecikmelerini artırır
Şekil 1A , çeşitli yoğunluklarda (4, 50, 100 ve 200 lux) yeşil ışık yayan diyotlara (GLED) maruz kalmanın, 7 günlük bir maruz kalma süresi boyunca saf bir sıçan modelinde pençe çekme gecikmelerini önemli ölçüde artırdığını ve GLED'in antinosiseptif bir etkisini gösterdiğini göstermekte...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Son çalışmalar, yeşil ışık (GLED) analjezisinin altında yatan mekanizmaları araştırmıştır 13,21,22,23,24. Bununla birlikte, klinik uygulamaya çevirisini geliştirmek için metodolojinin daha fazla standardizasyonuna ihtiyaç vardır. Klinik öncesi modellerde gözlenen doza bağlı antinosiseptif etkiler, terap?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Dr. İbrahim, Arizona Üniversitesi'ne Luxxon Therapeutics'e dışarıdan bir ilgi duyduğunu açıkladı. Bu çıkardan kaynaklanan çıkar çatışmaları, Arizona Üniversitesi tarafından politikalarına uygun olarak yönetilmektedir. Diğer tüm yazarların bildirecek herhangi bir çıkar çatışması yoktur. Makalenin yazarlarından hiçbiri başka bir şekilde herhangi bir ücret, geri ödeme veya onur ödülü almamıştır. Yazarlar, bu çalışma ile ilişkili herhangi bir satıcı veya ilaç şirketi ile bağlantılı değildir. Bu araştırma, makale veya özetin hiçbiri daha önce sunulmamıştır ve başka bir dergi tarafından yayınlanmak üzere değerlendirilmemektedir.
Teşekkürler
Bu araştırma, Arizona Üniversitesi Kapsamlı Ağrı ve Bağımlılık Merkezi (M.M.I., L.F.M.), Arizona Üniversitesi Anesteziyoloji Bölümü (LFM) ve Arizona Üniversitesi, Tıp Fakültesi, Tucson'daki Tıp Bilimcisi Eğitim Programı (MSTP) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Referanslar
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417(2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052(2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938(2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236(2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474(2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290(2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164(2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555(2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005(2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164(2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939(2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır