Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Optimierung von Photoneuromodulationstechniken zur Bewertung der Rolle von grünen Leuchtdioden in der Schmerztherapie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Jüngste Entwicklungen in der Schmerzforschung unterstreichen das Potenzial der Photoneuromodulation mit grünen Leuchtdioden (GLED) als nicht-pharmakologische Behandlung. GLED moduliert die Schmerzwege und bietet eine wirksame Schmerzlinderung. Dieser Artikel zielt darauf ab, GLED-Expositionsprotokolle zu standardisieren und zu verfeinern, die Konsistenz zwischen den Studien zu verbessern und die klinische Anwendung dieser Therapie voranzutreiben.
Zusammenfassung
Trotz umfangreicher Forschung und der Identifizierung zahlreicher schmerzstillender Ziele ist das Spektrum der pharmakologischen Behandlungen für Schmerzen nach wie vor begrenzt. Ein möglicher Paradigmenwechsel könnte jedoch eine neue Welle nicht-pharmakologischer Schmerzbehandlungen mit bemerkenswerter Sicherheit, Wirksamkeit und Verträglichkeit einleiten. Ein vielversprechendes Forschungsgebiet ist die Photoneuromodulation mit grünen Leuchtdioden (GLED, 525 nm), die das Potenzial zur Schmerzlinderung sowohl bei akuten als auch bei chronischen Erkrankungen gezeigt haben, was zu zahlreichen präklinischen und klinischen Studien führte, die die Wirksamkeit dieser Therapie untersuchten. Diese Forschungsprojekte haben gezeigt, wie die Exposition gegenüber GLED die Aktivität des endogenen Opioidsystems im Gehirn und im Rückenmark nach der Aktivierung des M-Zapfens in der Netzhaut erhöht. Die Ergebnisse deuten darauf hin, dass GLED Schmerzen lindern kann, indem es den absteigenden Schmerzweg moduliert. Angesichts der überzeugenden Wirkung von GLED unterstreicht die Zunahme von Photoneuromodulationsuntersuchungen, wie wichtig es ist, Konsistenz in klar definierten und standardisierten Expositionsprotokollen für präklinische und klinische Studien herzustellen. In präklinischen Studien wurden positive Wirkungen nach einer Exposition von mindestens 2 Tagen beobachtet, wobei die Protokolle 8 Stunden Licht bei 100 Lux während der 12-stündigen Lichtphase umfassten. In klinischen Studien werden die Expositionsprotokolle auf die jeweilige untersuchte Pathologie zugeschnitten. Eine Exposition von 15 Minuten hat sich bei der Modulation akuter postoperativer Schmerzen als günstig erwiesen. Zur Modulation chronischer Schmerzen werden die Patienten angewiesen, GLED zu Hause für 1 bis 2 Stunden pro Tag über einen Zeitraum von 10 Wochen zu verwenden. In diesem Artikel werden präklinische und klinische Protokolle zur Verbesserung der Reproduzierbarkeit und Konsistenz in den verschiedenen Studien zur Bewertung der Vorteile der Photoneuromodulation beschrieben. Durch die Etablierung dieser standardisierten Protokolle zielt diese Arbeit darauf ab, die klinische Translation der GLED-Phototherapie als praktikable nicht-pharmakologische Behandlung von Schmerzen voranzutreiben.
Einleitung
Pharmakologische Behandlungen, insbesondere Opioide, werden bei der Behandlung von akuten und chronischen Schmerzzuständen nach wie vor stark eingesetzt1. Die Wirksamkeit der Schmerztherapie kann erheblich von der Häufigkeit und Schwere der Nebenwirkungen im Zusammenhang mit dem Opioidkonsum beeinflusst werden2. Aus diesem Grund erreicht eine beträchtliche Anzahl von Patienten unter Opioidbehandlung keine erfolgreiche Schmerzbehandlung3. Daher suchen Schmerzmediziner und die Patientengemeinschaft zunehmend nach nicht-pharmakologischen Behandlungen, die die mit herkömmlichen Schmerzmitteln verbundenen Nebenwirkungen vermeiden. Die Photoneuromodulation hat sich als vielversprechende Lösung und sichere Therapie zur Schmerzbehandlung erwiesen.
Die Photoneuromodulation (PNM) ist eine nicht-invasive Technik, bei der Leuchtdioden (LED) verwendet werden, um biologische Prozesse zu regulieren4. Die Phototherapie wurde vor Tausenden von Jahren mit Sonnenlicht oder Heliotherapie zur Behandlung von Hauterkrankungen etabliert5. In der Folge hat sich das Konzept der Beeinflussung biologischer Gewebe durch Licht erweitert, was zur Entwicklung des Begriffs der Photoneuromodulation führte. Die PNM-Forschung expandiert derzeit weltweit und hat ihre Wirksamkeit in einer Vielzahl klinischer Anwendungen gezeigt, darunter die Schmerztherapie 6,7,8,9, die Verbesserung der Schlafqualität bei Patienten mit Alzheimer-Krankheit 10 und die Kontrolle von Depressionen 11.
Präklinische Forschung und klinische Studien, die darauf abzielen, die Mechanismen und das therapeutische Potenzial der Photoneuromodulation für die Schmerztherapie zu untersuchen, rücken immer mehr in den Vordergrund. Unter diesen Ansätzen hat die grüne Leuchtdiodentherapie (GLED) mit einer Wellenlängenstimulation von 525 nm eine vielversprechende Wirksamkeit bei der Verringerung verschiedener Arten von Schmerzen gezeigt, einschließlich Migräne, Fibromyalgie und postoperativer Schmerzen 12,13,14,15,16. Klinische Studien haben in mehreren Studien gezeigt, dass die Green-Light-Therapie Patienten, die an Migräne leiden, durchweg zugute kommt 12,17,18, indem sie sowohl Kopfschmerzen als auch die Intensität der Photophobie während aktiver Migräneattacken reduziert19 sowie die Häufigkeit und Dauer von Migräneepisoden verringert 12. Präklinische Studien zeigten auch, dass die Exposition gegenüber GLED die thermische und mechanische Überempfindlichkeit in einem Nervenverletzungsmodell für neuropathische Schmerzen umkehren kann20. Darüber hinaus wurden in präklinischen Studien die Mechanismen untersucht, durch die GLED die Schmerzwahrnehmung und die sensorischen Schwellenwerte beeinflusst 13,21,22,23,24. Diese Studien unterstreichen die Beteiligung von M-Zapfen und die anschließende Modulation des ventralen lateralen Genikulatkerns (vLGN), was die Aktivität der enkephalinergen Neuronen erhöht, die zum dorsalen Raphe-Kern (DRN) projizieren22. Zusätzliche Forschungen haben auch die entscheidende Rolle der rostralen ventromedialen Medulla (RVM)21 hervorgehoben, einem Schlüsselregulator der absteigenden Schmerzmodulation. Zusammenfassend deuten diese Ergebnisse darauf hin, dass GLED die Schmerzwahrnehmung verändert, indem es visuelle Schaltkreise moduliert, die auf die absteigenden Schmerzbahnen wirken20,25. Es bedarf jedoch weiterer Forschung, um die Umsetzung in die klinische Anwendung zu erleichtern.
In diesem Artikel beschreiben wir eine umfassende Methodik für die Implementierung von GLED-basiertem PNM, die darauf abzielt, einen reproduzierbaren Rahmen sowohl für den experimentellen als auch für den klinischen Einsatz zu schaffen. Wir beschreiben das Design und den Betrieb der GLED-Exposition, skizzieren standardisierte Anwendungsprotokolle und diskutieren wichtige Überlegungen zur Sicherstellung von Wirksamkeit und Reproduzierbarkeit. Darüber hinaus stellen wir ein detailliertes Protokoll zur Beurteilung der Aktivität sowohl der aufsteigenden als auch der absteigenden Schmerzbahnen zur Verfügung, was eine tiefere Untersuchung ihrer Rolle bei der Modulation der GLED-induzierten Analgesie ermöglicht. Mit diesem Ansatz wollen wir die Forschung in der nicht-pharmakologischen Schmerztherapie vorantreiben und dazu beitragen, zugängliche, wirksame und sicherere Therapien zu entwickeln.
Protokoll
Alle Tierverfahren wurden vom Institutional Animal Care and Use Committee der University of Arizona genehmigt und entsprechen den Richtlinien für die Verwendung von Versuchstieren der National Institutes of Health. Erregerfreie, erwachsene Sprague-Dawley-Ratten (Gewicht bei der Untersuchung: 275-330 g) wurden in Standard-Vivarium-Rattenkäfigen (3 Ratten pro Käfig) in klimatisierten Räumen in einem 12-stündigen Hell-Dunkel-Zyklus untergebracht und erhielten frei Zugang zu Futter und Wasser. Alle Verhaltensexperimente wurden von Experimentatoren durchgeführt, die für die Behandlungsbedingungen verblindet waren. Alle menschlichen Eingriffe wurden vom Institutional Review Board (IRB) der University of Arizona unter der Protokollnummer (STUDY00000370) genehmigt. Diese Studie ist bei ClinicalTrials.gov unter NCT05295225 registriert.
1. Protokoll der Lichtexposition bei Tieren
- Optimierung der Lichteinwirkung und Vorbereitung der Tierhaltung
- Erhalten Sie Flexstreifen für Leuchtdioden (LED) im sichtbaren Spektrum mit den folgenden Eigenschaften: (i) Grüne LEDs (Materialtabelle), Wellenlänge von 525 nm, Leistung von 8 W, Spannung von 120 V und einem Abstrahlwinkel von 120°. (ii) Weiße LEDs (Materialtabelle), Leistung von 9,6 W, Spannung von 120 V und ein Abstrahlwinkel von 120°.
- Stellen Sie die Genauigkeit des Lichtspektrums mit einem Spektrometer sicher (für diese Studie haben wir den Biomedical Device Prototyping Service des BIO5 Institute an der University of Arizona verwendet).
HINWEIS: Die grüne LED sollte eine Mittenwellenlänge von 525 ± 10 nm (dem hellsten Emissionspunkt), eine Halbbreite (FWHM) über die gesamte Breite, die sich über weniger als 40 nm erstreckt, und einen Rekordintensitätsabfall (bei dem die Lichtintensität auf 50 % des Maximums abfällt) haben, der bei 500 ± 5 nm und 530 ± 5 nm21 liegen sollte. Die weiße LED-Halbschärfe sollte mehr als 90 nm umfassen. Es können mehrere Quellen für weißes Licht verwendet werden. Die Experimentatoren müssen die geringe Intensität der Wellenlänge von 525 nm und eine große Spanne des Spektrums sicherstellen, die mehrere Wellenlängen abdeckt21. - Verwenden Sie ein Luxmeter (Table of Materials), um die Lichtintensität zu messen und zu optimieren. Decken Sie die LEDs nach Bedarf mit schwarzem Klebeband (Materialtabelle) ab, um die gewünschte Intensität zu erreichen.
HINWEIS: Es ist wichtig, die Lichtintensität zu messen und zu validieren, da unterschiedliche Intensitäten die sensorischen Schwellenwerte auf unterschiedliche Weise beeinflussen können (Abbildung 1). Wenn die Intensität nicht genau ist, decken Sie einige der LEDs ab oder legen Sie sie frei, bis die gewünschte Intensität erreicht ist. - Befestigen Sie die LED-Streifen an den Oberkanten von Drahtregalen in einem dunklen Raum (Materialtabelle), um sicherzustellen, dass jedes Regal mit einer speziellen Lichtquelle ausgestattet ist. Platzieren Sie Zeitschaltuhren (Table of Materials) auf den LED-Streifen, um die Käfige 8 Stunden pro Tag von 6 bis 14 Uhr freizulegen.
- Installieren Sie transparente statische Käfige auf den Regalen. Umschließen Sie die Regale an allen Seiten vollständig mit dunklen Blechen (Materialtabelle), um die Belichtung zu optimieren und gleichzeitig Lichtinterferenzen zu minimieren.
- Verwenden Sie ein Luxmeter, um die Lichtintensität im Käfig endgültig zu optimieren, indem Sie einige der LEDs abdecken oder freilegen (100 Lux in der Mitte jedes Käfigs) (Ergänzende Abbildung 1).
- Beeinträchtigung des sensorischen Ausgangsverhaltens und Beginn der Exposition
- Lassen Sie die Ratten bei Ihrer Ankunft 1 Woche lang an die Tieranlage gewöhnen. Nach dieser Eingewöhnungsphase gewöhnen Sie die Ratten mindestens 7 Tage lang an die Handhabung durch den Versuchsleiter.
- Kategorisieren Sie die Tiere in drei Versuchsgruppen, basierend auf ihren Behandlungsbedingungen: (1) Grünlichtexposition (GLED) in Kombination mit chirurgischen Eingriffen, (2) Weißlichtexposition (WLED) in Kombination mit chirurgischen Eingriffen und (3) WLED-Kontrollgruppe mit Scheinoperation.
- Die Ratten werden vor dem Test 1 Stunde lang in durchsichtigen Plexiglasboxen auf einem Drahtgeflecht (Materialtabelle) im selben Raum wie der Testbereich akklimatisiert, vorzugsweise in Anwesenheit des Versuchsleiters.
- Um die präoperativen Schwellenwerte zu bestimmen, messen Sie die Pfotenentnahmeschwellen mit der Dixon-Auf-und-Ab-Methode mit von Frey-Filamenten26 an der linken Hinterpfote (Tabelle der Materialien), beginnend mit dem 4,31-Filament (19,6 mN), um die Ausgangsschwelle für die Pfotenentnahme zu bestimmen.
HINWEIS: Die mechanische Empfindlichkeit sollte nach der "Auf-und-Ab"-Methode beurteilt werden, indem die Entnahmeschwelle bestimmt wird. Wenn das Tier nicht auf das 4,31er Filament (19,6 mN) reagiert, verwenden Sie das dickere 4,56 Filament (39,2 mN) (eine Reaktion wird visuell als Zurückziehen, Schütteln oder Lecken der betroffenen Pfote vermerkt). Wenn das Tier auf das Filament 4.31 reagiert, verwenden Sie das dünnere Filament 4.08 (9.8 mN).- Tragen Sie jedes Filament senkrecht zur Plantaroberfläche der Hinterpfote auf, während die Tiere in hängenden Drahtgeflechtkäfigen positioniert werden.
- Passe den Filamentdruck basierend auf der vorherigen Filamentgröße an, entweder erhöhen oder verringernd.
- Verwenden Sie weiterhin entweder immer dickere oder dünnere Filamente, je nachdem, ob das Tier in der Folge positiv oder negativ reagiert hat.
- Notieren Sie sowohl negative als auch positive Antworten auf dem Datenblatt in der ergänzenden Tabelle 1.
HINWEIS: Jedes Filament sollte nacheinander nacheinander aufgetragen werden. Nach der ersten positiven Reaktion testen Sie die gleiche Pfote noch 4 Mal mit verschiedenen Filamenten. Um zuverlässige Ergebnisse bei allen Tieren zu gewährleisten, muss der Versuchsleiter vermeiden, das Filament auf die Fußballen aufzutragen.
- Akklimatisieren Sie die Ratten 1 Stunde lang in durchsichtigen Plexiglasboxen auf dem Hargreaves-Gerät (Materialtabelle), bevor Sie im selben Raum wie der Testbereich testen, um die Ausgangstemperatur der thermischen Empfindlichkeit mit dem Hargreaves-Test zu messen.
HINWEIS: Der Hargreaves-Test erfordert, dass die Ratten einige Sekunden lang still bleiben. Wenn die Ratten nach der anfänglichen 1-stündigen Gewöhnungsphase immer noch übermäßig aktiv sind, verlängern Sie die Eingewöhnungszeit nach Bedarf. Stellen Sie sicher, dass die Ratten ruhig und unbeweglich, aber wachsam genug sind, um nicht einzuschlafen. Vor der Durchführung des Hargreaves-Tests (Materialtabelle) ist es entscheidend, die Intensität des Infrarotlichts einzustellen, um eine Ausgangsbasis für die Messung der Schmerzempfindlichkeit zu schaffen. Das Ziel ist es, dass die Entzugslatenz zu Studienbeginn durchschnittlich bei etwa 20 s liegt, was eine ausreichende Empfindlichkeit bietet, um Veränderungen der Schmerzreaktion, wie z. B. Hyper-/Hypoalgesie, zu erkennen. Beim Zurückziehen der Pfote stoppt ein Bewegungsmelder sowohl den Reiz als auch den Timer. Um Gewebeschäden zu vermeiden, wird ein maximaler Cutoff von 33,5 s angewendet. - Um die präoperativen Verhaltensschwellen zu beurteilen, platzieren Sie den Infrarotlaser unter der Mitte der linken Hinterpfote des Tieres (unter Verwendung der Hilfslinien des Infrarotstrahlers).
- Starten Sie den Hitzereiz, um die Zeit zu messen, die das Tier benötigt, um seine Pfote als Reaktion auf die Hitze zurückzuziehen (Entzugslatenz).
HINWEIS: Wenn die durchschnittliche Entnahmelatenz nicht annähernd 20 s beträgt, passen Sie die Intensität an und wiederholen Sie den Test, bis der gewünschte Durchschnitt bestimmt ist. Die Intensität wird dann für den Rest des Experiments konstant gehalten. In dieser Studie haben wir eine Stimulusintensität von 30 (50 W) verwendet. Wenn der Test wiederholt werden muss, warten Sie einen Abstand von 5 Minuten, bevor Sie den Test an demselben Tier wiederholen. - Notieren Sie die Abhebungslatenz auf dem Datenblatt in der ergänzenden Tabelle 2.
HINWEIS: Um eine Beeinflussung der Temperatur des Wärmereizes zu vermeiden, reinigen Sie den Urin während der Versuche.
- Starten Sie den Hitzereiz, um die Zeit zu messen, die das Tier benötigt, um seine Pfote als Reaktion auf die Hitze zurückzuziehen (Entzugslatenz).
- Nach dem Erwerb des sensorischen Grundverhaltens werden die Tiere 4 Tage vor der Operation (8 Stunden pro Tag, von 6 bis 14 Uhr) in statischen Käfigen mit kontinuierlichem Zugang zu Futter und Wasser untergebracht.
- Induktion des Schmerzmodells und postoperative Bewertung der sensorischen Schwellen
- Nach Beendigung der Exposition um 14 Uhr an Tag 4 ist eine Inzisionsoperation nach dem Brennan-Modell an der linken Hinterpfote durchzuführen, um postoperative Schmerzen zu induzieren27,28.
- Setzen Sie die Exposition an Tag 5 fort. Nachdem die Exposition an Tag 5 um 14 Uhr beendet ist, führen Sie die von-Frey- und Hargreaves-Tests wie zuvor beschrieben durch, um die thermische und mechanische Überempfindlichkeit 1 Tag nach der Operation zu bewerten.
- Setzen Sie die Exposition an Tag 6 fort. Nachdem die Exposition an Tag 6 um 14 Uhr beendet ist, führen Sie die von-Frey- und Hargreaves-Tests wie zuvor beschrieben durch, um die thermische und mechanische Überempfindlichkeit 2 Tage nach der Operation zu bewerten.
HINWEIS: Jedes Tier ist von der Studie auszuschließen, wenn es die vom Institutional Animal Care and Use Committee festgelegten Endpunktkriterien erreicht. - Führen Sie nach Abschluss der Verhaltenstests eine Euthanasie an den Tieren gemäß den vom Institutional Animal Care and Use Committee festgelegten Protokollen durch.
- Analyse von Tierversuchen
- Geben Sie die mechanischen Entnahmemuster der Antworten in die Allodynia Software (National Instruments, LabView 2015) ein, um die mechanischen sensorischen Schwellenwertezu bewerten 29.
HINWEIS: Die Software verwendet die nichtparametrische Dixon-Methode, wie von Chaplan et al.30 beschrieben. - Melden Sie die Entnahmelatenzen in einer Tabelle für die anschließende statistische Analyse der thermischen Allodynie.
- Generieren Sie ein Diagramm, das die mittlere Empfindlichkeit (Schwellenwerte oder Latenzen) als Funktion der Zeit anzeigt.
- Geben Sie die mechanischen Entnahmemuster der Antworten in die Allodynia Software (National Instruments, LabView 2015) ein, um die mechanischen sensorischen Schwellenwertezu bewerten 29.
2. Lichtexpositionsprotokoll beim Menschen
- Einrichten des Expositionsraums für die Bewertung von Probanden
- Beginnen Sie mit der Vorbereitung des Belichtungsraums und stellen Sie sicher, dass er vollständig frei von externen Lichtquellen ist, um mögliche Interferenzen zu vermeiden.
HINWEIS: Dieser Schritt ist wichtig, um die Auswirkungen der LED-Leuchten zu isolieren. - Positionieren Sie die LED-Leuchten in einem Abstand von 3-6 Fuß vom Stuhl des Probanden.
HINWEIS: Dieser Bereich basiert auf früheren klinischen Studien, um eine gleichbleibende Lichtintensität und effektive Belichtung zu gewährleisten. - Montieren Sie die 2 m langen LED-Streifen und stellen Sie den gewünschten Lichtintensitätsbereich von 90-100 Lux mit einem Luxmeter sicher (Materialtabelle und ergänzende Abbildung 2).
- Optimieren Sie die Lichtintensität, indem Sie die Lichtstreifen neu positionieren oder einige der LEDs abdecken, um sicherzustellen, dass die Motive im primären Bereich, in dem sie sitzen, 90-100 Lux erhalten.
- Beginnen Sie mit der Vorbereitung des Belichtungsraums und stellen Sie sicher, dass er vollständig frei von externen Lichtquellen ist, um mögliche Interferenzen zu vermeiden.
- Einführungsschritte zum Testen der mechanischen zeitlichen Summenauswertung
- Stellen Sie vor der Durchführung einer Bewertung die richtige Handhygiene sicher, indem Sie sich gründlich die Hände waschen und anschließend Handschuhe anziehen.
- Reinigen und desinfizieren Sie das kalibrierte von-Frey-Filament (6,65 mN, entspricht 300 g Kraft), um die Sterilität zu gewährleisten, bevor Sie die mechanische Empfindlichkeit bewerten.
- Beantragen Sie die Erlaubnis, den Trapezmuskel für die bevorstehende Untersuchung freizulegen.
- Informieren Sie den Patienten, dass das von-Frey-Filament auf der nicht-dominanten Seite des Trapezmuskels angelegt wird, bis sich das Filament biegt.
- Weisen Sie den Patienten an, seine Schmerzen auf einer Skala von 0 bis 10 zu bewerten, wobei 0 für keine Schmerzen und 10 für die schlimmsten Schmerzen steht, die man sich vorstellen kann, unmittelbar nachdem der Bediener "Jetzt" gesagt hat.
HINWEIS: Stellen Sie sicher, dass der Patient eine schnelle und genaue Antwort gibt, wenn der Bediener "Jetzt" sagt. - Tragen Sie das Filament 3 Mal an drei verschiedenen Punkten (1 Zoll Abstand) auf den nicht dominanten Trapezmuskel auf, wobei Sie zwischen jeder Anwendung ein Intervall von 5 s einhalten müssen.
- Informieren Sie den Probanden, dass von Frey Filament 10 Mal einmal pro 1 s auf die gleiche Stelle aufgetragen wird, und bitten Sie den Probanden, den Schmerz der letzten Anwendung zu bewerten.
HINWEIS: Verwenden Sie für alle 10 Anwendungen die gleiche Stelle auf dem Trapezmuskel. - Messen Sie den temporalen Summationseffekt, indem Sie das Filament 10 Mal auf den nicht-dominanten Trapezius auftragen und bitten Sie den Probanden, den Schmerz am Ende der Stimuli zu bewerten.
- Prüfung der mechanischen zeitlichen Summierung
- Gönnen Sie sich nach den Eingewöhnungsschritten eine 3-minütige Pause und informieren Sie den Patienten, dass das von-Frey-Filament auf die dominante Seite des Trapezmuskels aufgebracht wird.
- Reinigen und desinfizieren Sie das kalibrierte von Frey Filament.
- Weisen Sie den Patienten an, seine Schmerzen auf einer Skala von 0 bis 10 zu bewerten, unmittelbar nachdem der Bediener "Jetzt" gesagt hat.
- Tragen Sie das Filament 3 Mal an 3 verschiedenen Punkten (1 Zoll Abstand) auf den dominanten Trapezmuskel auf, wobei Sie zwischen jeder Anwendung ein Intervall von 5 s einhalten müssen. Halten Sie das Ansprechen des Patienten auf dem Aktblatt fest (Ergänzende Tabelle 3).
- Informieren Sie den Probanden, dass das von-Frey-Filament 10 Mal pro 1 s auf die gleiche Stelle aufgetragen wird, und bitten Sie den Probanden, den Schmerz der letzten Anwendung zu bewerten.
- Messen Sie den temporalen Summationseffekt, indem Sie das Filament 10 Mal auf den dominanten Trapezius auftragen. Notieren Sie die Antwort des Probanden auf dem Schaublatt (Ergänzende Tabelle 3).
- Wiederholen Sie den Vorgang zweimal im Abstand von 3 Minuten und notieren Sie die Antworten der Probanden auf dem Aufzeichnungsblatt (Ergänzende Tabelle 3).
- Eingewöhnungsschritte für die Bewertung der konditionierten Schmerzmodulation
- Bereiten Sie ein 12 °C kaltes Wasserbad vor (Ergänzende Abbildung 3).
HINWEIS: Überprüfen Sie die Temperatur vor dem Test mit dem Thermometer (Materialtabelle). Nehmen Sie bei Bedarf zusätzliches Eis bereit, um die Temperatur während des Testzeitraums anzupassen. - Reinigen und desinfizieren Sie das Algometer.
- Verwenden Sie die Medoc-Software zur Bewertung des CPM (Table of Materials).
- Wählen Sie die Option AlgoMed (Ergänzende Abbildung 4). Suchen Sie auf dem Startbildschirm das Algometer-Gerät und klicken Sie darauf, um es zu aktivieren.
- Wählen Sie den richtigen Patienten aus der Liste aus und wählen Sie das Testprogramm aus.
- Wählen Sie den Standort aus, an dem das Gerät angewendet werden soll. Wählen Sie für diesen Eingewöhnungsschritt den nicht-dominanten Trapezmuskel aus dem Körperdiagramm aus (Ergänzende Abbildung 5).
HINWEIS: Nachdem Sie auf "Zum Test gehen" geklickt haben, werden Sie zum Testbildschirm weitergeleitet. Bevor Druck ausgeübt wird, verlangt die Software, dass man einen Vortest durchführt, bei dem das Gerät noch keinen Druck ausübt. Dieser Vortest muss jedes Mal abgeschlossen werden, wenn ein neuer Test gestartet wird. - Starten Sie einen Test und es kommt zu einer Zeitüberschreitung von 5 s.
- Informieren Sie den Patienten, dass das Gerät die Höhe des ausgeübten Drucks misst und verwendet wird, um Druck auf die nicht-dominante Seite des Trapezmuskels auszuüben. Bitten Sie den Patienten, "Stopp" zu sagen, sobald er Schmerzen verspürt.
- Klicken Sie auf Start. Das System erzwingt eine Wartezeit von 5 Sekunden, bevor mit der Anwendung des Geräts begonnen wird.
- Bringen Sie das Algometer auf den Trapezius an, indem Sie die Kraft mit einer Geschwindigkeit von 30 kPa/s erhöhen (Ergänzende Abbildung 6).
- Halten Sie das Ansprechen des Patienten auf dem Aktblatt fest (Ergänzende Tabelle 3).
HINWEIS: Für diese Studie beträgt der maximal ausgeübte Druck 650 kPa. Diese Studie bewertet speziell das Einsetzen von Schmerzen, nicht die Schmerztoleranz. - Informieren Sie die Teilnehmer, dass sie für die Bewertung ein Eiswasserbad verwenden werden.
- Überprüfen Sie die Wassertemperatur mit dem Thermometer (Materialtabelle) auf etwa 12 °C. Stellen Sie einen Timer auf 10 s ein.
- Weisen Sie den Teilnehmer an, seine dominante Hand bis zum Handgelenk ins Wasser zu tauchen, wobei Sie darauf achten, dass die Hand entspannt ist und die Finger gespreizt sind.
- Bitten Sie den Teilnehmer, seine Schmerzen auf einer Skala von 0 bis 10 zu bewerten, wenn der Bediener am Ende von 10 s "jetzt" sagt.
- Fragen Sie nach der Schmerzbewertung am Ende der 10 s und vermerken Sie die Reaktion des Patienten auf dem Aufzeichnungsblatt (Ergänzende Tabelle 3).
- Bereiten Sie ein 12 °C kaltes Wasserbad vor (Ergänzende Abbildung 3).
- Erprobung der konditionierten Schmerzmodulation
- Überprüfen Sie die Wassertemperatur mit dem Thermometer (Materialtabelle).
- Reinigen und desinfizieren Sie das Algometer.
- Beginnen Sie nach einer 3-minütigen Pause mit der Bewertung der konditionierten Schmerzmodulation (CPM), indem Sie die Erlaubnis beantragen, den dominanten Trapezmuskel für die bevorstehende Beurteilung freizulegen.
- Bitten Sie den Patienten, "Stopp" zu sagen, sobald er Schmerzen verspürt. Klicken Sie in der Software auf Start.
- Wenden Sie das Algometer am Trapezius an, indem Sie die Kraft mit einer Rate von 30 kPa/s erhöhen und das Ansprechen des Patienten auf dem Aktblatt aufzeichnen (Ergänzende Tabelle 3).
- Wiederholen Sie die Anwendung noch 2 Mal an verschiedenen Stellen des dominanten Trapezmuskels, mit einem Abstand von jeweils 3 Minuten.
- Stellen Sie sicher, dass das Algometer vor jeder Anwendung gründlich gereinigt und desinfiziert wird, um ein Verrutschen durch die Ansammlung von Hautölen von Probanden zu verhindern.
- Halten Sie das Ansprechen des Patienten auf dem Aktblatt fest (Ergänzende Tabelle 3). Warten Sie 5 Minuten, bevor Sie zum konditionierten Stimulustest übergehen.
- Klicken Sie auf Start. Das System erzwingt eine Wartezeit von 5 Sekunden, bevor mit der Anwendung des Geräts begonnen wird.
- Reinigen und desinfizieren Sie das Algometer.
- Weisen Sie den Patienten an, seine nicht dominante Hand bis zum Handgelenk in das Eiswasserbad zu tauchen.
- Wenden Sie das Algometer am Trapezius an, indem Sie die Kraft mit einer Rate von 30 kPa/s erhöhen und das Ansprechen des Patienten auf dem Aktblatt aufzeichnen (Ergänzende Tabelle 3).
- Wiederholen Sie die Anwendung noch zwei weitere Male an verschiedenen Stellen des Trapezmuskels, mit einem Abstand von jeweils 5 Minuten.
HINWEIS: Brechen Sie die Studie ab, wenn nach dem ersten Screening eine bisher unentdeckte Erkrankung festgestellt wird, insbesondere wenn die Erkrankung die Studie beeinträchtigen könnte. - Beginnen Sie nach der Erfassung der Ausgangswerte vor der Exposition, den Patienten den ihm zugewiesenen Lichtbedingungen auszusetzen.
- Weisen Sie die Freiwilligen an, nicht direkt auf die Lichtquelle zu starren.
HINWEIS: Stattdessen sollten sie das Licht in ihr peripheres Sichtfeld eindringen lassen, wie sie es bei jeder Umgebungslichtquelle in ihrem Zuhause tun würden (Ergänzende Abbildung 7). - Setzen Sie die Motive 1,5 Stunden lang LED-Licht aus.
HINWEIS: Bei längerer Lichtbehandlung verabreichen sich die Probanden bis zu 10 Wochen lang selbst zu Hause. Umfragen wie der Fibromyalgia Impact Questionnaire (FIQ), der HIT-6 (Headache Impact Test), der PSQI (Pittsburgh Sleep Quality Index) und der EQ-5D-5L (zur Beurteilung des allgemeinen Gesundheitszustands) sowie Schmerzfragebögen können verwendet werden, um die Auswirkungen der Behandlung im Laufe der Zeit zu überwachen. - Ermutigen Sie die Freiwilligen während der Exposition, sich an Aktivitäten zu beteiligen, die keine zusätzlichen Lichtquellen erfordern, wie z. B. Lesen oder Schreiben.
HINWEIS: Intensitäten von 4-100 Lux sorgen für eine ausreichende Ausleuchtung. - Raten Sie davon ab, während der Expositionszeit zu schlafen, um die vollständige Einhaltung des Protokolls zu gewährleisten.
- Wiederholen Sie nach der Lichtexpositionstherapie alle Messungen, die zu Beginn durchgeführt wurden.
- Analyse menschlicher Daten
- Berechnen Sie für die mechanische zeitliche Summierung den Durchschnitt der 3 Ausgangsmaße und den Durchschnitt der 3 wiederholten Stimuli.
- Berechnen Sie den Prozentsatz der mechanischen temporalen Summierung, indem Sie die durchschnittliche Schmerzbewertung nach den sich wiederholenden Stimuli durch die durchschnittliche Schmerzbewertung zu Studienbeginn dividieren und das Ergebnis mit 100 multiplizieren, um es als Prozentsatz auszudrücken.
HINWEIS: Ein Prozentsatz von mehr als 100% deutet auf eine Zunahme der Schmerzwahrnehmung bei wiederholten Reizen hin, was auf das Vorhandensein einer temporalen Summation hindeutet. - Für die mechanisch konditionierte Schmerzmodulation (CPM) berechnen Sie den Durchschnitt der letzten 2 Schmerzschwellen (in kPa), die während der unkonditionierten Stimuli (ohne kaltes Bad) erhalten wurden.
- Berechnen Sie den Mittelwert der letzten 2 Schmerzschwellenwerte (in kPa) während des Konditionierungsreizes.
- Verwenden Sie die folgende Gleichung, um den CPM zu berechnen:
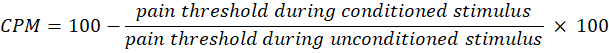
HINWEIS: Ein CPM-Wert von 0 zeigt an, dass sich die Schmerzwahrnehmung nicht geändert hat, ein negativer Wert zeigt eine schmerzsensorische Hemmung während des konditionierten Stimulus an und ein positiver Wert zeigt eine Schmerzlinderung während des konditionierten Stimulus an. - Bewerten Sie die Veränderungen sowohl der temporalen Summation als auch der CPM vor und nach der Lichtexposition, um zu beurteilen, wie sich die Therapie auf die Aktivität der aufsteigenden bzw. absteigenden Schmerzwege auswirkt.
Ergebnisse
Die Exposition mit grünem Licht erhöht die Latenzen des Pfotenentzugs dosisabhängig
Abbildung 1A zeigt, dass die Exposition gegenüber grünen Leuchtdioden (GLED) bei verschiedenen Intensitäten (4, 50, 100 und 200 Lux) die Latenzen des Pfotenentzugs in einem naiven Rattenmodell über einen Zeitraum von 7 Tagen signifikant erhöhte, was auf eine antinozizeptive Wirkung von GLED hinweist. Die Ausgangsla...
Diskussion
Neuere Studien haben die Mechanismen untersucht, die der Analgesie des grünen Lichts (GLED) zugrunde liegen 13,21,22,23,24. Eine weitere Standardisierung der Methodik ist jedoch erforderlich, um ihre Umsetzung in die klinische Praxis zu verbessern. Die dosisabhängigen antinozizeptiven Effekte, die in präklinischen Modellen ...
Offenlegungen
Dr. Ibrahim hat der University of Arizona eine externe Beteiligung an Luxxon Therapeutics offengelegt. Interessenkonflikte, die sich aus diesem Interesse ergeben, werden von der University of Arizona in Übereinstimmung mit ihren Richtlinien gehandhabt. Alle anderen Autoren haben keinen Interessenkonflikt zu melden. Keiner der Autoren des Manuskripts erhielt eine Vergütung, Erstattung oder ein Honorar in sonstiger Weise. Die Autoren sind nicht mit einem Anbieter oder Pharmaunternehmen verbunden, das mit dieser Studie in Verbindung steht. Keines dieser Forschungsergebnisse, Manuskripte oder Abstracts wurde zuvor vorgestellt und wird auch nicht für eine Veröffentlichung in einer anderen Zeitschrift in Betracht gezogen.
Danksagungen
Diese Forschung wurde vom Comprehensive Center for Pain and Addiction-University of Arizona (M.M.I., L.F.M.), der Abteilung für Anästhesiologie an der University of Arizona (L.F.M.) und dem Medical Scientist Training Program (MSTP) an der University of Arizona, College of Medicine, Tucson, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Referenzen
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten