Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Optimisation des techniques de photoneuromodulation pour évaluer le rôle des diodes électroluminescentes vertes dans la gestion de la douleur
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les développements récents dans la recherche sur la douleur mettent en évidence le potentiel de la photoneuromodulation à l’aide de diodes électroluminescentes vertes (GLED) comme traitement non pharmacologique. GLED module les voies de la douleur, offrant un soulagement efficace de la douleur. Cet article vise à normaliser et à affiner les protocoles d’exposition au GLED, à améliorer la cohérence entre les études et à faire progresser l’application clinique de cette thérapie.
Résumé
Malgré des recherches approfondies et l’identification de nombreuses cibles analgésiques, la gamme de traitements pharmacologiques disponibles pour la douleur reste limitée. Cependant, un changement de paradigme potentiel pourrait introduire une nouvelle vague de traitements non pharmacologiques de la douleur avec une sécurité, une efficacité et une tolérabilité remarquables. Un domaine de recherche prometteur est la photoneuromodulation à l’aide de diodes électroluminescentes vertes (GLED, 525 nm), qui ont montré un potentiel pour soulager la douleur dans les conditions aiguës et chroniques, conduisant à de nombreuses études précliniques et cliniques explorant l’efficacité de cette thérapie. Ces projets de recherche ont démontré comment l’exposition à la GLED augmente l’activité du système opioïde endogène dans le cerveau et la moelle épinière après l’activation du cône M dans la rétine. Les résultats suggèrent que la GLED peut soulager la douleur en modulant la voie descendante de la douleur. À la lumière des effets convaincants de la LED, la prolifération des études de photoneuromodulation souligne l’importance d’établir une cohérence dans les protocoles d’exposition bien définis et standardisés pour les essais précliniques et cliniques. Dans les études précliniques, des effets bénéfiques ont été observés après un minimum de 2 jours d’exposition, avec des protocoles impliquant 8 h de lumière à 100 lux pendant la phase de lumière de 12 h. Dans les essais cliniques, les protocoles d’exposition sont adaptés à la pathologie spécifique étudiée. Une exposition de 15 minutes s’est avérée favorable dans la modulation de la douleur post-chirurgicale aiguë. Pour la modulation de la douleur chronique, les patients sont invités à utiliser GLED à domicile pendant 1 à 2 heures par jour pendant 10 semaines. Cet article détaille les protocoles précliniques et cliniques pour améliorer la reproductibilité et la cohérence dans les différentes études évaluant les bénéfices de la photoneuromodulation. En établissant ces protocoles standardisés, ce travail vise à faire progresser l’application clinique de la photothérapie GLED en tant que traitement non pharmacologique viable de la douleur.
Introduction
Les traitements pharmacologiques, en particulier les opioïdes, continuent d’être largement utilisés pour gérer les douleurs aiguës et chroniques1. L’efficacité de la gestion de la douleur peut être considérablement affectée par la fréquence et la gravité des effets secondaires associés à l’utilisation d’opioïdes2. Pour cette raison, un nombre important de patients sous traitement opioïde ne parviennent pas à une gestion efficace de la douleur3. Par conséquent, les médecins spécialistes de la douleur et la communauté des patients recherchent de plus en plus des traitements non pharmacologiques qui évitent les effets secondaires associés aux analgésiques traditionnels. La photoneuromodulation est apparue comme une solution prometteuse et une thérapie sûre pour gérer la douleur.
La photoneuromodulation (PNM) est une technique non invasive qui utilise des diodes électroluminescentes (LED) pour réguler les processus biologiques4. La photothérapie a été établie il y a des milliers d’années en utilisant la lumière du soleil, ou héliothérapie, pour traiter les affections cutanées5. Par la suite, le concept de lumière influençant les tissus biologiques s’est élargi, conduisant au développement du terme de photoneuromodulation. La recherche sur la PNM s’étend maintenant à l’échelle mondiale et a montré son efficacité dans une variété d’applications cliniques, notamment la gestion de la douleur 6,7,8,9, l’amélioration de la qualité du sommeil chez les patients atteints de la maladie d’Alzheimer 10 et le contrôle de la dépression 11.
L’accent est de plus en plus mis sur la recherche préclinique et les essais cliniques visant à étudier les mécanismes et le potentiel thérapeutique de la photoneuromodulation pour la gestion de la douleur. Parmi ces approches, la thérapie par diodes électroluminescentes vertes (GLED), utilisant une stimulation de longueur d’onde de 525 nm, a montré une efficacité prometteuse dans la réduction de divers types de douleur, notamment les migraines, la fibromyalgie et la douleur post-chirurgicale 12,13,14,15,16. Des essais cliniques ont démontré que la thérapie par la lumière verte profite systématiquement aux patients souffrant de migraine dans plusieurs études 12,17,18, en réduisant à la fois la douleur des maux de tête et l’intensité de la photophobie pendant les crises de migraine actives 19, ainsi qu’en diminuant la fréquence et la durée des épisodes de migraine12. Des études précliniques ont également démontré que l’exposition à la GLED peut inverser l’hypersensibilité thermique et mécanique dans un modèle de lésion nerveuse de douleur neuropathique20. De plus, des études précliniques ont exploré les mécanismes par lesquels la GLED influence la perception de la douleur et les seuils sensoriels 13,21,22,23,24. Ces études mettent en évidence l’implication des cônes M et la modulation ultérieure du noyau géniculé latéral ventral (vLGN), ce qui augmente l’activité des neurones enképhalinergiques projetés vers le noyau du raphé dorsal (DRN)22. D’autres recherches ont également souligné le rôle essentiel de la moelle ventromédiale rostrale (RVM)21, un régulateur clé de la modulation descendante de la douleur. Collectivement, ces résultats suggèrent que la GLED modifie la perception de la douleur en modulant les circuits visuels qui agissent sur les voies descendantes de la douleur20,25. Cependant, des recherches supplémentaires sont nécessaires pour faciliter son application en utilisation clinique.
Dans cet article, nous détaillons une méthodologie complète pour la mise en œuvre de la PNM basée sur GLED, visant à fournir un cadre reproductible pour une utilisation expérimentale et clinique. Nous décrivons la conception et le fonctionnement de l’exposition à la GED, décrivons des protocoles d’application normalisés et discutons des principaux facteurs à prendre en compte pour assurer l’efficacité et la reproductibilité. De plus, nous fournissons un protocole détaillé pour évaluer l’activité des voies de la douleur ascendante et descendante, permettant une enquête plus approfondie sur leurs rôles dans la modulation de l’analgésie induite par la GLED. En partageant cette approche, nous visons à faire progresser la recherche sur la gestion non pharmacologique de la douleur et à contribuer au développement de thérapies accessibles, efficaces et plus sûres.
Protocole
Toutes les procédures sur les animaux ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Université de l’Arizona et sont conformes aux directives d’utilisation des animaux de laboratoire des National Institutes of Health. Des rats Sprague Dawley adultes exempts d’agents pathogènes (poids au moment de l’essai : 275-330 g) ont été logés dans des cages à rats de vivarium standard (3 rats par cage) dans des pièces climatisées selon un cycle lumière/obscurité de 12 heures et ont eu un accès à volonté à la nourriture et à l’eau. Toutes les expériences comportementales ont été menées par des expérimentateurs aveugles aux conditions de traitement. Toutes les procédures humaines ont reçu l’approbation de l’Institutional Review Board (IRB) de l’Université de l’Arizona sous le numéro de protocole (STUDY00000370). Cette étude est enregistrée auprès des ClinicalTrials.gov sous NCT05295225.
1. Protocole d’exposition à la lumière chez les animaux
- Optimisation de l’exposition à la lumière et préparation du bâtiment d’élevage
- Obtenez des bandes flexibles de diodes électroluminescentes (LED) à spectre visible avec les caractéristiques suivantes : (i) LED vertes (Table des matériaux), longueur d’onde de 525 nm, puissance de 8 W, tension de 120 V et un angle de faisceau de 120°. (ii) LED blanches (Table des matériaux), puissance de 9,6 W, tension de 120 V et un angle de faisceau de 120°.
- Assurer la précision du spectre lumineux à l’aide d’un spectromètre (pour cette étude, nous avons utilisé le service de prototypage de dispositifs biomédicaux de l’Institut BIO5 de l’Université de l’Arizona).
REMARQUE : La LED verte doit avoir une longueur d’onde centrale de 525 ± 10 nm (le point d’émission le plus brillant), un demi-maximum pleine largeur (FWHM) qui s’étend sur moins de 40 nm et une baisse d’intensité record (où l’intensité lumineuse chute à 50 % du maximum) qui doit être à 500 ± 5 nm et 530 ± 5 nm21. La LED blanche FWHM doit s’étendre sur plus de 90 nm. Plusieurs sources de lumière blanche peuvent être utilisées. Les expérimentateurs doivent s’assurer de la faible intensité de la longueur d’onde de 525 nm et d’une large étendue du spectre, couvrant plusieurs longueurs d’onde21. - Utilisez un luxmètre (Table des matériaux) pour mesurer et optimiser l’intensité lumineuse. Couvrez les LED avec du ruban adhésif noir (Table des matériaux) au besoin pour obtenir l’intensité souhaitée.
REMARQUE : Il est crucial de mesurer et de valider l’intensité lumineuse, car différentes intensités peuvent affecter les seuils sensoriels de différentes manières (Figure 1). Si l’intensité n’est pas précise, couvrez ou découvrez certaines des LED jusqu’à ce que l’intensité souhaitée soit atteinte. - Fixez les bandes LED sur les bords supérieurs des étagères grillagées dans une pièce sombre (Table des matériaux) pour vous assurer que chaque étagère est équipée d’une source d’exposition à la lumière dédiée. Placez des minuteries (Table des Matériaux) sur les bandes LED pour exposer les cages pendant 8 h par jour de 6h à 14h.
- Installez des cages statiques transparentes sur les étagères. Entourez entièrement les étagères de feuilles sombres sur tous les côtés (table des matériaux) pour optimiser l’exposition tout en minimisant les interférences lumineuses.
- À l’aide d’un luxmètre, vous obtiendrez l’optimisation finale de l’intensité lumineuse à l’intérieur de la cage en couvrant ou en découvrant certaines des LED (100 lux au centre de chaque cage) (Figure supplémentaire 1).
- Obtention du comportement sensoriel de base et début de l’exposition
- À leur arrivée, laissez les rats s’acclimater à l’animalerie pendant 1 semaine. Après cette période d’acclimatation, habituez les rats à la manipulation de l’expérimentateur pendant au moins 7 jours.
- Catégorisez les animaux en trois groupes expérimentaux en fonction de leurs conditions de traitement : (1) exposition à la lumière verte (GLED) combinée à une intervention chirurgicale, (2) exposition à la lumière blanche (WLED) combinée à une intervention chirurgicale, et (3) groupe témoin WLED avec chirurgie simulée.
- Acclimatez les rats dans des boîtes en plexiglas transparent sur un treillis métallique (Table des matériaux) pendant 1 h avant le test, dans la même pièce que la zone de test, en présence de l’expérimentateur de préférence.
- Pour évaluer les seuils préopératoires, mesurez les seuils de retrait de la patte à l’aide de la méthode de haut en bas de Dixon avec les filaments de von Frey26 sur la patte arrière gauche (Table des matériaux), en commençant par le filament 4,31 (19,6 mN) pour établir le seuil de retrait de base de la patte.
REMARQUE : La sensibilité mécanique doit être évaluée à l’aide de la méthode « haut et bas » en déterminant le seuil de retrait. Si l’animal ne répond pas au filament 4,31 (19,6 mN), utilisez le filament 4,56 plus épais (39,2 mN) (une réponse est notée visuellement comme un retrait, une secousse ou un léchage de la patte affectée). Si l’animal réagit au filament 4,31, utilisez le filament 4,08 (9,8 mN), plus mince.- Appliquez chaque filament perpendiculairement à la surface plantaire de la patte arrière pendant que les animaux sont positionnés dans des cages en treillis métallique suspendues.
- Ajustez la pression du filament, en augmentant ou en diminuant, en fonction de la taille du filament précédente.
- Continuez à utiliser des filaments de plus en plus épais ou plus minces, selon que l’animal a eu des réponses ultérieures positives ou négatives, respectivement.
- Notez les réponses négatives et positives sur la feuille de données fournie dans le tableau supplémentaire 1.
REMARQUE : Chaque filament doit être appliqué un à la fois de manière séquentielle. Après la première réponse positive, testez la même patte 4 fois de plus avec des filaments différents. Pour garantir des résultats fiables sur tous les animaux, l’expérimentateur doit éviter d’appliquer le filament sur les coussinets plantaires.
- Acclimatez les rats dans des boîtes en plexiglas transparent sur l’appareil Hargreaves (table des matériaux) pendant 1 h avant de procéder au test dans la même pièce que la zone d’essai pour mesurer la sensibilité thermique de référence à l’aide du test Hargreaves.
REMARQUE : Le test Hargreaves exige que les rats restent immobiles pendant quelques secondes. Si les rats sont encore trop actifs après la période d’habituation initiale de 1 heure, prolongez le temps d’acclimatation au besoin. Assurez-vous que les rats sont calmes et stationnaires, mais suffisamment alertes pour éviter de s’endormir. Avant d’effectuer le test de Hargreaves (Table des matériaux), il est crucial de régler l’intensité de la lumière infrarouge afin d’établir une base de référence pour mesurer la sensibilité à la douleur. L’objectif est que la latence de sevrage soit en moyenne d’environ 20 s pour la ligne de base, ce qui offre une sensibilité suffisante pour détecter les changements dans la réponse à la douleur, tels que l’hyper/hypoalgésie. Lors du retrait de la patte, un détecteur de mouvement arrête à la fois le stimulus et la minuterie. Pour éviter d’endommager les tissus, une coupure maximale de 33,5 s est appliquée. - Pour évaluer les seuils comportementaux préopératoires, placez le laser infrarouge sous le centre de la patte arrière gauche de l’animal (en utilisant les lignes de guidage de l’émetteur infrarouge).
- Démarrez le stimulus thermique pour mesurer le temps qu’il faut à l’animal pour retirer sa patte en réponse à la chaleur (latence de retrait).
REMARQUE : Si la latence moyenne de retrait n’est pas proche de 20 s, ajustez l’intensité et répétez le test jusqu’à ce que la moyenne souhaitée soit déterminée. L’intensité est ensuite maintenue constante pour le reste de l’expérience. Dans cette étude, nous avons utilisé une intensité de stimulus de 30 (50 W). Si l’essai doit être répété, prévoyez des intervalles de 5 minutes avant de répéter l’essai sur le même animal. - Notez la latence de retrait sur la feuille de données fournie dans le tableau supplémentaire 2.
REMARQUE : Pour éviter d’affecter la température du stimulus thermique, nettoyez toute urine pendant les essais.
- Démarrez le stimulus thermique pour mesurer le temps qu’il faut à l’animal pour retirer sa patte en réponse à la chaleur (latence de retrait).
- Suite à l’acquisition des comportements sensoriels de base, loger les animaux dans des cages statiques pour une exposition à la lumière avec un accès continu à la nourriture et à l’eau pendant 4 jours avant l’intervention (8 h par jour, de 6h à 14h).
- Induction du modèle de douleur et évaluation post-chirurgicale des seuils sensoriels
- Après la fin de l’exposition à 14 heures le jour 4, effectuez une chirurgie d’incision suivant le modèle Brennan sur la patte arrière gauche pour induire une douleur postopératoire27,28.
- Continuez l’exposition le jour 5. Après la fin de l’exposition à 14 h le jour 5, effectuez les tests de von Frey et Hargreaves, comme décrit précédemment, pour évaluer l’hypersensibilité thermique et mécanique 1 jour après la chirurgie.
- Continuez l’exposition le jour 6. Après la fin de l’exposition à 14 heures le jour 6, effectuez les tests de von Frey et Hargreaves, comme décrit précédemment, pour évaluer l’hypersensibilité thermique et mécanique 2 jours après la chirurgie.
REMARQUE : Exclure tout animal de l’étude s’il atteint les critères d’évaluation établis par le Comité institutionnel sur le soin et l’utilisation des animaux. - Effectuer l’euthanasie sur les animaux en suivant les protocoles décrits par le Comité institutionnel de soin et d’utilisation des animaux après avoir terminé les tests comportementaux.
- Analyse des données animales
- Entrez les schémas de retrait mécanique des réponses dans le logiciel Allodynia (National Instruments, LabView 2015) pour évaluer les seuils sensoriels mécaniques29.
REMARQUE : Le logiciel utilise la méthode non paramétrique de Dixon, telle que détaillée par Chaplan et al.30. - Indiquez les latences de retrait dans un tableur pour une analyse statistique ultérieure de l’allodynie thermique.
- Générer un graphique affichant la sensibilité moyenne (seuils ou latences) en fonction du temps.
- Entrez les schémas de retrait mécanique des réponses dans le logiciel Allodynia (National Instruments, LabView 2015) pour évaluer les seuils sensoriels mécaniques29.
2. Protocole d’exposition à la lumière chez l’homme
- Mise en place de la salle d’exposition pour l’évaluation du sujet humain
- Commencez par préparer la salle d’exposition, en vous assurant qu’elle est complètement exempte de toute source de lumière externe afin d’éliminer les interférences potentielles.
REMARQUE : Cette étape est essentielle pour isoler les effets des lumières LED. - Positionnez les lumières LED à une distance de 3 à 6 pieds de la chaise des sujets.
REMARQUE : Cette plage est basée sur des essais cliniques antérieurs pour assurer une intensité lumineuse constante et une exposition efficace. - Installez les bandes LED de 2 m en assurant la plage d’intensité lumineuse souhaitée de 90 à 100 lux à l’aide d’un luxmètre (tableau des matériaux et figure supplémentaire 2).
- Optimisez l’intensité lumineuse en repositionnant les bandes lumineuses ou en couvrant certaines LED, en veillant à ce que les sujets reçoivent 90 à 100 lux dans la zone principale où ils sont assis.
- Commencez par préparer la salle d’exposition, en vous assurant qu’elle est complètement exempte de toute source de lumière externe afin d’éliminer les interférences potentielles.
- Étapes de familiarisation pour l’essai de l’évaluation mécanique de la sommation temporelle
- Avant de procéder à une évaluation, assurez-vous d’une bonne hygiène des mains en vous lavant soigneusement les mains, puis en enfilant des gants.
- Nettoyez et désinfectez le filament von Frey calibré (6,65 mN, équivalent à 300 g de force) pour garantir la stérilité avant d’évaluer la sensibilité mécanique.
- Demandez l’autorisation d’exposer le muscle trapèze pour l’évaluation à venir.
- Informez le patient que le filament de von Frey sera appliqué sur le côté non dominant du muscle trapèze jusqu’à ce que le filament se plie.
- Demandez au patient d’évaluer sa douleur sur une échelle de 0 à 10, où 0 représente l’absence de douleur et 10 représente la pire douleur imaginable immédiatement après que l’opérateur a dit « Maintenant ».
REMARQUE : Assurez-vous que le patient fournit une réponse rapide et précise lorsque l’opérateur dit « maintenant ». - Appliquez le filament 3 fois à trois points différents (à 1 pouce d’intervalle) sur le muscle trapèze non dominant, en laissant un intervalle de 5 s entre chaque application.
- Informez le sujet que le filament von Frey sera appliqué 10 fois au même endroit une fois toutes les 1 s et demandez au sujet d’évaluer la douleur de la dernière application.
REMARQUE : Utilisez le même endroit sur le muscle trapèze pour les 10 applications. - Mesurez l’effet de sommation temporelle en appliquant le filament 10 fois sur le trapèze non dominant et demandez au sujet d’évaluer la douleur à la fin des stimuli.
- Essais de sommation temporelle mécanique
- Après les étapes de familiarisation, prévoyez une pause de 3 minutes et informez le patient que le filament von Frey sera appliqué sur le côté dominant du muscle trapèze.
- Nettoyez et désinfectez le filament von Frey calibré.
- Demandez au patient d’évaluer sa douleur sur une échelle de 0 à 10 immédiatement après que l’opérateur a dit « Maintenant ».
- Appliquez le filament 3 fois à 3 points différents (à 1 pouce d’intervalle) sur le muscle trapèze dominant, en laissant un intervalle de 5 s entre chaque application. Consigner la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3).
- Informez le sujet que le filament von Frey sera appliqué 10 fois au même endroit une fois toutes les 1 s et demandez au sujet d’évaluer la douleur de la dernière application.
- Mesurez l’effet de sommation temporelle en appliquant le filament 10 fois sur le trapèze dominant. Notez la réponse du sujet sur la feuille d’enregistrement (tableau supplémentaire 3).
- Répétez le processus deux fois à 3 minutes d’intervalle et notez les réponses des sujets sur la feuille d’enregistrement (tableau supplémentaire 3).
- Étapes de familiarisation pour l’évaluation de la modulation de la douleur conditionnée
- Préparez un bain d’eau froide à 12 °C (figure supplémentaire 3).
REMARQUE : Vérifiez la température avant le test à l’aide du thermomètre (Table des matériaux). Ayez de la glace supplémentaire si nécessaire pour ajuster la température pendant la période de test. - Nettoyez et désinfectez l’algomètre.
- Utiliser le logiciel Medoc pour l’évaluation de la CPM (Table of Materials).
- Sélectionnez l’option AlgoMed (Figure supplémentaire 4). Sur l’écran d’accueil, recherchez et cliquez sur l’Algomètre pour l’activer.
- Sélectionnez le bon patient dans la liste et choisissez le programme de test.
- Sélectionnez le site d’application de l’appareil. Pour cette étape de familiarisation, choisissez le muscle trapèze non dominant dans le schéma corporel (Figure supplémentaire 5).
REMARQUE : Après avoir cliqué sur aller au test, on sera dirigé vers l’écran de test. Avant d’appliquer une pression, le logiciel exigera que l’on effectue un pré-test, où l’appareil n’applique pas encore de pression. Ce pré-test doit être terminé chaque fois qu’un nouveau test est lancé. - Démarrez un test et expirez 5 s.
- Informez le patient que l’appareil mesure la quantité de pression appliquée et qu’il sera utilisé pour appliquer une pression sur le côté non dominant du muscle trapèze. Demandez au patient de dire « stop » dès qu’il commence à ressentir de la douleur.
- Cliquez sur Démarrer. Le système imposera une attente de 5 secondes avant de commencer à appliquer l’appareil.
- Appliquez l’algomètre sur le trapèze en augmentant la force à une vitesse de 30 kPa/s (figure supplémentaire 6).
- Consigner la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3).
REMARQUE : Pour cette étude, la pression maximale appliquée est de 650 kPa. Cette étude évalue spécifiquement l’apparition de la douleur, et non la tolérance à la douleur. - Informez les participants qu’ils utiliseront un bain d’eau glacée pour l’évaluation.
- Vérifiez que la température de l’eau à l’aide du thermomètre (Table des matériaux) est d’environ 12 °C. Réglez une minuterie sur 10 s.
- Demandez au participant d’immerger sa main dominante dans l’eau jusqu’au poignet, en s’assurant que la main est détendue et que les doigts sont écartés.
- Demandez au participant d’évaluer sa douleur sur une échelle de 0 à 10 lorsque l’opérateur dit « maintenant » à la fin de 10 s.
- Demandez l’évaluation de la douleur à la fin des 10 s et notez la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3).
- Préparez un bain d’eau froide à 12 °C (figure supplémentaire 3).
- Test de modulation conditionnée de la douleur
- Vérifiez la température de l’eau à l’aide du thermomètre (Table des matériaux).
- Nettoyez et désinfectez l’algomètre.
- Après une pause de 3 minutes, commencez l’évaluation de la modulation de la douleur conditionnée (CPM) en demandant la permission d’exposer le muscle trapèze dominant pour l’évaluation à venir.
- Demandez au patient de dire « stop » dès qu’il commence à ressentir de la douleur. Cliquez sur Démarrer dans le logiciel.
- Appliquez l’algomètre sur le trapèze en augmentant la force à une vitesse de 30 kPa/s et notez la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3).
- Répétez l’application 2 fois de plus sur différents sites du muscle trapèze dominant, avec un intervalle de 3 minutes entre chacun.
- Assurez-vous que l’algomètre est soigneusement nettoyé et désinfecté avant chaque application pour éviter de glisser causé par l’accumulation d’huiles cutanées sur les sujets.
- Consigner la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3). Attendez 5 min avant de passer au test de stimulus conditionné.
- Cliquez sur Démarrer. Le système imposera une attente de 5 secondes avant de commencer à appliquer l’appareil.
- Nettoyez et désinfectez l’algomètre.
- Demandez au patient d’immerger sa main non dominante jusqu’au poignet dans le bain d’eau glacée.
- Appliquez l’algomètre sur le trapèze en augmentant la force à une vitesse de 30 kPa/s et notez la réponse du patient sur la feuille d’enregistrement (tableau supplémentaire 3).
- Répétez l’application deux fois de plus sur différents sites du muscle trapèze, avec un intervalle de 5 minutes entre chacun.
REMARQUE : Interrompre l’étude si une condition médicale non découverte auparavant est identifiée après le dépistage initial, en particulier si la condition a le potentiel d’interférer avec l’étude. - Après l’acquisition des valeurs de pré-exposition de base, commencez à exposer le patient à la condition lumineuse qui lui est attribuée.
- Demandez aux volontaires d’éviter de regarder directement la source lumineuse.
REMARQUE : Au lieu de cela, ils doivent laisser la lumière pénétrer dans leur vision périphérique comme ils le feraient avec n’importe quelle source de lumière ambiante dans leur maison (Figure supplémentaire 7). - Exposez les sujets à la lumière LED pendant 1,5 h.
REMARQUE : Pour un traitement prolongé par la lumière, les sujets s’auto-administrent l’exposition à la maison jusqu’à 10 semaines. Des enquêtes, telles que le Fibromyalgia Impact Questionnaire (FIQ), le HIT-6 (Headache Impact Test), le PSQI (Pittsburgh Sleep Quality Index) et le EQ-5D-5L (pour évaluer la santé globale), ainsi que des questionnaires sur la douleur, peuvent être utilisés pour surveiller les effets du traitement au fil du temps. - Pendant l’exposition, encouragez les bénévoles à s’engager dans des activités qui ne nécessitent pas de sources de lumière supplémentaires, comme la lecture ou l’écriture.
REMARQUE : Des intensités de 4 à 100 lux fournissent un éclairage suffisant. - Découragez le sommeil pendant la période d’exposition pour assurer le respect total du protocole.
- Après la thérapie d’exposition à la lumière, répétez toutes les mesures effectuées au départ.
- Analyse des données humaines
- Pour la sommation temporelle mécanique, calculez la moyenne des 3 mesures de base et la moyenne des 3 stimuli répétés.
- Calculez le pourcentage de sommation temporelle mécanique en divisant l’indice moyen de douleur après les stimuli répétitifs par l’indice moyen de douleur de base et en multipliant le résultat par 100 pour l’exprimer en pourcentage.
REMARQUE : Un pourcentage supérieur à 100 % indique une augmentation de la perception de la douleur avec des stimuli répétés, suggérant la présence d’une sommation temporelle. - Pour la modulation mécanique conditionnée de la douleur (MPC), calculez la moyenne des 2 derniers seuils de douleur de référence (en kPa) obtenus lors des stimuli non conditionnés (sans bain froid).
- Calculez la moyenne des 2 dernières valeurs seuils de douleur (en kPa) pendant le stimulus de conditionnement.
- Utilisez l’équation suivante pour calculer le CPM :
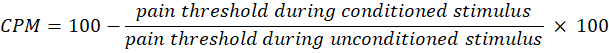
REMARQUE : Une valeur CPM de 0 indique qu’il n’y a pas de changement dans la perception de la douleur, une valeur négative indique une inhibition sensorielle de la douleur pendant le stimulus conditionné et une valeur positive indique une facilitation de la douleur pendant le stimulus conditionné. - Évaluez les changements dans la sommation temporelle et la CPM avant et après l’exposition à la lumière pour évaluer comment la thérapie affecte l’activité des voies de la douleur ascendante et descendante, respectivement.
Résultats
L’exposition à la lumière verte augmente les latences de retrait des pattes de manière dose-dépendante
La figure 1A montre que l’exposition à des diodes électroluminescentes vertes (GLED) à diverses intensités (4, 50, 100 et 200 lux) a augmenté de manière significative les latences de retrait des pattes dans un modèle de rat naïf sur une période d’exposition de 7 jours, indiquant un eff...
Discussion
Des études récentes ont exploré les mécanismes sous-jacents à l’analgésie à lumière verte (GLED) 13,21,22,23,24. Cependant, une normalisation plus poussée de la méthodologie est nécessaire pour améliorer son application dans la pratique clinique. Les effets antinociceptifs dose-dépendants observés dans les mod?...
Déclarations de divulgation
Le Dr Ibrahim a divulgué à l’Université de l’Arizona un intérêt extérieur pour Luxxon Therapeutics. Les conflits d’intérêts résultant de cet intérêt sont gérés par l’Université de l’Arizona conformément à ses politiques. Tous les autres auteurs n’ont aucun conflit d’intérêts à signaler. Aucun des auteurs du manuscrit n’a reçu de rémunération, de remboursement ou d’honoraires de quelque manière que ce soit. Les auteurs ne sont affiliés à aucun fournisseur ou société pharmaceutique associé à cette étude. Aucune de ces recherches, manuscrits ou résumés n’a été présenté auparavant et n’est pas envisagé pour publication par une autre revue.
Remerciements
Cette recherche a été financée par le Comprehensive Center for Pain and Addiction de l’Université de l’Arizona (M.M.I., L.F.M.), le Département d’anesthésiologie de l’Université de l’Arizona (L.F.M.) et le Medical Scientist Training Program (MSTP) de l’Université de l’Arizona, College of Medicine, Tucson.
matériels
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Références
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon