Method Article
التصنيع الدقيق للبصريات القابلة للزرع مدمجة في نافذة تصوير مجهرية للتصوير المتقدم في الجسم الحي
In This Article
Summary
يصف هذا البروتوكول تصنيع نافذة تصوير متكاملة قابلة للزرع باستخدام الطباعة بالليزر ثلاثية الأبعاد. تتكون النافذة من نظام من العدسات الدقيقة إلى جانب السقالات الدقيقة. تتضمن الطريقة بلمرة ثنائية الفوتون (2PP) لمقاومة الضوء المتوافقة حيويا SZ2080 في تسلسل مستمر ، مما يؤدي إلى تحسين كفاءة التصنيع والمحاذاة بين المكونات المختلفة.
Abstract
في سياق المواد الحيوية واختبار الأدوية في النماذج الحيوانية ، تقدم هذه الدراسة بروتوكولا مبسطا لتصنيع نافذة تصوير متكاملة جديدة قابلة للزرع. يشتمل الجهاز الصغير على نظام متطور من العدسات الدقيقة إلى جانب سقالات دقيقة مصممة خصيصا للقياس الكمي للاستجابة المناعية في الجسم الحي باستخدام الفحص المجهري المتقدم للإثارة غير الخطية. يعتمد البروتوكول على بلمرة الفوتونين (2PP) لمقاومة الضوء المتوافقة حيويا SZ2080 ، والتي تتيح تصنيع السقالات الدقيقة والعدسات الدقيقة في تسلسل مستمر لتعزيز كفاءة التصنيع ودقته. لزيادة تحسين السرعة والدقة والسلامة الهيكلية ، تم تنفيذ نهج تصنيع البصريات الهجين ، بما في ذلك 2PP للغلاف الخارجي للعدسة الدقيقة متبوعا بالتشابك السائب للأشعة فوق البنفسجية للقلب الداخلي. تعمل هذه التقنية المبتكرة على تحسين الخصائص البصرية للعدسات الدقيقة مع تبسيط عملية الإنتاج. يظهر الجهاز الصغير الناتج قابلية عالية للتكرار والاستقرار الميكانيكي ، مما يجعله طريقة فعالة للنماذج الأولية للأنظمة البصرية الدقيقة لمجموعة من التطبيقات الطبية الحيوية.
Introduction
يمكن الفحص المجهري داخل الحيوية دراسة العمليات البيولوجية في الحية عن طريق التصور في الوقت الفعلي. عند دمجها مع مناهج التصوير غير الخطي الفلورية ، يمكن أن تصل إلى دقة على المقياس الخلويالفرعي 1. وبالتالي ، فقد أصبحت أداة مهمة في العديد من المجالات ، مثل اختبارات المناعة أو دراسات السرطان ، حيث تعتبر مراقبة الخلايا داخل بيئتها الفسيولوجية الحقيقية أمرا مهما.
الأساليب الشائعة لعمليات التفتيش داخل الحيوية ، مثل غرف طيات الجلد الظهرية أو نوافذ التصوير في الجمجمة والبطن ، شديدة التوغل وتشكل صعوبات في عمليات التفتيش طويلة الأمد لنفس النقطة. وبالتالي ، فإن مناهج التصوير الجديدة في الجسم الحي التي تقلل من ضائقة وتسمح بإعادة وضع المنظر البصري بسهولة أمر مرغوب فيهبشدة 2.
في هذا الإطار ، من الممكن تطوير نافذة تصوير مصغرة جديدة تعتمد على ركيزة زجاجية تحتوي على جانب تصوير مع عدسات دقيقة بصرية وجانب مرجعي للأنسجة مع سقالات دقيقة ثلاثية الأبعاد (ثلاثية الأبعاد). يمكن زرع نافذة التصوير المصغرة هذه "subcute" في وستعمل كهدف مجهر "داخلي". سيكون مبدأ عمل الجهاز هو استخدام العدسات الدقيقة إلى جانب مجهر خارجي منخفض الفتحة العددية (NA) بهدف إجراء تصوير غير خطي في الجسم الحي للعمليات البيولوجية التي تحدث داخل السقالات. ستعوض العدسات الدقيقة عن الانحراف الكروي بسبب التصوير من خلال وسط غير متجانس مثل الأنسجة3،4 ، في حين أن السقالة الدقيقة ستقود تجديد الأنسجة وستعمل كمنارات بصرية5،6،7 ، مما يسمح بالفحص لفترة طويلة لنفس النقطة.
تم بالفعل عرض المكونات الأساسية للجهاز ، أي السقالات الدقيقة والعدسات الدقيقة ، بشكل منفصل ، لكن دمجها في نفس الجهاز يمثل العديد من التحديات نظرا لطبيعتها ثلاثية الأبعاد وحجم الميكرومتر والحاجة إلى محاذاة بصرية مثالية بينها. يمكن للسقالات الدقيقة ، التي تتكون من شبكات متوازية المستطيلات المستطيلة ، ذات الأبعاد الكلية التمثيلية ~ 500 ميكرومتر × 500 ميكرومتر × 100 ميكرومتر وبأحجام المسام ~ 50 ميكرومتر × 50 ميكرومتر × 20 ميكرومتر ، توجيه تجنيد الخلايا والأوعية الدموية الجديدة ، وبالتالي تعزيز تكامل الأنسجة. علاوة على ذلك ، نظرا للتألق الذاتي ، تعمل السقالات الدقيقة كمنارة مضان في الموقع مما يسمح بإعادة التموضع والمحاذاة بسرعة تحت المجهر وحتى تصحيح الانحرافات الكروية أثناء التصوير غير الخطي لتمكين الملاحظات الطولية عالية الدقة في الجسم الحي 5. أثبتت العدسات الدقيقة ذات الفتحة العددية العالية ، ذات الملامح الكروية أو شبه المكافئة والأطوال البؤرية التي تبلغ بضع مئات من الميكرومترات ، قدراتها على التصوير الخطي وغير الخطي للعينات البيولوجية إذا تم دمجها مع مجهر متحد البؤر أو ثنائي الفوتون3،4.
يتم تصنيع العدسات الدقيقة والسقالات الدقيقة بواسطة نقش ليزر ثلاثي الأبعاد ، المعروف أيضا باسم بلمرة الفوتون الثنائي (2PP). في 2PP ، يتم تركيز شعاع ليزر الفيمتو ثانية بالأشعة تحت الحمراء بإحكام داخل مقاومة للضوء قابلة للمعالجة بالأشعة فوق البنفسجية ، وبسبب امتصاص الفوتون المتعدد في البقعة البؤرية ، يتم إنشاء فوكسل محصور من المواد المبلمرة بحجم ميكرومتر فرعي (~ 100 نانومتر). من خلال تحريك تركيز الليزر فيما يتعلق بعينة مقاومة الضوء ، يمكن الحصول على هياكل ثلاثية الأبعاد للمواد المبلمرة بعد غسل المواد غير المبلمرة8. تتميز العملية بدقة عالية جوهرية وطبيعة ثلاثية الأبعاد تسمح بالحصول على هياكل مجهرية ثلاثية الأبعاد ، مثل السقالات والعدسات ، مع ثبات جيد وجودة سطح عالية9،10،11. هناك تقنيات مختلفة لتصنيع السقالات الدقيقة المسامية مثل الطباعة ثلاثية الأبعاد أو الطباعة النانوية أو الغزل الكهربائي12،13،14،15. كل هذه التقنيات تعاني من عيب رئيسي. إنهم غير قادرين على الوصول إلى الدقة في نطاق الميكرومتر الفرعي ، مما يعطي هياكل ذات أحجام مسام (~ 100 ميكرومتر) أكبر من الحجم الخلوي ، ولا تحاكي المصفوفة خارج الخلية ، وهو أمر ضروري لتجديد الأنسجة بشكل جيد. يمكن التعامل مع تصنيع العدسات الدقيقة بطرق تعتمد على تكرار العدسة من قالب أو قناع مثل القولبة بالحقن أو النقش الساخن أو قولبة الأشعة فوق البنفسجية ، أو بطرق مباشرة مثل إعادة التدفق الحراري أو النقش البلاستيكي الدقيق أو نفث القطرات الدقيقة16،17. كلها تقدم قيودا على مورفولوجيا السطح التي يمكن الحصول عليها ويصعب دمجها في تدفق التصنيع حيث يجب أيضا تصنيع السقالات الدقيقة. على الجانب الآخر ، أظهر 2PP تعدد استخداماته في تصنيع المكونات البصرية المعقدة18،19 ، مثل العدسات الكروية أو المكافئة ، أو العدسات الحيورية ، أو حتى مجموعات من العدسات المختلفة في نفس المكون البصري20،21،22،23،24. في هذا الإطار ، يبدو أن 2PP هي أفضل تقنية لتصنيع كل يحتوي على كل من العدسات والسقالات الدقيقة.
على الرغم من كونه خيارا فريدا لتحقيق هذه الهياكل ثلاثية الأبعاد بدقة ميكرومتر ، إلا أن 2PP يقدم قيدين رئيسيين ، أي أنه نهج يستغرق وقتا طويلا للهياكل ذات الحجم الكبير نسبيا ، ويقدم عمق تصنيع محدود (على طول المحور البصري) بسبب مسافة العمل القصيرة لأهداف المجهر المستخدمة للتركيز المحكم.
تقترح هذه المقالة بروتوكولا فريدا لتصنيع السقالات الدقيقة والعدسات الدقيقة على الجانبين المتقابلين من الركيزة الزجاجية في عملية تشعيع بخطوة طولية واحدة تضمن محاذاة جيدة لكلا العنصرين وتتغلب على قيود عمق التصنيع. تم تحسين البروتوكول أيضا لوقت التصنيع. من ناحية أخرى ، يوفر التشعيع بخطوة واحدة وقت المحاذاة ، واستخدام نهج هجين يجمع بين 2PP لغلاف العدسة والمعالجة بالأشعة فوق البنفسجية لمقاومة الضوء الداخلية يقلل من وقت التشعيع للعدسات ذات الحجم الكبير25. تسمح قدرة 2PP على تصنيع هياكل ثلاثية الأبعاد حرة الشكل باستخدام هذا البروتوكول لأي تصميم عدسة دقيقة وسقالة صغيرة ، وبالتالي تمكين الطريقة الحالية.
Protocol
تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تحضير العينة
- أول إسقاط الصب (الشكل 1 أ)
- نظف بالأسيتون على كلا السطحين بغطاء زجاجي دائري بقطر 12 مم (سمك 170 ميكرومتر).
- جفف كلا السطحين بغاز النيتروجين بدرجة حرارة الغرفة.
- قم بإيداع كمية مضبوطة تبلغ 46 ميكرولتر من السائل المقاوم للضوء على جانب واحد من الغطاء الزجاجي باستخدام ماصة حجمية.
ملاحظة: المواد الحساسة للضوء المستخدمة في هذا البروتوكول هي مادة متوافقة حيويا ، هجينة عضوية / غير عضوية مقاومة للضوء تعرف باسم SZ2080 ، وهي معروفة جيدا وتم التحقق من صحتها للتطبيقات الطبيةالحيوية 26. انتبه لترك حلقة خارجية مجانية على الركيزة الزجاجية. نظرا لكونها خالية من مقاومة الضوء ، تضمن هذه المساحة الزجاجية الاحتفاظ الصحيح للعينة داخل الدعامة للمساعدة في التحضير بشكل أفضل. - اترك العينة تحت الغطاء الكيميائي لمدة 48 ساعة للسماح بتجفيف أول قطرة من مقاومة الضوء عن طريق تبخر المذيب ، والوصول إلى حالة سول جل.
- الصب الثاني (الشكل 1 أ)
- عندما تصل القطرة الأولى من مقاومة الضوء إلى حالة sol-gel (الخطوة 1.1.4.) ، اقلب العينة رأسا على عقب ، مع تعريض السطح النظيف.
- ضع العينة على حامل داعم ، وارفع أول سطح مصبوب من الأرض.
- قم بإيداع قطرة ثانية من 46 ميكرولتر من مقاومة الضوء السائلة على السطح الزجاجي النظيف ، تاركا الحلقة الخارجية وكذلك في الخطوة 1.1.3.
- اترك العينة تحت الغطاء الكيميائي لمدة 48 ساعة على الأقل ، واترك المذيب يتبخر.
ملاحظة: بعد 4-6 أيام ، تكون العينة ذات الصب المزدوج جاهزة للاستخدام ل 2PP (الشكل 1 ب). من الآن فصاعدا ، انتبه إلى عدم تعريض العينة للضوء المحيط بسبب المواد الحساسة للضوء. يؤدي التعرض للضوء إلى تدهور مقاومة الضوء.
2. بلمرة الفوتونين (2PP) للبنى المجهرية
- محاذاة الإعداد (الشكل 2)
- قم بتشغيل مصدر ليزر الأشعة تحت الحمراء القريبة من الفيمتو ثانية (الطول الموجي 1030 نانومتر ، 1 ميجاهرتز ، مع الحد الأدنى لمدة النبضة = 230 fs).
ملاحظة: اضبط معلمات الليزر مثل عرض النبضة ومعدل التكرار. - قم بمحاذاة المسار البصري لشعاع الليزر حتى يصل إلى هدف المجهر من خلال سلسلة من البصريات والمرايا المثبتة على حوامل المرآة الحركية. قم بتدوير المرايا بشكل متكرر لتوسيط الشعاع داخل ثقوب محاذاة الأشعة تحت الحمراء القريبة (NIR).
ملاحظة: يجب أن تكون مسافة العمل الموضوعية للمجهر أطول من الارتفاع الكلي للجهاز النهائي المراد تصنيعه (ارتفاع العدسة + سمك الغطاء + ارتفاع السقالة الدقيقة). تم تصميم ثقوب NIR بشكل صحيح لتبسيط محاذاة حزم الأشعة تحت الحمراء. يضمن ذلك محاذاة دقيقة للشعاع على طول المسار البصري ، مرورا بمكونات مثل لوحة نصف الموجة ، وموسع الشعاع ، والمرآة ثنائية اللون. للتحكم التلقائي في طاقة الليزر ، يمر الشعاع عبر مستقطب أفقي ولوحة نصف موجة ، ويتم تثبيت الثاني على دوار آلي. إذا لزم الأمر ، يمكن أن يمر الشعاع عبر موسع شعاع لتكبير قطر الحزمة وتحقيق المدخل الخلفي الهدفي. - قم بتوجيه شعاع الليزر بشكل عمودي على حامل العينة عن طريق محاذاته باستخدام توسيط الانعكاس الخلفي.
- قم بتركيب هدف مجهر مسافة العمل الطويلة على الدعم المخصص في نهاية المسار البصري بالقرب من العينة (الشكل 2).
ملاحظة: يتم تركيب كاميرا CCD فوق المرآة ثنائية اللون محاذاة للمحور البصري الموضوعي لمراقبة عملية التصنيع. سيسمح للمرء برؤية بقعة تركيز الليزر والهياكل المبلمرة.
- قم بتشغيل مصدر ليزر الأشعة تحت الحمراء القريبة من الفيمتو ثانية (الطول الموجي 1030 نانومتر ، 1 ميجاهرتز ، مع الحد الأدنى لمدة النبضة = 230 fs).
- تركيب العينة
- قم بتثبيت (بالشريط) الغطاء الزجاجي المزدوج على حامل العينة المركب على مراحل الترجمة. قم بتركيب العينة بحيث تكون القطرة المودعة الثانية متجهة لأسفل.
ملاحظة: يحتوي حامل العينة على ثقب مركزي حيث يمكن تعليق العينة من المرحلة الأرضية5. يتم توصيل الحامل بنظام ميكانيكي gimbal يتم تثبيته في مرحلة انتقالية X و Y لحركة العينة. - قم بتوسيط العينة يدويا باستخدام هدف المجهر المركب.
- قم بتثبيت (بالشريط) الغطاء الزجاجي المزدوج على حامل العينة المركب على مراحل الترجمة. قم بتركيب العينة بحيث تكون القطرة المودعة الثانية متجهة لأسفل.
- توسيط العينة
- اضبط طاقة الليزر على الحد الأدنى للقيمة الكافية لرؤية انعكاس الشعاع على برنامج كاميرا CCD (حوالي 5 ميجاوات).
ملاحظة: قم بقياس قوة الليزر في التلميذ الخلفي للهدف (يبلغ نقل الهدف المستخدم في هذا البروتوكول 70٪ عند الطول الموجي 1030 نانومتر.) - قم بتشغيل برنامج واجهة المشغل لوحدة التحكم في الحركة وكاميرا CCD.
- ركز شعاع الليزر على السطح العلوي لأول قطرة مقاومة للضوء.
- باتباع المظهر الجانبي المنحني للقطرة ، أوجد حواف العينة على طول الاتجاهين X و Y. قم بتعيين مركز السقوط كمرجع صفري مطلق بواسطة البرنامج.
ملاحظة: يلعب الشريط المستخدم لإصلاح العينة دورا في اكتشاف الحواف عن طريق تعديل معامل الانكسار ، وبالتالي انعكاس الحزمة.
- اضبط طاقة الليزر على الحد الأدنى للقيمة الكافية لرؤية انعكاس الشعاع على برنامج كاميرا CCD (حوالي 5 ميجاوات).
- تعويض إمالة العينة
- في وسط العينة ، ركز شعاع الليزر على سطح الواجهة بين السطح العلوي للغطاء الزجاجي وقاعدة القطرة الأولى من مقاومة الضوء. قم بتعيينه كمرجع صفري على المحور Z.
- بالنظر إلى قطر العينة ، انتقل إلى موضع الحافة (بالنسبة للغطاء 12 مم ، يكون ~ - 4 مم) في الاتجاه السلبي للمحور X. في هذا الموضع ، قم بتركيز سطح الواجهة (بين الزجاج والقطرة العلوية لمقاومة الضوء) وقم بتعيينه كمرجع صفر مطلق على طول الاتجاه الرأسي Z.
- انتقل إلى موضع الحافة في الاتجاه الإيجابي للمحور X (بالنسبة للغطاء 12 مم ، يكون ~ + 4 مم). أوجد هنا سطح الواجهة الذي يحرك الهدف على طول الاتجاه الرأسي Z.
- قم بإمالة العينة لتصحيح الانحراف في الاتجاه Z بين الموضعين السالبين والموجب على طول المحور X. استخدم تصاعدا حركيا قابلا للتعديل لإمالة حامل العينة (مثل المحاور).
- كرر الخطوات 2.4.2-2.4.4 بشكل متكرر حتى تصبح العينة متوازنة تماما على المحور X.
- تنفيذ نفس الإجراء الموضح في الخطوات 2.4.2-2.4.5 على طول الاتجاه Y.
- بمجرد أن تكون العينة متوازنة تماما على كل من المحور المستوي X و Y ، عد إلى الموضع المركزي وركز الواجهة بين الزجاج ومقاوم الضوء في تلك المرحلة.
- قم بتعيين قيمة Z الجديدة للتركيز كمرجع في المحور Z (Z = 0).
ملاحظة: يهدف الإجراء الوارد في الخطوة 2.4 إلى ضمان العمودية المثالية بين شعاع الليزر وسطح الغطاء لضمان التثبيت المثالي لهياكل 2PP التي سيتم تصنيعها لاحقا. من 2.4 فصاعدا ، يجب تنفيذ جميع الإجراءات المطابقة لمعامل الانكسار. لذلك، أضف وسيط الهدف لمطابقة الفهرس إذا لزم الأمر.
- السقالات الدقيقة 2PP على انخفاض مقاومة الضوء السفلية
- قم بتشغيل نظام إضاءة LED أحمر لمراقبة عملية البلمرة في الوقت الفعلي.
ملاحظة: يتم وضع إضاءة الصمام الثنائي الباعث للضوء الأحمر أسفل حامل العينة المعقد (الشكل 2). ستسمح هذه الإضاءة للمرء برؤية الحجم المبلمر أثناء عملية 2PP. المقاوم للضوء حساس للأطوال الموجية الأقصر (الضوء المرئي). لذلك ، لن يزعج ضوء LED الأحمر العينة. - مع إيقاف تشغيل الليزر ، حرك الهدف على طول الاتجاه Z أسفل زلة الغطاء الزجاجي للعثور على سطح الواجهة الثاني بين السطح السفلي للزجاج وقاعدة القطرة السفلية للمقاومة.
ملاحظة: سيتم العثور على السطح البيني الثاني عند قيمة Z تساوي تقريبا سمك الغطاء (170 ميكرومتر). - قم بزيادة طاقة الليزر حتى 100 ميجاوات للسماح ببلمرة الفوتون في الانخفاض السفلي.
- قم بضبط الموضع البؤري (زيادة Z) للعثور على الواجهة الثانية عن طريق بلمرة بنية مرجعية بسيطة.
ملاحظة: مثال على الهيكل المرجعي هو خط بلمر بطول 50 ميكرومتر. - قم بتعيين الموضع البؤري الأول حيث تتم بلمرة البنية المرجعية كمرجع صفري على طول الاتجاه الرأسي (المحور Z).
ملاحظة: يؤكد المرجع الوارد في الخطوة 2.5.5 المستوى الأساسي ل 2PP للسقالات الدقيقة. - اضبط قوى البلمرة (~ 100-200 ميجاوات) وقم بتشغيل كود الماكينة كبرنامج تحكم رقمي بالكمبيوتر (CNC) للحركة المناسبة للمراحل الانتقالية لتصنيع الهيكل ثلاثي الأبعاد المطلوب (الشكل 3 أ).
ملاحظة: يتكون برنامج CNC من مجموعة من الإحداثيات المكانية (x ، y ، z) التي تحدد الطريقة التي تتحرك بها المنصات الانتقالية لإنتاج الكائن ثلاثي الأبعاد النهائي. ستتأثر قوى البلمرة هذه بارتفاع القطرة العلوية والظروف التجريبية المحددة (مقاومة الضوء والليزر ونظام الحركة).
- قم بتشغيل نظام إضاءة LED أحمر لمراقبة عملية البلمرة في الوقت الفعلي.
- العدسات الدقيقة 2PP على قطرة مقاومة الضوء العلوية
- بالانتقال على طول المحور Z ، عد إلى الواجهة الأولى بين السطح الزجاجي العلوي والانخفاض العلوي لمقاومة الضوء (الخطوة 2.4.8). حافظ على نفس النظام المرجعي المستوي (إحداثيات X ، Y) لضمان محاذاة مثالية للعدسات الدقيقة 2PP مع الهياكل المجهرية المصنعة بالفعل.
- ابحث عن الواجهة عن طريق بلمرة بنية مرجعية بسيطة.
ملاحظة: استخدم نفس العملية الموضحة في الخطوة 2.5.4 ، ولكن تختلف فقط في اتجاه الحركة الرأسية. - اضبط السطر الأول من البلمرة كمرجع صفري على طول الاتجاه الرأسي (المحور Z).
ملاحظة: يؤكد المرجع الوارد في الخطوة 2.6.3 المستوى الأرضي ل 2PP للعدسات الدقيقة. - قم بتعيين معلمات التصنيع ل 2PP لمحيط العدسة الدقيقة المطلوبة (الشكل 3 ب). يصف شعاع الليزر مسارا دائريا يتناقص نصف قطره لبلمرة السطح الخارجي لعدسة دقيقة واحدة باستمرار. اضبط معلمات الفقس والتقطيع على طول اتجاهين X و Z ، على التوالي.
ملاحظة: يجب أن يأخذ تصميم العدسات في الاعتبار البعد البؤري الفعال الذي يرغب فيه المستخدم. كقاعدة عامة ، يجب أن تكون قيمة أطول من سمك الغطاء ، ويجب أن تسمح بتصوير الأطلس بأكمله. يوصى بمحاكاة حسابية أولية للنظام البصري النهائي. - اضبط قوة البلمرة (~ 15-20 ميجاوات) وقم بتشغيل البرنامج الذي يوجه حركة المراحل الانتقالية.
ملاحظة: ستتأثر قوى البلمرة هذه بارتفاع القطرة العلوية والظروف التجريبية المحددة وتصميم العدسة الدقيقة المطلوبة (الشكل 3 ب). يعرض الشكل 4 مثالا تمثيليا للعدسة الدقيقة المكافئة مع الوظيفة البارامترية التي تصف ملف تعريف العدسة الدقيقة وخصائصها الهندسية الرئيسية.
3. تطوير العينة
- قم بإزالة العينة من إعداد التصنيع التجريبي.
- مع إيقاف تشغيل الليزر ، قم بتعطيل المحور الانتقالي X و Y و Z وقم بإزالة الحامل.
- انزع الشريط اللاصق وافصل العينة عن الحامل.
ملاحظة: قبل تطوير العينة ، انتبه إلى عدم تعريض العينة للضوء المحيط بسبب المواد الحساسة للضوء. من شأن التعرض للضوء أن يربط الكمية الكاملة من مقاومة الضوء.
- تطوير العينة (الشكل 5 أ)
- ضع العينة في دعامة مناسبة لرفعها عن الأرض وتثبيتها في وضع أفقي.
ملاحظة: حامل العينة هذا عبارة عن رف عينة مخصص مطبوع باتفاقية مستوى الخدمة مصمم بشكل صحيح لفضح كل من الأسطح النموذجية 2PP للحل المطور5. - قم بإعداد دورق سعة 50 مل وضع الدعامة التي تحمل العينة بداخلها.
ملاحظة: انتبه للحفاظ على العدسات الدقيقة 2PP على السطح العلوي لتجنب أي تشوه هيكلي أثناء التطوير بسبب قلبها الداخلي غير المبلمر. - املأ الدورق ب ~ 20 مل من المحلول النامي ، مع تغطية العينة بالكامل. يتكون المحلول من محلول كحول الأيزوبروبيل بنسبة 50٪ (حجم / حجم) 2-بنتانون و 50٪ (حجم / حجم).
- اترك العينة داخل المحلول المطور لمدة 45 دقيقة.
- ضع العينة في دعامة مناسبة لرفعها عن الأرض وتثبيتها في وضع أفقي.
- غسل العينة
- ارفع الدعم من الحل المتطور.
- عن طريق التعامل معها يدويا أو باستخدام زوج من الملقط ، خذ العينة واغسلها بعناية ببضع قطرات من كحول الأيزوبروبيل.
- جفف كل من الأسطح المصنعة للغطاء الزجاجي بتدفق لطيف من النيتروجين (في درجة حرارة الغرفة).
ملاحظة: يتم تنفيذ جميع الإجراءات الموضحة في الخطوات 3.2-3.3 تحت غطاء دخان كيميائي.
4. عينة من الأشعة فوق البنفسجية
- تعرض Microlense للأشعة فوق البنفسجية (الطول الموجي 385 نانومتر) (الشكل 5 ب)
- ضع الغطاء الزجاجي على حامل عينة معلق من المستوى الأرضي. ضع العينة بحيث تكون العدسات الدقيقة متجهة لأسفل.
ملاحظة: يحتوي حامل العينة على ثقب مركزي لوضع العينة معلقة من المرحلة الأرضية ، مما يحافظ على سلامة البنية المجهرية على السطح السفلي. - قم بإعداد مصباح للأشعة فوق البنفسجية بطول موجي 385 نانومتر.
- ضع العينة تحت مصدر الأشعة فوق البنفسجية الموجه بشكل عمودي فيما يتعلق بسطح الغطاء الزجاجي.
- قم بتعريض العينة للأشعة فوق البنفسجية التي تم ضبطها عند 300 ميجاوات لمدة 120 ثانية.
ملاحظة: يحدث التعرض للأشعة فوق البنفسجية مرورا بالركيزة الدقيقة والزجاجية. بهذه الطريقة ، سيتم ربط قلب العدسات الذي لم يتم بلمرته بعد بالأشعة فوق البنفسجية ، مما يتجنب التعرض المباشر والإضافي للسطح المبلمر مسبقا. - قم بتسمية مصدر الأشعة فوق البنفسجية عند -45 درجة و + 45 درجة فيما يتعلق بالموضع الطبيعي لمستوى العينة ، كرر الخطوة 4.1.4.
ملاحظة: سيسمح هذا التعرض للأشعة فوق البنفسجية من ثلاث خطوات بزوايا مختلفة بالتشابك الكامل للمقاومة غير المبلمرة بالكامل داخل حجم العدسات الدقيقة ، مما يحقق الاستقرار. هذا مهم بشكل خاص للعدسات الدقيقة العريضة. - قم بإزالة العينة من الحامل وتخزينها.
- ضع الغطاء الزجاجي على حامل عينة معلق من المستوى الأرضي. ضع العينة بحيث تكون العدسات الدقيقة متجهة لأسفل.
5. التوصيف المورفولوجي
- عمليات الاستحواذ على الفحص المجهري الإلكتروني (SEM) (الشكل 6)
- تحضير محطة SEM. قم بتوصيل قطعة من شريط الكربون بحامل SEM للالتصاق بالعينة.
- ضع عينة الزجاج على الحامل عند 45 درجة فيما يتعلق باتجاه كاميرا SEM. انتبه إلى إرفاق العينة في مساحة فارغة على الغطاء للحفاظ على سلامة الهيكل (الشكل 6 ب).
- كرر عملية الاستحواذ كما في الخطوة 5.1.2 لكل من أسطح الغطاء الزجاجي لجمع صور 3D SEM للسقالات الدقيقة والعدسات الدقيقة (الشكل 6 أ ، ج).
- افصل العينة بعناية عن شريط الكربون وقم بتخزينها في صندوق مغطى.
النتائج
تم توفير بروتوكول لتصنيع جهاز مجهري قابل للزرع على الوجهين يحتوي على نظام بصري ومرجع تحليل الأنسجة. تستغل العملية بلمرة الليزر ثنائية الفوتون لتصنيع الهياكل المجهرية ثلاثية الأبعاد والبصريات الدقيقة على الجانب الآخر من نفس الركيزة. يسمح استخدام هدف مسافة العمل الطويلة بتصنيع كلا الهيكلين دون قلب الركيزة ، مما يوفر خطوة إعادة المحاذاة ويضمن محاذاة مثالية بين كلا المكونين. سيعمل هذا الجهاز على تمكين التصوير المتقدم في الموقع من خلال السماح بتصحيح الانحرافات البصرية والملاحظات المتكررة لنفس المنطقة ، وذلك بفضل البصريات الدقيقة والإطار المرجعي المصنوع من الدقيقة. يوضح الشكل 1 إجراء إعداد كلا سطحي الركيزة الداعمة للتصنيع اللاحق. يتم تمثيل رسم تخطيطي للإعداد التجريبي المستخدم لتصنيع سطحي العينة في الشكل 2. تظهر الصورة أيضا حامل العينة الموضوعية المعقد ، مع التركيز الأول على العينة التي تضيء بنظام إضاءة LED أحمر ، مما يسمح بمراقبة التصنيع في الوقت الفعلي باستخدام رؤية الماكينة. يوضح الشكل 3 نوعيا مرونة البروتوكول في السماح بالتصنيع الدقيق لمختلف تصميمات السقالات الدقيقة والعدسات الدقيقة. يسلط الشكل 4 الضوء على وظيفة الترهل المستخدمة لتصميم العدسة الدقيقة ذات المظهر الجانبي المكافئ اللاكروي ورسم تخطيطي لتصميم تمثيلي مرتبط بميزاته الرئيسية كمثال. في الشكل 5 ، تم الإبلاغ عن خطوات تطوير العينة والتعرض للأشعة فوق البنفسجية اللازمة لربط الحجم الكامل للعدسات الدقيقة بالكامل. أخيرا ، يوضح الشكل 6 أمثلة على نتائج التصنيع الدقيق. يسمح الإجراء المقدم ببلمرة الهياكل الدقيقة ثلاثية الأبعاد لكلا السطحين من نفس الجهاز ، مما يضمن دقة واستقرارا ممتازين. أخيرا ، الشكل 7 هو رسم توضيحي يمثل سير العمل العام للبروتوكول ، وينتهي بالشكل 8 ، والذي يوضح مثالا على التطبيق النهائي للجهاز المقترح ، أي التصوير في المختبر للخلايا المزروعة داخل السقالة الدقيقة.

الشكل 1: بروتوكول لإعداد العينة. توضح هذه الصورة رسما تخطيطيا لعملية الإرسال ذات الخطوات المزدوجة لصب القطرات المقاوم للضوء على غطاء زجاجي دائري داعم (A). على اليمين ، تم الإبلاغ عن صورة للعينة مع المقاومة الضوئية المجففة المودعة على كلا الجانبين (ب). العينة مدعومة من قبل حامل العينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
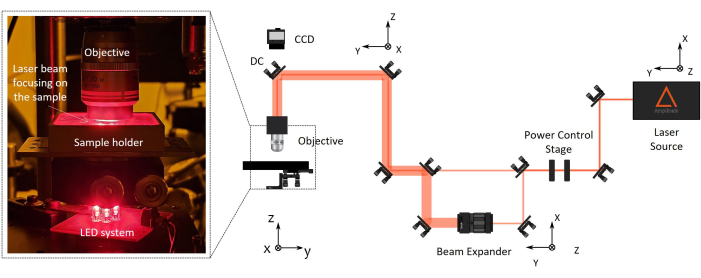
الشكل 2: إعداد تصنيع بلمرة ليزر ثنائية الفوتون (2PP). على اليمين، يتم الإبلاغ عن رسم تخطيطي تمثيلي لإعداد التصنيع. المكونات الرئيسية للإعداد هي مصدر ليزر فيمتو ثانية بطول موجي يبلغ 1030 نانومتر ، وعرض نبضة أدنى يبلغ 230 fs ، ومعدل تكرار 1 ميجاهرتز) ، ومرحلة للتحكم في الطاقة ، وموسع شعاع ، ومرآة ثنائية اللون ، وهدف مجهر ذات فتحة عددية عالية (100x ، NA 1.1). يتم تركيب كاميرا CCD فوق المرآة ثنائية اللون المحاذاة للمحور البصري الموضوعي لمراقبة عملية التصنيع. على اليسار ، يوجد انفجار ، مع تكبير الجزء الأخير من الإعداد البصري الذي يظهر صورة لنظام إضاءة الهدف / حامل العينة / LED المعقد لرؤية الماكينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
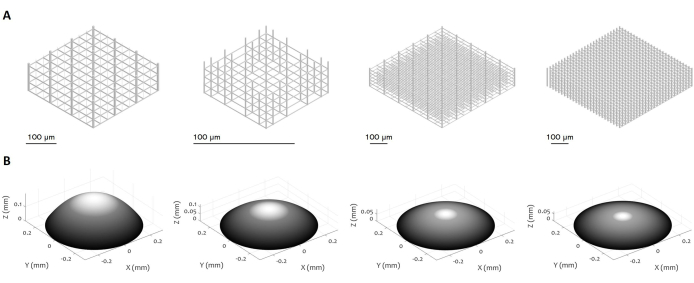
الشكل 3: تصميمات متعددة للبنى المجهرية ثلاثية الأبعاد والعدسات الدقيقة. يعرض الشكل أمثلة مختلفة ل (أ) السقالات الدقيقة و (ب) العدسات الدقيقة التي يمكن تصنيعها باستخدام الإجراء المقترح. تتيح المرونة العالية للبروتوكول تصنيع الهياكل المجهرية بمجموعة متنوعة من الميزات الهندسية والدقة والأبعاد والحجم ، مما يدل على تعدد استخداماته. يهدف المقياس الرمادي في اللوحة (B) إلى إبراز الانخفاض في قوة الليزر وسرعة الكتابة لتنعيم السطح وتقليل خشونة السطح. يتم تعيين المعلمات الدقيقة للتصنيع وفقا للتصميم المحدد للعدسة الدقيقة. أشرطة المقياس: 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: مثال على العدسات الدقيقة المصنعة. تعرض اللوحة مثالا تمثيليا لمظهر مكافئ شبه كروي يسلط الضوء على الوصف البارامتري للسطح المنحني للعدسة كدالة ترهل z(r) (A). هنا ، Htot هو سمك العدسة ، r هو الإحداثي الشعاعي ، و fn هو البعد البؤري للعدسة الانكسارية المكافئة التي تختلف عن بعدها البؤري الفعال. يتم تحديد قوة الانكسار من خلال معامل انكسار العدسة وكيف تختلف عن تلك الموجودة في الوسط المحيط. على اليمين ، يسلط رسم التصميم الضوء على المستويين الرئيسيين اللذين يقعان عند الرأس V1 وبضعة ميكرومتر فوق السطح 2 (Π1 و Π2 ، خطوط متقطعة) (B). يظهر الرسم عدسة دقيقة مكافئة شبه كروية واحدة بقطر 600 ميكرومتر وملفقة على ركيزة زجاجية N-BK7 (بسمك 170 ميكرومتر). (ج) يؤكد المعلمات الهندسية للعدسة المكافئة اللاكروية المصنوعة بدقة في مقاومة الضوء SZ2080. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
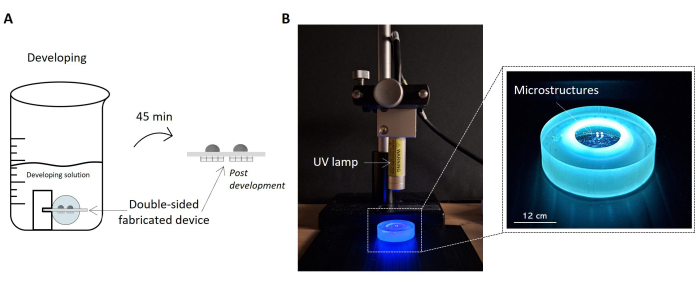
الشكل 5: بروتوكولات تطوير العينة والتعرض للأشعة فوق البنفسجية. تسلط الصورة الضوء على العينة المصنعة المنقوعة في حل التطوير كرسم تخطيطي (A). يتم رفع العينة داخل المحلول بواسطة الحامل ، مما يسمح بالتطوير السليم لكلا جانبي العينة والحصول على جهاز مجهر على الوجهين. على اليمين ، يتم الإبلاغ عن صورة لتكوين الإعداد للإشعاع فوق البنفسجي للعينة (B). تظهر الصورة مصباح الأشعة فوق البنفسجية الموضوع بشكل عمودي على سطح العينة. كما هو مذكور في ورقة بيانات مصباح الأشعة فوق البنفسجية ، فإن المسافة الحالية بين المصباح والعينة تتوافق مع مسافة تشغيل المصباح. يتم تمييز العينة التي تخضع للأشعة فوق البنفسجية ويتم التعامل معها بواسطة حامل العينة في صورة التكبير على اليمين. شريط المقياس: 12 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: عمليات الاستحواذ على الفحص المجهري الإلكتروني (SEM) للنتائج التمثيلية للتصنيع. تسلط اللوحة الضوء على جهاز مصنع على الوجهين من خلال عرض جانبي (B) ونتيجتين تمثيليتين للعدسة الدقيقة المصنعة (A) والسقالة الدقيقة (C) بواسطة صور SEM. يمكن رؤية البنيين اللذين وضعا على وجوه مختلفة لنفس الركيزة الزجاجية بوضوح في الصورة المركزية (ب). يتم تمثيل العدسات الدقيقة على السطح السفلي للزجاج ، بينما توجد السقالات الدقيقة في السطح العلوي. تظهر صورة SEM للعدسة الدقيقة المصنعة ذات التصميم الكروي على اليمين كمثال على النتيجة المستقرة والسلسة للتصنيع (A). على اليسار ، تسلط الصورة الضوء على نتيجة تمثيلية لسقالة صغيرة مسامية 2PP بهندسة تعسفية (C). قضبان المقياس: (A ، C) - 50 ميكرومتر ؛ (ب) - 1 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
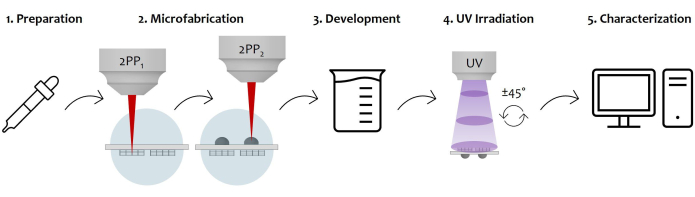
الشكل 7: رسم تخطيطي لسير عمل البروتوكول وتطبيق الجهاز: يعرض الشكل عملية التصنيع الشاملة المرسومة خطوة بخطوة. يبدأ بتحضير العينة عن طريق الصب المتتابع للضوء المقاوم للضوء على كلا سطحي الركيزة الزجاجية (1). بمجرد أن يصل المقاوم الضوئي إلى حالة سول هلام ، تكون العينة جاهزة للتصنيع بواسطة بلمرة ليزر ثنائية الفوتون (2). لذلك ، يتم تشعيع كل من قطرات مقاومة الضوء بالتتابع ، مما يؤدي إلى هيكلة مجهرية للبنى المجهرية أولا ثم العدسات الدقيقة. بعد ذلك ، تخضع الركيزة الدقيقة على الوجهين لإجراء تطوير لإزالة جميع المقاومة غير المبلمرة المحيطة بالتركيبات (3). للقيام بذلك ، تنقع العينة في محلول كحولي ثم تجفف برفق. يتبع الأشعة فوق البنفسجية للعينة عن طريق المرور عبر الركيزة الزجاجية لربط اللب الداخلي غير المبلمر للعدسات الدقيقة تماما (4). أخيرا ، يتم إجراء فحص جودة العينة الدقيقة عن طريق عمليات الاستحواذ على الفحص المجهري الإلكتروني الماسح (SEM) لتوصيف الهياكل المجهرية شكليا (5). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: التطبيق المحتمل لنافذة التصوير المجهرية. على اليسار ، يوضح رسم تمثيلي النظام البصري الذي يتكون منه الجهاز مقترنا بهدف مجهر خارجي في نظام المسح القياسي (A). هذا هو ما يسمى بالتكوين الافتراضي المستخدم في هذه الحالة لتصوير نمو الخلايا الحية داخل السقالة الدقيقة. تم زرع الخلايا الليفية الفلورية (بروتين التألق الأحمر (RFP) المسمى) على السطح الزجاجي للجهاز ، الذي يحمل الهياكل المجهرية ثلاثية الأبعاد. تم التقاط صور مضان متحد البؤر للخلايا في المستوى البؤري للغطاء الزجاجي (B ، علامة التصنيف الخضراء) ، وبالتالي مع الاستخدام الوحيد للهدف الخارجي ، ومن خلال عدسة دقيقة واحدة في مستواها البؤري (A ، الهاشتاج البنفسجي). تظهر نوى الخلية باللون الأزرق (تلطيخ Hoechst) ، والهيكل الخلوي باللون الأحمر (RFP). قضبان المقياس: (B) - 100 ميكرومتر ؛ (C) - 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لضمان تصوير دقيق للمنطقة المطلوبة 3,6 في النافذة ذات البنية الدقيقة ، من الضروري أن يكون لديك محاذاة دقيقة للهيكلين (السقالة الدقيقة والعدسات الدقيقة). هذا يشكل التحدي الرئيسي للبروتوكول المقترح حيث ترتبط الدقة العالية ل 2PP ارتباطا وثيقا بالحد من عمق التصنيع 3,6. قد يكون قلب العينة أثناء التصنيع لتعريض كلا السطحين بالتتابع لشعاع الليزر خيارا ، ولكنه يعقد إعادة المحاذاة ويستغرق وقتاطويلا 5. ومن شأن ذلك أيضا أن يخلق صعوبات في العثور على نفس النظام المرجعي ومن ثم يضر بالمحاذاة الجيدة بين المكونات البصرية الدقيقة والسقالات الدقيقة. يؤدي إجراء العملية برمتها بشكل مستمر دون فك العينة إلى الحفاظ على نظام مرجعي متسق ، وبالتالي تسهيل وضمان المحاذاة الدقيقة للهياكل. للقيام بذلك ، نستخدم هدف مسافة العمل الطويلة (2.5 مم) الذي يحافظ على دقة جيدة بفضل فتحة العدسة العددية العالية (الخطوة 1.1). يقلل هذا النهج أيضا بشكل كبير من وقت التصنيع لأنه يوفر محاذاة العينة بعد قلبها3. بالإضافة إلى ذلك ، فإن التعامل مع العينات يشكل تحديا آخر نظرا لصغر حجمها وهشاشتها ، مما يجعل التلاعب والمحاذاة الدقيقة أكثر أهمية.
في عمليات 2PP ، يعد التحقيق الواسع في عملية التصنيع أمرا ضروريا لإنشاء معلمات رئيسية مثل الطول الموجي الأمثل لليزر وعرض النبضة بالإضافة إلى قوى الليزر وحركات المسرح9،10،11. لذلك ، تم إجراء توصيف شامل لعملية 2PP ، حتى مع الأخذ في الاعتبار التكوينات المختلفة للإعداد التجريبي لضمان هياكل ثلاثية الأبعاد عالية الثبات وعالية الدقة مع تفاصيل على نطاق خلوي للتطبيقات البيولوجية ،27،28،29،30. بالإضافة إلى ذلك ، كان تقليل خشونة سطح العدسات الدقيقة القابلة للزرع أمرا بالغ الأهمية للحصول على بصريات دقيقة عالية الجودة مع الميزات البصرية المرغوبة ، وبالتالي تقليل الاستجابة المناعية للغرسة19،22،31. لذلك ، يكمن تحدي العملية في ضبط معلمات مثل القدرة وعرض النبضة بناء على عوامل تجريبية مثل معامل الانكسار وحجم المادة الحساسة للضوء ، والظروف البيئية (على سبيل المثال ، الرطوبة ودرجة الحرارة) ، وكفاءة الليزر. كان هناك حاجة أيضا إلى توصيف شامل لوقت التعرض للأشعة فوق البنفسجية وشثته للربط الكامل بين الحجم الكامل للعدسات الدقيقة ، مما يضمن استقرارها. يجب تصميم هذه الإعدادات وفقا لمصدر الأشعة فوق البنفسجية ومسافة التشغيل والحجم المحدد للعنصر المراد بلمرة الأشعة فوق البنفسجية.
يتمثل القيد الأساسي لعملية 2PP في إنتاجيتها المنخفضة بسبب الدقة العالية للغاية التي تقدمها. بالنظر إلى ذلك ، فإن الميزات المبلمرة صغيرة جدا ، من مئات النانومتر إلى بضعة ميكرومترات9،26. لذلك ، تزداد أوقات التصنيع بشكل كبير عند إنتاج هياكل على مقياس مئات الميكرومتر ، وهي كبيرة نسبيا وفقا لمعايير 2PP ، خاصة إذا كانت الهياكل الضخمة. نتيجة لذلك ، قد يستغرق إنشاء أجهزة متكاملة بهياكل متعددة ذات أبعاد كبيرة عدة ساعات. في هذا الإطار ، عزز بروتوكول UV-2PP الهجين المقترح لتصنيع العدسات الدقيقة انخفاضا بنسبة 98٪ في وقت تصنيع عدسة دقيقة واحدة مقارنة ب 2PP من حجمها بالكامل. سمح ذلك بزيادة الدقة في المسح الضوئي 2PP للغلاف الخارجي للعدسة الدقيقة ، مما يقلل من خشونة السطح مع الحصول على غلاف عدسة دقيقة سميكة بما يكفي لضمان استقرار العدسة ، كل ذلك في وقت تصنيع مقبول. ولزيادة تسريع العملية، سيقترح في المستقبل نهج التوازي للسماح بالكتابة المتزامنة لهياكل متعددة32. ستتضمن هذه الإستراتيجية تقسيم شعاع الليزر إلى حزم متعددة لإنشاء العديد من النقاط المحورية ، مما يتيح التصنيع المتوازي وبالتالي تقليل وقت الإنتاج الإجمالي بشكل كبير.
على عكس تقنيات الطباعة الحجرية اللينة الأكثر شيوعا ، تتمثل إحدى المزايا الرئيسية ل 2PP في أنه نهج تصنيع مضاف بدون قناع يتيح تصنيع هياكل تعسفية ضمن حجم من المواد الحساسةللضوء 11. تسمح هذه القدرة بإنتاج هياكل معقدة ثلاثية الأبعاد ومسامية مع إمكانات تخصيص عالية. علاوة على ذلك ، استنادا إلى مبدأ الامتصاص غير الخطي ، يسمح 2PP بالوصول إلى دقة أقل من حد الحيود ، وهو أمر لا يمكن تحقيقه بواسطة تقنيات الطباعة ثلاثية الأبعاد القياسية أو نمذجة الترسيب المنصهر (FDM) كمثال33. هذا ذو قيمة خاصة لإنشاء سقالات ثلاثية الأبعاد مسامية بميزات على نطاق خلوي لدعم النمو الخلوي والتجنيد وتكامل الأنسجة.
إن إنتاج الأجهزة القابلة للزرع ذات البنية الدقيقة مع البصريات المتكاملة من خلال العملية المقترحة هنا لديه القدرة على التأثير بشكل كبير على التطبيقات التي تشمل علم الأحياء الميكانيكي ، ونمذجة الأمراض في المختبر ، وهندسة الأنسجة (الشكل 7 والشكل 8). يتيح البروتوكول المقدم تصنيع جهاز تقني عالي الجودة يتميز بهياكل مجهرية تدعم تكامل الأنسجة بينما تعمل في نفس الوقت كنقاط مرجعية للتصوير في الجسم الحي. بالإضافة إلى ذلك ، عززت تلك العدسات الدقيقة المصممة بشكل صحيح التصوير غير الخطي المتقدم عن طريق تصحيح الانحرافات الكروية التي تسببها الأنسجة المحيطةبالغرسة 4. في الواقع ، يسمح لنا تعدد استخدامات العملية بضبط تصميم الجهاز مثل ، على سبيل المثال ، لإنشاء سقالات وهياكل مرجعية بهندسة محسنة لتطبيقات محددة ، مما يساعد في كل من عمليات إعادة البناء ثلاثية الأبعاد وتصحيح انحرافات التصوير في المعالجة اللاحقة. أخيرا ، فإن تصميم العدسة الدقيقة بناء على مؤشرات انكسار الأنسجة يعزز التصوير الخاص بالتطبيق ، مما يؤدي إلى إنشاء عدسة بصرية في الموقع داخل الجهاز بشكل فعال.
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تلقى هذا البحث تمويلا من الاتحاد الأوروبي في إطار برنامج البحث والابتكار Horizon 2020 (G.A. No. 964481-IN2SIGHT).
Materials
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
References
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926(2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103(2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107(2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527(2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20(2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810(2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204(2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179(2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621(2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646(2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577(2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794(2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved