Method Article
Microfabricação de Óptica Implantável Integrada em uma Janela de Imagem Microestruturada para Imagem In Vivo Avançada
Neste Artigo
Erratum Notice
Resumo
Este protocolo descreve a fabricação de uma janela de imagem integrada implantável usando impressão a laser 3D. A janela consiste em um sistema de microlentes acopladas a micro-andaimes. O método envolve a polimerização de dois fótons (2PP) do fotorresistente biocompatível SZ2080 em uma sequência contínua, otimizando a eficiência de fabricação e o alinhamento entre os diferentes componentes.
Resumo
No contexto de biomateriais e testes de drogas em modelos animais, este estudo apresenta um protocolo simplificado para a fabricação de uma nova janela de imagem integrada implantável. O microdispositivo compreende um sofisticado sistema de microlentes acopladas a microandaimes projetados especificamente para quantificação in vivo da resposta imune usando microscopia de excitação não linear avançada. O protocolo é baseado na polimerização de dois fótons (2PP) do fotorresistente biocompatível SZ2080, que permite a fabricação de micro-andaimes e micro-lentes em uma sequência contínua para aumentar a eficiência e a precisão da fabricação. Para melhorar ainda mais a velocidade, precisão e integridade estrutural, uma abordagem de fabricação óptica híbrida foi implementada, envolvendo o 2PP do invólucro externo da microlente seguido de reticulação UV em massa do núcleo interno. Esta técnica inovadora otimiza as propriedades ópticas das microlentes enquanto agiliza o processo de produção. O microdispositivo resultante demonstra alta reprodutibilidade e estabilidade mecânica, tornando-o um método eficaz para prototipagem de sistemas ópticos em microescala para uma variedade de aplicações biomédicas.
Introdução
A microscopia intravital capacita o estudo de processos biológicos em animais vivos por meio da visualização em tempo real. Quando combinado com abordagens de imagem não linear fluorescente, pode até atingir uma resolução na escala subcelular1. Consequentemente, tornou-se uma ferramenta importante em muitos campos, como testes de imunologia ou estudos de câncer, onde a observação das células dentro de seu ambiente fisiológico real é importante.
Abordagens comuns para inspeções intravitais, como câmaras de dobras cutâneas dorsais ou janelas de imagem craniana e abdominal, são altamente invasivas e apresentam dificuldades para inspeções de longo prazo do mesmo ponto. Assim, novas abordagens de imagem in vivo que reduzam o sofrimento animal e permitam o fácil reposicionamento da visão óptica são fortemente desejáveis2.
Nessa estrutura, é possível avançar uma nova janela de imagem miniaturizada baseada em um substrato de vidro que contém um lado de imagem com microlentes ópticas e um lado de referência de tecido com microscaffolds tridimensionais (3D). Esta janela de imagem miniaturizada pode ser implantada "subcuta" no animal e funcionará como uma objetiva de microscópio "interna". O princípio de funcionamento do dispositivo será usar as microlentes acopladas a uma objetiva de microscópio externa de baixa abertura numérica (NA) para realizar imagens não lineares in vivo dos processos biológicos que ocorrem dentro dos andaimes. As microlentes compensarão a aberração esférica devido à imagem através de um meio não homogêneo como tecido 3,4, enquanto o micro-andaime impulsionará a regeneração do tecido e atuará como balizas ópticas 5,6,7, permitindo assim a inspeção de longo prazo do mesmo ponto.
Os componentes básicos do dispositivo, ou seja, micro-scaffolds e micro-lentes, já foram demonstrados separadamente, mas sua integração no mesmo dispositivo apresenta vários desafios devido à sua natureza 3D, seu tamanho micrométrico e a necessidade de ter um alinhamento óptico perfeito entre eles. Os micro-andaimes, constituídos por grelhas paralelepípedas rectangulares, com dimensões totais representativas ~ 500 μm x 500 μm x 100 μm e com tamanhos de poros ~ 50 μm x 50 μm x 20 μm, podem orientar o recrutamento celular e a nova vascularização, promovendo assim a integração tecidual. Além disso, devido à sua autofluorescência, os microscaffolds funcionam como um farol de fluorescência in situ, permitindo um rápido reposicionamento e alinhamento ao microscópio e até mesmo uma correção de aberrações esféricas durante imagens não lineares para permitir observações longitudinais in vivo de alta resolução5. As microlentes de alta abertura numérica, com perfis esféricos ou quase-parabólicos e distâncias focais de algumas centenas de micrômetros, demonstraram suas capacidades para imagens lineares e não lineares de espécimes biológicos se combinadas com um microscópio confocal ou de dois fótons 3,4.
As microlentes e os micro-andaimes são fabricados por inscrição a laser 3D, também conhecida como polimerização de dois fótons (2PP). Em 2PP, um feixe de laser infravermelho de femtossegundo é fortemente focado dentro de um fotorresistente curável por UV e, devido à absorção de vários fótons no ponto focal, um voxel confinado de material polimerizado é criado com tamanho submicrométrico (~ 100 nm). Ao mover o foco do laser em relação à amostra fotorresistente, estruturas tridimensionais de material polimerizado podem ser obtidas após a lavagem do material não polimerizado8. O processo tem uma resolução intrinsecamente alta e uma natureza 3D que permite a aquisição de microestruturas 3D, como andaimes e lentes, com boa estabilidade e alta qualidade superficial 9,10,11. Existem diferentes técnicas para a fabricação de micro-andaimes porosos, como impressão 3D, nanoimprinting ou eletrofiação 12,13,14,15. Todas essas técnicas sofrem de uma desvantagem principal; Eles não são capazes de atingir resoluções na faixa submicrométrica, dando assim estruturas com tamanhos de poros (~ 100 μm) maiores que o tamanho celular, e não imitam a matriz extracelular, o que é essencial para uma boa regeneração tecidual. A fabricação de microlentes pode ser abordada por métodos baseados na replicação da lente a partir de um molde ou máscara, como moldagem por injeção, gravação a quente ou moldagem UV, ou por métodos diretos, como refluxo térmico, gravação microplástica ou jateamento de microgotículas16,17. Todos eles apresentam limitações na morfologia superficial que podem ser obtidas e são difíceis de integrar em um fluxo de fabricação onde os micro-scaffolds também devem ser fabricados. Por outro lado, o 2PP demonstrou sua versatilidade para a fabricação de componentes ópticos complexos18,19, como lentes esféricas ou parabólicas, lentes difrativas ou mesmo combinações de lentes diferentes no mesmo componente óptico 20,21,22,23,24. Nesse contexto, o 2PP parece ser a melhor técnica para a fabricação de um todo que contém lentes e micro-andaimes.
Apesar de ser uma escolha única para a realização dessas estruturas 3D com resolução micrométrica, o 2PP apresenta duas limitações principais, ou seja, é uma abordagem demorada para estruturas de volume relativamente grande e apresenta uma profundidade de fabricação limitada (ao longo do eixo óptico) devido à curta distância de trabalho das objetivas de microscópio usadas para foco apertado.
Este artigo propõe um protocolo único para a fabricação dos micro-scaffolds e das microlentes nos lados opostos de um substrato de vidro em um processo de irradiação de etapa longitudinal que garante um bom alinhamento de ambos os elementos e supera as limitações de profundidade de fabricação. O protocolo também é otimizado para o tempo de fabricação; por um lado, a irradiação em uma etapa economiza tempo de alinhamento, e o uso de uma abordagem híbrida que combina 2PP do invólucro da lente e cura UV dos fotorresistentes internos reduz o tempo de irradiação para as lentes de alto volume25. A capacidade do 2PP de fabricar estruturas 3D de forma livre permite o uso deste protocolo para qualquer projeto de microlente e microandaime, fortalecendo assim o método atual.
Protocolo
Os detalhes dos reagentes e dos equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Preparação da amostra
- Primeira fundição (Figura 1A)
- Limpar com acetona em ambas as superfícies de uma lamínula circular de vidro de 12 mm de diâmetro (170 μm de espessura).
- Seque ambas as superfícies com gás nitrogênio em temperatura ambiente.
- Deposite uma quantidade controlada de 46 μL de fotorresistente líquido em um lado da lamínula de vidro usando uma pipeta de volume.
NOTA: O material fotossensível usado neste protocolo é um fotorresistente orgânico/inorgânico híbrido biocompatível conhecido como SZ2080, que é bem conhecido e validado para aplicações biomédicas26. Preste atenção para deixar um anel externo livre no substrato de vidro. Por estar livre de fotorresistentes, este espaço vítreo garante a correta retenção da amostra dentro do suporte para melhor auxiliar no preparo. - Deixar a amostra sob a capa química durante 48 h para permitir a secagem da primeira gota de fotorresistente por evaporação do solvente, atingindo o estado sol-gel.
- Segunda fundição (Figura 1A)
- Quando a primeira gota de fotorresistente atingir o estado sol-gel (etapa 1.1.4.), vire a amostra de cabeça para baixo, expondo a superfície limpa.
- Coloque a amostra em um suporte de suporte, levantando a primeira superfície fundida do solo.
- Deposite uma segunda gota de 46 μL de fotorresistente líquido na superfície limpa do vidro, deixando o anel externo, bem como na etapa 1.1.3.
- Deixar a amostra sob a cobertura química durante, pelo menos, 48 h, deixando evaporar o solvente.
NOTA: Após 4-6 dias, a amostra de gota dupla está pronta para ser usada para 2PP (Figura 1B). A partir de agora, preste atenção para não expor a amostra à luz ambiente devido ao material fotossensível. A exposição à luz degrada o fotorresistente.
2. Polimerização de dois fótons (2PP) das microestruturas
- Alinhamento de configuração (Figura 2)
- Ligue a fonte de laser infravermelho próximo de femtossegundo (comprimento de onda de 1030 nm, 1 MHz, com duração mínima de pulso = 230 fs).
NOTA: Defina os parâmetros do laser, como a largura de pulso e a taxa de repetição. - Alinhe o caminho óptico do feixe de laser até atingir a objetiva do microscópio por meio de uma série de ópticas e espelhos montados em montagens de espelho cinemáticas. Gire iterativamente os espelhos para centralizar o feixe dentro dos orifícios de alinhamento do infravermelho próximo (NIR).
NOTA: A distância de trabalho da objetiva do microscópio deve ser maior que a altura total do dispositivo final a ser fabricado (altura da lente + espessura da lamínula + altura do microandaime). Os furos NIR são projetados adequadamente para simplificar o alinhamento dos feixes IR. Isso garante o alinhamento preciso do feixe ao longo do caminho óptico, passando por componentes como uma placa de meia onda, um expansor de feixe e um espelho dicróico. Para controlar automaticamente a potência do laser, o feixe passa por um polarizador horizontal e uma placa de meia onda, e o segundo é montado em um rotador motorizado. Se necessário, o feixe pode passar por um expansor de feixe para aumentar o diâmetro do feixe e cumprir a entrada traseira do objetivo. - Direcione o feixe de laser perpendicularmente ao suporte de amostra, alinhando-o usando a centralização de reflexão reversa.
- Monte a objetiva do microscópio de longa distância de trabalho no suporte dedicado no final do caminho óptico próximo à amostra (Figura 2).
NOTA: Uma câmera CCD é montada acima do espelho dicróico alinhado ao eixo óptico da objetiva para monitoramento do processo de fabricação. Isso permitirá ver o ponto de foco do laser e as estruturas polimerizadas.
- Ligue a fonte de laser infravermelho próximo de femtossegundo (comprimento de onda de 1030 nm, 1 MHz, com duração mínima de pulso = 230 fs).
- Montagem de amostra
- Fixar (com fita adesiva) a lamínula de vidro de dupla gota no porta-amostras montado nas fases de tradução. Monte a amostra com a segunda gota depositada voltada para baixo.
NOTA: O porta-amostras possui um orifício central onde a amostra pode ser suspensa no estágio de solo5. O suporte é conectado a um sistema mecânico de cardan que é aparafusado a um estágio de translação X, Y para o movimento da amostra. - Centralize a amostra manualmente com a objetiva de microscópio montada.
- Fixar (com fita adesiva) a lamínula de vidro de dupla gota no porta-amostras montado nas fases de tradução. Monte a amostra com a segunda gota depositada voltada para baixo.
- Centralização de amostras
- Defina a potência do laser no valor mínimo suficiente para ver o reflexo do feixe no software da câmera CCD (cerca de 5 mW).
NOTA: Meça a potência do laser na pupila posterior da objetiva (a transmissão da objetiva usada neste protocolo é de 70% no comprimento de onda de 1030 nm). - Ligue o software de interface do operador para o controlador de movimento e a câmera CCD.
- Focalize o feixe de laser na superfície superior da primeira gota fotorresistente.
- Seguindo o perfil curvo da gota, encontre as bordas da amostra ao longo das direções X e Y. Defina o centro da gota como uma referência de zero absoluto por software.
NOTA: A fita usada para fixar a amostra desempenha um papel na detecção de bordas, modificando o índice de refração e, portanto, a reflexão do feixe.
- Defina a potência do laser no valor mínimo suficiente para ver o reflexo do feixe no software da câmera CCD (cerca de 5 mW).
- Compensação de inclinação de amostra
- No centro da amostra, focalize o feixe de laser na superfície de interface entre a superfície superior da lamínula de vidro e a base da primeira gota de fotorresistente. Defina-o como referência zero no eixo Z.
- Considerando o diâmetro da amostra, mova-se para a posição da borda (para a lamínula de 12 mm, é ~ - 4 mm) na direção negativa do eixo X. Nessa posição, focalize a superfície da interface (entre o vidro e a gota superior do fotorresistente) e defina-a como uma referência de zero absoluto ao longo da direção vertical Z.
- Deslocar-se para a posição da aresta na direção positiva do eixo X (para a lamínula de 12 mm, é ~ + 4 mm). Encontre aqui a superfície da interface movendo a objetiva ao longo da direção vertical Z.
- Incline a amostra para corrigir o desvio na direção Z entre as posições negativa e positiva ao longo do eixo X. Use uma montagem cinemática ajustável para inclinação do porta-amostras (como um gimbal).
- Repita as etapas 2.4.2-2.4.4 iterativamente até que a amostra esteja completamente equilibrada no eixo X.
- Execute o mesmo procedimento descrito nas etapas 2.4.2-2.4.5 ao longo da direção Y.
- Uma vez que a amostra esteja perfeitamente equilibrada nos eixos planares X e Y, volte para a posição central e foque a interface entre o vidro e o fotorresistente nesse ponto.
- Defina o novo valor Z do foco como referência no eixo Z (Z = 0).
NOTA: O procedimento da etapa 2.4 visa garantir a perpendicularidade perfeita entre o feixe de laser e a superfície da lamínula para garantir uma ancoragem perfeita das estruturas de 2PP que serão fabricadas posteriormente. A partir de 2,4, todos os procedimentos devem ser realizados de acordo com o índice de refração. Portanto, adicione o meio de correspondência de índice do objetivo, se necessário.
- Micro-andaimes 2PP na queda fotorresistente inferior
- Ligue um sistema de iluminação LED vermelho para monitoramento em tempo real do processo de polimerização.
NOTA: Uma iluminação de diodo emissor de luz vermelha é colocada sob o complexo sample cardan-suporte (Figura 2). Esta iluminação permitirá ver o volume polimerizado durante o processo de 2PP. O fotorresistente é sensível a comprimentos de onda mais curtos (luz visível); portanto, a luz LED vermelha não vai perturbar a amostra. - Com o laser desligado, mova a objetiva ao longo da direção Z abaixo da lamínula de vidro para encontrar a segunda superfície de interface entre a superfície inferior do vidro e a base da gota inferior de resistência.
NOTA: A segunda interface será encontrada em um valor Z aproximadamente igual à espessura da lamínula (170 μm). - Aumente a potência do laser em até 100 mW para permitir que a polimerização de dois fótons ocorra na queda inferior.
- Ajuste a posição focal (aumentando Z) para encontrar a segunda interface polimerizando uma estrutura de referência simples.
NOTA: Um exemplo de estrutura de referência é uma linha polimerizada de 50 μm de comprimento. - Defina a primeira posição focal onde a polimerização da estrutura de referência ocorre como a referência zero ao longo da direção vertical (eixo Z).
NOTA: A referência na etapa 2.5.5 sublinha o plano base para o 2PP dos microandaimes. - Defina as potências de polimerização (~ 100-200 mW) e execute o código de máquina como um programa de controle numérico computadorizado (CNC) para o movimento adequado dos estágios de translação para fabricar a estrutura 3D desejada (Figura 3A).
NOTA: O programa CNC é composto por um conjunto de coordenadas espaciais (x, y, z) que determinam para que lado as plataformas de translação se movem para produzir o objeto 3D final. Esses poderes de polimerização serão influenciados pela altura da queda superior e pelas condições experimentais específicas (fotorresistente, laser e sistema de movimento).
- Ligue um sistema de iluminação LED vermelho para monitoramento em tempo real do processo de polimerização.
- Microlentes 2PP na gota fotorresistente superior
- Movendo-se ao longo do eixo Z, volte para a primeira interface entre a superfície superior do vidro e a gota superior do fotorresistente (etapa 2.4.8). Manter o mesmo sistema de referência planar (coordenadas X, Y) para garantir um alinhamento perfeito das microlentes 2PP com as microestruturas já fabricadas.
- Encontre a interface polimerizando uma estrutura de referência simples.
NOTA: Use o mesmo processo descrito na etapa 2.5.4, mas diferindo apenas na direção do movimento vertical. - Defina a primeira linha de polimerização como referência zero ao longo da direção vertical (eixo Z).
NOTA: A referência na etapa 2.6.3 sublinha o plano de aterramento para o 2PP das microlentes. - Defina os parâmetros de fabricação para o 2PP do contorno da microlente desejada (Figura 3B). O feixe de laser descreve uma trajetória circular decrescente em raio para polimerizar continuamente a superfície externa de uma única microlente. Defina os parâmetros de hachura e fatiamento ao longo das direções X e Z, respectivamente.
NOTA: O design das lentes deve considerar a distância focal efetiva desejada pelo usuário. Como regra geral, deve ser um valor maior que a espessura da lamínula e deve permitir a imagem de todo o atlas. Recomenda-se uma simulação computacional preliminar do sistema óptico final. - Defina a potência de polimerização (~ 15-20 mW) e execute o programa que orienta o movimento dos estágios de translação.
NOTA: Esses poderes de polimerização serão influenciados pela altura da queda superior, pelas condições experimentais específicas e pelo design da microlente desejada (Figura 3B). A Figura 4 mostra um exemplo representativo de microlente parabólica com a função paramétrica que descreve o perfil da microlente e suas principais características geométricas.
3. Desenvolvimento da amostra
- Remova a amostra da configuração de fabricação experimental.
- Com o laser desligado, desative os eixos de translação X, Y e Z e remova o suporte.
- Retire a fita adesiva e retire a amostra do suporte.
NOTA: Antes do desenvolvimento da amostra, preste atenção para não expor a amostra à luz ambiente devido ao material fotossensível. A exposição à luz reticularia toda a quantidade de fotorresistente.
- Desenvolvimento da amostra (Figura 5A)
- Coloque a amostra em um suporte adequado para levantá-la do solo e segure-a na posição horizontal.
NOTA: Este suporte de amostra é um rack de amostra impresso em SLA personalizado projetado adequadamente para expor as superfícies prototipadas de 2PP à solução em desenvolvimento5. - Prepare um copo de 50 mL e coloque o suporte que transporta a amostra dentro dele.
NOTA: Preste atenção à manutenção das microlentes 2PP na superfície superior para evitar qualquer deformação estrutural durante o desenvolvimento devido ao seu núcleo interno não polimerizado. - Encha o copo com ~ 20 mL de solução de revelação, cobrindo completamente a amostra. A solução é feita com 50% (v/v) de 2-pentanona e 50% (v/v) de solução de álcool isopropílico.
- Deixe a amostra dentro da solução de revelação por 45 min.
- Coloque a amostra em um suporte adequado para levantá-la do solo e segure-a na posição horizontal.
- Lavagem de amostras
- Levante o suporte da solução em desenvolvimento.
- Manuseando-o manualmente ou usando uma pinça, pegue a amostra e lave-a cuidadosamente com algumas gotas de álcool isopropílico.
- Seque ambas as superfícies fabricadas da lamínula de vidro com um fluxo suave de nitrogênio (à temperatura ambiente).
NOTA: Todos os procedimentos descritos nas etapas 3.2-3.3 são realizados sob uma capela de exaustão química.
4. Irradiação UV da amostra
- Exposição microlente à radiação UV (comprimento de onda de 385 nm) (Figura 5B)
- Colocar a lamínula de vidro num suporte de amostras suspenso do plano de massa. Coloque a amostra com as microlentes voltadas para baixo.
NOTA: O porta-amostras possui um orifício central para colocar a amostra suspensa no estágio de solo, preservando a integridade da microestrutura na superfície inferior. - Prepare uma lâmpada UV com um comprimento de onda de 385 nm.
- Posicione a amostra sob a fonte de UV perpendicularmente orientada em relação à superfície da lamínula de vidro.
- Expor a amostra à radiação UV fixada em 300 mW durante 120 s.
NOTA: A exposição aos raios UV ocorre passando pelo micro-andaime e substrato de vidro. Desta forma, o núcleo ainda não polimerizado das lentes será reticulado por UV, evitando a exposição direta e adicional à superfície previamente polimerizada. - Titulando a fonte UV a -45° e +45° em relação à posição normal do plano de amostra, repita a etapa 4.1.4.
NOTA: Esta exposição UV em três etapas em diferentes ângulos permitirá a reticulação total de toda a resistência não polimerizada dentro do volume das microlentes, alcançando estabilidade. Isso é particularmente importante para microlentes amplas. - Remova a amostra do suporte e guarde-a.
- Colocar a lamínula de vidro num suporte de amostras suspenso do plano de massa. Coloque a amostra com as microlentes voltadas para baixo.
5. Caracterização morfológica
- Aquisições de Microscopia Eletrônica de Varredura (SEM) (Figura 6)
- Prepare a estação SEM. Prenda um pedaço de fita de carbono ao suporte SEM para aderência da amostra.
- Coloque a amostra de vidro no suporte a 45° em relação à orientação da câmera SEM. Preste atenção ao anexar a amostra em um espaço vazio na lamínula para preservar a integridade da estrutura (Figura 6B).
- Repita a aquisição como na etapa 5.1.2 para ambas as superfícies da lamínula de vidro para coletar imagens SEM 3D dos microandaimes e das microlentes (Figura 6A, C).
- Separe cuidadosamente a amostra da fita de carbono e guarde-a em uma caixa coberta.
Resultados
Foi fornecido um protocolo para a fabricação de um dispositivo microestruturado implantável de dupla face contendo um sistema óptico e uma referência de análise tecidual. O processo explora a polimerização a laser de dois fótons para fabricar microestruturas 3D e micro-ópticas no lado oposto do mesmo substrato. O uso de uma objetiva de longa distância de trabalho permite a fabricação de ambas as estruturas sem inverter o substrato, economizando a etapa de realinhamento e garantindo um alinhamento perfeito entre os dois componentes. Este dispositivo capacitará imagens avançadas in situ , permitindo a correção de aberrações ópticas e observações repetidas da mesma área, graças à micro-óptica e a um quadro de referência microfabricado. A Figura 1 mostra o procedimento de preparação de ambas as superfícies do substrato de suporte para fabricação subsequente. Um esboço da configuração experimental usada para microfabricar ambas as superfícies da amostra é representado na Figura 2. A imagem também mostra o complexo suporte de amostra de objetiva, com o primeiro focando na amostra que é iluminada por um sistema de iluminação de LED vermelho, permitindo o monitoramento em tempo real da fabricação usando visão de máquina. A Figura 3 demonstra qualitativamente a flexibilidade do protocolo em permitir a microfabricação de vários projetos de micro-andaimes e microlentes. A Figura 4 destaca a função de curvatura usada para projetar microlentes com um perfil parabólico asférico e um esboço de um projeto representativo correlacionado às suas principais características como exemplo. Na Figura 5, são relatadas as etapas de desenvolvimento da amostra e exposição aos raios UV necessárias para reticular totalmente todo o volume das microlentes. Finalmente, a Figura 6 mostra exemplos de resultados de microfabricação. O procedimento apresentado permite a polimerização de microestruturas 3D de ambas as superfícies do mesmo dispositivo, garantindo excelente resolução e estabilidade. Por fim, a Figura 7 é uma ilustração que representa o fluxo de trabalho geral do protocolo, terminando com a Figura 8, que mostra um exemplo de uma aplicação final do dispositivo proposto, ou seja, imagens in vitro de células cultivadas dentro do micro-andaime.

Figura 1: Protocolo para preparo de amostras. Esta imagem mostra um esboço do processo de dupla etapa para fundição por gota fotorresistente em uma lamínula de vidro circular de suporte (A). À direita, é relatada uma imagem da amostra com o fotorresistente seco depositado em ambos os lados (B). A amostra é suportada pelo suporte da amostra. Clique aqui para ver uma versão maior desta figura.
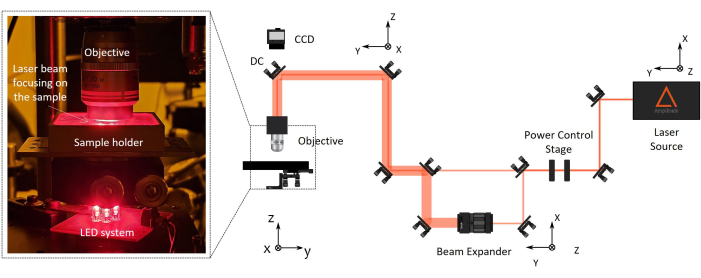
Figura 2: Configuração de fabricação de polimerização a laser de dois fótons (2PP). À direita, um diagrama representativo da configuração de fabricação é relatado. Os principais componentes da configuração são uma fonte de laser de femtossegundo com comprimento de onda de 1030 nm, largura de pulso mínima de 230 fs e taxa de repetição de 1 MHz), um palco para controle de potência, um expansor de feixe, um espelho dicróico e uma objetiva de microscópio de alta abertura numérica (100x, NA 1.1). Uma câmera CCD é montada acima do espelho dicróico alinhado ao eixo óptico da objetiva para monitoramento do processo de fabricação. À esquerda, há uma ampliação, com o zoom da parte final da configuração óptica mostrando uma fotografia do complexo sistema de iluminação objetiva / suporte de amostra / LED para visão de máquina. Clique aqui para ver uma versão maior desta figura.
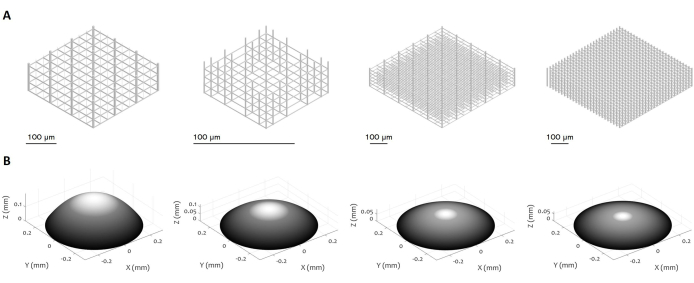
Figura 3: Múltiplos projetos de microestruturas 3D e microlentes. A figura exibe vários exemplos de (A) micro-andaimes e (B) microlentes que podem ser fabricadas usando o procedimento proposto. A alta flexibilidade do protocolo permite a fabricação de microestruturas com uma variedade de características geométricas, resolução, dimensões e volume, demonstrando sua versatilidade. A escala de cinza no painel (B) visa destacar a diminuição da potência do laser e da velocidade de escrita para suavizar a superfície e minimizar a rugosidade da superfície. Parâmetros precisos de fabricação são definidos de acordo com o design específico da microlente. Barras de escala: 100 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 4: Exemplo de microlente fabricada. O painel mostra um exemplo representativo de um perfil parabólico asférico destacando a descrição paramétrica da superfície curva da lente como função de curvatura z(r) (A). Aqui, Htot é a espessura da lente, r é a coordenada radial e fn é a distância focal de uma lente refrativa parabólica que difere de sua distância focal efetiva. A potência dióptrica é determinada pelo índice de refração da lente e como ela difere das do meio circundante. À direita, o esboço do projeto destaca os dois planos principais situados no vértice V1 e alguns μm acima da superfície 2 (Π1 e Π2, linhas tracejadas) (B). O esboço mostra uma única microlente parabólica asférica com um diâmetro de 600 μm e fabricada em um substrato de vidro N-BK7 (com uma espessura de 170 μm). (C) sublinha os parâmetros geométricos para a lente parabólica asférica microfabricada em SZ2080 fotorresistente. Clique aqui para ver uma versão maior desta figura.
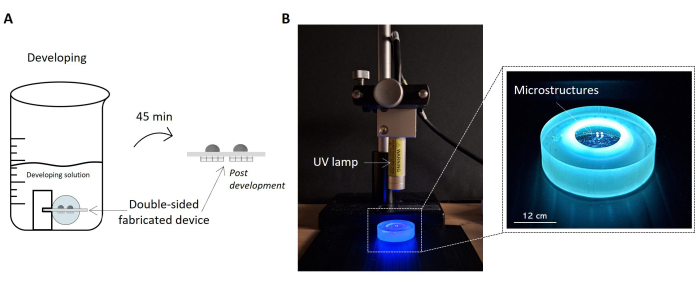
Figura 5: Protocolos para desenvolvimento de amostras e exposição aos raios UV. A imagem destaca a amostra fabricada embebida na solução de desenvolvimento como um esboço (A). A amostra é levantada dentro da solução pelo suporte, permitindo o desenvolvimento adequado de ambos os lados da amostra e a obtenção do dispositivo microestruturado de dupla face. À direita, uma imagem da configuração de configuração para irradiação UV da amostra é relatada (B). A imagem mostra a lâmpada UV posicionada perpendicularmente à superfície da amostra. Conforme declarado na folha de dados da lâmpada UV, a distância atual entre a lâmpada e a amostra é consistente com a distância de operação da lâmpada. A amostra submetida à radiação UV e manuseada pelo porta-amostras é destacada na imagem ampliada à direita. Barra de escala: 12 cm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Aquisições de microscopia eletrônica de varredura (SEM) de resultados representativos de fabricação. O painel destaca um dispositivo fabricado de dupla face através de uma vista lateral (B) e dois resultados representativos de microlente fabricada (A) e micro-andaime (C) por imagens SEM. As duas construções colocadas em faces diferentes do mesmo substrato de vidro são claramente visíveis na imagem central (B). As microlentes são representadas na superfície inferior do vidro, enquanto os micro-andaimes estão na superior. A imagem SEM de microlentes fabricadas com um design esférico é mostrada à direita como um exemplo do resultado estável e suave da fabricação (A). À esquerda, a imagem destaca um resultado representativo de um micro-andaime poroso 2PP com geometria arbitrária (C). Barras de escala: (A,C) - 50 μm; (B) - 1 cm. Clique aqui para ver uma versão maior desta figura.
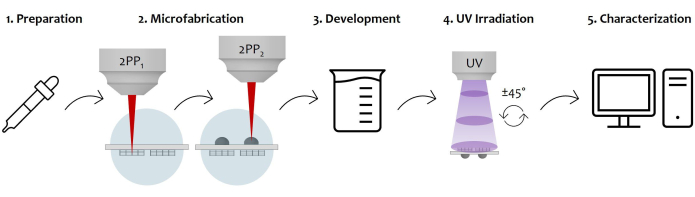
Figura 7: Diagrama esquemático do fluxo de trabalho do protocolo e aplicação do dispositivo: A figura exibe o processo geral de fabricação esboçado passo a passo. Começa com a preparação da amostra pela fundição sequencial de gotas fotorresistentes em ambas as superfícies do substrato de vidro (1). Uma vez que o fotorresistente atinge um estado sol-gel, a amostra está pronta para ser fabricada por polimerização a laser de dois fótons (2). Portanto, ambas as gotas fotorresistentes são irradiadas sequencialmente, microestruturando primeiro as microestruturas e depois as microlentes. Posteriormente, o substrato microfabricado de dupla face passa por um procedimento de desenvolvimento para remover toda a resistência não polimerizada ao redor das construções (3). Para isso, a amostra é embebida em uma solução alcoólica e depois seca suavemente. Segue a irradiação UV da amostra passando pelo substrato vítreo para reticular completamente o núcleo interno não polimerizado das microlentes (4). Por fim, uma verificação de qualidade da amostra microfabricada é realizada por meio de aquisições de Microscopia Eletrônica de Varredura (MEV) para caracterizar morfologicamente as microestruturas (5). Clique aqui para ver uma versão maior desta figura.

Figura 8: Potencial aplicação da janela de imagem microestruturada. À esquerda, um esboço representativo ilustra o sistema óptico constituído pelo dispositivo acoplado a uma objetiva de microscópio externa em um sistema de varredura padrão (A). Esta é a chamada configuração virtual usada neste caso para a imagem do crescimento de células vivas dentro do micro-andaime. Fibroblastos de fluorescência (marcados com Proteína de Fluorescência Vermelha (RFP)) foram semeados na superfície de vidro do dispositivo, que carrega as microestruturas 3D. Imagens de fluorescência confocal de células foram tiradas no plano focal da lamínula de vidro (B, hashtag verde), portanto, com o único uso da objetiva externa, e através de uma única microlente em seu plano focal (A, hashtag violeta). Os núcleos celulares são visíveis em azul (coloração de Hoechst) e o citoesqueleto em vermelho (RFP). Barras de escala: (B) - 100 μm; (C) - 50 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Para garantir imagens precisas da área desejada 3,6 na janela microestruturada, é obrigatório ter um alinhamento preciso das duas estruturas (micro-andaime e micro-lentes). Isso representa o principal desafio do protocolo proposto, pois a alta resolução do 2PP está intimamente relacionada a uma limitação na profundidade de fabricação 3,6. Inverter a amostra durante a fabricação para expor sequencialmente ambas as superfícies ao feixe de laser pode ser uma opção, mas complica o realinhamento e é demorado5. Isso também introduziria dificuldades em encontrar o mesmo sistema de referência e, assim, comprometeria o bom alinhamento entre os componentes micro-ópticos e os micro-andaimes. A condução de todo o processo continuamente sem desmontar a amostra mantém um sistema de referência consistente, facilitando e garantindo o alinhamento preciso das estruturas. Para isso, usamos uma objetiva de longa distância de trabalho (2,5 mm) que mantém uma boa resolução graças à sua alta abertura numérica (passo 1.1). Essa abordagem também reduz significativamente o tempo de fabricação, pois economiza o alinhamento da amostra após inlancá-la3. Além disso, o manuseio das amostras representa outro desafio devido ao seu pequeno tamanho e fragilidade, tornando a manipulação e o alinhamento preciso ainda mais críticos.
Nos processos de 2PP, uma ampla investigação do processo de fabricação é essencial para estabelecer parâmetros-chave, como o comprimento de onda ideal do laser, largura de pulso, bem como potências do laser e movimentos de estágio 9,10,11. Portanto, uma caracterização abrangente do processo 2PP, mesmo considerando diferentes configurações da configuração experimental para primeiro garantir estruturas 3D altamente estáveis e de alta resolução com detalhes em escala celular para aplicações biológicas, foi realizada 27,28,29,30. Além disso, minimizar a rugosidade da superfície das microlentes implantáveis foi crucial para a obtenção de micro-ópticas de alta qualidade com as características ópticas desejadas, reduzindo assim a resposta imunológica ao implante 19,22,31. Portanto, o desafio do processo está em ajustar parâmetros como potência e largura de pulso com base em fatores experimentais, como índice de refração e volume do material fotossensível, condições ambientais (por exemplo, umidade e temperatura) e eficiência do laser. Também foi necessária uma caracterização extensiva para que o tempo e a intensidade da exposição aos raios UV reticulassem totalmente todo o volume das microlentes, garantindo sua estabilidade. Essas configurações devem ser adaptadas à fonte de UV, à distância de operação e ao volume específico do elemento a ser polimerizado por UV.
Uma das principais limitações do processo 2PP é seu baixo rendimento devido à resolução extremamente alta que oferece. Diante disso, as características polimerizadas são muito pequenas, de centenas de nanômetros a alguns micrômetros 9,26. Portanto, os tempos de fabricação aumentam significativamente ao produzir estruturas na escala de centenas de micrômetros, que são relativamente grandes para os padrões 2PP, especialmente se estruturas volumosas. Como resultado, a criação de dispositivos integrados com várias estruturas de dimensões tão grandes pode levar várias horas. Nesse contexto, o protocolo híbrido UV-2PP proposto para a fabricação de microlentes aumentou uma redução de 98% no tempo de fabricação de uma única microlente em comparação com o 2PP de todo o seu volume. Isso permitiu maior precisão na varredura de 2PP do invólucro externo da microlente, reduzindo a rugosidade da superfície e obtendo um invólucro de microlente espesso o suficiente para garantir a estabilidade da lente, tudo dentro de um tempo de fabricação tolerável. Para acelerar ainda mais o processo, uma abordagem de paralelização será proposta no futuro para permitir a escrita simultânea de várias estruturas32. Essa estratégia envolveria a divisão do feixe de laser em vários feixes para criar vários pontos focais, permitindo a fabricação paralela e, assim, reduzindo bastante o tempo geral de produção.
Ao contrário das técnicas litográficas suaves mais comuns, uma das principais vantagens do 2PP é que ele é uma abordagem de manufatura aditiva sem máscara que permite a fabricação de estruturas arbitrárias dentro de um volume de material fotossensível11. Essa capacidade permite a produção de estruturas tridimensionais e porosas complexas com alto potencial de personalização. Além disso, com base no princípio da absorção não linear, o 2PP permite atingir uma resolução abaixo do limite de difração, o que é inatingível por técnicas padrão de impressão 3D ou modelagem por deposição fundida (FDM) como exemplo33. Isso é particularmente valioso para a criação de andaimes 3D porosos com recursos de escala celular para apoiar o crescimento celular, recrutamento e integração de tecidos.
A produção de dispositivos implantáveis microestruturados com óptica integrada pelo processo proposto aqui tem o potencial de impactar significativamente aplicações que abrangem mecanobiologia, modelagem de doenças in vitro e engenharia de tecidos (Figura 7 e Figura 8). O protocolo apresentado permite a fabricação de um dispositivo técnico de alta qualidade com microestruturas que suportam a integração do tecido e, ao mesmo tempo, servem como pontos de referência de imagem in vivo . Além disso, essas microlentes adequadamente projetadas aprimoraram a imagem não linear avançada, corrigindo as aberrações esféricas causadas pelo tecido ao redor do implante4. A versatilidade do processo, de fato, nos permite ajustar o design do dispositivo como, por exemplo, criar andaimes e estruturas de referência com uma geometria otimizada para aplicações específicas, auxiliando tanto nas reconstruções 3D quanto na correção de aberrações de imagem no pós-processamento. Por fim, a adaptação do design de microlentes com base nos índices de refração do tecido aprimora a imagem específica da aplicação, criando efetivamente uma lente óptica in situ dentro do dispositivo.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Esta pesquisa recebeu financiamento da União Europeia no âmbito do programa de pesquisa e inovação Horizonte 2020 (GA No. 964481-IN2SIGHT).
Materiais
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
Referências
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926(2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103(2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107(2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527(2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20(2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810(2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204(2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179(2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621(2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646(2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577(2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794(2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636(2020).
Erratum
Formal Correction: Erratum: Microfabrication of Implantable Optics Integrated in a Microstructured Imaging Window for Advanced In Vivo Imaging
Posted by JoVE Editors on 6/04/2025. Citeable Link.
This corrects the article 10.3791/67975
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados