Method Article
高度な In vivo イメージングのための微細構造イメージングウィンドウに統合された埋め込み型光学系の微細加工
要約
このプロトコルは、3Dレーザー印刷を使用した埋め込み型統合イメージングウィンドウの作成について説明しています。このウィンドウは、マイクロレンズとマイクロスキャフォールドを組み合わせたシステムで構成されています。この方法では、生体適合性フォトレジストSZ2080の2光子重合(2PP)を連続的に行い、製造効率と異なるコンポーネント間のアライメントを最適化します。
要約
動物モデルにおける生体材料と薬物試験の文脈で、この研究は、新しい埋め込み型統合イメージングウィンドウを製造するための合理化されたプロトコルを提示します。このマイクロデバイスは、高度な非線形励起顕微鏡を使用して免疫応答を in vivo で定量するために特別に設計されたマイクロスキャフォールドと組み合わせたマイクロレンズの洗練されたシステムで構成されています。このプロトコルは、生体適合性フォトレジストSZ2080の2光子重合(2PP)に基づいており、マイクロスキャフォールドとマイクロレンズを連続的に製造して製造効率と精度を向上させることができます。速度、精度、構造的完全性をさらに向上させるために、マイクロレンズの外殻の2PPと、それに続く内核のUVバルク架橋を含むハイブリッド光学製造アプローチが実装されました。この革新的な技術は、マイクロレンズの光学特性を最適化しながら、製造プロセスを合理化します。得られたマイクロデバイスは、高い再現性と機械的安定性を示し、さまざまな生物医学アプリケーション向けのマイクロスケール光学システムのプロトタイピングに効果的な方法となっています。
概要
生体内顕微鏡検査は、リアルタイムの可視化により、生きた動物の生物学的プロセスの研究を強化します。蛍光ノンリニアイメージングアプローチと組み合わせると、細胞内スケール1の分解能にも到達できます。その結果、免疫検査やがん研究など、実際の生理学的環境内の細胞の観察が重要な多くの分野で重要なツールとなっています。
背側の皮膚折り畳み室や頭蓋および腹部のイメージングウィンドウなど、生体内検査の一般的なアプローチは侵襲性が高く、同じポイントの長時間の検査には困難をもたらします。したがって、動物の苦痛を軽減し、光学的視野の再配置を容易にする新しい in vivo イメージングアプローチが強く望まれています2。
このフレームワークでは、光学マイクロレンズを用いたイメージング面と3次元(3D)マイクロスキャフォールドを用いた組織参照面を含むガラス基板をベースとした、新しい小型イメージングウィンドウを進めることが可能となります。この小型化されたイメージングウィンドウは、動物に「サブキュート」に埋め込むことができ、「内部」顕微鏡の対物レンズとして機能します。デバイスの動作原理は、マイクロレンズと組み合わせた外部の低開口数(NA)顕微鏡対物レンズを使用して、足場内で行われる生物学的プロセスの生体内非線形イメージングを実行することです。マイクロレンズは、組織3,4のような不均質な媒体を介したイメージングによる球面収差を補正し、一方、マイクロ足場は組織の再生を促進し、光ビーコン5,6,7として機能するため、同じ点の長時間の検査が可能になります。
デバイスの基本コンポーネントであるマイクロスキャフォールドとマイクロレンズは、すでに別々に実証されていますが、同じデバイスに統合するには、3Dの性質、マイクロメータサイズ、およびそれら間の完全な光学アライメントの必要性のために、いくつかの課題があります。長方形の直方体グリッドで構成されたマイクロスキャフォールドは、代表的な全体寸法が~500 μm x 500 μm x 100 μm、細孔サイズが~50 μm x 50 μm x 20 μmで、細胞の動員と新しい血管新生をガイドし、組織の統合を促進することができます。さらに、マイクロスキャフォールドは自家蛍光により、in situ蛍光ビーコンとして機能し、顕微鏡下での迅速な再配置とアライメントを可能にし、非線形イメージング中の球面収差の補正さえ可能にし、高解像度の縦断的生体内観察を可能にします5。球面または準放物面プロファイルと数百マイクロメートルの焦点距離を持つ高開口マイクロレンズは、共焦点顕微鏡または2光子顕微鏡と組み合わせることで、生体試料の線形および非線形イメージングの能力を実証しています3,4。
マイクロレンズとマイクロスキャフォールドは、2光子重合(2PP)とも呼ばれる3Dレーザー刻印によって製造されます。2PPでは、赤外線フェムト秒レーザービームがUV硬化型フォトレジスト内に密集し、焦点での多光子吸収により、サブマイクロメートルサイズ(~100nm)の重合材料の閉じ込められたボクセルが生成されます。フォトレジスト試料に対してレーザーフォーカスを移動させることにより、未重合材料8を洗い流した後の重合材料の立体構造を得ることができる。このプロセスは、本質的に高い解像度と3Dの性質を備えているため、足場やレンズなどの3D微細構造を良好な安定性と高い表面品質で取得できます9,10,11。多孔質マイクロスキャフォールドの製造には、3Dプリンティング、ナノインプリント、エレクトロスピニング12,13,14,15など、さまざまな技術があります。これらすべての手法には、主な欠点があります。サブマイクロメートル範囲の分解能に達することができないため、細胞サイズよりも大きな細孔サイズ(~100μm)の構造が得られ、良好な組織再生に不可欠な細胞外マトリックスを模倣していません。マイクロレンズの製造は、射出成形、ホットエンボス加工、またはUV成形のような金型またはマスクからのレンズの複製に基づく方法、または熱リフロー、マイクロプラスチックエンボス加工またはマイクロ液滴噴射16,17のような直接的な方法によってアプローチすることができる。それらのすべては、取得できる表面形態に限界があり、マイクロ足場も製造しなければならない製造フローに統合することは困難です。一方、2PPは、球面レンズまたは放物面レンズ、回折レンズ、あるいは同じ光学部品20,21,22,23,24内の異なるレンズの組み合わせのような複雑な光学部品18,19の製造のためのその汎用性を実証している.このフレームワークでは、2PPは、レンズとマイクロスキャフォールドの両方を含む全体の製造に最適な技術であるように見えます。
マイクロメートルの分解能でこれらの3D構造を実現するためのユニークな選択肢であるにもかかわらず、2PPには2つの主要な制限があります、すなわち、比較的大きな体積構造には時間のかかるアプローチであり、タイトなフォーカシングに使用される顕微鏡対物レンズの作動距離が短いため、(光軸に沿って)製造深度が限られています。
この記事では、ガラス基板の反対側にあるマイクロスキャフォールドとマイクロレンズを1縦方向のステップ照射プロセスで製造するための独自のプロトコルを提案します。これにより、両方の要素の良好な位置合わせが保証され、製造深度の制限が克服されます。このプロトコルは、製造時間にも最適化されています。一方では、ワンステップ照射によりアライメント時間が節約され、レンズシェルの2PPと内部フォトレジストのUV硬化を組み合わせたハイブリッドアプローチの使用により、大容量レンズの照射時間が短縮されます25。2PPが自由形状の3D構造を作製する能力により、このプロトコルをあらゆるマイクロレンズおよびマイクロスキャフォールド設計に使用できるようになり、現在の方法が強化されます。
プロトコル
本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1. サンプル調製
- 最初のドロップキャスティング(図1A)
- 直径12 mmの円形ガラスカバースリップ(厚さ170 μm)の両面をアセトンで清掃します。
- 両面を室温の窒素ガスで乾かします。
- ボリュームピペットを使用して、ガラスカバースリップの片面に制御された量の液体フォトレジストを堆積させます。
注:このプロトコルで使用される感光性材料は、SZ2080として知られる生体適合性のハイブリッド有機/無機フォトレジストであり、生物医学的用途26でよく知られており、検証されています。ガラス基板上に自由な外部環を残すように注意してください。フォトレジストを含まないこのガラス質のスペースは、サンプルをサポート内に正しく保持し、調製をよりよく支援します。 - サンプルを化学フードの下に48時間放置して、溶媒の蒸発によってフォトレジストの最初の一滴を乾燥させ、ゾルゲル状態に到達させます。
- 2 回目のドロップキャスティング (図 1A)
- フォトレジストの最初の一滴がゾルゲル状態(ステップ1.1.4)に達したら、サンプルを逆さまにしてきれいな表面を露出させます。
- サンプルを支持ホルダーに置き、最初にドロップキャストした表面を地面から持ち上げます。
- ステップ1.1.3と同様に、外部環を残して、きれいなガラス表面に46μLの液体フォトレジストの2滴目を堆積させます。
- サンプルをケミカルフードの下に少なくとも48時間放置し、溶媒を蒸発させます。
注:4〜6日後、ダブルドロップキャストサンプルを2PPに使用する準備が整います(図1B)。今後は、感光性材料のためにサンプルを周囲光にさらさないように注意してください。光を露光するとフォトレジストが劣化します。
2. 微細構造の二光子重合(2PP)
- セットアップの位置合わせ(図2)
- フェムト秒近赤外レーザー光源(波長1030 nm、1 MHz、最小パルス幅= 230 fs)をオンにします。
注:パルス幅や繰り返し率などのレーザーパラメータを設定します。 - レーザービームの光路を、キネマティックミラーマウントに取り付けられた一連の光学系とミラーを通じて顕微鏡の対物レンズに到達するまで位置合わせします。ミラーを繰り返し回転させて、ビームを近赤外線(NIR)アライメントピンホールの中央に配置します。
注:顕微鏡の対物レンズの作動距離は、製造する最終デバイスの全高(レンズの高さ+カバースリップの厚さ+マイクロ足場の高さ)よりも長くする必要があります。NIRピンホールは、IRビームの位置合わせを簡素化するために適切に設計されています。これにより、光路に沿った正確なビームアライメントが保証され、半波長板、ビームエキスパンダー、ダイクロイックミラーなどのコンポーネントを通過します。レーザー出力を自動的に制御するために、ビームは水平偏光子と半波長板を通過し、2番目は電動ローテーターに取り付けられます。必要に応じて、ビームはビームエキスパンダーを通過してビーム径を拡大し、対物レンズの後部入口を満たすことができます。 - レーザービームをサンプルホルダーに対して垂直に向け、後方反射センタリングを使用してサンプルホルダーを位置合わせします。
- 長作動距離顕微鏡対物レンズは、サンプルに近い光路の端にある専用サポートに取り付けます(図2)。
注:CCDカメラは、製造プロセスの監視のために、対物レンズの光軸に位置合わせされたダイクロイックミラーの上に取り付けられています。これにより、レーザーフォーカススポットと重合構造を見ることができます。
- フェムト秒近赤外レーザー光源(波長1030 nm、1 MHz、最小パルス幅= 230 fs)をオンにします。
- サンプルのマウント
- ダブルドロップガラスカバースリップを、トランスレーションステージに取り付けられたサンプルホルダーにテープで固定します。2番目に堆積した液滴を下に向けてサンプルをマウントします。
注:サンプルホルダーには、サンプルを地上ステージ5から吊り下げることができる中央の穴があります。ホルダーは、サンプルの動きのためにX、Y並進ステージにねじ込まれたジンバル機械システムに接続されています。 - 取り付けられた顕微鏡対物レンズでサンプルを手動で中央に配置します。
- ダブルドロップガラスカバースリップを、トランスレーションステージに取り付けられたサンプルホルダーにテープで固定します。2番目に堆積した液滴を下に向けてサンプルをマウントします。
- サンプルセンタリング
- レーザー出力は、CCDカメラソフトウェアでビームの反射を見るのに十分な最小値(約5mW)に設定してください。
注:対物レンズの後瞳でレーザー出力を測定します(このプロトコルで使用される対物レンズの透過率は、1030nmの波長で70%です)。 - モーションコントローラーとCCDカメラのオペレーターインターフェースソフトウェアの電源を入れます。
- レーザービームを最初のフォトレジスト滴の上面に集束させます。
- 液滴の曲線プロファイルに従って、X 方向と Y 方向に沿ったサンプル エッジを見つけます。ソフトウェアによる絶対零度基準として液滴の中心を設定します。
注:サンプルを固定するために使用されるテープは、屈折率、つまりビーム反射を変更することにより、エッジの検出に役割を果たします。
- レーザー出力は、CCDカメラソフトウェアでビームの反射を見るのに十分な最小値(約5mW)に設定してください。
- サンプルの傾き補正
- サンプルの中央で、レーザービームをガラスカバースリップの上面とフォトレジストの最初の滴の基部との間の界面に集束させます。Z 軸上のゼロ基準として設定します。
- サンプルの直径を考慮して、X軸の負の方向にエッジ位置(12mmのカバーガラスの場合、~-4mm)に移動します。その位置で、界面(ガラスとフォトレジストの上部液滴の間)に焦点を合わせ、垂直方向Zに沿った絶対零度基準として設定します。
- X軸の正の方向のエッジ位置に移動します(12mmのカバースリップの場合、~+4mmです)。ここでは、対物レンズを垂直方向Zに沿って移動させるインターフェース面を見つけます。
- サンプルを傾けて、X軸に沿った負の位置と正の位置の間のZ方向の偏差を補正します。サンプルホルダーの傾きには、調整可能なキネマティックマウント(ジンバルなど)を使用します。
- サンプルがX軸上で完全にバランスが取れるまで、手順2.4.2〜2.4.4を繰り返します。
- 手順 2.4.2 から 2.4.5 で説明したのと同じ手順を Y 方向に沿って実行します。
- サンプルがX平面軸とY平面軸の両方で完全にバランスが取れたら、中心位置に戻り、ガラスとフォトレジストの間の界面をその点で焦点を合わせます。
- フォーカスの新しい Z 値を Z 軸の基準として設定します (Z = 0)。
注:ステップ2.4の手順は、レーザービームとカバースリップ表面との間の完全な垂直性を確保して、後で製造される2PP構造の完全な固定を確保することを目的としています。2.4以降は、すべての手順を屈折率に合わせて実行する必要があります。したがって、必要に応じて、目的のインデックス照合の媒体を追加します。
- 下部フォトレジストドロップに2PPのマイクロスキャフォールド
- 赤色LED照明システムをオンにすると、重合プロセスをリアルタイムで監視できます。
注:赤色発光ダイオード照明は、複雑なサンプルホルダージンバルの下に配置されます(図2)。この照明により、2PPプロセス中に重合量を見ることができます。フォトレジストは短波長(可視光)に敏感です。したがって、赤色LEDライトはサンプルを乱すことはありません。 - レーザーをオフにした状態で、対物レンズをガラスカバーガラスの下のZ方向に沿って移動させ、ガラスの底面とレジストの下滴の基部との間の2番目の界面を見つけます。
注:2番目のインターフェースは、カバースリップの厚さ(170μm)にほぼ等しいZ値にあります。 - レーザー出力を最大100 mWまで増やして、ボトムドロップで2光子重合が起こるようにします。
- 焦点位置を調整し(Zを大きくする)、単純な参照構造を重合して2番目の界面を見つけます。
注:参照構造の例としては、長さ50 μmの重合ラインがあります。 - 参照構造の重合が行われる最初の焦点位置を、垂直方向(Z軸)に沿ったゼロ基準として設定します。
注:手順2.5.5の参照は、マイクロスキャフォールドの2PPのベースプレーンに下線を引いています。 - 重合パワー(~100-200 mW)を設定し、マシンコードをコンピューター数値制御(CNC)プログラムとして実行して、並進ステージの適切な動きを実現し、目的の3D構造を作製します(図3A)。
注:CNCプログラムは、並進プラットフォームが最終的な3Dオブジェクトを生成するために移動する方向を決定する一連の空間座標(x、y、z)で構成されています。これらの重合力は、上部液滴の高さと特定の実験条件(フォトレジスト、レーザー、および移動システム)の影響を受けます。
- 赤色LED照明システムをオンにすると、重合プロセスをリアルタイムで監視できます。
- 上部フォトレジストドロップ上のマイクロレンズ2PP
- Z軸に沿って移動し、上部ガラス表面とフォトレジストの上部液滴との間の最初の界面に戻ります(ステップ2.4.8)。同じ平面参照系(X、Y座標)を維持して、マイクロレンズ2PPとすでに製造された微細構造との完全な位置合わせを確保します。
- 単純な参照構造を重合して界面を見つけます。
注意: 手順2.5.4で説明したのと同じプロセスを使用しますが、垂直方向の動きの方向が異なるだけです。 - 重合の最初の線を垂直方向(Z軸)に沿ったゼロ基準として設定します。
注:手順2.6.3の参照は、マイクロレンズの2PPのグランドプレーンに下線を引いています。 - 目的のマイクロレンズの輪郭の2PPの作製パラメータを設定します(図3B)。レーザービームは、半径が小さくなる円軌道を描き、単一のマイクロレンズの外面を連続的に重合します。ハッチング パラメータとスライス パラメータをそれぞれ X 方向と Z 方向に沿って設定します。
注意: レンズの設計では、ユーザーが希望する有効焦点距離を考慮する必要があります。経験則として、カバースリップの厚さよりも長い値にする必要があり、アトラス全体をイメージできる必要があります。最終的な光学系の予備的な計算シミュレーションが推奨されます。 - 重合電力(~15-20 mW)を設定し、並進ステージの動きをガイドするプログラムを実行します。
注:これらの重合力は、上部液滴の高さ、特定の実験条件、および目的のマイクロレンズの設計に影響されます(図3B)。 図4 は、マイクロレンズのプロファイルとその主要な幾何学的特徴を記述するパラメトリック関数を持つパラボラマイクロレンズの代表的な例を示しています。
3. サンプル開発
- 実験用製造セットアップからサンプルを取り出します。
- レーザーをオフにした状態で、X、Y、Zの並進軸を無効にし、ホルダーを取り外します。
- 粘着テープをはがし、サンプルをホルダーから取り外します。
注:サンプルを開発する前に、感光性材料のためにサンプルを周囲光にさらさないように注意してください。光を露光すると、フォトレジストの全量が架橋されます。
- サンプル開発(図5A)
- サンプルを適切なサポートに置き、地面から持ち上げて水平位置に保持します。
注:このサンプルホルダーは、2PPプロトタイプ表面の両方を開発ソリューション5にさらすように適切に設計されたカスタムSLA印刷サンプルラックです。 - 50mLのビーカーを用意し、サンプルを載せたサポートをその中に置きます。
注:2PPマイクロレンズは、未重合の内核による現像中の構造変形を避けるために、上面に維持することに注意を払ってください。 - ビーカーに~20 mLの現像液を入れ、サンプルを完全に覆います。この溶液は、50%(v / v)の2-ペンタノンと50%(v / v)のイソプロピルアルコール溶液で作られています。
- サンプルを現像液中に45分間放置します。
- サンプルを適切なサポートに置き、地面から持ち上げて水平位置に保持します。
- サンプル洗浄
- 開発中のソリューションからサポートを持ち上げます。
- 手動で取り扱うか、ピンセットを使用してサンプルを採取し、数滴のイソプロピルアルコールで慎重に洗います。
- ガラスカバースリップの加工された表面の両方を窒素の穏やかな流れ(室温)で乾燥させます。
注意: 手順3.2〜3.3で説明されているすべての手順は、化学ドラフトの下で実行されます。
4. サンプルUV照射
- マイクロレンズの紫外線(波長385nm)への曝露(図5B)
- ガラスカバースリップをグランドプレーンから吊り下げられたサンプルホルダーに置きます。マイクロレンズを下に向けてサンプルを置きます。
注:サンプルホルダーには、サンプルを地上ステージから吊り下げて配置するための中央の穴があり、底面の微細構造の完全性を維持します。 - 波長385nmのUVランプを準備します。
- サンプルをUV光源の下に、ガラスカバーガラスの表面に対して垂直に向けます。
- サンプルを300 mWに設定されたUV放射に120秒間さらします。
注:UV曝露は、マイクロスキャフォールドとガラス基板を通過して発生します。このようにして、レンズのまだ重合していないコアはUV架橋され、以前に重合された表面への直接的および追加の曝露を回避します。 - UV光源のタイトルを、サンプル平面の法線位置に対して-45°と+45°に付け、手順4.1.4を繰り返します。
注:この3段階のUV露光を異なる角度で行うことで、マイクロレンズの体積内の未重合レジスト全体を完全に架橋することができ、安定性が得られます。これは、広角マイクロレンズでは特に重要です。 - サンプルをホルダーから取り出して保管します。
- ガラスカバースリップをグランドプレーンから吊り下げられたサンプルホルダーに置きます。マイクロレンズを下に向けてサンプルを置きます。
5. 形態学的特性評価
- 走査型電子顕微鏡(SEM)の収集(図6)
- SEMステーションを準備します。サンプルを密着させるために、カーボンテープをSEMホルダーに取り付けます。
- SEMカメラの向きに対して45°のホルダーにガラスサンプルを置きます。構造の完全性を維持するために、カバーガラスの空きスペースにサンプルを取り付けるように注意してください(図6B)。
- ガラスカバースリップの両面でステップ5.1.2と同様に取得を繰り返し、マイクロスキャフォールドとマイクロレンズの3D SEM画像を収集します(図6A、C)。
- サンプルをカーボンテープから慎重に取り外し、蓋付きの箱に保管します。
結果
光学系および組織分析基準を含む両面埋め込み型微細構造デバイスの作製のためのプロトコルが提供されている。このプロセスでは、2光子レーザー重合を利用して、同じ基板の反対側に3D微細構造とマイクロオプティクスを作製します。長い作動距離対物レンズの使用は基質をひっくり返すことなしで両方の構造の作成を可能にし、再位置合わせステップを救い、両方の部品間の完全な位置合わせを保証する。このデバイスは、マイクロオプティクスと微細加工された基準フレームにより、光学収差の補正と同じ領域の繰り返し観察を可能にすることにより、高度なin situ イメージングを可能にします。 図1 は、その後の製造のために支持基板の両面を準備する手順を示しています。サンプルの両表面を微細加工するために使用した実験装置のスケッチを 図2に示します。この画像は、複雑な対物レンズサンプルホルダーも示しており、最初の画像は赤色LED照明システムによって照らされたサンプルに焦点を当てており、マシンビジョンを使用して製造をリアルタイムで監視できます。 図3 は、マイクロスキャフォールドとマイクロレンズのさまざまな設計の微細加工を可能にするプロトコルの柔軟性を定性的に示しています。 図4 は、非球面放物面プロファイルを持つマイクロレンズの設計に使用されるサグ機能と、その主要な特徴と相関する代表的な設計のスケッチを例に示しています。 図5では、マイクロレンズの全体積を完全に架橋するために必要なサンプル現像とUV露光の手順が報告されています。最後に、 図6 は微細加工の結果の例を示しています。提示された手順により、同じデバイスの両表面の3D微細構造の重合が可能になり、優れた分解能と安定性が保証されます。最後に、 図7 は、プロトコルの一般的なワークフローを表す図であり、 図8で終わり、提案されたデバイスの最終適用例、すなわち、マイクロスキャフォールド内で増殖した細胞の in vitro イメージングの例を示している。

図1:サンプル調製のプロトコル。 この画像は、支持する円形ガラスカバースリップ(A)へのフォトレジストドロップキャスティングの2段階のプロセスのスケッチを示しています。右側には、乾燥したフォトレジストを両面に堆積させたサンプルの写真が示されています(B)。サンプルはサンプルホルダーによって支持されます。 この図の拡大版を表示するには、ここをクリックしてください。
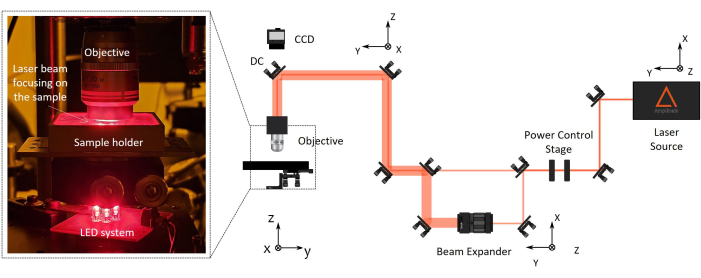
図2:2光子レーザー重合(2PP)製造セットアップ。 右側には、製造セットアップの代表的な図が表示されます。主な構成部品は、波長1030nm、最小パルス幅230fs、繰り返し周波数1MHzのフェムト秒レーザー光源、パワー制御用ステージ、ビームエキスパンダー、ダイクロイックミラー、高開口顕微鏡対物レンズ(100倍、NA1.1)です。CCDカメラは、製造プロセスを監視するために、対物光軸に整列したダイクロイックミラーの上に取り付けられています。左側にはブローアップがあり、光学セットアップの最後の部分のズームには、マシンビジョン用の複雑な対物レンズ/サンプルホルダー/LED照明システムの写真が表示されています。 この図の拡大版を表示するには、ここをクリックしてください。
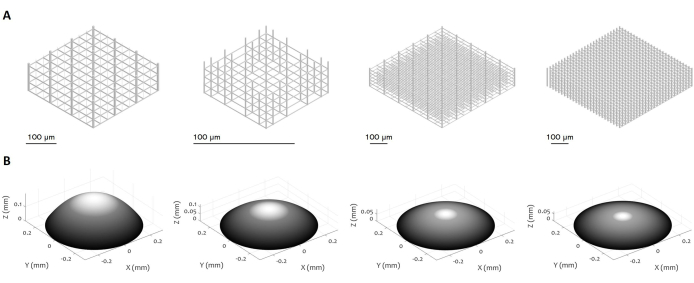
図3:3D微細構造とマイクロレンズの複数の設計。 図は、提案手順を用いて製造可能な(A)マイクロスキャフォールドと(B)マイクロレンズの様々な例を示しています。このプロトコルの高い柔軟性により、さまざまな幾何学的特徴、分解能、寸法、体積を持つ微細構造の製造が可能になり、その汎用性が実証されています。パネル(B)のグレースケールは、レーザー出力と書き込み速度の低下を強調して、表面を滑らかにし、表面の粗さを最小限に抑えることを目的としています。製造の正確なパラメータは、マイクロレンズの特定の設計に従って設定されます。スケールバー:100μmこの 図の拡大版を表示するには、ここをクリックしてください。

図4:作製したマイクロレンズの例。 このパネルは、レンズの曲面のパラメトリックな記述をサグ関数z(r)(A)として強調する非球面放物面プロファイルの代表的な例を示しています。ここで、Htot はレンズの厚さ、r は半径方向の座標、fn は有効焦点距離とは異なる放物面屈折レンズの焦点距離です。屈折度は、レンズの屈折率と、それが周囲の媒体の屈折率とどのように異なるかによって決まります。右側の設計スケッチでは、頂点 V1 とサーフェス 2 から数 μm 上にある 2 つの主平面 (Π1 と Π2、破線) が強調表示されています (B)。スケッチは、直径600μmの単一の非球面パラボラマイクロレンズをN-BK7ガラス基板(厚さ170μm)上に製造したものです。(C)は、SZ2080フォトレジストで微細加工された非球面パラボラレンズの幾何学的パラメータに下線を引いています。 この図の拡大版を表示するには、ここをクリックしてください。
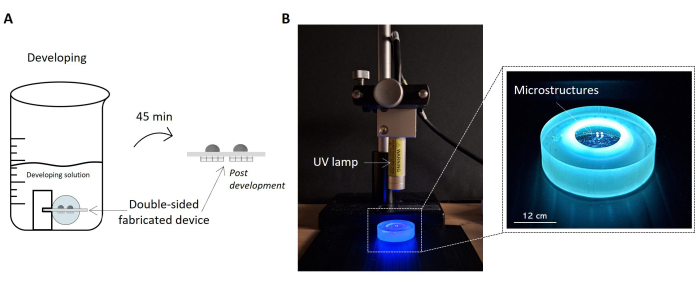
図5:サンプル開発とUV曝露のプロトコル。 画像は、開発ソリューションに浸された作製サンプルをスケッチ(A)として強調しています。サンプルはホルダーによって溶液内に持ち上げられるため、サンプルの両側が適切に展開され、両面の微細構造デバイスが得られます。右側には、サンプルのUV照射のセットアップ構成の写真が示されています(B)。写真は、サンプルの表面に対して垂直に配置されたUVランプを示しています。UVランプのデータシートに記載されているように、ランプとサンプルの間の現在の距離は、ランプの動作距離と一致しています。UV照射を受け、サンプルホルダーで取り扱われているサンプルは、右側のズームイン画像で強調表示されています。スケールバー:12 cmこの 図の拡大版を表示するには、ここをクリックしてください。

図6:走査型電子顕微鏡(SEM)による製造の代表的な結果の取得。 パネルは、側面図(B)を通じて両面作製デバイスを強調し、作製されたマイクロレンズ(A)とマイクロスキャフォールド(C)の2つの代表的な結果をSEM画像によって強調します。同じガラス基板の異なる面に横たわる2つの構造物は、中央の写真(B)ではっきりと見えます。マイクロレンズはガラスの下面に、マイクロスキャフォールドは上面に描かれています。球状にデザインしたマイクロレンズのSEM像を、安定した滑らかな作製結果の一例として右に示します(A)。左側の画像は、任意の形状の2PP多孔質マイクロスキャフォールドの代表的な結果を示しています(C)。スケールバー:(A、C)-50μm;(B) - 1 cm. この図の拡大版を表示するには、ここをクリックしてください。
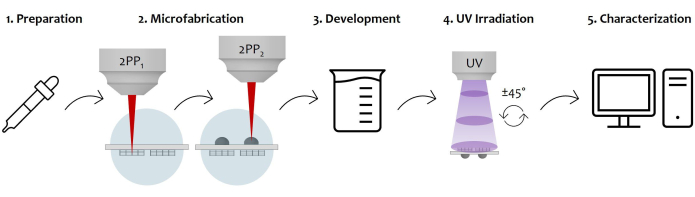
図7:プロトコルワークフローとデバイスアプリケーションの概略図: この図は、ステップバイステップでスケッチされた全体的な製造プロセスを示しています。これは、ガラス基板(1)の両面にシーケンシャルフォトレジストドロップキャスティングによるサンプルの調製から始まります。フォトレジストがゾルゲル状態に達すると、サンプルは2光子レーザー重合によって製造する準備が整います(2)。したがって、両方のフォトレジスト滴に順次照射され、最初に微細構造を微細化し、次にマイクロレンズを微細構造化します。その後、両面微細加工基板は、コンストラクト(3)を囲むすべての未重合レジストを除去するための現像手順を受けます。これを行うには、サンプルをアルコール溶液に浸し、次に穏やかに乾燥させます。サンプルのUV照射に続いて、ガラス状基板を通過してマイクロレンズの未重合内核を完全に架橋します(4)。最後に、微細構造を形態学的に特徴付けるために、走査型電子顕微鏡(SEM)取得によって微細加工されたサンプルの品質チェックが行われます(5)。 この図の拡大版を表示するには、ここをクリックしてください。

図8:微細構造イメージングウィンドウの潜在的なアプリケーション。 左側の代表的なスケッチは、標準的なスキャンシステム(A)で外部顕微鏡対物レンズに結合されたデバイスによって構成される光学システムを示しています。これは、マイクロスキャフォールド内の生細胞増殖のイメージングに使用される、いわゆる仮想構成です。蛍光線維芽細胞(Red Fluorescence Protein(RFP)標識)を、3D微細構造を持つデバイスのガラス表面に播種しました。細胞の共焦点蛍光画像は、ガラスカバースリップの焦点面(B、 緑色のハッシュタグ)で撮影されているため、外部対物レンズのみを使用し、その焦点面で単一のマイクロレンズ(A、 紫色のハッシュタグ)を介して撮影されています。細胞核は青色(Hoechst染色)、細胞骨格は赤色(RFP)で見えます。スケールバー:(B)-100μm;(C) - 50 μm. この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
マイクロストラクチャードウィンドウ内の所望の領域3,6の正確なイメージングを確保するためには、2つの構造(マイクロスキャフォールドとマイクロレンズ)の正確な位置合わせが必須です。これは、2PPの高分解能が製造深さ3,6の制限と密接に関連しているため、提案されたプロトコルの主な課題を提起します。製造中にサンプルを反転させて、両方の表面をレーザービームに順次さらすという選択肢もありますが、再アライメントが複雑になり、時間がかかります5。これにより、同じ参照系を見つけるのが難しくなり、マイクロ光学コンポーネントとマイクロスキャフォールドの間の良好な位置合わせが損なわれます。サンプルをアンマウントせずにプロセス全体を連続的に実施することで、一貫した参照系が維持され、構造の正確な位置合わせが容易になり、保証されます。そのために、高い開口数(ステップ1.1)により良好な解像度を維持する長作動距離対物レンズ(2.5mm)を使用します。このアプローチは、サンプルを反転させた後のサンプルの位置合わせを節約するため、製造時間も大幅に短縮します3。さらに、サンプルの取り扱いは、サイズが小さく壊れやすいため、別の課題を引き起こし、操作と正確なアライメントがさらに重要になります。
2PPプロセスでは、最適なレーザー波長、パルス幅、レーザー出力、ステージモーションなどの主要なパラメータを確立するために、製造プロセスの広範な調査が不可欠です9,10,11。したがって、2PPプロセスの包括的な特性評価は、生物学的アプリケーションのための細胞スケールの詳細を備えた非常に安定した高解像度の3D構造を最初に確保するために、実験セットアップのさまざまな構成を考慮しても実行されています27,28,29,30。さらに、埋め込み型マイクロレンズの表面粗さを最小限に抑えることは、所望の光学的特徴を有する高品質のマイクロ光学系を得るために重要であり、それによりインプラント19,22,31に対する免疫学的応答を低下させる。したがって、このプロセスの課題は、感光性材料の屈折率や体積、環境条件(湿度や温度など)、レーザー効率などの実験要因に基づいて、出力やパルス幅などのパラメータを調整することにあります。また、マイクロレンズの全容積を完全に架橋し、その安定性を確保するためには、UV露光時間と強度についても広範な特性評価が必要でした。これらの設定は、UVソース、動作距離、およびUV重合するエレメントの比体積に合わせて調整する必要があります。
2PPプロセスの主な制限は、非常に高い分解能を提供するためのスループットの低さです。それを考えると、重合された特徴は、数百ナノメートルから数マイクロメートル9,26まで、非常に小さいです。したがって、特にかさばる構造物の場合、2PP規格では比較的大きい数百マイクロメートルのスケールで構造物を製造する場合、製造時間が大幅に増加します。その結果、このような大きな寸法の複数の構造を持つ統合デバイスを作成するには、数時間かかる場合があります。このフレームワークでは、マイクロレンズ製造用に提案されたハイブリッドUV-2PPプロトコルにより、1つのマイクロレンズの製造時間が、その全体積の2PPと比較して98%短縮されました。これにより、マイクロレンズの外殻の2PPスキャンの精度が向上し、表面粗さを減らしながら、レンズの安定性を確保するのに十分な厚さのマイクロレンズシェルを得ることができました。このプロセスをさらに高速化するために、将来的には、複数の構造体32の同時書き込みを可能にする並列化アプローチが提案される予定である。この戦略では、レーザービームを複数のビームに分割して複数の焦点を作成し、並列製造を可能にし、全体的な生産時間を大幅に短縮します。
最も一般的なソフトリソグラフィー技術とは異なり、2PPの主な利点の1つは、感光性材料のボリューム11内で任意の構造を製造できるマスクレス積層造形アプローチであることです。この機能により、複雑な3次元および多孔質構造を高いカスタマイズ可能性で製造できます。さらに、非線形吸収の原理に基づいて、2PPは、標準的な3D印刷技術や例として熱溶解積層法(FDM)では達成できない回折限界未満の分解能に到達することを可能にする33。これは、細胞の成長、動員、および組織統合をサポートするための細胞スケールの特徴を持つ多孔質3Dスキャフォールドを作成する場合に特に価値があります。
ここで提案したプロセスによる光学系を統合した微細構造の埋め込み型デバイスの製造は、メカノバイオロジー、in vitro疾患モデリング、組織工学にまたがるアプリケーションに大きな影響を与える可能性があります(図7および図8)。提示されたプロトコルは、組織統合をサポートする微細構造を特徴とする高品質の技術デバイスの作製を可能にすると同時に、in vivoイメージング基準点として機能します。さらに、適切に設計されたマイクロレンズは、インプラント4の周囲の組織によって引き起こされる球面収差を補正することにより、高度な非線形イメージングを強化しました。実際、このプロセスの汎用性により、たとえば、特定のアプリケーション向けに最適化された形状で足場や参照構造を作成するなど、デバイスの設計を調整することができ、3D再構築と後処理での画像収差の修正の両方に役立ちます。最後に、組織の屈折率に基づいてマイクロレンズの設計を調整することで、アプリケーション固有のイメージングを強化し、デバイス内にin situ光学レンズを効果的に作成します。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、Horizon 2020研究およびイノベーションプログラム(G.A. No. 964481-IN2SIGHT)の下で欧州連合から資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
参考文献
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926(2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103(2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107(2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527(2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20(2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810(2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204(2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179(2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621(2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646(2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577(2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794(2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved