Method Article
Microfabricación de ópticas implantables integradas en una ventana de imagen microestructurada para la obtención de imágenes in vivo avanzadas
En este artículo
Resumen
Este protocolo describe la fabricación de una ventana de imagen integrada implantable mediante impresión láser 3D. La ventana consiste en un sistema de microlentes acopladas a micro-andamios. El método consiste en la polimerización de dos fotones (2PP) del fotorresistente biocompatible SZ2080 en una secuencia continua, optimizando la eficiencia de fabricación y la alineación entre los diferentes componentes.
Resumen
En el contexto de las pruebas de biomateriales y fármacos en modelos animales, este estudio presenta un protocolo simplificado para fabricar una nueva ventana de imagen integrada implantable. El microdispositivo comprende un sofisticado sistema de microlentes acopladas a microandamios diseñados específicamente para la cuantificación in vivo de la respuesta inmunitaria mediante microscopía de excitación no lineal avanzada. El protocolo se basa en la polimerización de dos fotones (2PP) del fotorresistente biocompatible SZ2080, que permite la fabricación de microandamios y microlentes en una secuencia continua para mejorar la eficiencia y la precisión de la fabricación. Para mejorar aún más la velocidad, la precisión y la integridad estructural, se implementó un enfoque de fabricación de óptica híbrida, que involucró el 2PP de la capa exterior de la microlente seguido de la reticulación masiva UV del núcleo interno. Esta innovadora técnica optimiza las propiedades ópticas de las microlentes al tiempo que agiliza el proceso de producción. El microdispositivo resultante demuestra una alta reproducibilidad y estabilidad mecánica, lo que lo convierte en un método eficaz para la creación de prototipos de sistemas ópticos a microescala para una amplia gama de aplicaciones biomédicas.
Introducción
La microscopía intravital permite el estudio de los procesos biológicos en animales vivos mediante la visualización en tiempo real. Cuando se combina con enfoques de imágenes fluorescentes no lineales, puede incluso alcanzar una resolución a escala subcelular1. En consecuencia, se ha convertido en una herramienta importante en muchos campos, como las pruebas de inmunología o los estudios del cáncer, donde es importante la observación de las células dentro de su entorno fisiológico real.
Los abordajes comunes para las inspecciones intravitales, como las cámaras de pliegues cutáneos dorsales o las ventanas de imágenes craneales y abdominales, son altamente invasivos y plantean dificultades para las inspecciones a largo plazo del mismo punto. Por lo tanto, son muy deseables nuevos enfoques de obtención de imágenes in vivo que reduzcan el sufrimiento de los animales y permitan un fácil reposicionamiento de la vista óptica2.
En este marco, es posible avanzar en una nueva ventana de imagen miniaturizada basada en un sustrato de vidrio que contiene un lado de imagen con microlentes ópticas y un lado de referencia de tejido con microandamios tridimensionales (3D). Esta ventana de imagen miniaturizada se puede implantar "subcutáneamente" en el animal y funcionará como un objetivo de microscopio "interno". El principio de funcionamiento del dispositivo será utilizar las microlentes junto con un objetivo de microscopio externo de baja apertura numérica (NA) para realizar imágenes no lineales in vivo de los procesos biológicos que tienen lugar dentro de los andamios. Las microlentes compensarán la aberración esférica debida a la obtención de imágenes a través de un medio no homogéneo como el tejido 3,4, mientras que el microandamio impulsará la regeneración del tejido y actuará como balizas ópticas 5,6,7, permitiendo así la inspección a largo plazo del mismo punto.
Los componentes básicos del dispositivo, es decir, microandamios y microlentes, ya se han demostrado por separado, pero su integración en el mismo dispositivo presenta varios desafíos debido a su naturaleza 3D, su tamaño micrométrico y la necesidad de tener una alineación óptica perfecta entre ellos. Los microandamios, que consisten en rejillas cuboides rectangulares, con dimensiones totales representativas ~ 500 μm x 500 μm x 100 μm y con tamaños de poro ~ 50 μm x 50 μm x 20 μm, pueden guiar el reclutamiento celular y la nueva vascularización, promoviendo así la integración tisular. Además, debido a su autofluorescencia, los microandamios funcionan como un faro de fluorescencia in situ, lo que permite un rápido reposicionamiento y alineación bajo el microscopio e incluso una corrección de las aberraciones esféricas durante la obtención de imágenes no lineales para permitir observaciones longitudinales in vivo de alta resolución5. Las microlentes de alta apertura numérica, con perfiles esféricos o cuasi-parabólicos y distancias focales de unos pocos cientos de micrómetros, han demostrado sus capacidades para la obtención de imágenes lineales y no lineales de muestras biológicas si se combinan con un microscopio confocal o de dos fotones 3,4.
Las microlentes y los microandamios se fabrican mediante inscripción láser 3D, también conocida como polimerización de dos fotones (2PP). En 2PP, un rayo láser infrarrojo de femtosegundo se enfoca firmemente dentro de una fotorresistencia curable por UV y, debido a la absorción de múltiples fotones en el punto focal, se crea un vóxel confinado de material polimerizado con un tamaño submicrométrico (~ 100 nm). Al mover el foco láser con respecto a la muestra fotorresistente, se pueden obtener estructuras tridimensionales de material polimerizado después de lavar el material no polimerizado8. El proceso tiene una alta resolución intrínseca y una naturaleza 3D que permite la adquisición de microestructuras 3D, como andamios y lentes, con buena estabilidad y alta calidad superficial 9,10,11. Existen diferentes técnicas para la fabricación de microandamios porosos como la impresión 3D, la nanoimpresión o el electrohilado 12,13,14,15. Todas estas técnicas adolecen de un principal inconveniente; No son capaces de alcanzar resoluciones en el rango submicrométrico, dando así estructuras con tamaños de poros (~100 μm) mayores que el tamaño celular, y no imitan la matriz extracelular, que es esencial para una buena regeneración de tejidos. La fabricación de microlentes puede abordarse mediante métodos basados en la replicación de la lente a partir de un molde o mascarilla como el moldeo por inyección, el estampado en caliente o el moldeo UV, o mediante métodos directos como el reflujo térmico, el relieve microplástico o el chorro de microgotas16,17. Todos ellos presentan limitaciones en la morfología superficial que se pueden obtener y son difíciles de integrar en un flujo de fabricación donde también se deben fabricar los microandamios. Por otro lado, el 2PP ha demostrado su versatilidad para la fabricación de componentes ópticos complejos18,19, como lentes esféricas o parabólicas, lentes difractivas o incluso combinaciones de diferentes lentes en el mismo componente óptico 20,21,22,23,24. En este marco, el 2PP parece ser la mejor técnica para la fabricación de un todo que contenga tanto lentes como microandamios.
A pesar de ser una opción única para la realización de estas estructuras 3D con resolución micrométrica, 2PP presenta dos limitaciones principales, es decir, es un enfoque que requiere mucho tiempo para estructuras de volumen relativamente grandes y presenta una profundidad de fabricación limitada (a lo largo del eje óptico) debido a la corta distancia de trabajo de los objetivos del microscopio utilizados para un enfoque estrecho.
Este artículo propone un protocolo único para la fabricación de los microandamios y las microlentes en los lados opuestos de un sustrato de vidrio en un proceso de irradiación de un paso longitudinal que garantiza una buena alineación de ambos elementos y supera las limitaciones de la profundidad de fabricación. El protocolo también está optimizado para el tiempo de fabricación; por un lado, la irradiación de un solo paso ahorra tiempo de alineación, y el uso de un enfoque híbrido que combina 2PP de la carcasa de la lente y curado UV de los fotorresistentes internos reduce el tiempo de irradiación para las lentes de gran volumen25. La capacidad de 2PP para fabricar estructuras 3D de forma libre permite el uso de este protocolo para cualquier diseño de microlentes y microandamios, potenciando así el método actual.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Preparación de la muestra
- Primera caída (Figura 1A)
- Limpiar con acetona en ambas superficies de un cubreobjetos de vidrio circular de 12 mm de diámetro (170 μm de espesor).
- Seque ambas superficies con gas nitrógeno a temperatura ambiente.
- Depositar una cantidad controlada de 46 μL de fotorresistencia líquida en un lado del cubreobjetos de vidrio con una pipeta de volumen.
NOTA: El material fotosensible utilizado en este protocolo es un fotorresistente híbrido orgánico/inorgánico biocompatible conocido como SZ2080, que es bien conocido y validado para aplicaciones biomédicas26. Preste atención para dejar un anillo externo libre en el sustrato de vidrio. Al estar libre de fotorresistencia, este espacio acristalado asegura la correcta sujeción de la muestra dentro del soporte para ayudar mejor a la preparación. - Dejar la muestra bajo la cubierta química durante 48 h para permitir el secado de la primera gota de fotorresistencia por la evaporación del disolvente, alcanzando el estado sol-gel.
- Segunda caída (Figura 1A)
- Cuando la primera gota de fotorresistente alcance el estado sol-gel (paso 1.1.4.), voltee la muestra boca abajo, exponiendo la superficie limpia.
- Coloque la muestra en un soporte de soporte, levantando la primera superficie moldeada del suelo.
- Depositar una segunda gota de 46 μL de fotorresistencia líquida sobre la superficie limpia del vidrio, dejando el anillo externo así como en el paso 1.1.3.
- Deje la muestra bajo la cubierta química durante al menos 48 h, dejando que el disolvente se evapore.
NOTA: Después de 4-6 días, la muestra de doble gota está lista para ser utilizada para 2PP (Figura 1B). A partir de ahora, preste atención a no exponer la muestra a la luz ambiental debido al material fotosensible. La exposición a la luz degrada la fotorresistencia.
2. Polimerización de dos fotones (2PP) de las microestructuras
- Configuración de alineación (Figura 2)
- Encienda la fuente láser de infrarrojo cercano de femtosegundos (longitud de onda de 1030 nm, 1 MHz, con duración mínima de pulso = 230 fs).
NOTA: Configure los parámetros del láser como el ancho de pulso y la tasa de repetición. - Alinee la trayectoria óptica del rayo láser hasta que alcance el objetivo del microscopio a través de una serie de ópticas y espejos montados en monturas de espejo cinemático. Gire iterativamente los espejos para centrar el haz dentro de los orificios de alineación del infrarrojo cercano (NIR).
NOTA: La distancia de trabajo del objetivo del microscopio debe ser mayor que la altura total del dispositivo final que se va a fabricar (altura de la lente + espesor del cubreobjetos + altura del microandamio). Los orificios NIR están diseñados correctamente para simplificar la alineación de los haces IR. Esto garantiza una alineación precisa del haz a lo largo de la ruta óptica, pasando a través de componentes como una placa de media onda, un expansor de haz y un espejo dicroico. Para controlar automáticamente la potencia del láser, el haz pasa a través de un polarizador horizontal y una placa de media onda, y el segundo se monta en un rotador motorizado. Si es necesario, el haz puede pasar a través de un expansor de haz para ampliar el diámetro del haz y cumplir con el objetivo de entrada trasera. - Dirija el rayo láser perpendicularmente al portamuestras alineándolo mediante el centrado de retrorreflexión.
- Monte el objetivo del microscopio de larga distancia de trabajo en el soporte dedicado al final de la trayectoria óptica cerca de la muestra (Figura 2).
NOTA: Se monta una cámara CCD sobre el espejo dicroico alineado con el eje óptico objetivo para el monitoreo del proceso de fabricación. Permitirá ver el punto de enfoque láser y las estructuras polimerizadas.
- Encienda la fuente láser de infrarrojo cercano de femtosegundos (longitud de onda de 1030 nm, 1 MHz, con duración mínima de pulso = 230 fs).
- Montaje de muestras
- Fije (con cinta adhesiva) el cubreobjetos de vidrio de doble caída en el portamuestras montado en las etapas de traducción. Monte la muestra con la segunda gota depositada hacia abajo.
NOTA: El portamuestras tiene un orificio central donde se puede suspender la muestra de la etapa de suelo5. El soporte está conectado a un sistema mecánico de cardán que se atornilla a una etapa de traslación X, Y para el movimiento de la muestra. - Centre la muestra manualmente con el objetivo de microscopio montado.
- Fije (con cinta adhesiva) el cubreobjetos de vidrio de doble caída en el portamuestras montado en las etapas de traducción. Monte la muestra con la segunda gota depositada hacia abajo.
- Centrado de muestras
- Ajuste la potencia del láser al valor mínimo suficiente para ver la reflexión del haz en el software de la cámara CCD (alrededor de 5 mW).
NOTA: Mida la potencia del láser en la pupila posterior del objetivo (la transmisión del objetivo utilizado en este protocolo es del 70% a una longitud de onda de 1030 nm). - Encienda el software de la interfaz de operador para el controlador de movimiento y la cámara CCD.
- Enfoque el rayo láser en la superficie superior de la primera gota de fotorresistencia.
- Siguiendo el perfil curvo de la gota, encuentre los bordes de la muestra a lo largo de las direcciones X e Y. Establezca el centro de la caída como una referencia de cero absoluto por software.
NOTA: La cinta utilizada para fijar la muestra desempeña un papel en la detección de bordes al modificar el índice de refracción y, por lo tanto, la reflexión del haz.
- Ajuste la potencia del láser al valor mínimo suficiente para ver la reflexión del haz en el software de la cámara CCD (alrededor de 5 mW).
- Ejemplo de compensación de inclinación
- En el centro de la muestra, enfoque el rayo láser en la superficie de la interfaz entre la superficie superior del cubreobjetos de vidrio y la base de la primera gota de fotorresistencia. Establézcalo como referencia cero en el eje Z.
- Teniendo en cuenta el diámetro de la muestra, muévase a la posición del borde (para el cubreobjetos de 12 mm, es ~ - 4 mm) en la dirección negativa del eje X. En esa posición, enfoque la superficie de la interfaz (entre el vidrio y la gota superior de fotorresistencia) y configúrela como una referencia de cero absoluto a lo largo de la dirección vertical Z.
- Muévase a la posición del borde en la dirección positiva del eje X (para el cubreobjetos de 12 mm, es ~ + 4 mm). Encuentre aquí la superficie de la interfaz moviendo el objetivo a lo largo de la dirección vertical Z.
- Incline la muestra para corregir la desviación en la dirección Z entre las posiciones negativa y positiva a lo largo del eje X. Utilice un montaje cinemático ajustable para inclinar el portamuestras (como un cardán).
- Repita los pasos 2.4.2-2.4.4 de forma iterativa hasta que la muestra esté completamente equilibrada en el eje X.
- Realice el mismo procedimiento descrito en los pasos 2.4.2-2.4.5 a lo largo de la dirección Y.
- Una vez que la muestra esté perfectamente equilibrada en los ejes planos X e Y, regrese a la posición central y enfoque la interfaz entre el vidrio y la fotorresistencia en ese punto.
- Establezca el nuevo valor Z del foco como referencia en el eje Z (Z = 0).
NOTA: El procedimiento del paso 2.4 tiene como objetivo garantizar la perpendicularidad perfecta entre el rayo láser y la superficie del cubreobjetos para garantizar un anclaje perfecto de las estructuras de 2PP que se fabricarán posteriormente. A partir de 2,4, todos los procedimientos deben realizarse coincidiendo con el índice de refracción. Por lo tanto, agregue el medio de coincidencia de índices del objetivo si es necesario.
- Micro-andamios de 2PP en la caída fotorresistente inferior
- Encienda un sistema de iluminación LED roja para el seguimiento en tiempo real del proceso de polimerización.
NOTA: Se coloca una iluminación de diodo emisor de luz roja debajo del complejo cardán portamuestras (Figura 2). Esta iluminación permitirá ver el volumen polimerizado durante el proceso de 2PP. El fotorresistente es sensible a longitudes de onda más cortas (luz visible); por lo tanto, la luz LED roja no va a perturbar la muestra. - Con el láser apagado, mueva el objetivo a lo largo de la dirección Z debajo del cubreobjetos de vidrio para encontrar la segunda superficie de interfaz entre la superficie inferior del vidrio y la base de la gota inferior de resistencia.
NOTA: La segunda interfaz se encontrará con un valor Z aproximadamente igual al espesor del cubreobjetos (170 μm). - Aumente la potencia del láser hasta 100 mW para permitir que se produzca la polimerización de dos fotones en la caída inferior.
- Ajuste la posición focal (Z creciente) para encontrar la segunda interfaz polimerizando una estructura de referencia simple.
NOTA: Un ejemplo de una estructura de referencia es una línea polimerizada de 50 μm de longitud. - Establezca la primera posición focal en la que se produce la polimerización de la estructura de referencia como referencia cero a lo largo de la dirección vertical (eje Z).
NOTA: La referencia en el paso 2.5.5 subraya el plano base para el 2PP de los microandamios. - Establezca las potencias de polimerización (~ 100-200 mW) y ejecute el código de máquina como un programa de control numérico por computadora (CNC) para el movimiento adecuado de las etapas de traslación para fabricar la estructura 3D deseada (Figura 3A).
NOTA: El programa CNC se compone de un conjunto de coordenadas espaciales (x, y, z) que determinan en qué dirección se mueven las plataformas de traslación para producir el objeto 3D final. Estos poderes de polimerización estarán influenciados por la altura de la caída superior y las condiciones experimentales específicas (fotorresistencia, láser y sistema de movimiento).
- Encienda un sistema de iluminación LED roja para el seguimiento en tiempo real del proceso de polimerización.
- Microlentes 2PP en la gota fotorresistente superior
- Moviéndose a lo largo del eje Z, regrese a la primera interfaz entre la superficie superior del vidrio y la gota superior de fotorresistencia (paso 2.4.8). Mantener el mismo sistema de referencia plana (coordenada X, Y) para asegurar una perfecta alineación de las microlentes 2PP con las microestructuras ya fabricadas.
- Encuentre la interfaz polimerizando una estructura de referencia simple.
NOTA: Utilice el mismo proceso descrito en el paso 2.5.4, pero solo difiere en la dirección del movimiento vertical. - Establezca la primera línea de polimerización como referencia cero a lo largo de la dirección vertical (eje Z).
NOTA: La referencia en el paso 2.6.3 subraya el plano de tierra para el 2PP de las microlentes. - Establezca los parámetros de fabricación para el 2PP del contorno de la microlente deseada (Figura 3B). El rayo láser describe una trayectoria circular que disminuye en radio para polimerizar continuamente la superficie externa de una sola microlente. Establezca los parámetros de sombreado y corte a lo largo de las direcciones X y Z, respectivamente.
NOTA: El diseño de las lentes debe tener en cuenta la distancia focal efectiva deseada por el usuario. Como regla general, debe ser un valor más largo que el grosor del cubreobjetos y debe permitir obtener imágenes de todo el atlas. Se recomienda una simulación computacional preliminar del sistema óptico final. - Configure la potencia de polimerización (~ 15-20 mW) y ejecute el programa que guía el movimiento de las etapas de traducción.
NOTA: Estos poderes de polimerización se verán influenciados por la altura de la caída superior, las condiciones experimentales específicas y el diseño de la microlente deseada (Figura 3B). La Figura 4 muestra un ejemplo representativo de microlente parabólica con la función paramétrica que describe el perfil de la microlente y sus principales características geométricas.
3. Desarrollo de la muestra
- Retire la muestra de la configuración de fabricación experimental.
- Con el láser apagado, desactive los ejes de traslación X, Y y Z y retire el soporte.
- Despegue la cinta adhesiva y separe la muestra del soporte.
NOTA: Antes de revelar la muestra, preste atención a no exponer la muestra a la luz ambiental debido al material fotosensible. La exposición a la luz reticularía toda la cantidad de fotorresistencia.
- Desarrollo de la muestra (Figura 5A)
- Coloque la muestra en un soporte adecuado para levantarla del suelo y mantenerla en posición horizontal.
NOTA: Este portamuestras es un estante de muestras personalizado impreso por SLA correctamente diseñado para exponer las superficies prototipadas de 2PP a la solución en desarrollo5. - Prepare un vaso de precipitados de 50 ml y coloque en su interior el soporte que lleva la muestra.
NOTA: Preste atención al mantenimiento de las microlentes 2PP en la superficie superior para evitar cualquier deformación estructural durante el desarrollo debido a su núcleo interno no polimerizado. - Llene el vaso de precipitados con ~20 ml de solución reveladora, cubriendo completamente la muestra. La solución está formada por una solución de alcohol isopropílico al 50% (v/v) de 2-pentanona y al 50% (v/v).
- Deje la muestra dentro de la solución de revelado durante 45 min.
- Coloque la muestra en un soporte adecuado para levantarla del suelo y mantenerla en posición horizontal.
- Lavado de muestras
- Levante el soporte de la solución en desarrollo.
- Manipulándola manualmente o utilizando unas pinzas, tome la muestra y lávela cuidadosamente con unas gotas de alcohol isopropílico.
- Seque ambas superficies fabricadas del cubreobjetos de vidrio con un flujo suave de nitrógeno (a temperatura ambiente).
NOTA: Todos los procedimientos descritos en los pasos 3.2-3.3 se realizan bajo una campana de gases químicos.
4. Muestra de irradiación UV
- Exposición de la microlente a la radiación UV (longitud de onda de 385 nm) (Figura 5B)
- Coloque el cubreobjetos de vidrio en un portamuestras suspendido del plano de tierra. Coloque la muestra con las microlentes hacia abajo.
NOTA: El portamuestras tiene un orificio central para colocar la muestra suspendida de la etapa del suelo, preservando la integridad de la microestructura en la superficie inferior. - Prepare una lámpara UV con una longitud de onda de 385 nm.
- Coloque la muestra debajo de la fuente UV orientada perpendicularmente con respecto a la superficie del cubreobjetos de vidrio.
- Exponga la muestra a la radiación UV fijada en 300 mW durante 120 s.
NOTA: La exposición a los rayos UV se produce al pasar a través del microandamio y el sustrato de vidrio. De esta forma, el núcleo aún no polimerizado de las lentes será reticulado por UV, evitando la exposición directa y adicional a la superficie previamente polimerizada. - Titulando la fuente UV a -45° y +45° con respecto a la posición normal del plano de la muestra, repita el paso 4.1.4.
NOTA: Esta exposición UV de tres pasos en diferentes ángulos permitirá la reticulación completa de toda la resistencia no polimerizada dentro del volumen de las microlentes, logrando estabilidad. Esto es particularmente importante para las microlentes gran angular. - Retire la muestra del soporte y guárdela.
- Coloque el cubreobjetos de vidrio en un portamuestras suspendido del plano de tierra. Coloque la muestra con las microlentes hacia abajo.
5. Caracterización morfológica
- Adquisiciones de microscopía electrónica de barrido (SEM) (Figura 6)
- Prepara la estación SEM. Fije un trozo de cinta de carbono al soporte SEM para la adherencia de la muestra.
- Coloque la muestra de vidrio en el soporte a 45° con respecto a la orientación de la cámara SEM. Preste atención a colocar la muestra en un espacio vacío en el cubreobjetos para preservar la integridad de la estructura (Figura 6B).
- Repita la adquisición como en el paso 5.1.2 para ambas superficies del cubreobjetos de vidrio para recopilar imágenes SEM 3D de los microandamios y las microlentes (Figura 6A, C).
- Separe con cuidado la muestra de la cinta de carbón y guárdela en una caja tapada.
Resultados
Se ha proporcionado un protocolo para la fabricación de un dispositivo microestructurado implantable de doble cara que contiene un sistema óptico y una referencia de análisis de tejidos. El proceso aprovecha la polimerización láser de dos fotones para fabricar microestructuras 3D y microópticas en el lado opuesto del mismo sustrato. El uso de un objetivo de larga distancia de trabajo permite la fabricación de ambas estructuras sin voltear el sustrato, ahorrando el paso de realineación y garantizando una alineación perfecta entre ambos componentes. Este dispositivo potenciará la obtención de imágenes avanzadas in situ al permitir la corrección de aberraciones ópticas y observaciones repetidas de la misma área, gracias a la microóptica y a un marco de referencia microfabricado. La Figura 1 muestra el procedimiento para preparar ambas superficies del sustrato de soporte para la fabricación posterior. En la Figura 2 se representa un boceto de la configuración experimental utilizada para microfabricar ambas superficies de la muestra. La imagen también muestra el complejo portador de muestras objetivo, con el primero centrándose en la muestra que está iluminada por un sistema de iluminación LED-rojo, lo que permite el seguimiento en tiempo real de la fabricación mediante visión artificial. La Figura 3 demuestra cualitativamente la flexibilidad del protocolo para permitir la microfabricación de varios diseños de micro-andamios y microlentes. En la Figura 4 se destaca la función de pandeo utilizada para diseñar microlentes con un perfil parabólico asférico y un boceto de un diseño representativo correlacionado con sus características principales a modo de ejemplo. En la Figura 5, se informan los pasos de revelado de la muestra y exposición a los rayos UV necesarios para entrecruzar todo el volumen de las microlentes por completo. Por último, en la Figura 6 se muestran ejemplos de resultados de microfabricación. El procedimiento presentado permite la polimerización de microestructuras 3D de ambas superficies de un mismo dispositivo, lo que garantiza una excelente resolución y estabilidad. Por último, la Figura 7 es una ilustración que representa el flujo de trabajo general del protocolo, terminando con la Figura 8, que muestra un ejemplo de una aplicación final del dispositivo propuesto, es decir, imágenes in vitro de células cultivadas dentro del microandamio.

Figura 1: Protocolo para la preparación de muestras. Esta imagen muestra un boceto del proceso de doble paso para la fundición por caída fotorresistente en un cubreobjetos de vidrio circular de soporte (A). A la derecha, se muestra una imagen de la muestra con el fotorresistente seco depositado en ambos lados (B). La muestra está soportada por el portamuestras. Haga clic aquí para ver una versión más grande de esta figura.
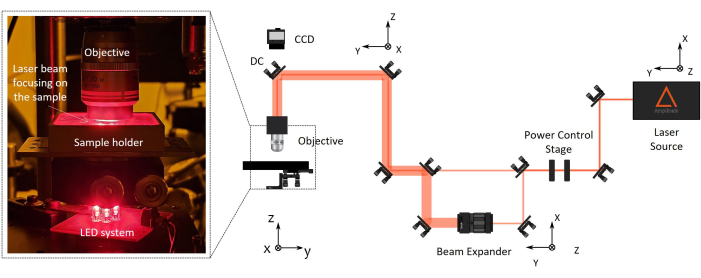
Figura 2: Configuración de fabricación de polimerización por láser de dos fotones (2PP). A la derecha, se muestra un diagrama representativo de la configuración de fabricación. Los componentes principales de la configuración son una fuente láser de femtosegundo con una longitud de onda de 1030 nm, un ancho de pulso mínimo de 230 fs y una tasa de repetición de 1 MHz), una etapa para el control de potencia, un expansor de haz, un espejo dicroico y un objetivo de microscopio de alta apertura numérica (100x, NA 1.1). Una cámara CCD está montada sobre el espejo dicroico alineado con el eje óptico objetivo para el monitoreo del proceso de fabricación. A la izquierda, hay una ampliación, con el zoom de la parte final de la configuración óptica que muestra una fotografía del complejo sistema de iluminación de objetivos/portamuestras/LED para la visión artificial. Haga clic aquí para ver una versión más grande de esta figura.
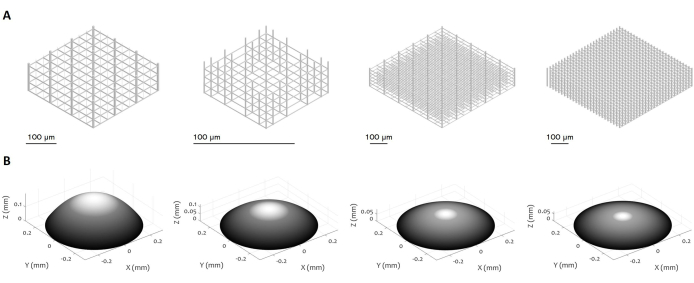
Figura 3: Múltiples diseños de microestructuras 3D y microlentes. La figura muestra varios ejemplos de (A) microandamios y (B) microlentes que se pueden fabricar utilizando el procedimiento propuesto. La alta flexibilidad del protocolo permite la fabricación de microestructuras con una variedad de características geométricas, resolución, dimensiones y volumen, lo que demuestra su versatilidad. La escala de grises en el panel (B) tiene como objetivo resaltar la disminución de la potencia del láser y la velocidad de escritura para suavizar la superficie y minimizar la rugosidad de la superficie. Los parámetros precisos de fabricación se establecen de acuerdo con el diseño específico de la microlente. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ejemplo de microlente fabricada. El panel muestra un ejemplo representativo de un perfil parabólico asférico, destacando la descripción paramétrica de la superficie curva de la lente como función de pandeo z(r) (A). Aquí, Htot es el grosor de la lente, r es la coordenada radial y fn es la distancia focal de una lente refractiva parabólica que difiere de su distancia focal efectiva. La potencia dióptrica está determinada por el índice de refracción de la lente y cómo difiere de los del medio circundante. A la derecha, el boceto de diseño destaca los dos planos principales que se encuentran en el vértice V1 y a unos pocos μm por encima de la superficie 2 (Π1 y Π2, líneas discontinuas) (B). El boceto muestra una sola microlente parabólica asférica con un diámetro de 600 μm y fabricada sobre un sustrato de vidrio N-BK7 (con un espesor de 170 μm). (C) subraya los parámetros geométricos de la lente parabólica asférica microfabricada en fotorresistencia SZ2080. Haga clic aquí para ver una versión más grande de esta figura.
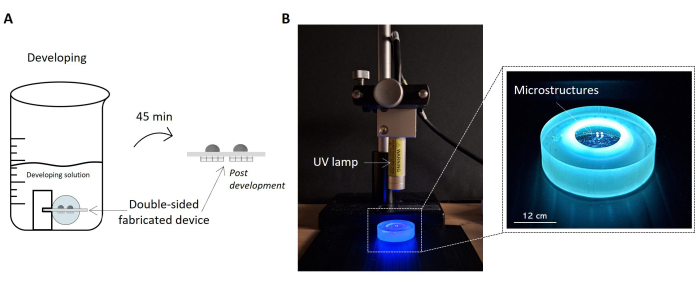
Figura 5: Protocolos para el revelado de muestras y exposición a rayos UV. La imagen resalta la muestra fabricada empapada en la solución de desarrollo como un boceto (A). La muestra es levantada dentro de la solución por el soporte, permitiendo el correcto revelado de ambos lados de la muestra y obteniendo el dispositivo microestructurado de doble cara. A la derecha, se muestra una imagen de la configuración de la instalación para la irradiación UV de la muestra (B). La imagen muestra la lámpara UV colocada perpendicular a la superficie de la muestra. Como se indica en la hoja de datos de la lámpara UV, la distancia actual entre la lámpara y la muestra es consistente con la distancia de funcionamiento de la lámpara. La muestra sometida a radiación UV y manipulada por el portamuestras se resalta en la imagen ampliada de la derecha. Barra de escala: 12 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Adquisiciones de microscopía electrónica de barrido (SEM) de resultados representativos de la fabricación. El panel destaca un dispositivo fabricado a doble cara a través de una vista lateral (B) y dos resultados representativos de microlentes (A) y microandamios (C) fabricados por imágenes SEM. Las dos construcciones colocadas sobre diferentes caras del mismo sustrato de vidrio son claramente visibles en la imagen central (B). Las microlentes están representadas en la superficie inferior del vidrio, mientras que los microandamios están en la superior. La imagen SEM de la microlente fabricada con un diseño esférico se muestra a la derecha como ejemplo del resultado estable y suave de la fabricación (A). A la izquierda, la imagen destaca un resultado representativo de un microandamio poroso de 2PP con geometría arbitraria (C). Barras de escala: (A,C) - 50 μm; (B) - 1 cm. Haga clic aquí para ver una versión más grande de esta figura.
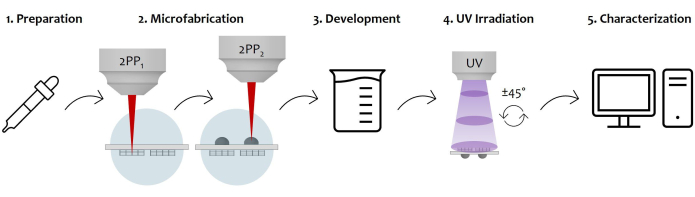
Figura 7: Diagrama esquemático del flujo de trabajo del protocolo y la aplicación del dispositivo: La figura muestra el proceso de fabricación general esbozado paso a paso. Comienza con la preparación de la muestra mediante la colada secuencial de fotorresistencia en ambas superficies del sustrato de vidrio (1). Una vez que la fotorresistencia alcanza un estado sol-gel, la muestra está lista para ser fabricada por polimerización láser de dos fotones (2). Por lo tanto, ambas gotas fotorresistentes se irradian secuencialmente, microestructurando primero las microestructuras y luego las microlentes. Posteriormente, el sustrato microfabricado de doble cara se somete a un procedimiento de revelado para eliminar toda la resistencia no polimerizada que rodea las construcciones (3). Para ello, la muestra se sumerge en una solución alcohólica y luego se seca suavemente. Sigue la irradiación UV de la muestra pasando a través del sustrato vítreo para reticular completamente el núcleo interno no polimerizado de las microlentes (4). Por último, se realiza un control de calidad de la muestra microfabricada mediante adquisiciones de microscopía electrónica de barrido (SEM) para caracterizar morfológicamente las microestructuras (5). Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Posible aplicación de la ventana de imágenes microestructuradas. A la izquierda, un boceto representativo ilustra el sistema óptico constituido por el dispositivo acoplado a un objetivo de microscopio externo en un sistema de escaneo estándar (A). Esta es la llamada configuración virtual utilizada en este caso para la obtención de imágenes del crecimiento de células vivas dentro del microandamio. Los fibroblastos de fluorescencia (marcados con proteína de fluorescencia roja (RFP)) se sembraron en la superficie de vidrio del dispositivo, que lleva las microestructuras 3D. Las imágenes de fluorescencia confocal de las células se han tomado en el plano focal del cubreobjetos de vidrio (B, hashtag verde), por lo tanto, con el único uso del objetivo externo, y a través de una sola microlente en su plano focal (A, hashtag violeta). Los núcleos celulares son visibles en azul (tinción de Hoechst) y el citoesqueleto en rojo (RFP). Barras de escala: (B) - 100 μm; (C) - 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Para garantizar una imagen precisa del área deseada 3,6 en la ventana microestructurada, es obligatorio tener una alineación precisa de las dos estructuras (microandamio y microlentes). Esto plantea el principal desafío del protocolo propuesto, ya que la alta resolución de 2PP está estrechamente relacionada con una limitación en la profundidad de fabricación 3,6. Voltear la muestra durante la fabricación para exponer secuencialmente ambas superficies al rayo láser puede ser una opción, pero complica la realineacióny requiere mucho tiempo. Esto también introduciría dificultades para encontrar el mismo sistema de referencia y, por lo tanto, comprometería la buena alineación entre los componentes microópticos y los microandamios. La realización de todo el proceso de forma continua sin desmontar la muestra mantiene un sistema de referencia consistente, lo que facilita y garantiza una alineación precisa de las estructuras. Para ello, utilizamos un objetivo de larga distancia de trabajo (2,5 mm) que mantiene una buena resolución gracias a su alta apertura numérica (paso 1.1). Este enfoque también reduce significativamente el tiempo de fabricación, ya que ahorra la alineación de la muestra después de voltearla3. Además, la manipulación de las muestras plantea otro desafío debido a su pequeño tamaño y fragilidad, lo que hace que la manipulación y la alineación precisa sean aún más críticas.
En los procesos 2PP, es esencial una amplia investigación del proceso de fabricación para establecer parámetros clave como la longitud de onda láser óptima, el ancho de pulso, así como las potencias del láser y los movimientos de la etapa 9,10,11. Por lo tanto, se ha realizado una caracterización integral del proceso 2PP, incluso considerando diferentes configuraciones de la configuración experimental para garantizar primero estructuras 3D altamente estables y de alta resolución con detalles a escala celular para aplicaciones biológicas 27,28,29,30. Además, minimizar la rugosidad de la superficie de las microlentes implantables fue crucial para obtener microópticas de alta calidad con las características ópticas deseadas, reduciendo así la respuesta inmunológica al implante 19,22,31. Por lo tanto, el desafío del proceso radica en ajustar parámetros como la potencia y el ancho de pulso en función de factores experimentales como el índice de refracción y el volumen del material fotosensible, las condiciones ambientales (por ejemplo, humedad y temperatura) y la eficiencia del láser. También se requirió una caracterización exhaustiva del tiempo y la intensidad de la exposición a los rayos UV para entrecruzar completamente todo el volumen de las microlentes, lo que garantizó su estabilidad. Estos ajustes deben adaptarse a la fuente UV, la distancia de funcionamiento y el volumen específico del elemento que se va a polimerizar UV.
Una limitación principal del proceso 2PP es su bajo rendimiento debido a la resolución extremadamente alta que ofrece. Dado eso, las características polimerizadas son muy pequeñas, desde cientos de nanómetros hasta unos pocos micrómetros 9,26. Por lo tanto, los tiempos de fabricación aumentan significativamente cuando se producen estructuras a escala de cientos de micrómetros, que son relativamente grandes para los estándares de 2PP, especialmente si se trata de estructuras voluminosas. Como resultado, la creación de dispositivos integrados con múltiples estructuras de dimensiones tan grandes puede llevar varias horas. En este marco, el protocolo híbrido UV-2PP propuesto para la fabricación de microlentes mejoró una reducción del 98% en el tiempo de fabricación de una sola microlente en comparación con los 2PP de todo su volumen. Esto permitió una mayor precisión en el escaneo 2PP de la carcasa exterior de la microlente, reduciendo la rugosidad de la superficie y obteniendo una carcasa de microlente lo suficientemente gruesa como para garantizar la estabilidad de la lente, todo dentro de un tiempo de fabricación tolerable. Para acelerar aún más el proceso, en el futuro se propondrá un enfoque de paralelización que permita la escritura simultánea de múltiples estructuras32. Esta estrategia implicaría dividir el rayo láser en múltiples haces para crear varios puntos focales, lo que permitiría la fabricación paralela y, por lo tanto, reduciría en gran medida el tiempo total de producción.
A diferencia de las técnicas de litografía blanda más comunes, una de las ventajas clave del 2PP es que es un enfoque de fabricación aditiva sin máscara que permite la fabricación de estructuras arbitrarias dentro de un volumen de material fotosensible11. Esta capacidad permite la producción de estructuras tridimensionales y porosas complejas con un alto potencial de personalización. Además, basado en el principio de absorción no lineal, el 2PP permite alcanzar una resolución por debajo del límite de difracción, lo que es inalcanzable mediante técnicas estándar de impresión 3D o modelado por deposición fundida (FDM) como ejemplo33. Esto es particularmente valioso para crear andamios 3D porosos con características a escala celular para respaldar el crecimiento celular, el reclutamiento y la integración de tejidos.
La producción de dispositivos implantables microestructurados con óptica integrada mediante el proceso propuesto aquí tiene el potencial de tener un impacto significativo en aplicaciones que abarcan la mecanobiología, el modelado de enfermedades in vitro y la ingeniería de tejidos (Figura 7 y Figura 8). El protocolo presentado permite la fabricación de un dispositivo técnico de alta calidad con microestructuras que apoyan la integración de tejidos y, al mismo tiempo, sirven como puntos de referencia de imágenes in vivo . Además, esas microlentes correctamente diseñadas mejoraron la obtención de imágenes no lineales avanzadas al corregir las aberraciones esféricas causadas por el tejido que rodea el implante4. La versatilidad del proceso, de hecho, nos permite ajustar el diseño del dispositivo como, por ejemplo, crear andamios y estructuras de referencia con una geometría optimizada para aplicaciones específicas, ayudando tanto en las reconstrucciones 3D como en la corrección de las aberraciones de la imagen en el posprocesamiento. Por último, la adaptación del diseño de las microlentes en función de los índices de refracción de los tejidos mejora las imágenes específicas de la aplicación, creando eficazmente una lente óptica in situ dentro del dispositivo.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Esta investigación ha recibido financiación de la Unión Europea en el marco del programa de investigación e innovación Horizonte 2020 (G.A. Nº 964481-IN2SIGHT).
Materiales
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
Referencias
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926 (2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103 (2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107 (2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527 (2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20 (2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810 (2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204 (2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179 (2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621 (2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646 (2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577 (2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794 (2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados