Method Article
集成在微结构成像窗口中的植入式光学元件的微纳加工,用于先进的 体内 成像
Erratum Notice
摘要
该协议描述了使用 3D 激光打印制造植入式集成成像窗口。该窗口由一个微透镜系统和微型支架组成。该方法涉及生物相容性光刻胶 SZ2080 的双光子聚合 (2PP) 连续序列,以优化制造效率和不同组件之间的对齐。
摘要
在动物模型中的生物材料和药物测试的背景下,本研究提出了一种简化的方案,用于制造一种新型的植入式集成成像窗口。该微型器件包括一个复杂的微透镜系统,该系统与微支架相结合,专门设计用于使用先进的非线性激发显微镜对免疫反应进行 体内 定量。该协议基于生物相容性光刻胶 SZ2080 的双光子聚合 (2PP),能够连续制造微型支架和微透镜,以提高制造效率和精度。为了进一步提高速度、精度和结构完整性,实施了一种混合光学制造方法,包括微透镜外壳的 2PP,然后是内芯的 UV 体交联。这种创新技术优化了微透镜的光学特性,同时简化了生产过程。所得微器件表现出高重现性和机械稳定性,使其成为为一系列生物医学应用制作微型光学系统原型的有效方法。
引言
活体显微镜通过实时可视化支持对活体动物的生物过程的研究。当与荧光非线性成像方法结合使用时,它甚至可以达到亚细胞尺度的分辨率1。因此,它已成为许多领域的重要工具,例如免疫学测试或癌症研究,在这些领域中,观察细胞在其真实生理环境中的观察非常重要。
常见的活体检查方法,例如背侧皮褶室或颅腹成像窗,具有高度侵入性,难以对同一点进行长时间检查。因此,强烈希望 采用新的体内 成像方法来减少动物的痛苦并允许轻松重新定位光学视图2。
在这个框架中,可以推进一种基于玻璃基板的新型小型化成像窗口,该窗口包含带有光学微透镜的成像侧和带有三维 (3D) 微支架的组织参考侧。这种小型化成像窗口可以“亚切”植入动物体内,并用作“内部”显微镜物镜。该设备的工作原理是使用微透镜与外部低数值孔径 (NA) 显微镜物镜耦合,对支架内发生的生物过程进行体内非线性成像。微透镜将补偿由于通过非均匀介质(如组织 3,4)成像而导致的球面像差,而微支架将驱动组织再生并充当光信标 5,6,7,从而允许对同一点进行长时间检查。
该设备的基本组件,即微型支架和微透镜,已经单独进行了演示,但由于它们的 3D 性质、微米级尺寸以及它们之间需要完美的光学对准,它们在同一设备中的集成带来了一些挑战。微型支架由矩形长方体网格组成,具有代表性的整体尺寸 ~ 500 μm x 500 μm x 100 μm,孔径 ~ 50 μm x 50 μm x 20 μm,可以引导细胞募集和新的血管化,从而促进组织整合。此外,由于它们的自发荧光,微型支架起到原位荧光信标的作用,因此可以在显微镜下快速重新定位和对准,甚至可以在非线性成像过程中校正球面像差,以实现高分辨率纵向体内观察5。高数值孔径微透镜具有球面或准抛物线轮廓,焦距为几百微米,如果与共聚焦或双光子显微镜结合使用,它们已经证明了它们对生物标本进行线性和非线性成像的能力 3,4。
微透镜和微支架是通过 3D 激光刻字制造的,也称为双光子聚合 (2PP)。在 2PP 中,红外飞秒激光束紧密聚焦在紫外光固化光刻胶内,由于焦点处的多光子吸收,产生了亚微米尺寸 (~100 nm) 的聚合材料的受限体素。通过相对于光刻胶样品移动激光焦点,在洗去未聚合材料后可以获得聚合材料的三维结构8。该工艺具有固有的高分辨率和 3D 性质,可以获取 3D 微结构,如支架和透镜,具有良好的稳定性和高表面质量 9,10,11。制造多孔微型支架有不同的技术,如 3D 打印、纳米印记或静电纺丝 12,13,14,15。所有这些技术都有一个主要缺点;它们无法达到亚微米范围内的分辨率,因此产生的结构孔隙尺寸 (~100 μm) 大于细胞尺寸,并且不模拟细胞外基质,这对于良好的组织再生至关重要。微透镜的制造可以通过基于从模具或掩模中复制透镜的方法(如注塑成型、热压花或 UV 成型)或通过直接方法(如热回流焊、微塑料压花或微滴喷射)来实现16,17。所有这些都对可以获得的表面形态存在限制,并且难以集成到还必须制造微型支架的制造流程中。另一方面,2PP 已经证明了它在制造复杂光学元件18,19 方面的多功能性,如球面或抛物面透镜、衍射透镜,甚至是同一光学元件中不同透镜的组合 20,21,22,23,24.在这个框架中,2PP 似乎是制造包含透镜和微型支架的整体的最佳技术。
尽管 2PP 是实现这些微米级分辨率 3D 结构的独特选择,但它存在两个主要局限性,即,对于相对较大的体积结构来说,它是一种耗时的方法,并且由于用于紧密聚焦的显微镜物镜的工作距离短,它的制造深度(沿光轴)有限。
本文提出了一种独特的协议,用于在单纵向步辐照过程中制造玻璃基板相对两侧的微支架和微透镜,以保证两个元件的良好对准并克服制造深度的限制。该协议还针对制造时间进行了优化;一方面,一步照射节省了对准时间,并且使用结合了透镜外壳的 2PP 和内部光刻胶的 UV 固化的混合方法减少了大体积透镜的照射时间25。2PP 制造自由形状 3D 结构的能力允许将此协议用于任何微透镜和微支架设计,从而为当前方法提供支持。
研究方案
本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 样品制备
- 第一次滴铸(图 1A)
- 在直径为 12 mm 的圆形玻璃盖玻片(厚度 170 μm)的两个表面上用丙酮清洁。
- 用室温氮气干燥两个表面。
- 使用体积移液器将受控量的 46 μL 液体光刻胶沉积在玻璃盖玻片的一侧。
注:本协议中使用的光敏材料是一种称为 SZ2080 的生物相容性、有机/无机混合光刻胶,它是众所周知的,并已针对生物医学应用进行了验证26。注意在玻璃基板上留出一个自由的外部环。由于不含光刻胶,这个玻璃状空间可确保将样品正确固定在支架内,以更好地协助制备。 - 将样品放在化学罩下 48 小时,让第一滴光刻胶通过溶剂蒸发干燥,达到溶胶-凝胶状态。
- 第二次滴铸(图 1A)
- 当第一滴光刻胶达到溶胶-凝胶状态(步骤 1.1.4.)时,将样品倒置,露出干净的表面。
- 将样品放在支撑支架上,从地面上抬起第一个液滴铸造表面。
- 在干净的玻璃表面上沉积第二滴 46 μL 液体光刻胶,留下外部环以及步骤 1.1.3。
- 将样品放在化学罩下至少 48 小时,让溶剂蒸发。
注意:4-6 天后,双滴铸样品即可用于 2PP(图 1B)。从现在开始,注意不要由于光敏材料的原因将样品暴露在环境光下。光照会降低光刻胶的质量。
2. 微结构的双光子聚合 (2PP)
- 设置对齐(图 2)
- 打开飞秒近红外激光源(1030 nm 波长,1 MHz,最小脉冲持续时间 = 230 fs)。
注意:设置激光参数,如脉冲宽度和重复率。 - 对准激光束的光路,直到它通过安装在运动镜支架上的一系列光学元件和反射镜到达显微镜物镜。迭代旋转反射镜,使光束在近红外 (NIR) 对准针孔内居中。
注意:显微镜物镜的工作距离应长于要制造的最终设备的总高度(镜头高度 + 盖玻片厚度 + 微型支架高度)。NIR 针孔经过适当设计,可简化 IR 光束的对准。这确保了光束沿光路精确对准,穿过半波板、扩束镜和二向色镜等组件。为了自动控制激光功率,光束穿过水平偏振器和半波片,第二个安装在电动旋转器上。如果需要,光束可以通过扩束器以扩大光束直径并实现目标后入口。 - 通过使用背向反射居中对准样品架,将激光束垂直于样品架。
- 将长工作距离显微镜物镜安装在靠近样品的光路末端的专用支架上(图 2)。
注意:CCD 相机安装在与物镜光轴对准的二向色镜上方,用于制造过程监控。它将允许人们看到激光聚焦点和聚合结构。
- 打开飞秒近红外激光源(1030 nm 波长,1 MHz,最小脉冲持续时间 = 230 fs)。
- 样品安装
- 将(用胶带)固定在安装在平移台上的样品架上的双滴玻璃盖玻片上。安装样品,将第二个沉积的液滴朝下。
注意:样品架有一个中心孔,样品可以悬挂在地面载物台5 上。支架连接到万向节机械系统,该系统拧到 X、Y 平移台上,用于样品运动。 - 使用已安装的显微镜物镜手动将样品居中。
- 将(用胶带)固定在安装在平移台上的样品架上的双滴玻璃盖玻片上。安装样品,将第二个沉积的液滴朝下。
- 样品居中
- 将激光功率设置为足以在 CCD 相机软件上看到光束反射的最小值(约 5 mW)。
注意:测量物镜后瞳处的激光功率(本协议中使用的物镜的透射率在 1030 nm 波长下为 70%。 - 打开运动控制器和 CCD 相机的作界面软件。
- 将激光束聚焦在第一个光刻胶液滴的上表面。
- 沿着液滴的弯曲轮廓,沿 X 和 Y 方向找到样品边缘。通过软件将液滴中心设置为绝对零点参考。
注:用于固定样品的胶带通过改变折射率(即光束反射)在边缘检测中发挥作用。
- 将激光功率设置为足以在 CCD 相机软件上看到光束反射的最小值(约 5 mW)。
- 样品倾斜补偿
- 在样品的中心,将激光束聚焦在玻璃盖玻片上表面和第一滴光刻胶底部之间的界面表面。将其设置为 Z 轴上的零参考。
- 考虑到样品的直径,沿 X 轴的负方向移动到边缘位置(对于 12 mm 盖玻片,为 ~ - 4 mm)。在该位置,聚焦界面表面(玻璃和光刻胶的上层之间)并将其设置为沿垂直方向 Z 的绝对零点参考。
- 沿 X 轴的正方向移动到边缘位置(对于 12 mm 盖玻片,为 ~ + 4 mm)。在此处找到沿垂直方向 Z 移动物镜的界面表面。
- 倾斜样品以校正沿 X 轴的负位置和正位置之间的 Z 方向偏差。使用可调节的运动支架进行样品架倾斜(如万向节)。
- 迭代重复步骤 2.4.2-2.4.4,直到样品在 X 轴上完全平衡。
- 沿 Y 方向执行步骤 2.4.2-2.4.5 中描述的相同过程。
- 一旦样品在 X 和 Y 平面轴上完美平衡,回到中心位置并将玻璃和光刻胶之间的界面聚焦在该点。
- 将焦点的新 Z 值设置为 Z 轴 (Z = 0) 中的参考。
注意:步骤 2.4 中的程序旨在确保激光束和盖玻片表面之间的完美垂直度,以确保稍后将制造的 2PP 结构的完美锚定。从 2.4 开始,所有程序都必须与折光率相匹配。因此,如果需要,请添加目标的索引匹配媒介。
- 微脚手架 2PP 在下部光刻胶滴落
- 打开红色 LED 照明系统,实时监控聚合过程。
注意:红光发光二极管照明放置在复杂的样品架万向节下方(图 2)。这种照明将允许人们在 2PP 过程中看到聚合体积。光刻胶对较短的波长(可见光)敏感;因此,红色 LED 灯不会干扰样品。 - 在激光关闭的情况下,沿玻璃盖玻片下方的 Z 方向移动物镜,以找到玻璃底面和下液滴光刻胶底部之间的第二个界面表面。
注意:第二个界面位于 Z 值大约等于盖玻片厚度 (170 μm) 处。 - 将激光功率提高到 100 mW,让双光子聚合发生在底部液滴中。
- 调整焦点位置(增加 Z)以通过聚合简单的参考结构找到第二个界面。
注:参考结构的一个示例是 50 μm 长的聚合线。 - 将参考结构发生聚合的第一个焦点位置设置为沿垂直方向 (Z 轴) 的零参考。
注意:步骤 2.5.5 中的参考为微型脚手架的 2PP 的底平面加了下划线。 - 设置聚合功率 (~ 100-200 mW) 并将机器代码作为计算机数控 (CNC) 程序运行,以便平移阶段的正确运动以制造所需的 3D 结构(图 3A)。
注意:CNC 程序由一组空间坐标(x、y、z)组成,这些坐标确定平移平台以何种方式移动以生成最终的 3D 对象。这些聚合能力将受到上液滴高度和特定实验条件(光刻胶、激光和运动系统)的影响。
- 打开红色 LED 照明系统,实时监控聚合过程。
- 上部光刻胶滴上的微透镜 2PP
- 沿 Z 轴移动,回到上部玻璃表面和上部光刻胶液滴之间的第一个界面(步骤 2.4.8)。保持相同的平面参考系统(X、Y 坐标),以确保微透镜 2PP 与已经制造的微结构完美对齐。
- 通过聚合一个简单的参考结构来找到界面。
注意:使用步骤 2.5.4 中描述的相同过程,但仅在垂直运动的方向上有所不同。 - 将第一条聚合线设置为沿垂直方向(Z 轴)的零参考。
注意:步骤 2.6.3 中的参考在微透镜 2PP 的接地平面上划线。 - 为所需微透镜轮廓的 2PP 设置制造参数(图 3B)。激光束描述了半径减小的圆形轨迹,以连续聚合单个微透镜的外表面。分别沿 X 和 Z 方向设置剖面线和切片参数。
注意:镜头的设计应考虑用户所需的有效焦距。根据经验,它的值应该比盖玻片厚度长,并且它应该允许对整个图集进行成像。建议对最终光学系统进行初步计算模拟。 - 设置聚合功率 (~ 15-20 mW) 并运行引导平移阶段运动的程序。
注意:这些聚合能力将受到上液滴高度、特定实验条件和所需微透镜设计的影响(图 3B)。 图 4 显示了抛物面微透镜的代表性示例,该示例具有描述微透镜轮廓及其主要几何特征的参数函数。
3. 样品开发
- 从实验制造设置中删除样品。
- 在激光关闭的情况下,禁用 X、Y 和 Z 平移轴并移除支架。
- 撕下胶带,将样品从支架上取下。
注:在样品显影之前,请注意由于光敏材料的原因,不要将样品暴露在环境光下。曝光会交联整个量的光刻胶。
- 样品开发(图 5A)
- 将样品放在适当的支撑物中,将其从地面提起并保持在水平位置。
注意:该样品架是一个定制的 SLA 打印样品架,经过适当设计,可将 2PP 原型表面暴露给显影溶液5。 - 准备一个 50 mL 烧杯,并将装有样品的支架放入其中。
注意:注意将 2PP 微透镜保持在上表面,以避免在显影过程中由于内芯未聚合而发生任何结构变形。 - 用 ~20 mL 显影液填充烧杯,完全覆盖样品。该溶液由 50% (v/v) 2-戊酮和 50% (v/v) 异丙醇溶液制成。
- 将样品留在显影溶液中 45 分钟。
- 将样品放在适当的支撑物中,将其从地面提起并保持在水平位置。
- 样品清洗
- 从开发中的解决方案中提升支持。
- 通过手动处理或使用一把镊子,取样并用几滴异丙醇小心清洗。
- 用温和的氮气流(在室温下)干燥玻璃盖玻片的两个预制表面。
注意:步骤 3.2-3.3 中描述的所有程序均在化学通风橱下执行。
4. 样品紫外线照射
- 微透镜暴露于紫外线辐射(385 nm 波长)(图 5B)
- 将玻璃盖玻片放在悬挂在接地平面上的样品架上。将样品置于微透镜朝下。
注:样品架有一个中心孔,用于将样品悬浮在地面上,保持底面微观结构的完整性。 - 准备波长为 385 nm 的紫外灯。
- 将样品放置在 UV 源下,相对于玻璃盖玻片表面垂直定向。
- 将样品暴露在设置为 300 mW 的紫外线辐射下 120 秒。
注意:紫外线照射会穿过微型脚手架和玻璃基板。通过这种方式,透镜尚未聚合的核心将被紫外线交联,避免直接和额外暴露在先前聚合的表面。 - 相对于样品平面的法线位置,在 -45° 和 +45° 处为 UV 源添加标题,重复步骤 4.1.4。
注意:这种不同角度的三步紫外线曝光将允许在微透镜体积内完全交联整个未聚合的光刻胶,从而实现稳定性。这对于宽微透镜尤其重要。 - 从支架中取出样品并储存。
- 将玻璃盖玻片放在悬挂在接地平面上的样品架上。将样品置于微透镜朝下。
5. 形态学表征
- 扫描电子显微镜 (SEM) 采集(图 6)
- 准备 SEM 站。将一条碳带贴在 SEM 支架上以确保样品粘附。
- 将玻璃样品放在支架上,相对于 SEM 相机的方向成 45°。注意将样品附在盖玻片上的空白处,以保持结构完整性(图 6B)。
- 如步骤 5.1.2 中对玻璃盖玻片的两个表面重复采集,以收集微支架和微透镜的 3D SEM 图像(图 6A,C)。
- 小心地将样品从碳带上取下,并将其存放在有盖的盒子中。
结果
已经提供了制造包含光学系统和组织分析参考的双面植入式微结构设备的协议。该工艺利用双光子激光聚合在同一衬底的另一侧制造 3D 微结构和微光学元件。使用长工作距离物镜允许在不翻转基板的情况下制造两种结构,节省了重新对准步骤,并保证了两个组件之间的完美对准。借助微光学元件和微加工参考系,该设备允许对同一区域进行光学像差校正和重复观察,从而实现先进的 原位 成像。 图 1 显示了为后续制造准备支撑基材的两个表面的程序。用于微制造样品两个表面的实验装置的草图如图 2 所示。该图像还显示了复杂的物镜样品架,第一个聚焦在由红色 LED 照明系统照亮的样品上,从而可以使用机器视觉实时监控制造过程。 图 3 定性地证明了该协议的灵活性,允许对各种设计的微支架和微透镜进行微加工。 图 4 突出显示了用于设计具有非球面抛物线轮廓的微透镜的垂度函数,以及与其主要特征相关的代表性设计草图作为示例。 在图 5 中,报告了完全交联整个微透镜体积所需的样品显影和紫外线暴露步骤。最后, 图 6 显示了微纳加工结果的示例。所提出的程序允许同一器件的两个表面的 3D 微结构聚合,确保出色的分辨率和稳定性。最后, 图 7 是代表协议一般工作流程的插图,以 图 8 结尾,它显示了拟议设备的最终应用示例,即在微型支架内生长的细胞的 体外 成像。

图 1:样品制备方案。 该图显示了在支撑的圆形玻璃盖玻片 (A) 上进行光刻胶滴铸的双步过程的草图。右图是两面沉积了干燥光刻胶的样品的照片 (B)。样品由样品架支撑。 请单击此处查看此图的较大版本。
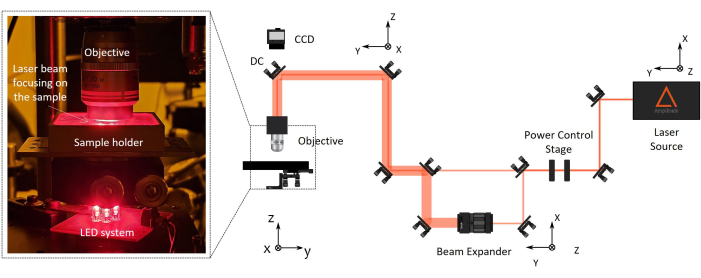
图 2:双光子激光聚合 (2PP) 制造设置。 右侧报告了制造设置的代表性图。设置主要组件是波长为 1030 nm、最小脉冲宽度为 230 fs 和 1 MHz 重复频率的飞秒激光源、功率控制平台、扩束镜、二向色镜和高数值孔径显微镜物镜(100x,NA 1.1)。CCD 相机安装在对准物镜光轴的二向色镜上方,用于制造过程监控。在左侧,有一个放大,光学装置最后一部分的变焦显示了用于机器视觉的复杂物镜/样品架/LED 照明系统的照片。 请单击此处查看此图的较大版本。
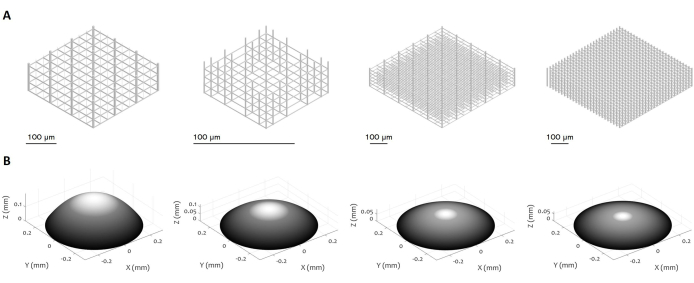
图 3:3D 微结构和微透镜的多种设计。 该图显示了可以使用拟议程序制造的 (A) 微支架和 (B) 微透镜的各种示例。该协议的高度灵活性使制造具有各种几何特征、分辨率、尺寸和体积的微结构成为可能,展示了其多功能性。面板 (B) 中的灰度旨在突出激光功率和写入速度的降低,以平滑表面并最大限度地减少表面粗糙度。根据微透镜的具体设计设置精确的制造参数。比例尺:100 μm。 请点击此处查看此图的较大版本。

图 4:制造的微透镜示例。 该面板显示了非球面抛物线轮廓的代表性示例,突出显示了镜头曲面的参数描述,即垂度函数 z(r) (A)。其中,Htot 是透镜厚度,r 是径向坐标,fn 是抛物面折射透镜的焦距,它不同于其有效焦距。屈光度取决于晶状体的折射率以及它与周围介质的折射率有何不同。在右侧,设计草图突出显示了位于顶点 V1 和表面 2 上方几微米的两个主平面(Π1 和 Π2,虚线)(B)。该草图显示了一个直径为 600 μm 的非球面抛物面微透镜,并在 N-BK7 玻璃基板(厚度为 170 μm)上制造。(C) 强调了在 SZ2080 光刻胶中微制造的非球面抛物面透镜的几何参数。 请单击此处查看此图的较大版本。
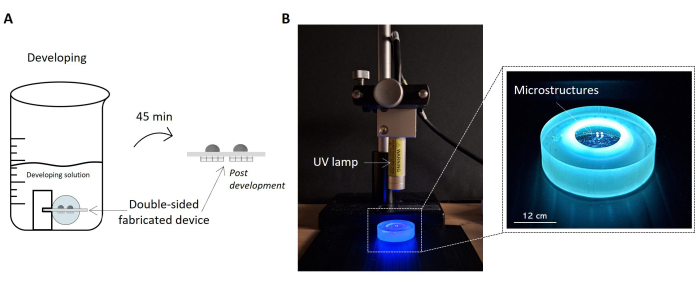
图 5:样品显影和紫外线暴露方案。 该图以草图 (A) 的形式突出显示了浸泡在开发解决方案中的制造样品。样品通过支架在溶液内提起,允许样品的两侧正确显影并获得双面微结构装置。右侧报告了样品紫外线照射的设置配置的图片 (B)。图中显示了垂直于样品表面放置的紫外灯。如紫外灯的数据表中所述,灯和样品之间的电流距离与灯的工作距离一致。接受紫外线辐射并由样品架处理的样品在右侧的放大图像中突出显示。比例尺:12 厘米。 请点击此处查看此图的较大版本。

图 6:扫描电子显微镜 (SEM) 采集的代表性制造结果。该面板通过侧视图 (B) 突出显示了双面制造器件,并通过 SEM 图像突出显示了制造微透镜 (A) 和微支架 (C) 的两个代表性结果。位于同一玻璃基板不同面上的两种结构在中心图片 (B) 中清晰可见。微透镜位于玻璃的底面,而微脚手架位于上表面。右图显示了具有球形设计的制造微透镜的 SEM 图像,作为制造稳定和平滑结果的示例 (A)。在左侧,该图像突出显示了具有任意几何形状 (C) 的 2PP 多孔微支架的代表性结果。比例尺:(A,C) - 50 μm;请点击此处查看此图的较大版本。
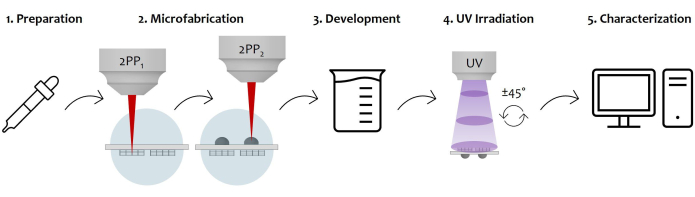
图 7:协议工作流程和设备应用的示意图: 该图显示了逐步绘制的整个制造过程。它首先通过在玻璃基板的两个表面上进行连续光刻胶滴铸来制备样品 (1)。一旦光刻胶达到溶胶-凝胶状态,就可以通过双光子激光聚合制备样品 (2)。因此,两个光刻胶液滴都被顺序照射,首先对微结构进行微结构,然后对微透镜进行微结构。之后,双面微加工衬底经过显影程序,以去除结构周围所有未聚合的光刻胶 (3)。为此,将样品浸泡在酒精溶液中,然后轻轻干燥。在样品的紫外线照射下,穿过玻璃基板,使微透镜的未聚合内芯完全交联 (4)。最后,通过扫描电子显微镜 (SEM) 采集对微加工样品进行质量检查,以从形态学上表征微观结构 (5)。 请单击此处查看此图的较大版本。

图 8:微结构成像窗口的潜在应用。 在左侧,一个具有代表性的草图说明了由耦合到标准扫描系统中外部显微镜物镜的设备构成的光学系统 (A)。这就是所谓的虚拟配置,在本例中用于对微型支架内活细胞生长进行成像。荧光成纤维细胞(红色荧光蛋白 (RFP) 标记)接种在带有 3D 微结构的装置的玻璃表面上。细胞的共聚焦荧光图像是在玻璃盖玻片焦平面(B, 绿色标签)上拍摄的,因此仅使用外部物镜,并通过其焦平面上的单个微透镜(A, 紫色标签)拍摄。细胞核以蓝色可见(Hoechst 染色),细胞骨架以红色 (RFP) 可见。比例尺:(B) - 100 μm;(C) - 50 μm。 请单击此处查看此图的较大版本。
讨论
为了确保在微结构窗口中对所需区域 3,6 进行准确成像,必须对两个结构(微支架和微透镜)进行精确对准。这构成了所提出的协议的主要挑战,因为 2PP 的高分辨率与制造深度的限制密切相关 3,6。在制造过程中翻转样品以依次将两个表面暴露在激光束下可能是一种选择,但它会使重新对准复杂且耗时5.这也将带来寻找相同参考系统的困难,从而损害微光学元件和微型支架之间的良好对准。在不卸载样品的情况下连续执行整个过程可保持一致的参比系统,从而促进和保证结构的准确对准。为此,我们使用长工作距离物镜 (2.5 mm),由于其高数值孔径(步骤 1.1),该物镜保持了良好的分辨率。这种方法还显着减少了制造时间,因为它节省了翻转样品后的对齐时间3.此外,由于样品体积小且易碎,处理样品带来了另一个挑战,这使得作和精确对准变得更加重要。
在 2PP 工艺中,对制造工艺的广泛研究对于确定关键参数(如最佳激光波长、脉冲宽度以及激光功率和平台运动)至关重要 9,10,11。因此,已经对 2PP 工艺进行了全面表征,即使考虑了实验装置的不同配置,以首先确保高度稳定、高分辨率的 3D 结构以及用于生物应用的细胞尺度细节 27,28,29,30。此外,最小化植入式微透镜的表面粗糙度对于获得具有所需光学特征的高质量微光学元件至关重要,从而降低对植入物的免疫反应 19,22,31。因此,该工艺的挑战在于根据实验因素(如感光材料的折射率和体积、环境条件(如湿度和温度)以及激光效率)调整功率和脉冲宽度等参数。还需要对紫外线暴露时间和强度进行广泛的表征,以完全交联微透镜的整个体积,确保其稳定性。这些设置必须根据 UV 源、作距离和要 UV 聚合的元件的比体积进行定制。
2PP 工艺的一个主要限制是由于其提供的极高分辨率而导致的低通量。鉴于此,聚合特征非常小,从数百纳米到几微米 9,26。因此,在生产数百微米规模的结构时,制造时间会显著增加,而按照 2PP 标准,这些结构相对较大,尤其是在笨重的结构中。因此,创建具有如此大尺寸的多个结构的集成设备可能需要几个小时。在这个框架中,为微透镜制造提出的混合 UV-2PP 协议将单个微透镜的制造时间缩短了 98%,与整个体积的 2PP 相比。这样可以提高微透镜外壳的 2PP 扫描精度,降低表面粗糙度,同时获得足够厚的微透镜外壳以确保透镜稳定性,所有这些都在可容忍的制造时间内完成。为了进一步加快这一过程,未来将提出一种并行化方法,以允许同时写入多个结构32。这种策略涉及将激光束分成多个光束以创建多个焦点,从而实现并行制造,从而大大缩短整体生产时间。
与最常见的软光刻技术不同,2PP 的主要优势之一是它是一种无掩模增材制造方法,能够在一定体积的感光材料内制造任意结构11。这种能力允许生产具有高度定制潜力的复杂三维和多孔结构。此外,基于非线性吸收原理,2PP 可以达到低于衍射极限的分辨率,这是标准 3D 打印技术或熔融沉积建模 (FDM) 无法实现的33。这对于创建具有细胞规模特征的多孔 3D 支架以支持细胞生长、募集和组织整合特别有价值。
通过本文提出的工艺生产具有集成光学元件的微结构植入式设备有可能对机械生物学、体外疾病建模和组织工程的应用产生重大影响(图 7 和图 8)。所提出的协议能够制造一种高质量的技术设备,该设备具有支持组织整合的微结构,同时用作体内成像参考点。此外,这些设计合理的微透镜通过校正由植入物周围组织引起的球面像差来增强先进的非线性成像4。事实上,该工艺的多功能性使我们能够调整设备的设计,例如,创建具有针对特定应用优化的几何形状的支架和参考结构,从而有助于 3D 重建和后处理中的成像像差校正。最后,根据组织折射率定制微透镜设计可增强特定应用的成像,从而有效地在设备内创建原位光学透镜。
披露声明
作者声明没有利益冲突。
致谢
这项研究已获得欧盟 Horizon 2020 研究和创新计划 (G.A. No. 964481-IN2SIGHT) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
参考文献
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926(2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103(2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107(2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527(2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20(2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810(2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204(2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179(2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621(2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646(2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577(2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794(2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636(2020).
Erratum
Formal Correction: Erratum: Microfabrication of Implantable Optics Integrated in a Microstructured Imaging Window for Advanced In Vivo Imaging
Posted by JoVE Editors on 6/04/2025. Citeable Link.
This corrects the article 10.3791/67975
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。