Method Article
Микропроизводство имплантируемой оптики, интегрированной в микроструктурированное окно визуализации для расширенной визуализации in vivo
В этой статье
Резюме
Этот протокол описывает изготовление имплантируемого интегрированного окна визуализации с использованием лазерной 3D-печати. Окно состоит из системы микролинз, соединенных с микрокаркасами. Метод включает в себя двухфотонную полимеризацию (2PP) биосовместимого фоторезиста SZ2080 в непрерывной последовательности, оптимизируя эффективность производства и выравнивание между различными компонентами.
Аннотация
В контексте тестирования биоматериалов и лекарств на животных моделях, это исследование представляет собой оптимизированный протокол для создания нового имплантируемого интегрированного окна визуализации. Микроустройство включает в себя сложную систему микролинз в сочетании с микроскаффолдами, специально разработанными для количественной оценки иммунного ответа in vivo с использованием передовой микроскопии с нелинейным возбуждением. Протокол основан на двухфотонной полимеризации (2PP) биосовместимого фоторезиста SZ2080, что позволяет изготавливать микрокаркасы и микролинзы в непрерывной последовательности для повышения эффективности и точности производства. Для дальнейшего повышения скорости, точности и структурной целостности был реализован гибридный подход к изготовлению оптики, включающий 2PP внешней оболочки микролинзы с последующим объемным УФ-сшиванием внутреннего ядра. Эта инновационная технология оптимизирует оптические свойства микролинз и оптимизирует производственный процесс. Полученное микроустройство демонстрирует высокую воспроизводимость и механическую стабильность, что делает его эффективным методом прототипирования микромасштабных оптических систем для целого ряда биомедицинских приложений.
Введение
Прижизненная микроскопия позволяет изучать биологические процессы у живых животных с помощью визуализации в режиме реального времени. В сочетании с флуоресцентными нелинейными методами визуализации он может достигать разрешения даже в субклеточноммасштабе1. Следовательно, он стал важным инструментом во многих областях, таких как иммунологические тесты или исследования рака, где важно наблюдение за клетками в их реальной физиологической среде.
Распространенные подходы к прижизненным исследованиям, такие как камеры дорсальной кожной складки или окна для визуализации черепа и брюшной полости, являются высокоинвазивными и создают трудности для длительных исследований одной и той же точки. Таким образом, крайне желательны новые подходы к визуализации in vivo , которые уменьшают страдания животных и позволяют легко изменять положение оптическогоизображения2.
В этой связи можно усовершенствовать новое миниатюрное окно визуализации на основе стеклянной подложки, которая содержит сторону визуализации с оптическими микролинзами и тканевую референтную сторону с трехмерными (3D) микрокаркасами. Это миниатюрное окно визуализации может быть имплантировано животному «подложно» и будет функционировать как «внутренняя» мишень микроскопа. Принцип работы устройства будет заключаться в использовании микролинз в сочетании с объективом микроскопа с низкой числовой апертурой (NA) для выполнения in vivo нелинейной визуализации биологических процессов, происходящих внутри каркасов. Микролинзы будут компенсировать сферическую аберрацию, обусловленную визуализацией через неоднородную среду в виде ткани 3,4, в то время как микрокаркас будет стимулировать регенерацию тканей и действовать как оптические маяки 5,6,7, что позволит проводить долгосрочное обследование одной и той же точки.
Основные компоненты устройства, т.е. микроскаффолды и микролинзы, уже были продемонстрированы по отдельности, но их интеграция в одно и то же устройство сопряжена с рядом проблем из-за их 3D-природы, микрометрового размера и необходимости идеального оптического выравнивания между ними. Микроскаффолды, состоящие из прямоугольных кубоидных сеток, с репрезентативными габаритными размерами ~ 500 мкм x 500 мкм x 100 мкм и с размерами пор ~ 50 мкм x 50 мкм x 20 мкм, могут управлять набором клеток и новой васкуляризацией, тем самым способствуя интеграции тканей. Кроме того, благодаря своей автофлуоресценции микроскаффолды функционируют как флуоресцентные маяки in situ, что позволяет быстро перемещать и выравнивать под микроскопом и даже корректировать сферические аберрации во время нелинейной визуализации, что позволяет проводить продольныенаблюдения in vivo с высоким разрешением5. Микролинзы с высокой числовой апертурой, со сферическими или квазипараболическими профилями и фокусными расстояниями в несколько сотен микрометров, продемонстрировали свои возможности для линейной и нелинейной визуализации биологических образцов в сочетании с конфокальным или двухфотонным микроскопом 3,4.
Микролинзы и микрокаркасы изготавливаются с помощью лазерной 3D-печати, также известной как двухфотонная полимеризация (2PP). В 2PP инфракрасный фемтосекундный лазерный луч плотно фокусируется внутри УФ-отверждаемого фоторезиста, и за счет многофотонного поглощения в фокальной точке создается замкнутый воксель полимеризованного материала с субмикронным размером (~100 нм). Перемещая фокус лазера относительно образца фоторезиста, можно получить трехмерные структуры полимеризованного материала после смыва неполимеризованного материала8. Процесс имеет изначально высокое разрешение и 3D-природу, что позволяет получать 3D-микроструктуры, такие как каркасы и линзы, с хорошей стабильностью и высоким качеством поверхности 9,10,11. Существуют различные методы изготовления пористых микрокаркасов, такие как 3D-печать, наноимпринтинг или электроспиннинг 12,13,14,15. Все эти методы имеют главный недостаток; Они не способны достигать разрешения в субмикронном диапазоне, что дает структурам с размерами пор (~100 мкм) больше клеточного размера, и не имитируют внеклеточный матрикс, который необходим для хорошей регенерации тканей. К изготовлению микролинз можно подойти методами, основанными на воспроизведении линзы из пресс-формы или маски, такими как литье под давлением, горячее тиснение или УФ-формование, или прямыми методами, такими как термическое оплавление, тиснение микропластиком или струя микрокапель16,17. Все они имеют ограничения по морфологии поверхности, которые могут быть получены, и их трудно интегрировать в производственный процесс, где также должны быть изготовлены микрокаркасы. С другой стороны, 2PP продемонстрировал свою универсальность для изготовления сложных оптических компонентов18,19, таких как сферические или параболические линзы, дифракционные линзы или даже комбинации различных линз в одном и том же оптическом компоненте 20,21,22,23,24. В этом контексте 2PP представляется наилучшей техникой для изготовления целого, содержащего как линзы, так и микрокаркасы.
Несмотря на то, что 2PP является уникальным выбором для реализации этих 3D-структур с микрометровым разрешением, у него есть два основных ограничения: это трудоемкий подход для относительно больших объемных структур и ограниченная глубина изготовления (вдоль оптической оси) из-за короткого рабочего расстояния объективов микроскопа, используемых для точной фокусировки.
В данной статье предложен уникальный протокол изготовления микроскаффолдов и микролинз на противоположных сторонах стеклянной подложки в процессе облучения с одним продольным шагом, который гарантирует хорошее выравнивание обоих элементов и преодолевает ограничения по глубине изготовления. Протокол также оптимизирован с точки зрения времени изготовления; с одной стороны, одноступенчатое облучение экономит время юстировки, а использование гибридного подхода, сочетающего 2PP оболочки линзы и УФ-отверждение внутренних фоторезистов, сокращает время облучения объективов большого объема25. Способность 2PP создавать 3D-структуры произвольной формы позволяет использовать этот протокол для любой конструкции микролинз и микрокаркасов, тем самым расширяя возможности текущего метода.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Подготовка образцов
- Первое капельное литье (рис. 1A)
- Очистите ацетоном обе поверхности круглого стеклянного покровного стекла диаметром 12 мм (толщина 170 мкм).
- Высушите обе поверхности газообразным азотом комнатной температуры.
- Нанесите контролируемое количество 46 мкл жидкого фоторезиста на одну сторону стеклянного покровного стекла с помощью объемной пипетки.
ПРИМЕЧАНИЕ: Светочувствительный материал, используемый в данном протоколе, представляет собой биосовместимый гибридный органический/неорганический фоторезист, известный как SZ2080, который хорошо известен и валидирован для применения в биомедицине26. Обратите внимание на то, чтобы на стеклянной подложке оставалось свободное внешнее кольцо. Не содержащее фоторезиста, это стеклянное пространство обеспечивает правильное удержание образца внутри подложки, что лучше способствует подготовке. - Оставьте образец под химическим колпаком на 48 часов, чтобы дать возможность высохнуть первой капле фоторезиста за счет испарения растворителя, достигнув золь-гель состояния.
- Второе дропли-кастинг (рис. 1A)
- Когда первая капля фоторезиста достигнет золь-гель состояния (шаг 1.1.4.), переверните образец вверх дном, обнажив чистую поверхность.
- Поместите образец на поддерживающий держатель, приподняв первую отлитую каплем поверхность от земли.
- Нанесите вторую каплю 46 мкл жидкого фоторезиста на чистую поверхность стекла, оставив наружное пространство так же, как и на шаге 1.1.3.
- Оставьте образец под химическим колпаком не менее чем на 48 часов, дав растворителю испариться.
ПРИМЕЧАНИЕ: Через 4-6 дней образец с двойным капельным отливкой готов к использованию для 2PP (Рисунок 1B). С этого момента следите за тем, чтобы образец не подвергался воздействию окружающего света из-за светочувствительного материала. Воздействие света ухудшает фоторезист.
2. Двухфотонная полимеризация (2ПП) микроструктур
- Настройка выравнивания (рисунок 2)
- Включите фемтосекундный лазерный источник ближнего инфракрасного диапазона (длина волны 1030 нм, 1 МГц, минимальная длительность импульса = 230 фс).
ПРИМЕЧАНИЕ: Установите параметры лазера, такие как длительность импульса и частота повторения. - Выровняйте оптический путь лазерного луча до тех пор, пока он не достигнет объектива микроскопа, с помощью ряда оптики и зеркал, установленных на кинематических креплениях зеркал. Итеративно вращайте зеркала, чтобы центрировать луч в ближних инфракрасных (NIR) точечных отверстиях.
ПРИМЕЧАНИЕ: Рабочее расстояние объектива микроскопа должно быть больше общей высоты конечного изготавливаемого устройства (высота линзы + толщина покровного стекла + высота микрокаркаса). Точечные отверстия NIR правильно спроектированы для упрощения юстировки инфракрасных лучей. Это обеспечивает точную юстировку луча по оптическому пути, проходящему через такие компоненты, как полуволновая пластина, расширитель луча и дихроичное зеркало. Для автоматического управления мощностью лазера луч проходит через горизонтальный поляризатор и полуволновую пластину, а второй устанавливается на моторизованный ротатор. При необходимости луч может пройти через расширитель луча для увеличения диаметра луча и выполнения обратного входа объектива. - Направьте лазерный луч перпендикулярно держателю образца, выровняв его с помощью центрирования с обратным отражением.
- Установите объектив микроскопа с большим рабочим расстоянием на специальную опору в конце оптического пути рядом с образцом (рис. 2).
ПРИМЕЧАНИЕ: ПЗС-камера установлена над дихроичным зеркалом, выровненным по оптической оси объектива, для контроля процесса изготовления. Это позволит увидеть пятно фокусировки лазера и полимеризованные структуры.
- Включите фемтосекундный лазерный источник ближнего инфракрасного диапазона (длина волны 1030 нм, 1 МГц, минимальная длительность импульса = 230 фс).
- Монтаж образца
- Закрепите (с помощью скотча) двойную стеклянную защитную крышку на держателе образца, установленном на столиках для перевода. Установите образец второй осажденной каплей вниз.
ПРИМЕЧАНИЕ: Держатель образца имеет центральное отверстие, через которое образец может быть подвешен к наземной ступени5. Держатель подключен к карданной механической системе, которая привинчена к поступательному столику X, Y для перемещения образца. - Центрируйте образец вручную с помощью объектива микроскопа.
- Закрепите (с помощью скотча) двойную стеклянную защитную крышку на держателе образца, установленном на столиках для перевода. Установите образец второй осажденной каплей вниз.
- Центрирование образца
- Установите мощность лазера на минимальном значении, достаточном для того, чтобы увидеть отражение луча на программном обеспечении ПЗС-камеры (около 5 мВт).
ПРИМЕЧАНИЕ: Измерьте мощность лазера в заднем зрачке объектива (пропускание объектива, используемого в этом протоколе, составляет 70% на длине волны 1030 нм). - Включите программное обеспечение интерфейса оператора для контроллера движения и ПЗС-камеры.
- Сфокусируйте лазерный луч на верхней поверхности первой капли фоторезиста.
- Следуя изогнутому профилю капли, найдите образцы краев вдоль направлений X и Y. Установите центр капли в качестве абсолютного нуля с помощью программного обеспечения.
ПРИМЕЧАНИЕ: Лента, используемая для фиксации образца, играет роль в обнаружении краев путем изменения показателя преломления, следовательно, отражения луча.
- Установите мощность лазера на минимальном значении, достаточном для того, чтобы увидеть отражение луча на программном обеспечении ПЗС-камеры (около 5 мВт).
- Компенсация наклона образца
- В центре образца сфокусируйте лазерный луч на поверхности раздела между верхней поверхностью стеклянного покровного стекла и основанием первой капли фоторезиста. Установите его в качестве нулевой привязки по оси Z.
- Учитывая диаметр образца, переместиться в крайнее положение (для покровного стекла 12 мм это ~ - 4 мм) в отрицательном направлении оси X. В этом положении сфокусируйте поверхность границы раздела (между стеклом и верхней каплей фоторезиста) и установите ее в положение абсолютного нуля по вертикали Z.
- Переместитесь в положение края в положительном направлении оси X (для покровного стекла 12 мм это ~ + 4 мм). Здесь мы видим поверхность интерфейса, перемещающую объектив по вертикали Z.
- Наклоните образец, чтобы скорректировать отклонение в направлении Z между отрицательным и положительным положением по оси X. Используйте регулируемое кинематическое крепление для наклона держателя образца (как кардан).
- Повторяйте шаги 2.4.2-2.4.4 итеративно до тех пор, пока образец не будет полностью сбалансирован по оси X.
- Выполните ту же процедуру, что и в пунктах 2.4.2-2.4.5 по оси Y.
- Как только образец будет идеально сбалансирован по оси X и Y, вернитесь в центральное положение и сфокусируйте границу раздела между стеклом и фоторезистом в этой точке.
- Установите новое значение Z фокуса в качестве эталона по оси Z (Z = 0).
ПРИМЕЧАНИЕ: Процедура, описанная на шаге 2.4, направлена на обеспечение идеальной перпендикулярности между лазерным лучом и поверхностью покровного стекла для обеспечения идеального закрепления конструкций из 2PP, которые будут изготовлены позже. Начиная с версии 2.4, все процедуры должны выполняться в соответствии с показателем преломления. Поэтому при необходимости добавьте среду сопоставления индекса цели.
- Микроскаффолды 2ПП на нижнем падении фоторезиста
- Включите систему красной светодиодной подсветки для мониторинга процесса полимеризации в режиме реального времени.
ПРИМЕЧАНИЕ: Светодиодная подсветка с красным светом помещена под сложный держатель-кардан образца (рис. 2). Такая подсветка позволит увидеть полимеризованный объем в процессе 2PP. Фоторезист чувствителен к более коротким длинам волн (видимому свету); поэтому красно-светодиодный свет не будет возмущать образец. - При выключенном лазере переместите объектив по оси Z ниже защитного стекла, чтобы найти вторую поверхность раздела между нижней поверхностью стекла и основанием нижней капли резиста.
ПРИМЕЧАНИЕ: Вторая граница раздела будет находиться со значением Z, приблизительно равным толщине покровного стекла (170 мкм). - Увеличьте мощность лазера до 100 мВт, чтобы двухфотонная полимеризация произошла в нижней капле.
- Настройте положение фокуса (увеличивая Z), чтобы найти вторую границу раздела путем полимеризации простой эталонной структуры.
ПРИМЕЧАНИЕ: Примером эталонной структуры является полимеризованная линия длиной 50 мкм. - Установите первое фокальное положение, в котором происходит полимеризация эталонной структуры, в качестве нулевой точки отсчета по вертикали (ось Z).
ПРИМЕЧАНИЕ: Ссылка на шаге 2.5.5 подчеркивает базовую плоскость для 2PP микрокаркасов. - Установите мощность полимеризации (~ 100-200 мВт) и запустите машинный код в качестве программы с числовым программным управлением (ЧПУ) для правильного движения поступательных этапов для изготовления желаемой 3D-структуры (рис. 3A).
ПРИМЕЧАНИЕ: Программа ЧПУ состоит из набора пространственных координат (x, y, z), которые определяют, в каком направлении движутся трансляционные платформы для создания конечного 3D-объекта. Эти возможности полимеризации будут зависеть от высоты верхней капли и конкретных условий эксперимента (фоторезист, лазер и система движения).
- Включите систему красной светодиодной подсветки для мониторинга процесса полимеризации в режиме реального времени.
- Микролинзы 2ПП на верхнем падении фоторезиста
- Двигаясь по оси Z, вернемся к первому интерфейсу между верхней поверхностью стекла и верхней каплей фоторезиста (шаг 2.4.8). Поддерживайте одну и ту же планарную систему отсчета (координаты X, Y) для обеспечения идеального совмещения микролинз 2PP с уже изготовленными микроструктурами.
- Найдите интерфейс путем полимеризации простой эталонной структуры.
ПРИМЕЧАНИЕ: Используйте тот же процесс, который описан в шаге 2.5.4, но отличающийся только направлением вертикального движения. - Установите первую линию полимеризации в качестве нулевой точки отсчета по вертикали (ось Z).
ПРИМЕЧАНИЕ: Ссылка на шаге 2.6.3 подчеркивает плоскость заземления для 2PP микролинз. - Задайте параметры изготовления для 2PP контура нужного микрообъектива (рисунок 3B). Лазерный луч описывает круговую траекторию, уменьшающуюся в радиусе, для непрерывной полимеризации внешней поверхности одной микролинзы. Задайте параметры штриховки и нарезки по осям X и Z соответственно.
ПРИМЕЧАНИЕ: При проектировании объективов следует учитывать желаемое пользователем эффективное фокусное расстояние. Как правило, это должна быть величина больше толщины покровного стекла, и она должна позволять получить изображение всего атласа. Рекомендуется провести предварительное вычислительное моделирование окончательной оптической системы. - Установите мощность полимеризации (~15-20 мВт) и запустите программу, которая направляет движение поступательных этапов.
ПРИМЕЧАНИЕ: Эти возможности полимеризации будут зависеть от высоты верхней капли, конкретных условий эксперимента и конструкции желаемой микролинзы (Рисунок 3B). На рисунке 4 показан репрезентативный пример параболической микролинзы с параметрической функцией, описывающей профиль микролинзы и ее основные геометрические особенности.
3. Разработка образцов
- Извлеките образец из экспериментальной производственной установки.
- При выключенном лазере отключите поступательные оси X, Y и Z и снимите держатель.
- Снимите липкую ленту и отсоедините образец от держателя.
ПРИМЕЧАНИЕ: Перед проявкой образца обратите внимание на то, чтобы образец не подвергался воздействию окружающего света из-за светочувствительного материала. Воздействие света сшивало бы весь объем фоторезиста.
- Разработка образца (Рисунок 5A)
- Поместите образец в подходящую опору, чтобы поднять его над землей и удерживать в горизонтальном положении.
ПРИМЕЧАНИЕ: Этот держатель образцов представляет собой специальный штатив для образцов, напечатанный по SLA, правильно спроектированный для того, чтобы подвергнуть обе прототипированные поверхности 2PP воздействию разрабатываемого решения5. - Приготовьте стакан объемом 50 мл и поместите внутрь него опору с образцом.
ПРИМЕЧАНИЕ: Обратите внимание на сохранение микролинз 2PP на верхней поверхности, чтобы избежать структурной деформации во время проявки из-за их неполимеризованного внутреннего ядра. - Наполните стакан ~20 мл проявочного раствора, полностью покрывая образец. Раствор состоит из 50% (v/v) 2-пентанона и 50% (v/v) раствора изопропилового спирта.
- Оставьте образец внутри проявочного раствора на 45 минут.
- Поместите образец в подходящую опору, чтобы поднять его над землей и удерживать в горизонтальном положении.
- Промывка образцов
- Снимите поддержку с разрабатываемого решения.
- Взяв его в руки вручную или с помощью пинцета, возьмите образец и тщательно промойте его несколькими каплями изопропилового спирта.
- Высушите обе обработанные поверхности стеклянного покровного стекла слабым потоком азота (при комнатной температуре).
ПРИМЕЧАНИЕ: Все процедуры, описанные в шагах 3.2-3.3, выполняются под вытяжным шкафом для химических веществ.
4. Образец УФ-облучения
- Воздействие микролинз на УФ-излучение (длина волны 385 нм) (рис. 5B)
- Поместите стеклянный покровный стекло на держатель для образцов, подвешенный к плоскости заземления. Положите образец микролинзами вниз.
ПРИМЕЧАНИЕ: Держатель образца имеет центральное отверстие для размещения образца в подвешенном состоянии к наземному столику, сохраняя целостность микроструктуры на нижней поверхности. - Подготовьте УФ-лампу с длиной волны 385 нм.
- Расположите образец под источником ультрафиолетового излучения перпендикулярно по отношению к поверхности стеклянного покровного стекла.
- Подвергните образец воздействию ультрафиолетового излучения с мощностью 300 мВт в течение 120 с.
ПРИМЕЧАНИЕ: Воздействие ультрафиолета происходит при прохождении через микрокаркас и стеклянную подложку. Таким образом, еще не полимеризовавшаяся сердцевина линз будет сшита ультрафиолетом, что позволит избежать прямого и дополнительного воздействия на ранее полимеризованную поверхность. - Озаглавив источник ультрафиолетового излучения под углом -45° и +45° относительно нормального положения плоскости образца, повторите шаг 4.1.4.
ПРИМЕЧАНИЕ: Это трехступенчатое воздействие ультрафиолета под разными углами позволит полностью сшить весь неполимеризованный резист в объеме микролинзы, достигая стабильности. Это особенно важно для широкоугольных микролинз. - Извлеките образец из держателя и храните его.
- Поместите стеклянный покровный стекло на держатель для образцов, подвешенный к плоскости заземления. Положите образец микролинзами вниз.
5. Морфологическая характеристика
- Получение данных с помощью сканирующей электронной микроскопии (СЭМ) (Рисунок 6)
- Подготовьте станцию SEM. Прикрепите кусок углеродной ленты к держателю SEM для прилипания пробы.
- Поместите образец стекла на держатель под углом 45° по отношению к ориентации камеры SEM. Обратите внимание на прикрепление образца в пустом месте на покровном стекле, чтобы сохранить целостность структуры (рисунок 6B).
- Повторите получение, как на шаге 5.1.2, для обеих поверхностей стеклянного покровного стекла, чтобы получить 3D-изображения микрокаркасов и микролинз (рис. 6A, C).
- Аккуратно отсоедините образец от углеродной ленты и храните его в закрытой коробке.
Результаты
Предоставлен протокол изготовления двустороннего имплантируемого микроструктурированного устройства, содержащего оптическую систему и ссылку на анализ тканей. В этом процессе используется двухфотонная лазерная полимеризация для изготовления 3D-микроструктур и микрооптики на противоположной стороне одной и той же подложки. Использование объектива с большим рабочим расстоянием позволяет изготавливать обе конструкции без переворачивания подложки, сохраняя этап повторного выравнивания и гарантируя идеальное выравнивание между обоими компонентами. Это устройство расширит возможности визуализации in situ , позволяя корректировать оптические аберрации и повторять наблюдения одной и той же области благодаря микрооптике и микроискусственной системе отсчета. На рисунке 1 показана процедура подготовки обеих поверхностей несущей подложки к последующему изготовлению. Эскиз экспериментальной установки, используемой для микроизготовления обеих поверхностей образца, представлен на рисунке 2. На изображении также показан сложный держатель объектива и образца, первый из которых сфокусирован на образце, который подсвечивается системой красно-светодиодной подсветки, позволяющей контролировать производство в режиме реального времени с помощью машинного зрения. Рисунок 3 качественно демонстрирует гибкость протокола, позволяющую микроизготовление различных конструкций микроскаффолдов и микролинз. На рисунке 4 в качестве примера показана функция провисания, используемая при проектировании микролинзы с асферическим параболическим профилем, и эскиз репрезентативной конструкции, соотнесенной с ее основными особенностями. На рисунке 5 представлены этапы разработки образца и воздействия ультрафиолета, необходимые для полного сшивания всего объема микролинз. Наконец, на рисунке 6 показаны примеры результатов микропроизводства. Представленная методика позволяет проводить полимеризацию 3D микроструктур обеих поверхностей одного и того же устройства, обеспечивая превосходное разрешение и стабильность. Наконец, на рисунке 7 представлена иллюстрация, представляющая общий рабочий процесс протокола, заканчивающаяся рисунком 8, на котором показан пример окончательного применения предлагаемого устройства, т.е. визуализация in vitro клеток, выращенных внутри микрокаркаса.

Рисунок 1: Протокол пробоподготовки. На этом рисунке показан эскиз двухступенчатого процесса капельного литья фоторезиста на поддерживающее круглое стеклозащитное стекло (A). Справа представлено изображение образца с высушенным фоторезистом, нанесенным с обеих сторон (B). Образец поддерживается держателем образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
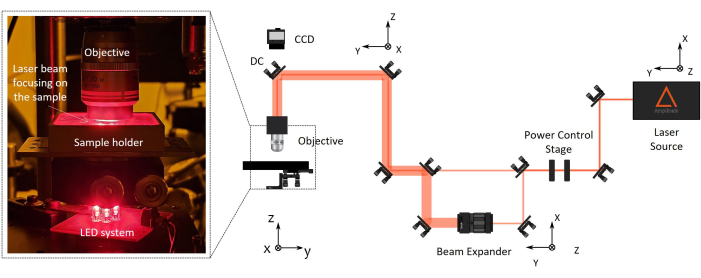
Рисунок 2: Производственная установка двухфотонной лазерной полимеризации (2PP). Справа представлена репрезентативная схема производственной установки. Основными компонентами установки являются фемтосекундный лазерный источник с длиной волны 1030 нм, минимальной шириной импульса 230 фс и частотой повторения 1 МГц), столик для управления мощностью, расширитель луча, дихроичное зеркало и объектив микроскопа с высокой числовой апертурой (100x, NA 1.1). ПЗС-камера установлена над дихроичным зеркалом, выровненным по оптической оси объектива, для мониторинга производственного процесса. Слева находится увеличенное изображение, при котором при увеличении последней части оптической установки показана фотография сложной системы объектива/держателя образца/светодиодной подсветки для машинного зрения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
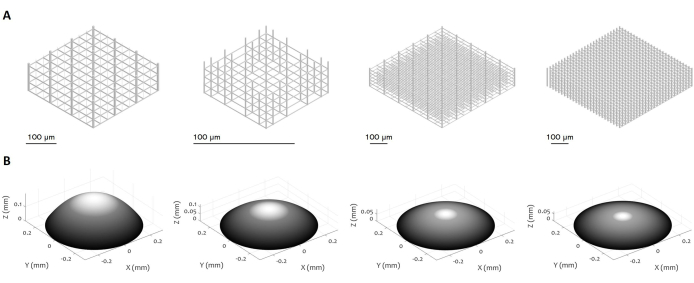
Рисунок 3: Множественные конструкции 3D-микроструктур и микролинз. На рисунке показаны различные примеры (А) микроскаффолдов и (В) микролинз, которые могут быть изготовлены с использованием предложенной процедуры. Высокая гибкость протокола позволяет изготавливать микроструктуры с различными геометрическими особенностями, разрешением, размерами и объемом, демонстрируя его универсальность. Серая шкала на панели (B) призвана подчеркнуть снижение мощности лазера и скорости записи для сглаживания поверхности и минимизации шероховатости поверхности. Точные параметры изготовления устанавливаются в соответствии с конкретной конструкцией микролинзы. Масштабные линейки: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Пример изготовленной микролинзы. На панели показан репрезентативный пример асферического параболического профиля, выделяющий параметрическое описание изогнутой поверхности объектива как функцию стреления z(r) (A). Здесь Htot — толщина линзы, r — радиальная координата, а fn — фокусное расстояние параболической рефракционной линзы, отличающееся от ее эффективного фокусного расстояния. Диоптрийная мощность определяется показателем преломления линзы и тем, как она отличается от преломления окружающей среды. Справа на эскизе выделены две главные плоскости, лежащие в вершине V1 и на высоте нескольких мкм над поверхностью 2 (Π1 и Π2, пунктирные линии) (B). На эскизе показана одна асферическая параболическая микролинза диаметром 600 мкм, изготовленная на стеклянной подложке N-BK7 (толщиной 170 мкм). (C) подчеркиваются геометрические параметры асферической параболической линзы, микроизготовленной из фоторезиста SZ2080. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
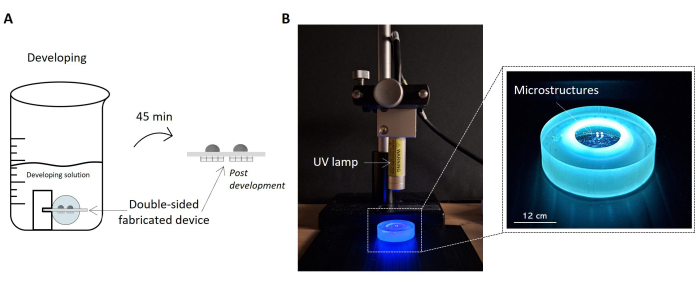
Рисунок 5: Протоколы разработки образцов и воздействия ультрафиолета. На изображении выделен изготовленный образец, пропитанный решением для разработки, в виде эскиза (А). Образец поднимается внутрь раствора с помощью держателя, что позволяет правильно проявлять обе стороны образца и получать двустороннее микроструктурированное устройство. Справа показано изображение конфигурации установки для УФ-облучения образца (B). На рисунке показана УФ-лампа, расположенная перпендикулярно поверхности образца. Как указано в техническом описании УФ-лампы, текущее расстояние между лампой и образцом соответствует рабочему расстоянию лампы. Образец, подвергающийся воздействию ультрафиолетового излучения и обрабатываемый держателем образца, выделен на увеличенном изображении справа. Масштабная линейка: 12 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 6: Получение репрезентативных результатов производства с помощью сканирующей электронной микроскопии (СЭМ). На панели выделено двустороннее изготовленное устройство с помощью бокового вида (B) и два репрезентативных результата изготовленной микролинзы (A) и микрокаркаса (C) с помощью изображений SEM. Две конструкции, лежащие на разных гранях одной и той же стеклянной подложки, хорошо видны на центральном рисунке (В). Микролинзы представлены на нижней поверхности стекла, а микрокаркасы – на верхней. СЭМ-изображение изготовленной микролинзы со сферической конструкцией показано справа в качестве примера стабильного и плавного результата изготовления (А). Слева на изображении выделен репрезентативный результат работы пористого микрокаркаса 2PP с произвольной геометрией (C). Масштабные линейки: (A,C) - 50 μм; (B) - 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
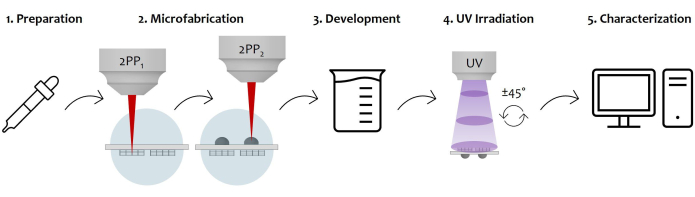
Рисунок 7: Принципиальная схема рабочего процесса протокола и приложения устройства: На рисунке показан общий производственный процесс, нарисованный шаг за шагом. Он начинается с подготовки образца путем последовательного капельного литья фоторезиста на обе поверхности стеклянной подложки (1). Как только фоторезист достигает золь-гель состояния, образец готов к изготовлению методом двухфотонной лазерной полимеризации (2). Таким образом, обе капли фоторезиста последовательно облучаются, микроструктурируя сначала микроструктуры, а затем микролинзы. После этого двусторонняя микроизготовленная подложка подвергается проявочной процедуре для удаления всего неполимеризованного резиста, окружающего конструкции (3). Для этого образец замачивают в спиртовом растворе, а затем аккуратно высушивают. После УФ-облучения образца проходит через стекловидную подложку для полного сшивания неполимеризованного внутреннего ядра микролинз (4). Наконец, проверка качества микроизготовленного образца выполняется с помощью сканирующей электронной микроскопии (СЭМ) для морфологической характеристики микроструктур (5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Потенциальное применение микроструктурированного окна визуализации. Слева на репрезентативном рисунке показана оптическая система, состоящая из устройства, соединенного с объективом внешнего микроскопа в стандартной сканирующей системе (А). Это так называемая виртуальная конфигурация, используемая в данном случае для визуализации роста живой клетки внутри микрокаркаса. Флуоресцентные фибробласты (меченые красными флуоресцентными белками (RFP)) были нанесены на стеклянную поверхность устройства, которое несет 3D-микроструктуры. Конфокальные флуоресцентные изображения клеток были получены в фокальной плоскости стеклянного покровного стекла (B, зеленый хэштег), то есть с использованием только внешнего объектива, и через одну микролинзу в его фокальной плоскости (A, фиолетовый хэштег). Ядра клеток видны синим цветом (окрашивание по методу Хёхста), а цитоскелет — красным (RFP). Масштабные линейки: (В) - 100 мкм; (C) - 50 μm. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Для обеспечения точного изображения нужной области 3,6 в микроструктурированном окне в обязательном порядке необходимо точное выравнивание двух структур (микроскаффолда и микролинз). В этом и заключается основная сложность предлагаемого протокола, так как высокое разрешение 2PP тесно связано с ограничением глубины изготовления 3,6. Переворачивание образца во время изготовления для последовательного воздействия лазерного луча на обе поверхности может быть вариантом, но это усложняет повторную юстировку и занимает много времени5. Это также создаст трудности в поиске одной и той же системы отсчета и, таким образом, поставит под угрозу хорошее выравнивание между микрооптическими компонентами и микрокаркасами. Непрерывное выполнение всего процесса без демонтажа образца поддерживает постоянную систему отсчета, тем самым облегчая и гарантируя точное выравнивание структур. Для этого мы используем объектив с большим рабочим расстоянием (2,5 мм), который сохраняет хорошее разрешение благодаря высокой числовой апертуре (шаг 1.1). Такой подход также значительно сокращает время изготовления, так как сохраняет выравнивание образца после его переворачивания3. Кроме того, работа с образцами представляет собой еще одну проблему из-за их небольшого размера и хрупкости, что делает манипуляции и точное выравнивание еще более важными.
В процессах 2PP широкое исследование процесса изготовления имеет важное значение для установления ключевых параметров, таких как оптимальная длина волны лазера, ширина импульса, а также мощность лазера и движения сцены 9,10,11. Таким образом, всесторонняя характеристика процесса 2PP, даже с учетом различных конфигураций экспериментальной установки, чтобы сначала обеспечить высокостабильные 3D-структуры с высоким разрешением и детализацией клеточного масштаба для биологических приложений, была выполнена 27,28,29,30. Кроме того, минимизация шероховатости поверхности имплантируемых микролинз имела решающее значение для получения высококачественной микрооптики с желаемыми оптическими характеристиками, тем самым снижая иммунологический ответ на имплантат 19,22,31. Таким образом, сложность процесса заключается в настройке таких параметров, как мощность и длительность импульса, на основе экспериментальных факторов, таких как показатель преломления и объем светочувствительного материала, условия окружающей среды (например, влажность и температура) и эффективность лазера. Также потребовалась обширная характеризация времени и интенсивности ультрафиолетового излучения, чтобы полностью сшить весь объем микролинз, обеспечивая их стабильность. Эти настройки должны быть адаптированы к источнику УФ-излучения, рабочему расстоянию и конкретному объему элемента, подлежащего УФ-полимеризации.
Основным ограничением процесса 2PP является его низкая пропускная способность из-за чрезвычайно высокого разрешения, которое он обеспечивает. Учитывая это, полимеризованные особенности очень малы, от сотен нанометров до нескольких микрометров 9,26. Поэтому время изготовления значительно увеличивается при производстве конструкций в масштабе сотен микрометров, которые относительно велики по меркам 2PP, особенно если это громоздкие конструкции. В результате создание интегрированных устройств с несколькими структурами таких больших размеров может занять несколько часов. В этом контексте гибридный протокол UV-2PP, предложенный для производства микролинз, позволил сократить время изготовления одной микролинзы на 98% по сравнению с 2PP от всего ее объема. Это позволило повысить точность сканирования внешней оболочки микролинзы с помощью 2PP, уменьшив шероховатость поверхности и получив достаточно толстую оболочку микролинзы для обеспечения стабильности линзы, и все это в течение приемлемого времени изготовления. Для дальнейшего ускорения этого процесса в будущем будет предложен подход к распараллеливанию, позволяющий одновременно записывать несколько структур32. Эта стратегия включает в себя разделение лазерного луча на несколько лучей для создания нескольких фокусных точек, что обеспечивает параллельное производство и тем самым значительно сокращает общее время производства.
В отличие от наиболее распространенных методов мягкой литографии, одним из ключевых преимуществ 2PP является то, что это аддитивный подход без маски, который позволяет изготавливать произвольные структуры в объеме светочувствительного материала. Эта возможность позволяет изготавливать сложные трехмерные и пористые структуры с высоким потенциалом индивидуализации. Более того, основываясь на принципе нелинейного поглощения, 2PP позволяет достичь разрешения ниже дифракционного предела, что недостижимо с помощью стандартных методов 3D-печати или моделирования методом наплавления (FDM) в качестве примера33. Это особенно ценно для создания пористых 3D-скаффолдов с функциями клеточного масштаба для поддержки клеточного роста, рекрутинга и интеграции тканей.
Производство микроструктурированных имплантируемых устройств с интегрированной оптикой с помощью предложенного здесь процесса может оказать значительное влияние на приложения, охватывающие механобиологию, моделирование заболеваний in vitro и тканевую инженерию (рис. 7 и рис. 8). Представленный протокол позволяет изготовить высококачественное техническое устройство, микроструктуры которого поддерживают интеграцию тканей и одновременно служат опорными точками визуализации in vivo . Кроме того, эти правильно спроектированные микролинзы улучшили передовую нелинейную визуализацию за счет коррекции сферических аберраций, вызванных тканями, окружающими имплантат4. Универсальность процесса, по сути, позволяет нам корректировать конструкцию устройства, например, создавать скаффолды и опорные структуры с оптимизированной для конкретных приложений геометрией, помогая как в 3D-реконструкциях, так и в коррекции аберраций изображения при постобработке. Наконец, индивидуальный дизайн микролинз на основе показателей преломления тканей улучшает визуализацию в зависимости от конкретного применения, эффективно создавая оптическую линзу in situ внутри устройства.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование получило финансирование от Европейского Союза в рамках программы исследований и инноваций «Горизонт 2020» (G.A. No 964481-IN2SIGHT).
Материалы
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
Ссылки
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926 (2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103 (2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107 (2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527 (2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20 (2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810 (2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204 (2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179 (2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621 (2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646 (2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577 (2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794 (2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены