Method Article
Microfabrication d’optiques implantables intégrées dans une fenêtre d’imagerie microstructurée pour une imagerie in vivo avancée
Dans cet article
Erratum Notice
Résumé
Ce protocole décrit la fabrication d’une fenêtre d’imagerie intégrée implantable à l’aide de l’impression laser 3D. La fenêtre est constituée d’un système de microlentilles couplées à des micro-échafaudages. La méthode implique une polymérisation à deux photons (2PP) de la résine photosensible biocompatible SZ2080 dans une séquence continue, optimisant l’efficacité de la fabrication et l’alignement entre les différents composants.
Résumé
Dans le contexte des biomatériaux et des tests de médicaments sur des modèles animaux, cette étude présente un protocole rationalisé pour la fabrication d’une nouvelle fenêtre d’imagerie intégrée implantable. Le micro-dispositif comprend un système sophistiqué de microlentilles couplées à des micro-échafaudages spécialement conçus pour la quantification in vivo de la réponse immunitaire à l’aide de la microscopie d’excitation non linéaire avancée. Le protocole est basé sur la polymérisation à deux photons (2PP) de la résine photosensible biocompatible SZ2080, qui permet la fabrication de micro-échafaudages et de micro-lentilles dans une séquence continue pour améliorer l’efficacité et la précision de la fabrication. Pour améliorer encore la vitesse, la précision et l’intégrité structurelle, une approche de fabrication d’optiques hybrides a été mise en œuvre, impliquant le 2PP de la coque extérieure de la microlentille suivi d’une réticulation UV en vrac du noyau interne. Cette technique innovante permet d’optimiser les propriétés optiques des microlentilles tout en rationalisant le processus de production. Le micro-dispositif résultant présente une reproductibilité et une stabilité mécanique élevées, ce qui en fait une méthode efficace pour le prototypage de systèmes optiques à l’échelle microscopique pour une gamme d’applications biomédicales.
Introduction
La microscopie intravitale permet d’étudier les processus biologiques chez les animaux vivants par visualisation en temps réel. Lorsqu’il est combiné à des approches d’imagerie fluorescente non linéaire, il peut même atteindre une résolution à l’échelle subcellulaire1. Par conséquent, il est devenu un outil important dans de nombreux domaines, tels que les tests d’immunologie ou les études sur le cancer, où l’observation des cellules à l’intérieur de leur environnement physiologique réel est importante.
Les approches courantes pour les inspections intravitales, telles que les chambres de plis cutanés dorsaux ou les fenêtres d’imagerie crânienne et abdominale, sont très invasives et posent des difficultés pour les inspections à long terme du même point. Ainsi, de nouvelles approches d’imagerie in vivo qui réduisent la détresse des animaux et permettent un repositionnement facile de la vue optique sont fortement souhaitables2.
Dans ce cadre, il est possible de mettre en avant une nouvelle fenêtre d’imagerie miniaturisée basée sur un substrat de verre contenant un côté d’imagerie avec des microlentilles optiques et un côté de référence tissulaire avec des micro-échafaudages tridimensionnels (3D). Cette fenêtre d’imagerie miniaturisée peut être implantée « subcute » dans l’animal et fonctionnera comme un objectif de microscope « interne ». Le principe de fonctionnement de l’appareil sera d’utiliser les microlentilles couplées à un objectif de microscope externe à faible ouverture numérique (NA) pour réaliser une imagerie non linéaire in vivo des processus biologiques se déroulant à l’intérieur des échafaudages. Les microlentilles compensent l’aberration sphérique due à l’imagerie à travers un milieu non homogène comme le tissu 3,4, tandis que le micro-échafaudage entraîne la régénération tissulaire et agit comme des balises optiques 5,6,7, permettant ainsi l’inspection à long terme du même point.
Les composants de base de l’appareil, c’est-à-dire les micro-échafaudages et les micro-lentilles, ont déjà été démontrés séparément, mais leur intégration dans le même appareil présente plusieurs défis en raison de leur nature 3D, de leur taille micrométrique et de la nécessité d’avoir un alignement optique parfait entre eux. Les micro-échafaudages, constitués de grilles cuboïdes rectangulaires, de dimensions totales représentatives ~ 500 μm x 500 μm x 100 μm et de tailles de pores ~ 50 μm x 50 μm x 20 μm, peuvent guider le recrutement cellulaire et la nouvelle vascularisation, favorisant ainsi l’intégration tissulaire. De plus, en raison de leur autofluorescence, les micro-échafaudages fonctionnent comme une balise de fluorescence in situ, permettant ainsi un repositionnement et un alignement rapides au microscope et même une correction des aberrations sphériques lors de l’imagerie non linéaire pour permettre des observations longitudinales in vivo à haute résolution5. Les microlentilles à haute ouverture numérique, avec des profils sphériques ou quasi-paraboliques et des distances focales de quelques centaines de micromètres, ont démontré leurs capacités d’imagerie linéaire et non linéaire d’échantillons biologiques si elles sont combinées à un microscope confocal ou à deux photons 3,4.
Les microlentilles et les micro-échafaudages sont fabriqués par inscription laser 3D, également connue sous le nom de polymérisation à deux photons (2PP). En 2PP, un faisceau laser femtoseconde infrarouge est étroitement focalisé à l’intérieur d’une résine photosensible durcissable aux UV, et en raison de l’absorption de plusieurs photons au point focal, un voxel confiné de matériau polymérisé est créé avec une taille submicrométrique (~100 nm). En déplaçant le foyer laser par rapport à l’échantillon de résine photosensible, des structures tridimensionnelles du matériau polymérisé peuvent être obtenues après lavage du matériau non polymérisé8. Le processus a une résolution intrinsèquement élevée et une nature 3D qui permet l’acquisition de microstructures 3D, comme des échafaudages et des lentilles, avec une bonne stabilité et une qualité de surface élevée 9,10,11. Il existe différentes techniques pour la fabrication de micro-échafaudages poreux comme l’impression 3D, la nano-impression ou l’électrofilage 12,13,14,15. Toutes ces techniques souffrent d’un inconvénient majeur ; Ils ne sont pas en mesure d’atteindre des résolutions submicrométriques, ce qui donne des structures avec des pores dont la taille (~100 μm) est supérieure à la taille cellulaire, et n’imitent pas la matrice extracellulaire, ce qui est essentiel pour une bonne régénération des tissus. La fabrication de microlentilles peut être abordée par des méthodes basées sur la réplication de la lentille à partir d’un moule ou d’un masque comme le moulage par injection, le gaufrage à chaud ou le moulage UV, ou par des méthodes directes comme la refusion thermique, le gaufrage de microplastiques ou le jet de microgouttelettes16,17. Tous présentent des limitations sur la morphologie de surface qui peuvent être obtenues et sont difficiles à intégrer dans un flux de fabrication où les micro-échafaudages doivent également être fabriqués. D’autre part, le 2PP a démontré sa polyvalence pour la fabrication de composants optiques complexes 18,19, tels que des lentilles sphériques ou paraboliques, des lentilles diffractives, ou même des combinaisons de différentes lentilles dans le même composant optique 20,21,22,23,24. Dans ce cadre, le 2PP apparaît comme la meilleure technique pour la fabrication d’un ensemble contenant à la fois des lentilles et des micro-échafaudages.
Bien qu’il s’agisse d’un choix unique pour la réalisation de ces structures 3D avec une résolution micrométrique, le 2PP présente deux limitations principales, à savoir qu’il s’agit d’une approche qui prend du temps pour des structures de volume relativement grands, et qu’elle présente une profondeur de fabrication limitée (le long de l’axe optique) en raison de la courte distance de travail des objectifs de microscope utilisés pour une mise au point serrée.
Cet article propose un protocole unique pour la fabrication des micro-échafaudages et des microlentilles sur les côtés opposés d’un substrat de verre dans un processus d’irradiation en une étape longitudinale qui garantit un bon alignement des deux éléments et surmonte les limites de profondeur de fabrication. Le protocole est également optimisé pour le temps de fabrication ; d’une part, l’irradiation en une seule étape permet de gagner du temps d’alignement, et l’utilisation d’une approche hybride qui combine 2PP de la coque de l’objectif et le durcissement UV des photorésines internes réduit le temps d’irradiation pour les objectifs à grand volume25. La capacité de 2PP à fabriquer des structures 3D de forme libre permet l’utilisation de ce protocole pour toute conception de microlentilles et de micro-échafaudages, renforçant ainsi la méthode actuelle.
Protocole
Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation de l’échantillon
- Premier lancer (Figure 1A)
- Nettoyez à l’acétone sur les deux surfaces d’une lamelle en verre circulaire de 12 mm de diamètre (170 μm d’épaisseur).
- Séchez les deux surfaces avec de l’azote gazeux à température ambiante.
- Déposer une quantité contrôlée de 46 μL de résine photosensible liquide sur un côté de la lamelle en verre à l’aide d’une pipette volumique.
REMARQUE : Le matériau photosensible utilisé dans ce protocole est une résine photosensible hybride organique/inorganique biocompatible connue sous le nom de SZ2080, bien connue et validée pour les applications biomédicales26. Faites attention à laisser un anneau externe libre sur le substrat en verre. Étant exempt de résine photosensible, cet espace vitreux assure le bon maintien de l’échantillon à l’intérieur du support pour mieux aider à la préparation. - Laissez l’échantillon sous le capot chimique pendant 48 h pour permettre le séchage de la première goutte de résine photosensible par l’évaporation du solvant, atteignant l’état sol-gel.
- Deuxième lancer (Figure 1A)
- Lorsque la première goutte de résine photosensible atteint l’état sol-gel (étape 1.1.4.), retournez l’échantillon, exposant la surface propre.
- Placez l’échantillon sur un support en soulevant la première surface coulée du sol.
- Déposez une deuxième goutte de 46 μL de résine photosensible liquide sur la surface du verre propre, en laissant l’anneau externe ainsi qu’à l’étape 1.1.3.
- Laissez l’échantillon sous le capot chimique pendant au moins 48 h, en laissant le solvant s’évaporer.
REMARQUE : Après 4 à 6 jours, l’échantillon à double coulée est prêt à être utilisé pour le 2PP (Figure 1B). À partir de maintenant, veillez à ne pas exposer l’échantillon à la lumière ambiante en raison du matériau photosensible. L’exposition à la lumière dégrade la résine photosensible.
2. Polymérisation à deux photons (2PP) des microstructures
- Alignement de la configuration (Figure 2)
- Allumez la source laser proche infrarouge femtoseconde (longueur d’onde de 1030 nm, 1 MHz, avec une durée d’impulsion minimale = 230 fs).
REMARQUE : Réglez les paramètres laser tels que la largeur d’impulsion et le taux de répétition. - Alignez le trajet optique du faisceau laser jusqu’à ce qu’il atteigne l’objectif du microscope à travers une série d’optiques et de miroirs montés sur des montures de miroir cinématique. Faites pivoter les miroirs de manière itérative pour centrer le faisceau dans les sténopés d’alignement proche infrarouge (NIR).
REMARQUE : La distance de travail de l’objectif du microscope doit être supérieure à la hauteur totale de l’appareil final à fabriquer (hauteur de l’objectif + épaisseur de la lamelle de recouvrement + hauteur du micro-échafaudage). Les sténopés NIR sont correctement conçus pour simplifier l’alignement des faisceaux IR. Cela garantit un alignement précis du faisceau le long de la voie optique, en passant à travers des composants tels qu’une plaque demi-onde, un expanseur de faisceau et un miroir dichroïque. Pour contrôler automatiquement la puissance du laser, le faisceau passe à travers un polariseur horizontal et une plaque demi-onde, et le second est monté sur un rotateur motorisé. Si nécessaire, le faisceau peut passer à travers un expanseur de faisceau pour agrandir le diamètre du faisceau et remplir l’entrée arrière de l’objectif. - Dirigez le faisceau laser perpendiculairement au porte-échantillon en l’alignant à l’aide du centrage par réflexion arrière.
- Montez l’objectif du microscope à longue distance de travail sur le support dédié à l’extrémité du chemin optique, à proximité de l’échantillon (Figure 2).
REMARQUE : Une caméra CCD est montée au-dessus du miroir dichroïque aligné sur l’axe optique de l’objectif pour la surveillance du processus de fabrication. Il permettra de voir le point focal laser et les structures polymérisées.
- Allumez la source laser proche infrarouge femtoseconde (longueur d’onde de 1030 nm, 1 MHz, avec une durée d’impulsion minimale = 230 fs).
- Montage de l’échantillon
- Fixez (avec du ruban adhésif) la lamelle en verre à double chute sur le porte-échantillon monté sur les platines de translation. Montez l’échantillon avec la deuxième goutte déposée vers le bas.
REMARQUE : Le porte-échantillon a un trou central où l’échantillon peut être suspendu au sol étape5. Le support est relié à un système mécanique à cardan qui est vissé à une platine de translation X, Y pour le mouvement de l’échantillon. - Centrez l’échantillon manuellement avec l’objectif de microscope monté.
- Fixez (avec du ruban adhésif) la lamelle en verre à double chute sur le porte-échantillon monté sur les platines de translation. Montez l’échantillon avec la deuxième goutte déposée vers le bas.
- Centrage de l’échantillon
- Réglez la puissance laser sur la valeur minimale suffisante pour voir la réflexion du faisceau sur le logiciel de la caméra CCD (environ 5 mW).
REMARQUE : Mesurez la puissance laser à la pupille arrière de l’objectif (la transmission de l’objectif utilisé dans ce protocole est de 70 % à une longueur d’onde de 1030 nm.) - Allumez le logiciel d’interface opérateur pour le contrôleur de mouvement et la caméra CCD.
- Focalisez le faisceau laser sur la surface supérieure de la première goutte de résine photosensible.
- En suivant le profil incurvé de la goutte, déterminez les bords de l’échantillon le long des directions X et Y. Définissez le centre de la goutte comme référence de zéro absolu par le logiciel.
REMARQUE : La bande utilisée pour fixer l’échantillon joue un rôle dans la détection des bords en modifiant l’indice de réfraction, donc la réflexion du faisceau.
- Réglez la puissance laser sur la valeur minimale suffisante pour voir la réflexion du faisceau sur le logiciel de la caméra CCD (environ 5 mW).
- Compensation de l’inclinaison de l’échantillon
- Au centre de l’échantillon, focalisez le faisceau laser sur la surface d’interface entre la surface supérieure de la lamelle en verre et la base de la première goutte de résine photosensible. Définissez-la comme référence zéro sur l’axe Z.
- Compte tenu du diamètre de l’échantillon, déplacez-vous vers la position du bord (pour la lamelle de 12 mm, elle est de ~ - 4 mm) dans la direction négative de l’axe X. Dans cette position, concentrez la surface d’interface (entre le verre et la goutte supérieure de résine photosensible) et définissez-la comme référence zéro absolu le long de la direction verticale Z.
- Se déplacer vers la position du bord dans la direction positive de l’axe X (pour la lamelle de 12 mm, elle est de ~ + 4 mm). Trouvez ici la surface d’interface déplaçant l’objectif le long de la direction verticale Z.
- Inclinez l’échantillon pour corriger l’écart dans la direction Z entre les positions négative et positive le long de l’axe X. Utilisez un support cinématique réglable pour l’inclinaison du porte-échantillon (comme un cardan).
- Répétez les étapes 2.4.2 à 2.4.4 de manière itérative jusqu’à ce que l’échantillon soit complètement équilibré sur l’axe X.
- Effectuez la même procédure que celle décrite aux étapes 2.4.2 à 2.4.5 dans la direction Y.
- Une fois que l’échantillon est parfaitement équilibré sur les axes plans X et Y, revenez à la position centrale et concentrez l’interface entre le verre et la résine photosensible à ce point.
- Définissez la nouvelle valeur Z du focus comme référence sur l’axe Z (Z = 0).
REMARQUE : La procédure de l’étape 2.4 vise à assurer la perpendicularité parfaite entre le faisceau laser et la surface de la lamelle pour assurer un ancrage parfait des structures 2PP qui seront fabriquées ultérieurement. À partir de la version 2.4, toutes les procédures doivent être effectuées en fonction de l’indice de réfraction. Par conséquent, ajoutez le support de correspondance indicielle de l’objectif si nécessaire.
- Micro-échafaudages 2PP sur la chute de résine photosensible inférieure
- Allumez un système d’éclairage LED rouge pour une surveillance en temps réel du processus de polymérisation.
REMARQUE : Une diode électroluminescente rouge est placée sous le cardan complexe du porte-échantillon (Figure 2). Cet éclairage permettra de voir le volume polymérisé pendant le processus 2PP. La résine photosensible est sensible aux longueurs d’onde plus courtes (lumière visible) ; par conséquent, le voyant LED rouge ne va pas perturber l’échantillon. - Avec le laser éteint, déplacez l’objectif le long de la direction Z sous la lamelle de verre pour trouver la deuxième surface d’interface entre la surface inférieure du verre et la base de la goutte inférieure de la réserve.
REMARQUE : La deuxième interface se trouve à une valeur Z approximativement égale à l’épaisseur de la lamelle (170 μm). - Augmentez la puissance du laser jusqu’à 100 mW pour permettre la polymérisation à deux photons dans la chute inférieure.
- Réglez la position focale (en augmentant Z) pour trouver la deuxième interface en polymérisant une structure de référence simple.
REMARQUE : Un exemple de structure de référence est une ligne polymérisée de 50 μm de long. - Définissez la première position focale où la polymérisation de la structure de référence a lieu en tant que référence zéro le long de la direction verticale (axe Z).
REMARQUE : La référence à l’étape 2.5.5 souligne le plan de base pour le 2PP des micro-échafaudages. - Réglez les puissances de polymérisation (~ 100-200 mW) et exécutez le code machine en tant que programme de commande numérique par ordinateur (CNC) pour le mouvement correct des étapes de translation afin de fabriquer la structure 3D souhaitée (Figure 3A).
REMARQUE : Le programme CNC est constitué d’un ensemble de coordonnées spatiales (x, y, z) qui déterminent la direction dans laquelle les plates-formes de translation se déplacent pour produire l’objet 3D final. Ces pouvoirs de polymérisation seront influencés par la hauteur de la chute supérieure et les conditions expérimentales spécifiques (photorésine, laser et système de mouvement).
- Allumez un système d’éclairage LED rouge pour une surveillance en temps réel du processus de polymérisation.
- Microlentilles 2PP sur la tige photosensible goutte
- En vous déplaçant le long de l’axe Z, revenez à la première interface entre la surface supérieure du verre et la goutte supérieure de résine photosensible (étape 2.4.8). Maintenir le même système de référence planaire (coordonnées X, Y) pour assurer un alignement parfait des microlentilles 2PP avec les microstructures déjà fabriquées.
- Trouvez l’interface en polymérisant une structure de référence simple.
REMARQUE : Utilisez le même processus décrit à l’étape 2.5.4, mais ne différant que par la direction du mouvement vertical. - Définissez la première ligne de polymérisation comme référence zéro le long de la direction verticale (axe Z).
REMARQUE : La référence à l’étape 2.6.3 souligne le plan de masse pour le 2PP des microlentilles. - Réglez les paramètres de fabrication pour le 2PP du contour de la microlentille souhaitée (Figure 3B). Le faisceau laser décrit une trajectoire circulaire dont le rayon diminue pour polymériser en continu la surface externe d’une seule microlentille. Définissez les paramètres de hachures et de découpage le long des directions X et Z, respectivement.
REMARQUE : La conception des objectifs doit tenir compte de la distance focale effective souhaitée par l’utilisateur. En règle générale, il doit s’agir d’une valeur supérieure à l’épaisseur de la lamelle, et il doit permettre d’imager l’ensemble de l’atlas. Une simulation informatique préliminaire du système optique final est recommandée. - Réglez la puissance de polymérisation (~ 15-20 mW) et lancez le programme qui guide le mouvement des étapes de translation.
REMARQUE : Ces puissances de polymérisation seront influencées par la hauteur de la chute supérieure, les conditions expérimentales spécifiques et la conception de la microlentille souhaitée (Figure 3B). La figure 4 présente un exemple représentatif de microlentille parabolique avec la fonction paramétrique qui décrit le profil de la microlentille et ses principales caractéristiques géométriques.
3. Développement de l’échantillon
- Retirez l’échantillon de l’installation de fabrication expérimentale.
- Avec le laser éteint, désactivez les axes de translation X, Y et Z et retirez le support.
- Décollez le ruban adhésif et détachez l’échantillon du support.
REMARQUE : Avant le développement de l’échantillon, veillez à ne pas exposer l’échantillon à la lumière ambiante en raison du matériau photosensible. L’exposition à la lumière réticulerait toute la quantité de résine photosensible.
- Développement de l’échantillon (figure 5A)
- Placez l’échantillon dans un support approprié pour le soulever du sol et maintenez-le en position horizontale.
REMARQUE : Ce porte-échantillon est un support d’échantillons personnalisé imprimé SLA correctement conçu pour exposer à la fois les surfaces prototypées 2PP à la solution de développement5. - Préparez un bécher de 50 ml et placez-y le support portant l’échantillon.
REMARQUE : Faites attention à maintenir les microlentilles 2PP sur la surface supérieure pour éviter toute déformation structurelle pendant le développement en raison de leur noyau interne non polymérisé. - Remplissez le bécher avec ~20 mL de solution de développement, en recouvrant complètement l’échantillon. La solution est composée de 50 % (v/v) de 2-pentanone et de 50 % (v/v) d’alcool isopropylique.
- Laissez l’échantillon à l’intérieur de la solution de développement pendant 45 min.
- Placez l’échantillon dans un support approprié pour le soulever du sol et maintenez-le en position horizontale.
- Lavage d’échantillons
- Levez le soutien de la solution en développement.
- En le manipulant manuellement ou à l’aide d’une pince à épiler, prélevez l’échantillon et lavez-le soigneusement avec quelques gouttes d’alcool isopropylique.
- Séchez les deux surfaces fabriquées de la lamelle en verre avec un léger écoulement d’azote (à température ambiante).
REMARQUE : Toutes les procédures décrites aux étapes 3.2 et 3.3 sont effectuées sous une hotte chimique.
4. Irradiation UV de l’échantillon
- Exposition des microlentilles au rayonnement UV (longueur d’onde de 385 nm) (Figure 5B)
- Placez la lamelle en verre sur un porte-échantillon suspendu au plan de masse. Posez l’échantillon avec les microlentilles vers le bas.
REMARQUE : Le porte-échantillon a un trou central pour placer l’échantillon suspendu à la scène du sol, préservant ainsi l’intégrité de la microstructure sur la surface inférieure. - Préparez une lampe UV d’une longueur d’onde de 385 nm.
- Placez l’échantillon sous la source UV de manière perpendiculaire par rapport à la surface de la lamelle de verre.
- Exposer l’échantillon à un rayonnement UV réglé à 300 mW pendant 120 s.
REMARQUE : L’exposition aux UV se produit en passant à travers le micro-échafaudage et le substrat de verre. De cette façon, le noyau non encore polymérisé des lentilles sera réticulé aux UV, évitant ainsi une exposition directe et supplémentaire à la surface préalablement polymérisée. - En titrant la source UV à -45° et +45° par rapport à la position normale du plan d’échantillonnage, répétez l’étape 4.1.4.
REMARQUE : Cette exposition UV en trois étapes à différents angles permettra de réticuler complètement l’ensemble de la réserve non polymérisée dans le volume des micro-lentilles, assurant ainsi la stabilité. Ceci est particulièrement important pour les microlentilles larges. - Retirez l’échantillon du support et rangez-le.
- Placez la lamelle en verre sur un porte-échantillon suspendu au plan de masse. Posez l’échantillon avec les microlentilles vers le bas.
5. Caractérisation morphologique
- Acquisitions par microscopie électronique à balayage (MEB) (Figure 6)
- Préparez la station SEM. Fixez un morceau de ruban de carbone au support SEM pour assurer l’adhérence de l’échantillon.
- Placez l’échantillon de verre sur le support à 45° par rapport à l’orientation de la caméra MEB. Veillez à fixer l’échantillon dans un espace vide sur la lamelle pour préserver l’intégrité de la structure (Figure 6B).
- Répétez l’acquisition comme à l’étape 5.1.2 pour les deux surfaces de la lamelle en verre afin de collecter des images MEB 3D des micro-échafaudages et des microlentilles (Figure 6A,C).
- Détachez soigneusement l’échantillon du ruban de carbone et rangez-le dans une boîte couverte.
Résultats
Un protocole pour la fabrication d’un dispositif microstructuré implantable double face contenant un système optique et une référence d’analyse tissulaire a été fourni. Le procédé exploite la polymérisation laser à deux photons pour fabriquer des microstructures 3D et des micro-optiques sur le côté opposé du même substrat. L’utilisation d’un objectif à longue distance de travail permet de fabriquer les deux structures sans retourner le substrat, ce qui permet d’économiser l’étape de réalignement et de garantir un alignement parfait entre les deux composants. Ce dispositif permettra une imagerie in situ avancée en permettant la correction des aberrations optiques et les observations répétées d’une même zone, grâce à des micro-optiques et à un cadre de référence microfabriqué. La figure 1 montre la procédure de préparation des deux surfaces du substrat de support pour la fabrication ultérieure. Une esquisse du dispositif expérimental utilisé pour microfabriquer les deux surfaces de l’échantillon est représentée à la figure 2. L’image montre également le porte-échantillon complexe de l’objectif, le premier se concentrant sur l’échantillon éclairé par un système d’éclairage LED rouge, permettant une surveillance en temps réel de la fabrication à l’aide de la vision industrielle. La figure 3 démontre qualitativement la flexibilité du protocole pour permettre la microfabrication de divers modèles de micro-échafaudages et de microlentilles. La figure 4 met en évidence la fonction d’affaissement utilisée pour concevoir une microlentille avec un profil parabolique asphérique et un croquis d’un dessin représentatif corrélé à ses principales caractéristiques à titre d’exemple. La figure 5 présente les étapes de développement de l’échantillon et d’exposition aux UV nécessaires pour réticuler complètement le volume total des microlentilles. Enfin, la figure 6 présente des exemples de résultats de microfabrication. Le procédé présenté permet la polymérisation de microstructures 3D des deux surfaces d’un même dispositif, assurant ainsi une excellente résolution et stabilité. Enfin, la figure 7 est une illustration représentant le flux de travail général du protocole, se terminant par la figure 8, qui montre un exemple d’application finale du dispositif proposé, c’est-à-dire l’imagerie in vitro de cellules cultivées à l’intérieur du micro-échafaudage.

Figure 1 : Protocole de préparation des échantillons. Cette image montre une esquisse du procédé en deux étapes pour le moulage en goutte de résine photosensible sur une lamelle de verre circulaire de support (A). Sur la droite, une photo de l’échantillon avec la résine photosensible séchée déposée des deux côtés est rapportée (B). L’échantillon est soutenu par le porte-échantillon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
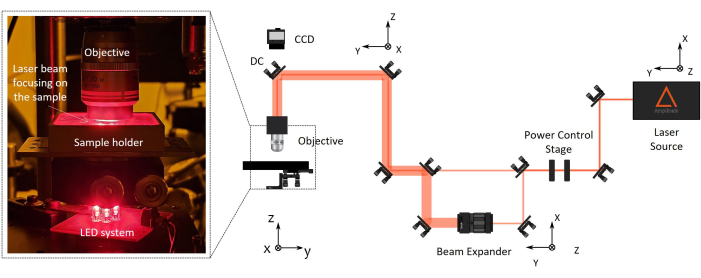
Figure 2 : Configuration de fabrication de polymérisation laser à deux photons (2PP). Sur la droite, un schéma représentatif de la configuration de fabrication est présenté. Les principaux composants de la configuration sont une source laser femtoseconde d’une longueur d’onde de 1030 nm, d’une largeur d’impulsion minimale de 230 fs et d’un taux de répétition de 1 MHz), d’un étage de contrôle de puissance, d’un expanseur de faisceau, d’un miroir dichroïque et d’un objectif de microscope à haute ouverture numérique (100x, NA 1.1). Une caméra CCD est montée au-dessus du miroir dichroïque aligné sur l’axe optique de l’objectif pour la surveillance du processus de fabrication. Sur la gauche, il y a un agrandissement, avec le zoom de la dernière partie de la configuration optique montrant une photographie du système complexe d’objectif/porte-échantillons/éclairage LED pour la vision industrielle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
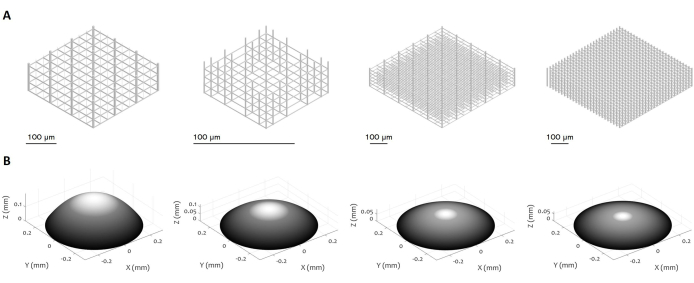
Figure 3 : Multiples conceptions de microstructures et de microlentilles 3D. La figure présente divers exemples de (A) micro-échafaudages et (B) de microlentilles qui peuvent être fabriqués à l’aide de la procédure proposée. La grande flexibilité du protocole permet la fabrication de microstructures avec une variété de caractéristiques géométriques, de résolution, de dimensions et de volumes, démontrant ainsi sa polyvalence. L’échelle de gris dans le panneau (B) vise à mettre en évidence la diminution de la puissance du laser et de la vitesse d’écriture pour lisser la surface et minimiser la rugosité de la surface. Des paramètres précis de fabrication sont définis en fonction de la conception spécifique de la microlentille. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Exemple de microlentille fabriquée. Le panneau montre un exemple représentatif d’un profil parabolique asphérique mettant en évidence la description paramétrique de la surface incurvée de la lentille comme fonction d’affaissement z (r) (A). Ici, Htot est l’épaisseur de la lentille, r est la coordonnée radiale et fn est la distance focale d’une lentille réfractive parabolique qui diffère de sa distance focale effective. La puissance dioptrique est déterminée par l’indice de réfraction de la lentille et par la façon dont elle diffère de celle du milieu environnant. À droite, l’esquisse met en évidence les deux plans principaux situés au sommet V1 et à quelques μm au-dessus de la surface 2 (Π1 et Π2, lignes pointillées) (B). Le croquis montre une seule microlentille parabolique asphérique d’un diamètre de 600 μm et fabriquée sur un substrat de verre N-BK7 (d’une épaisseur de 170 μm). (C) souligne les paramètres géométriques de la lentille parabolique asphérique microfabriquée dans la résine photosensible SZ2080. Veuillez cliquer ici pour voir une version agrandie de cette figure.
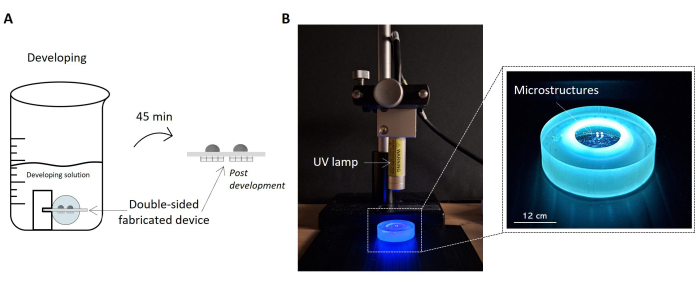
Figure 5 : Protocoles de développement des échantillons et d’exposition aux UV. L’image met en évidence l’échantillon fabriqué trempé dans la solution de développement sous la forme d’un croquis (A). L’échantillon est soulevé à l’intérieur de la solution par le support, ce qui permet le bon développement des deux côtés de l’échantillon et l’obtention du dispositif microstructuré double face. Sur la droite, une image de la configuration de la configuration pour l’irradiation UV de l’échantillon est présentée (B). L’image montre la lampe UV positionnée perpendiculairement à la surface de l’échantillon. Comme indiqué dans la fiche technique de la lampe UV, la distance de courant entre la lampe et l’échantillon est cohérente avec la distance de fonctionnement de la lampe. L’échantillon soumis à un rayonnement UV et manipulé par le porte-échantillon est mis en évidence dans l’image agrandie à droite. Barre d’échelle : 12 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Acquisitions par microscopie électronique à balayage (MEB) de résultats représentatifs de fabrication. Le panneau met en évidence un dispositif fabriqué à double face à travers une vue latérale (B) et deux résultats représentatifs de microlentille fabriquée (A) et de micro-échafaudage (C) par des images MEB. Les deux constructions posées sur des faces différentes du même substrat de verre sont clairement visibles sur l’image centrale (B). Les microlentilles sont représentées sur la surface inférieure du verre, tandis que les micro-échafaudages sont sur la surface supérieure. L’image MEB d’une microlentille fabriquée avec une conception sphérique est illustrée à droite comme exemple du résultat stable et lisse de la fabrication (A). Sur la gauche, l’image met en évidence un résultat représentatif d’un micro-échafaudage poreux de 2PP à géométrie arbitraire (C). Barres d’échelle : (A,C) - 50 μm ; (B) - 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
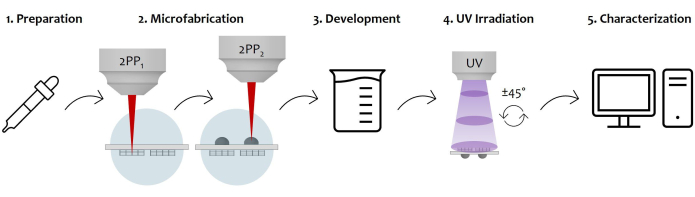
Figure 7 : Schéma de principe du flux de travail du protocole et de l’application du dispositif : La figure montre l’ensemble du processus de fabrication esquissé étape par étape. Cela commence par la préparation de l’échantillon par coulée séquentielle de photorésine sur les deux surfaces du substrat de verre (1). Une fois que la résine photosensible atteint un état sol-gel, l’échantillon est prêt à être fabriqué par polymérisation laser à deux photons (2). Par conséquent, les deux gouttes de résine photosensible sont irradiées séquentiellement, en microstructurant d’abord les microstructures, puis les microlentilles. Ensuite, le substrat microfabriqué double face subit une procédure de développement pour éliminer tous les résidus non polymérisés entourant les constructions (3). Pour ce faire, l’échantillon est trempé dans une solution alcoolisée, puis séché doucement. Suit l’irradiation UV de l’échantillon en passant à travers le substrat vitreux pour réticuler complètement le noyau interne non polymérisé des microlentilles (4). Enfin, un contrôle qualité de l’échantillon microfabriqué est effectué par acquisition de microscopie électronique à balayage (MEB) afin de caractériser morphologiquement les microstructures (5). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Application potentielle de la fenêtre d’imagerie microstructurée. À gauche, un croquis représentatif illustre le système optique constitué par le dispositif couplé à un objectif de microscope externe dans un système de balayage standard (A). Il s’agit de la configuration dite virtuelle utilisée dans ce cas pour l’imagerie de la croissance des cellules vivantes à l’intérieur du micro-échafaudage. Des fibroblastes de fluorescence (marqués Red Fluorescence Protein (RFP)) ont été ensemencés sur la surface en verre du dispositif, qui porte les microstructures 3D. Des images confocales en fluorescence des cellules ont été prises au niveau du plan focal de la lamelle de verre (B, hashtag vert), donc avec la seule utilisation de l’objectif externe, et à travers une seule microlentille à son plan focal (A, hashtag violet). Les noyaux cellulaires sont visibles en bleu (coloration de Hoechst) et le cytosquelette en rouge (RFP). Barres d’échelle : (B) - 100 μm ; (C) - 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Pour assurer une imagerie précise de la zone souhaitée 3,6 dans la fenêtre microstructurée, il est obligatoire d’avoir un alignement précis des deux structures (micro-échafaudage et micro-lentilles). Cela pose le principal défi du protocole proposé, car la haute résolution de 2PP est étroitement liée à une limitation de la profondeur de fabrication 3,6. Retourner l’échantillon pendant la fabrication pour exposer séquentiellement les deux surfaces au faisceau laser peut être une option, mais cela complique le réalignement et prend du temps5. Cela entraînerait également des difficultés à trouver le même système de référence et compromettrait ainsi le bon alignement entre les composants micro-optiques et les micro-échafaudages. La conduite de l’ensemble du processus en continu sans démonter l’échantillon permet de maintenir un système de référence cohérent, facilitant et garantissant ainsi un alignement précis des structures. Pour ce faire, nous utilisons un objectif à longue distance de travail (2,5 mm) qui maintient une bonne résolution grâce à sa grande ouverture numérique (étape 1.1). Cette approche réduit également considérablement le temps de fabrication, car elle permet d’économiser l’alignement de l’échantillon après son retournement3. De plus, la manipulation des échantillons pose un autre défi en raison de leur petite taille et de leur fragilité, ce qui rend la manipulation et l’alignement précis encore plus critiques.
Dans les procédés 2PP, une étude approfondie du processus de fabrication est essentielle pour établir des paramètres clés tels que la longueur d’onde laser optimale, la largeur d’impulsion ainsi que les puissances laser et les mouvements de la platine 9,10,11. Par conséquent, une caractérisation complète du processus 2PP, même en tenant compte des différentes configurations du dispositif expérimental pour garantir d’abord des structures 3D hautement stables et à haute résolution avec des détails à l’échelle cellulaire pour des applications biologiques, a été effectuée 27,28,29,30. De plus, la minimisation de la rugosité de surface des microlentilles implantables était cruciale pour obtenir des micro-optiques de haute qualité avec les caractéristiques optiques souhaitées, réduisant ainsi la réponse immunologique à l’implant 19,22,31. Par conséquent, le défi du processus consiste à ajuster des paramètres tels que la puissance et la largeur d’impulsion en fonction de facteurs expérimentaux tels que l’indice de réfraction et le volume du matériau photosensible, les conditions environnementales (par exemple, l’humidité et la température) et l’efficacité du laser. Une caractérisation approfondie a également été nécessaire pour le temps et l’intensité de l’exposition aux UV afin de réticuler complètement tout le volume des microlentilles, assurant ainsi leur stabilité. Ces paramètres doivent être adaptés à la source UV, à la distance de fonctionnement et au volume spécifique de l’élément à polymériser par UV.
L’une des principales limites du procédé 2PP est son faible débit en raison de la résolution extrêmement élevée qu’il offre. Étant donné que les caractéristiques polymérisées sont très petites, de centaines de nanomètres à quelques micromètres 9,26. Par conséquent, les temps de fabrication augmentent considérablement lors de la production de structures à l’échelle de centaines de micromètres, qui sont relativement grandes par rapport aux normes 2PP, surtout s’il s’agit de structures volumineuses. Par conséquent, la création d’appareils intégrés avec plusieurs structures de telles dimensions peut prendre plusieurs heures. Dans ce cadre, le protocole hybride UV-2PP proposé pour la fabrication de microlentilles a permis de réduire de 98 % le temps de fabrication d’une seule microlentille par rapport au 2PP de son volume total. Cela a permis d’augmenter la précision du balayage 2PP de la coque extérieure de la microlentille, réduisant ainsi la rugosité de la surface tout en obtenant une coque de microlentille suffisamment épaisse pour assurer la stabilité de l’objectif, le tout dans un délai de fabrication tolérable. Pour accélérer encore le processus, une approche de parallélisation sera proposée à l’avenir pour permettre l’écriture simultanée de plusieurs structures32. Cette stratégie impliquerait de diviser le faisceau laser en plusieurs faisceaux pour créer plusieurs points focaux, permettant une fabrication parallèle et réduisant ainsi considérablement le temps de production global.
Contrairement aux techniques de lithographie douce les plus courantes, l’un des principaux avantages du 2PP est qu’il s’agit d’une approche de fabrication additive sans masque qui permet la fabrication de structures arbitraires dans un volume de matériau photosensible11. Cette capacité permet la production de structures tridimensionnelles et poreuses complexes à fort potentiel de personnalisation. De plus, basé sur le principe de l’absorption non linéaire, le 2PP permet d’atteindre une résolution inférieure à la limite de diffraction, ce qui est impossible avec les techniques d’impression 3D standard ou la modélisation par dépôt de fil fondu (FDM) à titre d’exemple33. Ceci est particulièrement précieux pour créer des échafaudages 3D poreux avec des caractéristiques à l’échelle cellulaire pour soutenir la croissance cellulaire, le recrutement et l’intégration tissulaire.
La production de dispositifs implantables microstructurés avec optique intégrée par le procédé proposé ici a le potentiel d’avoir un impact significatif sur les applications couvrant la mécanobiologie, la modélisation des maladies in vitro et l’ingénierie tissulaire (Figure 7 et Figure 8). Le protocole présenté permet la fabrication d’un dispositif technique de haute qualité doté de microstructures qui favorisent l’intégration tissulaire tout en servant simultanément de points de référence d’imagerie in vivo . De plus, ces microlentilles correctement conçues ont amélioré l’imagerie non linéaire avancée en corrigeant les aberrations sphériques causées par le tissu entourant l’implant4. La polyvalence du processus, en effet, nous permet d’ajuster la conception de l’appareil, par exemple, pour créer des échafaudages et des structures de référence avec une géométrie optimisée pour des applications spécifiques, aidant à la fois aux reconstructions 3D et à la correction des aberrations d’imagerie en post-traitement. Enfin, l’adaptation de la conception des microlentilles en fonction des indices de réfraction tissulaire améliore l’imagerie spécifique à l’application, créant efficacement une lentille optique in situ au sein du dispositif.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a reçu un financement de l’Union européenne dans le cadre du programme de recherche et d’innovation Horizon 2020 (G.A. n° 964481-IN2SIGHT).
matériels
| Name | Company | Catalog Number | Comments |
| Beam Expander | Thorlabs, Germany | GBE03-C | 3X Achromatic Galilean Beam Expander, AR Coated: 650 - 1050 nm (GBE03-C) |
| Controlled Motorized Rotator | Aerotech, USA | MPS50GR | MPS50GR-TTM-G80-DC-LMO-PLOTS |
| Coverslips | Menzel-Glaser, Germany | CB00120RA1 | 12 mm diameter circular glass coverslip with a thickness between 170 and 230 µm (#1.5) |
| Development solution | Sigma Aldrich, USA. | Custom Solution | 50% v/v 2-pentanone, 50% v/v isopropyl alcohol solution |
| Dichroic Mirror (1030 nm) | Eskma Optics, Lithuania | 810-1030D | Ø1" Shortpass Dichroic Mirror, 805 nm Cutoff |
| Femtosecond laser | Satsuma, Amplitude | Satsuma Series | Femtosecond Ytterbium (Yb) fiber laser (λ = 1030nm, 1MHz, with minimum pulse duration = 230 fs, |
| Gimbal | Thorlabs, Germany | GMB100 | Gimbal Mounts 100 |
| Half wave plate | Thorlabs, Germany | AHWP05M-980 | λ/2 at 690-1200 nm (AHWP05M-980) |
| Machine vision | Thorlabs, Germany | DCU223M/DCU223C | CCD camera mounted behind a dichroic mirror |
| Microscope Objective | Nikon, Japan | MRD71100 | CFI plan 100×C WI objective with a numerical aperture 1.1 |
| Movement system | Aerotech, USA | ANT130-035-L-ZS; ANT95-50-XY | ANT130-035-L-ZS; ANT95-50-XY |
| NIR Alignment Pinhole | Thorlabs, Germany | VRC1D1 | Ø1" Disk made from slow-fading phosphor material with a 1.5 mm hole in the center |
| Photoresist SZ2080 | Forth, Greece | SZ2080 | UV curable photoresist SZ2080+Irgacure-369 Photoiniziator |
| Pipette | Gilson, USA | F123615 | Pipetman 100G |
| Scanning electron Microscope (SEM) | Phenom World, Netherlands | Phenom Pro | PHENOM PRO |
| Software CNC | Aerotech, USA | A3200 | Automation 3200 CNC Operator Interface |
| UV Lamp | Hamamatsu, Japan | LC-L1V3 | LIGHTNINGCURE ,LC-L1V3 |
Références
- Sadakane, O., et al. In vivo two-photon imaging of dendritic spines in marmoset neocortex. eNeuro. 2 (4), 1-10 (2015).
- Prunier, C., Chen, N., Ritsma, L., Vrisekoop, N. Procedures and applications of long-term intravital microscopy. Methods. 128, 52-64 (2017).
- Marini, M., et al. Microlenses fabricated by two-photon laser polymerization for cell imaging with non-linear excitation microscopy. Adv Funct Mater. 33 (39), 202213926(2023).
- Kariman, B. S., et al. High dioptric power micro-lens fabricated by two-photon polymerization. Opt Express. 32 (27), 48114-48131 (2024).
- Conci, C., et al. Advanced optical materials. Adv Opt Mater. 10 (7), e2101103(2022).
- Conci, C., et al. In vivo label-free tissue histology through a microstructured imaging window. APL Bioeng. 8 (1), 016107(2024).
- Dondossola, E., et al. Examination of the foreign body response to biomaterials by non-linear intravital microscopy. Nat Biomed Eng. 1 (1), 1-10 (2017).
- Lee, K. S., Kim, R. H., Yang, D. Y., Park, S. H. Advances in 3D nano/microfabrication using two-photon initiated polymerization. Prog Polym Sci. 33 (6), 631-681 (2008).
- LaFratta, C. N., et al. Multiphoton fabrication. Angew Chem Int Ed. 46 (33), 6238-6258 (2007).
- Malinauskas, M., et al. Ultrafast laser nanostructuring of photopolymers: A decade of advances. Phys Rep. 533 (1), 1-31 (2013).
- Zyla, G., Farsari, M. Frontiers of laser-based 3D printing: A perspective on multi-photon lithography. J Laser Micro/Nanoeng. 19 (1), 1-12 (2024).
- Eltom, A., Zhong, G., Muhammad, A. Scaffold techniques and designs in tissue engineering functions and purposes: A review. Adv Mater Sci. Eng. 2019, 3429527(2019).
- Yang, X., et al. Additive manufacturing of polymer-derived ceramics. Adv Powder Metall Part Mater. 351 (6268), 716-725 (2020).
- Cai, Y. Z., et al. Novel biodegradable three-dimensional macroporous scaffold using aligned electrospun nanofibrous yarns for bone tissue engineering. J Biomed Mater Res. 100 A (5), 1187-1194 (2012).
- Nandakumar, A., et al. A fast process for imprinting micro and nanopatterns on electrospun fiber meshes at physiological temperatures. Small. 9 (20), 3405-3409 (2013).
- Yuan, W., et al. Fabrication of microlens array and its application: A review. Chin J Mech Eng. 31 (1), 20(2018).
- Cai, S., et al. Microlenses arrays: Fabrication, materials, and applications. Microsc Res Tech. 84 (11), 2784-2806 (2021).
- Vaezi, M., et al. A review on 3D micro-additive manufacturing technologies. Int J Adv Manuf Technol. 67 (5-8), 1721-1754 (2013).
- Guo, R., et al. Microlens fabrication by means of femtosecond two-photon photopolymerization. Opt Express. 14 (2), 810(2006).
- Malinauskas, M., et al. A femtosecond laser-induced two-photon photopolymerization technique for structuring microlenses. J Opt. 12 (3), 035204(2010).
- Siegle, L., et al. Complex aspherical singlet and doublet micro-optics by grayscale 3D printing. Opt Express. 31 (3), 4179(2023).
- Gissibl, T., et al. Two-photon direct laser writing of ultracompact multi-lens objectives. Nat Photonics. 10 (8), 554-560 (2016).
- Thiele, S., et al. 3D printed stacked diffractive microlenses. Opt Express. 27 (24), 35621(2019).
- Balli, F., et al. A hybrid achromatic metalens. Nat Commun. 11 (1), 17646(2020).
- Gonzalez-Hernandez, D., et al. Laser 3D printing of inorganic free-form micro-optics. Photonics. 8 (12), 577(2021).
- Ovsianikov, A., et al. Ultra-low shrinkage hybrid photosensitive material for two-photon polymerization microfabrication. ACS Nano. 2 (11), 2257-2262 (2008).
- Madden, L. R., et al. Proangiogenic scaffolds as functional templates for cardiac tissue engineering. Proc Natl Acad Sci USA. 107 (34), 15211-15216 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomater. 9 (1), 4579-4584 (2013).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Ovsianikov, A., Mironov, V., Stampf, J., Liska, R. Engineering 3D cell-culture matrices: Multi-photon processing technologies for biological and tissue engineering applications. Expert Rev Med Devices. 9 (6), 613-633 (2012).
- Noskovicova, N., Hinz, B., Pakshir, P. Implant fibrosis and the underappreciated role of myofibroblasts in the foreign body reaction. Cells. 10 (7), 1794(2021).
- Zandrini, T., et al. Multi-foci laser microfabrication of 3D polymeric scaffolds for stem cell expansion in regenerative medicine. Sci Rep. 9 (1), 1-9 (2019).
- Rey, F., et al. Advances in tissue engineering and innovative fabrication techniques for 3D structures: Translational applications in neurodegenerative diseases. Cells. 9 (7), 1636(2020).
Erratum
Formal Correction: Erratum: Microfabrication of Implantable Optics Integrated in a Microstructured Imaging Window for Advanced In Vivo Imaging
Posted by JoVE Editors on 6/04/2025. Citeable Link.
This corrects the article 10.3791/67975
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon