Method Article
مراقبة الديناميكيات التوافقية للبروتينات المفردة غير المعدلة باستخدام نساقطات النوتوزان البلازمونية
In This Article
Summary
تستخدم المثقلة النانوية البلازمونية رنين البلازمون السطحي الموضعي في الهياكل النانوية الذهبية لاحتجاز الجسيمات النانوية المفردة ، بما في ذلك البروتينات ، داخل مجال بصري بمقياس نانومتر. تكشف التغييرات في الإشارة المتناثرة عن وجود البروتين والديناميكيات التوافقية ، مما يتيح المراقبة دون تعديلات الفلوروفور أو الربط السطحي.
Abstract
عادة ما تتطلب تقنيات الجزيء الفردي الحالية لتوصيف البروتينات ملصقات أو حبال أو استخدام ظروف محلول غير أصلية. يمكن لمثل هذه التغييرات أن تغير الفيزياء الحيوية للبروتين وتقلل من فائدة البيانات التي تم الحصول عليها. النساقط النانوي البلازموني هو تقنية تستخدم رنين البلازمون السطحي الموضعي (LSPR) على الهياكل النانوية الذهبية لتعزيز المجال الكهربائي داخل منطقة النقطة الساخنة المحصورة. يسمح هذا التحسين الميداني باستخدام قوى ليزر منخفضة لاحتجاز الجسيمات النانوية المفردة أصغر بكثير من الملقط البصري التقليدي ، وصولا إلى قطر بضعة نانومترات فقط ، مثل البروتينات المفردة. يؤدي محاصرة جزيئات البروتين المفردة داخل منطقة النقطة الساخنة إلى حدوث تحول في معامل الانكسار المحلي (نبروتين > نماء) ، مما يؤدي إلى تغيير تشتت الضوء كمنتج لقابلية استقطاب الجزيء ، والتي تتأثر بحجمه وتباين شكله ومعامل الانكسار. يجمع الصمام الثنائي الضوئي للانهيار الجليدي (APD) التغييرات اللاحقة في تشتت الضوء. يمكن بعد ذلك تحليل هذه التعديلات لتحديد التغيرات في الجزيء المحاصر ، بما في ذلك حجمه وتكوينه العالمي وديناميكيات التغيير التوافقي بمرور الوقت. يسمح دمج الموائع الدقيقة داخل النظام بالتغيرات البيئية الخاضعة للرقابة والمراقبة في الوقت الفعلي لتأثيراتها اللاحقة على الجزيء. في هذا البروتوكول ، نوضح خطوات حبس جزيئات البروتين الفردي ، وتغيير ظروف المحلول البيئي ، ومراقبة التغييرات التوافقية المقابلة لها باستخدام نظام الوقود النانوي البلازموني.
Introduction
تشمل التقنيات الحالية أحادية الجزيء لاستجواب ديناميكيات مطابقة البروتين الطرق القائمة على الملصقات مثل نقل طاقة الرنين الفلوري (FRET) 1،2 ، والأساليب القائمة على الربط مثل الملقط البصري3،4 والفحص المجهري للقوة الذرية (AFM) 5 ، والتقنيات القائمة على التداخل مثل المجهر المشتت بالتداخل (iSCAT) 6 ، أو التقنيات القائمة على الموائع النانوية مثل المسام النانوية7 ،8،9. في حين أن هذه الأساليب لها العديد من المزايا. تمنعهم بعض القيود الرئيسية من تقديم بيانات حول ديناميكيات توافق البروتين غير المعدلة. تتطلب FRET والملاقط البصرية وضع العلامات على الفلوروفور أو الربط على السطح ، مما قد يؤثر على الخصائص الفيزيائية الحيوية للبروتينات10،11،12. على الرغم من أن iSCAT خال من الملصقات من الناحية الفنية ، إلا أنه يتطلب أيضا تفاعلا بين البروتين والسطح لمراقبة التداخل المتولد بين الاثنين والذي يحتمل أن يؤثر على خصائص البروتينات. علاوة على ذلك ، مقيدة بنسبة الإشارة إلى الضوضاء ، يمكن ل iSCAT فقط اكتشاف البروتينات >40 كيلو دالتون بسبب ضوضاء المعدات وتقلبات الخلفية الشبيهةبالبقع 13. على الرغم من أنه يمكن تخفيف حد الحجم هذا من خلال التعلم الآلي ، إلا أن مكونات المخزن المؤقت محدودة لأنها يمكن أن تؤثر على الخصائص البصرية ، مما يؤدي إلى بيانات صاخبة13،14. تقدم المسام النانوية أوقات نقل سريعة للبروتينات من خلال المسام (عادة في حدود 5 ميكرو ثانية) ، مما يجعلها غير قادرة على اكتشاف ديناميكيات توافقية أبطأ15،16 ، على الرغم من البحث في التخفيف من هذه القيود ، مثل استخدام اوريغامي الحمض النووي في مصيدة التناضح الكهربائي النانوية17 أو دمج البلازمونات18،19،20،21. بالإضافة إلى ذلك ، يمكن أن تقلل تركيزات الملح العالية ، عادة حوالي 1 متر ، من قابلية تطبيق البيانات للعمل في الجسم الحي 15،22. يجب أن تراقب التقنية المثالية أحادية الجزيء لتوصيف البروتين البروتينات في الوقت الفعلي وتلتقط الديناميكيات التوافقية على مدى فترات أطول (أي مللي ثانية) دون الحاجة إلى تعديلات على ظروف البروتين أو المحلول غير الأصلي.
تشبه الملقط النانوي البلازموني الملقط البصري التقليدي ، بمعنى أنها تستخدم الضوء لاحتجاز المادة. ومع ذلك ، تستخدم اللوثان النانوي البلازموني الرنين البلازموني السطحي الموضعي (LSPR) لتعزيز المجال الكهربائي بعدة أوامر من حيث الحجم لتوليد قوة تدرج قوية بما يكفي لاحتجاز الجسيمات النانويةالمفردة 23. بالإضافة إلى ذلك ، يلعب الجسيم المحاصر دورا نشطا في تعزيز قوة المصيدة ، والمعروفة باسم محاصرة الحركة الخلفية المستحثة ذاتيا (SIBA) لهياكل الفتحةالنانوية 24. يسمح محاصرة SIBA هذه بقوى ليزر منخفضة (أي مللي واط) لاحتجاز الجسيمات الصغيرة التي يصل قطرها إلى بضعة نانومترات فقط ، مثل البروتينات25،26،27. يؤدي محاصرة جزيئات البروتين الفردي داخل منطقة النقطة الساخنة إلى حدوث تحول في معامل الانكسار المحلي (نبروتين >ماء) ، مما يؤدي إلى تغيير تشتت الضوء بناء على قابلية استقطاب الجزيء التي تتأثر بحجم البروتين وتباين الشكل ومعامل الانكسار28. ثم يكتشف الثنائي الضوئي للانهيار الجليدي (APD) هذه المعلومات لمراقبة التغييرات اللاحقة في تشتت الضوء. علاوة على ذلك ، تسمح النفخات النانوية البلازمونية بمراقبة البروتينات المحاصرة في الوقت الفعلي دون وضع العلامات والحبال وظروف المحلول القاسية لفترات زمنية طويلة (أي من دقائق إلى ساعات)29 ، مما يفي بمعايير تقنية الجزيء الفردي المثالية للبروتينات. باستخدام بنية الثقب النانوي المزدوج (DNH) ، أثبتت المثقلة النانوية البلازمونية قدرتها على حبس البروتينات المختلفة وتوضيح المعلومات الأساسية منها بما في ذلك التحولات التوافقية29 ، وحركية التفكيك30 ، والمناظر الطبيعية للطاقة31 ، وتتبع الانتشار32 ، وربطالترابط 33،34. إلى جانب هياكل DNH ، تم إثبات أن أشكال هندسة الهيكل البديلة تحبس الجسيمات ذات أحجام الجسيمات الصغيرة35،36. في هذا البروتوكول ، يتم تقديم الخطوات الأساسية لإعداد وتشغيل مثقل نانو البلازموني مع نظام الموائع الدقيقة المتكامل. نأمل أن يساعد هذا البروتوكول في زيادة إمكانية الوصول إلى النفاذات البلازمونية وفهمها للباحثين ، لا سيما أولئك الذين يعملون في مجالات البيولوجيا الهيكلية والفيزياء الحيوية.
Protocol
تنبيه: يرجى قراءة جميع أوراق بيانات السلامة ذات الصلة (SDS) لجميع المواد الكيميائية المستخدمة والالتزام بجميع ممارسات السلامة المناسبة ، وارتداء معدات الحماية الشخصية (نظارات السلامة بالليزر ، ومعاطف المختبر ، والقفازات) حسب الحاجة.
1. بناء إعداد الندوقط البلازموني
ملاحظة: يعتمد الإعداد البصري على مجموعة نظام الملقط البصري المعياري (OTKB) باستخدام ليزر و APD مختلفين (انظر جدول المواد). استخدم فقط المعدات البصرية على طاولة بصرية مناسبة لتقليل تأثير الاهتزازات الخارجية على النظام. كان الليزر في المجموعة 976 نانومتر ولكن نظرا لأن ذروة الطول الموجي للرنين الفردي لهياكل DNH تبلغ حوالي 740-760 نانومتر33. اخترنا ليزر NIR (852 نانومتر) لأنه قريب من ذروة الرنين ، ويحفز LSPR ، ولديه أيضا معدل عائد كشف أفضل بواسطة APD القائم على السيليكون. تم استخدام الليزر ذو الطول الموجيالأطول 20 أو18 أقصر لاحتجاز الجزيئات الحيوية.
- قم بإعداد الليزر في حامل ليزر الصمام الثنائي الضوئي وإدخاله في موازاة ، مما يؤدي إلى شعاع ليزر موازاة بعرض 1.7 مم لإعدادنا.
- أضف لوحة نصف موجة إلى مسار الضوء لضبط الاستقطاب. اضبط باستخدام مستقطب Glan-Taylor للتأكد من أن الاستقطاب الرأسي (استقطاب S) له أعلى شدة ضوء.
ملاحظة: يعد استخدام الاستقطاب الصحيح أمرا حيويا لضمان أقصى قدر من تحسين المجال الكهربائي من هياكل DNH لأنها تعتمد على الاستقطاب. - قم بتركيز الضوء من خلال إعداد موسع الشعاع الذي يتكون من عدسة مستوية مقعرة (f = -50 مم) متبوعة بعدسة محدبة (f = 150 مم) لزيادة عرض الشعاع إلى حوالي 5 مم لملء الفتحة الخلفية الكاملة للهدف السفلي.
- استخدم مرآة ثنائية اللون (تمريرة قصيرة 805 نانومتر) لتعكس الليزر إلى الموقع المطلوب. قم بإعداد الكاميرا (CCD) خلفها.
- أعد توجيه الضوء إلى الهدف السفلي (100x / 1.25 NA) ووضع الهدف العلوي (4x / 0.1 NA) إلى المسافة متحدة البؤر لجمع الضوء المرسل.
- أضف مرآة أخرى ثنائية اللون (تمريرة قصيرة 805 نانومتر) لتعكس ضوء الليزر باتجاه APD من خلال عدسة محدبة مستوية موضوعة في بعدها البؤري لتركيز الضوء في APD. أضف مصدر الضوء الأبيض (WLS) خلف المرآة ثنائية اللون حتى يتمكن من المرور مرة أخرى عبر الإعداد للوصول إلى الكاميرا. يوضح الشكل 1 مخططا لإعداد اللقطات النانوية البلازمونية المجمعة بالكامل.
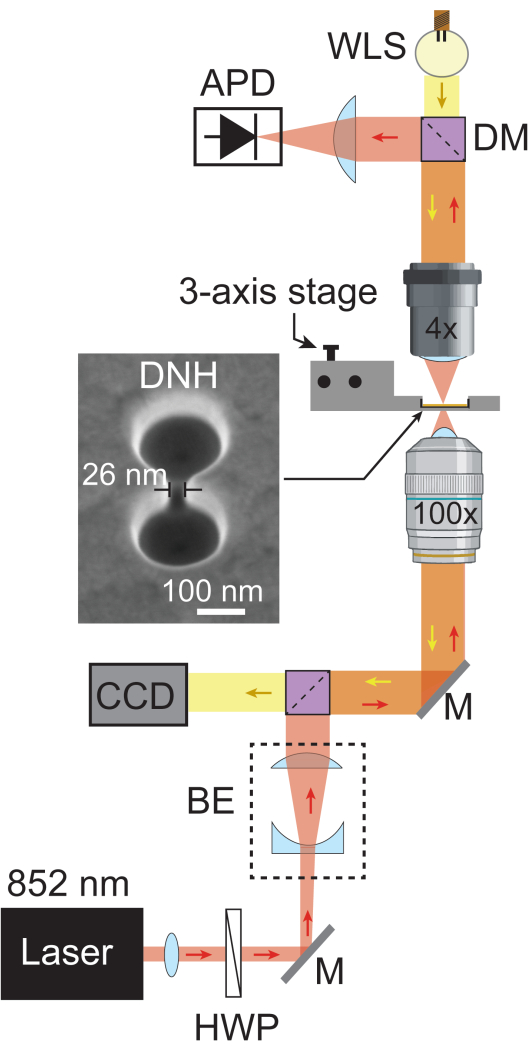
الشكل 1: إعداد النساقط البلازموني. يوضح التخطيطي المسار البصري الكامل لإعداد الملوثات النانوية البلازمونية. يمر شعاع ليزر 852 نانومتر (أحمر) عبر موازاة ولوحة نصف موجة ، ثم يتم توسيعه بواسطة موسع الشعاع (BE) إلى ~ 5.1 مم. يتم تركيزه لاحقا على العينة باستخدام هدف 100x. يتم جمع ضوء الليزر المرسل بواسطة هدف 4x ويتم تسجيله بواسطة APD بمعدل أخذ عينات 1 ميجاهرتز. يمر الضوء الأبيض من WLS (أصفر) عبر هدف 4x والعينة والهدف 100x قبل الوصول إلى CCD ، مما يوفر صورة مجال ساطعة للعينة. تم تصوير المناطق التي يتقاطع فيها كلا المسارين الخفيفين باللون البرتقالي. صورة التسويق عبر محرك البحث في DNH تم التقاطها عند إمالة 20 درجة. الاختصارات: BE = موسع الشعاع ، CCD = جهاز مقترن بالشحن ، DM = مرآة ثنائية اللون ، HWP = لوحة نصف موجة ، M = مرآة فضية ، و WLS = مصدر الضوء الأبيض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تصنيع هياكل DNH
- قم بإيداع 5 نانومتر Ti متبوعا ب 100 نانومتر Au على رقاقة سيليكا منصهرة بسمك 550 ميكرومتر باستخدام تبخر الشعاع الإلكتروني كما هو موضحسابقا 29،33. قطعي الرقاقة إلى مكعبات إلى عينات مقاس 1 سم × 1 سم جاهزة للاستخدام.
ملاحظة: تم اختيار تبخر الشعاع الإلكتروني لأنه ينتج طبقة ذهبية ذات خشونة سطحية منخفضة ، مما ينتج عنه هياكل DNH عالية الجودة بكفاءة محاصرة عالية37. - خذ عينة الفيلم الذهبي الفارغة وقم بتثبيتها في إعداد شعاع أيوني يركز على المجهر الإلكتروني الماسح (SEM-FIB) في درجة حرارة الغرفة باستخدام مصدر أيون الغاليوم.
- تأكد من محاذاة فتحات FIB النانوية مع SEM لإنتاج DNH في مواضع دقيقة.
- قم بإنشاء صندوق علامة باستخدام شعاع أيوني عالي التيار (على سبيل المثال ، 100 باسكال). ستكون هذه العلامة بمثابة دليل مرجعي لتحديد موضع هياكل DNH تحت الإعداد البصري.
- لإنشاء بنية DNH ، يتم ربط دائرتين بمسافة من المركز إلى المركز تبلغ 200 نانومتر وقطر 160 نانومتر بواسطة مستطيل (3 نانومتر × 40 نانومتر). لحجم الفجوة حوالي 20-30 نانومتر ، حفر الدوائر بعامل جرعة 0.09 ، بينما تتراوح جرعة المستطيل بين 0.300 إلى 0.350 باستخدام طاقة مسبار تبلغ 30 كيلو فولت وتيار شعاعي يبلغ 1 باسكال باسكال.
ملاحظة: يتميز SEM-FIB المستخدم بدقة 3 نانومتر عند طاقة المسبار هذه ، مما يسمح بتصنيع موثوق ل DNH بأحجام فجوات تتراوح بين 20-30 نانومتر. لن نستخدم دقة أقل لأن هذا سينتج عنه أحجام فجوات أكبر ، مما يقلل من كفاءة محاصرة DNH. إذا كان FIB غير ممكن ، فإن الطريقة البديلة لإنتاج هياكل DNH هي استخدام الطباعة الحجرية النانوية للبوليسترين38. نظرا للدقة العالية المطلوبة لتصنيع هياكل DNH ، قد لا تنتج نفس الوصفة نفس حجم الفجوة بين استخدامات SEM-FIB. قم بتغيير جرعة وارتفاع المستطيل (جرعة 0.280 إلى 0.350 وارتفاع 2 إلى 4 نانومتر) وقياس حجم الفجوة ، بهدف حوالي 20 نانومتر.
3. طلاء عينات DNH
- استخدم حاوية مقاومة للمذيبات ، مثل طبق تبلور مصنوع من زجاج البورسليكات 3.3 ، وأضف 20 مل من الإيثانول.
تنبيه: الإيثانول شديد الاشتعال ومهيج. استخدمه في غطاء الدخان فقط. تخزينها في مكان بارد وجيد التهوية. التعامل مع القفازات ومعطف المختبر. - وزن 32 مجم من بولي (إيثيلين جلايكول) ميثيل إيثر ثيول (PEG-thiol ؛ متوسط الوزن الجزيئي 800 جم / مول) واخلطه مع الإيثانول ، مما يضمن ذوبان كل PEG-thiol لإنتاج محلول بتركيز حوالي 2 ملي مولار لزيادة كثافة الطبقة الأحادية39.
تحذير: PEG-thiol مهيج. تعامل معها باستخدام معدات الوقاية الشخصية المناسبة. - أضف رقائق العينة التي تحتوي على الهياكل النانوية إلى الخليط باستخدام ملاقط مستقيمة ، وقم بتغطيتها ، واحتضانها طوال الليل (~ 16 ساعة) في درجة حرارة الغرفة حتى يشكل PEG-thiol طبقة أحادية التجميع ذاتيا على سطح الذهب.
- بعد الحضانة ، اشطف العينات عن طريق وضعها بملاقط مستقيمة فوق وعاء مناسب في غطاء الدخان. استخدم زجاجة بخاخ لرش الإيثانول على كل جانب جيدا. يجف تماما باستخدام مسدس هوائي قبل التخزين اللاحق أو التركيب في الملقط النانوي البلازموني.
ملاحظة: يمكن تخزين العينات عند 4 درجات مئوية لتحسين طول العمر لأنها يمكن أن تتحلل مع مرور الوقت.
4. تركيب العينة المطلية ب PEG في خلية تدفق
- ضع العينة المطلية في خلية التدفق المطبوعة ثلاثية الأبعاد (المطبوعة بواسطة طابعة Form 2 مع راتنج Clear V4) باستخدام ملاقط مستقيمة مع توجيه الطبقة الذهبية لأعلى (انظر الشكل التكميلي 1 للحصول على المعلمات والقيم الرئيسية في تصميم خلية التدفق لدينا).
- قشر جانبا واحدا من غطاء الشريط البلاستيكي الشفاف على الوجهين PET باستخدام ملاقط مستقيمة وضعه على العينة وخلية التدفق ، مما يضمن بقاء الهياكل النانوية وفتحات السحب / السحب في خلية التدفق مكشوفة. اضغط برفق حول حواف الشريط باستخدام ملاقط مستديرة للتأكد من التصاقها بشكل صحيح بخلية التدفق والعينة.
- انزع الجانب الآخر من الشريط ووضع غطاء زجاجي برفق (سمك 0.17 مم) فوق العينة باستخدام ملاقط مستديرة. اضغط برفق حول حواف الغطاء باستخدام ملاقط مستديرة للتأكد من أنها ملتصقة بشكل صحيح. يؤدي ذلك إلى إنشاء قناة سائلة (الارتفاع = 50 ميكرومتر ، الحجم = 3.5 ميكرولتر) داخل خلية التدفق.
ملاحظة: لا تضغط على الغطاء عند أو بالقرب من مكان وجود الهياكل النانوية لأنها قد تتلف. إذا كان الغطاء متسخا ، اغسله بالإيثانول وجففه بمسدس هوائي قبل تركيبه. - امزج أجزاء متساوية من A و B من محاليل السيليكون المكررة بنسبة 1: 1 (أو وفقا لتعليمات الشركة المصنعة) على شريحة مجهر باستخدام طرف ماصة صغير.
- املأ الفجوات بين الغطاء وخلية التدفق بالسيليكون المكرر المختلط ، وادفعه برفق أسفل الغطاء. أمسك خلية التدفق رأسا على عقب وضع السيليكون المكرر بحذر حول الجدار الداخلي للفتحة قبل استخدام طرف الماصة لتحريكه برفق على الحواف المرئية للجانب السفلي من السيليكا المنصهرة للعينة (انظر الشكل التكميلي 2).
- اتركيه ليجف مع توجيه الطبقة الذهبية لأعلى حتى يتماسك السيليكون المكرر تماما ، وفقا لتعليمات الشركة المصنعة.
ملاحظة: احرص على عدم السماح للسيليكون بتغطية الهياكل النانوية عند تطبيقه على الجانب السفلي من العينة. احرص على عدم إجبار السيليكون المكرر تحت الغطاء لأنه قد يدخل في فتحات السحب / السحب لخلية التدفق أو الهياكل النانوية ، والتي قد يكون من الصعب تنظيفها (الشكل التكميلي 3).
5. توصيل نظام الموائع الدقيقة
ملاحظة: تأكد من استخدام أنابيب نظيفة للنظام. هنا ، أنابيب PTFE صغيرة للمعرف: معرف 0.18 مم وأنابيب PTFE كبيرة المعرف: 0.8 مم ، ولكن ستعمل قيم المعرف الأخرى.
- قم بإعداد مضخة الحقنة وتوصيلها بصمام الملف اللولبي 3/2 اتجاهي باستخدام أنبوب PTFE الكبير. قم بتوصيل منفذ واحد من الصمام بالحاوية العازلة والآخر بملف تثبيت ، يبلغ حجمه حوالي 1 مل ، مصنوع من أنبوب معرف كبير لمنع التدفق العكسي إلى المحقنة.
ملاحظة: يمكن التحكم في الصمام 3/2 من خلال وحدة التحكم في الصمام ، والتي تحدد ما إذا كان المحلول قد تم غرسه / سحبه من الحاوية العازلة أو من ملف التثبيت - قم بتوصيل ملف التثبيت بالصمام المركزي للصمام المائل الدقيق ثنائي الاتجاه الدوار 12/1. قم بتوصيل الحاويات للحلول باستخدام أنابيب معرف صغيرة للعينات النادرة أو القيمة وأنابيب معرف كبيرة للباقي. استخدم صماما واحدا فقط للنقع في حاوية النفايات وآخر فقط للنقع في خلية التدفق ؛ استخدم أنابيب معرف صغيرة لصمام ضخ خلية التدفق.
- قم بتوصيل أنبوب معرف كبير من إخراج خلية التدفق بحاوية النفايات. يوضح الشكل 2 مخططا لنظام الموائع الدقيقة المتصل بالكامل.
ملاحظة: يفضل استخدام أنابيب PTFE ذات معرف صغير لسحب خلية التدفق والصمامات التي سيتم استخدامها لضخ البروتين نظرا لصغر الحجم حيث ستبقى العينة في الأنبوب. يفضل استخدام أنابيب PTFE ذات المعرف الكبير للمواد الأقل تكلفة أو الأكثر وفرة مثل المخازن المؤقتة. حاول استخدام الحد الأدنى من الأنابيب لتقليل هذا الحجم الميت بشكل أكبر.
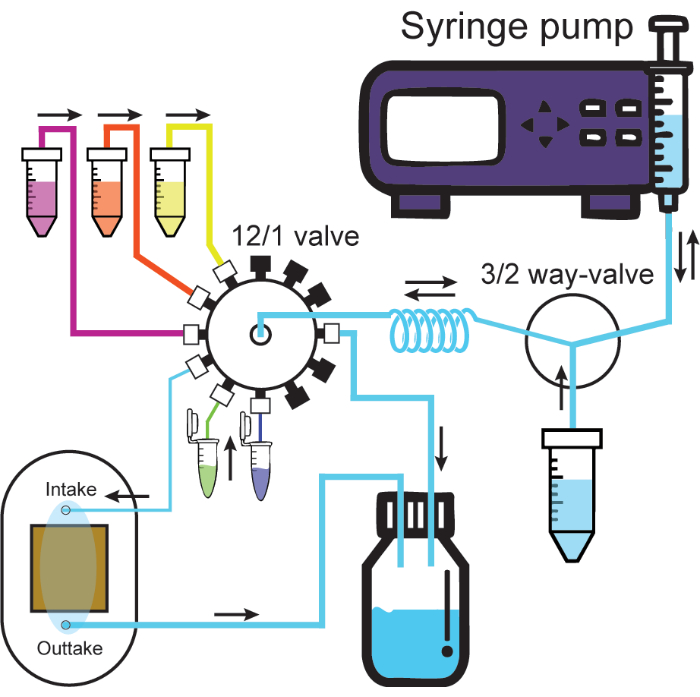
الشكل 2: نظام الموائع الدقيقة. يوضح التخطيطي نظام الموائع الدقيقة. تقوم مضخة الحقنة ببث أو سحب المحاليل من خلال منفذ واحد من الصمام 3/2 اتجاه، إما حاوية المحلول أو ملف الإمساك. تمر المحاليل المتصلة بصمام 12/1 دائما عبر ملف التثبيت عند سحبها ويمكن بعد ذلك ضخها من خلال القناة المطلوبة. سيؤدي التسريب إلى قناة السحب المتصلة بخلية التدفق إلى دفع المحلول من خلية التدفق إلى حاوية النفايات. تمثل الأنابيب السميكة والرقيقة أنابيب معرف كبيرة وصغيرة من البروتوكول. تمثل الأغطية السوداء على الصمام 12/1 قنوات مختومة. يتم تمييز اتجاهات التدفق بأسهم سوداء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. إعداد نظام الموائع الدقيقة
- قم بتحميل واجهة مستخدم نظام الموائع الدقيقة على جهاز الكمبيوتر وتحقق من توصيل المكونات بشكل صحيح. حدد أيقونة التشغيل بجوار السلك والموزع لفتح واجهة المستخدم الخاصة بهما. لتجاوز الصمام 3/2 اتجاه، أدر المنفذ 1 على السلك.
- تأكد من تنظيف الصمامات التي سيتم استخدامها داخل النظام عن طريق غرس الأيزوبروبانول (IPA) ثم غسل الأنابيب عدة مرات باستخدام عازل (عازلات) مختارة أو ماء مقطر لإزالة الهواء و IPA داخل النظام. يمكن إجراء التسريب عن طريق تحديد الصمام المطلوب في واجهة مستخدم الموزع وتشغيل مضخة الحقنة ، واختيار البثر / السحب ، واختيار الحجم المطلوب ومعدل التدفق (على سبيل المثال ، حجم 0.5 مل ومعدل تدفق 0.2 مل / دقيقة).
ملاحظة: لا تقم بغرس IPA في خلايا التدفق ، لأن ذلك سيؤدي إلى تدهور الخلية والغراء ، مما قد يؤدي إلى حدوث تسرب.
7. تركيب خلية التدفق في الملقطون النانوي البلازموني والتحقق من وجود تسرب
- قم بتوصيل أنابيب المدخل والمخرج بالجزء المناسب من خلية التدفق قبل وضعها على منديل نظيف بطبقة ذهبية متجهة لأعلى.
- قم بغرس المخزن المؤقت في خلية التدفق بمعدل تدفق مرتفع (~ 0.3 مل / دقيقة) وتحقق من أن السائل يتحرك عبر العينة في خلية التدفق وأنه لا يوجد سائل مرئي على السطح الخارجي أو السفلي لخلية التدفق. يمكن استخدام معدلات تدفق أعلى ، بشرط عدم حدوث تسرب. إذا تسربت العينة ، فقم بفك التركيب وإعادة التركيب.
- أضف 1-2 قطرات من زيت الغمر على هدف 100x قبل وضع خلية التدفق في مرحلة اللقط النانوي البلازموني مع توجيه الطبقة الذهبية لأسفل. ضع مشابك معدنية فوق مغناطيس خلية التدفق وأغلق المسرح للمساعدة في إبقائها في مكانها.
تنبيه: الزيت الموضوعي مادة مهيجة وخطرا على الصحة وسامة للحياة المائية ، تعامل معها فقط بالقفازات.
8. تحديد موقع الهياكل النانوية على العينة
- قم بتشغيل مصدر الضوء الأبيض. افتح برنامج الكاميرا وقم بزيادة وقت الكسب والتعرض حتى تصبح الهياكل النانوية مرئية. قم بتشغيل الليزر بطاقة ليزر عالية نسبيا واضبط المحور z يدويا حتى تظهر بقعة الليزر. أعط الأولوية لزيادة وقت التعرض والكسب على زيادة طاقة الليزر للعثور على بقعة الليزر.
تنبيه: يشكل الليزر خطرا محتملا جسيما على المستخدمين. تأكد من استخدام معدات الوقاية الشخصية المناسبة مثل نظارات السلامة بالليزر ذات الكثافة البصرية الكافية ضمن نطاق الطول الموجي المطلوب. - قم بتشغيل وحدة التحكم الكهروإجهادية وحدد الإعدادات المناسبة لمنفذ COM والجهد الأقصى. اضبط قيم المحاور x و y و z على نصف الجهد الأقصى للسماح بنطاق جيد لمحاذاة المرحلة في جميع الاتجاهات.
ملاحظة: يمكن العثور على منفذ COM الخاص بوحدة التحكم الكهروإجهادية وتغييره في مدير الجهاز ضمن علامة التبويب المنافذ. - حرك بقعة الليزر للتراكب بأحد DNH باستخدام مقابض التحكم في محاور المرحلة الرئيسية x و y و z. تأكد من تشغيل APD ثم أغلق العلبة برفق على المثقل النانوي البلازموني.
ملاحظة: سيساعد استخدام أداة الوسم في برنامج الكاميرا، إن وجد، على تحريك بقعة الليزر فوق بنية نانوية. اضبط العلامة على مركز بقعة الليزر وقم بإيقاف تشغيل الليزر ، لكن اترك مصدر الضوء الأبيض قيد التشغيل ، للسماح بمحاذاة أسهل للبنية النانوية. يمكن أن يكون APD مفرطا في التشبع والتلف إذا وصل إليه الكثير من ضوء الليزر. تأكد من أن العينة في طريق مسار الليزر وقم بزيادة طاقة الليزر تدريجيا لضمان عدم الوصول إلى التشبع. يمكن وضع مرشحات الكثافة المحايدة (N.D) قبل APD لتقليل الضوء الذي يصل إليه إذا لزم الأمر.
9. محاذاة الليزر على النحو الأمثل مع البنية النانوية المطلوبة
- افتح البرنامج المرتبط بتسجيل APD، مثل واجهة مستخدم Labview محلية الصنع، واضبط تردد القطع على 1 كيلو هرتز. قم بتسمية مسار الملف المطلوب وتنسيق تسمية الملفات التي سيتم حفظها وتعيينها.
- قم بإيقاف تشغيل مصدر الضوء الأبيض وإعادة تشغيل الليزر. اضبط على طاقة ليزر مناسبة (على سبيل المثال ، ~ 20 ميجاواط) واستخدم أدوات التحكم الكهروإجهادية لضبط المحاور x و y و z حتى تصبح إشارة APD عالية قدر الإمكان ، وتجنب تشبع APD وبأقل انحراف معياري (SD) للتتبع.
ملاحظة: من المحتمل أن يكون لدى APD نطاق حساسية مثالي للنقل (انظر دليل المنتج) وهو مثالي للبقاء ، على سبيل المثال ، 1000-2000 مللي فولت. يمكن استخدام مرشحات ND للحفاظ على ناقل الحركة حول هذا النطاق. ويتمثل الاعتبار الرئيسي في ألا يكون الإرسال قريبا من نقطة التشبع APD، لأن الانحباس قد يزيد من الإرسال إلى حد التشبع، مما يؤدي إلى فقدان البيانات.
10. غرس البروتينات في خلية التدفق
- قم بإيقاف تشغيل الليزر للحفاظ على عمر الهياكل النانوية وقم بتشغيل وحدة التحكم في مضخة الحقنة وواجهة مستخدم الموزع لضبط الصمام وسحب الكمية المطلوبة من البروتين (على سبيل المثال ، 30 ميكرولتر). للسحب باستخدام أنبوب المعرف الصغير ، يساعد معدل التدفق المنخفض على ضمان سحب جميع المحاليل (~ 0.01 - 0.1 مل / دقيقة). يمكن استخدام معدلات تدفق أعلى لتقليل الوقت الذي يقضيه الانتظار إذا رغبت في ذلك.
ملاحظة: يعتمد الحجم الأمثل للبروتين المراد استخدامه على مدى قيمة البروتين وما تأمل التجربة في تحقيقه. تركيز البروتين النموذجي الذي نستخدمه هو 1 ميكرومتر وحجم الكمية 100 ميكرولتر. إذا كانت عينة البروتين وفيرة ، فيمكن استخدام تركيزات أعلى لتقليل متوسط وقت الانحجاز. ومع ذلك ، إذا كانت التركيزات عالية جدا ، فإن خطر محاصرة اثنين من نفس البروتينات داخل البنية النانوية سيزداد. إذا تطلبت التجربة ضخ ترابط / بروتين مختلف بعد حبس البروتين الأولي ، فقد يفضل وجود حجم أقل من الكمية لتقليل النفايات والوقت المستغرق لضخ المحلول التالي. تأكد من بقاء الأنابيب مغمورة في المحلول لمنع دخول الهواء إلى النظام. يجب توخي الحذر بشكل خاص لحصص البروتين إذا لم يصل الأنبوب إلى قاع الحاوية أو تم سحب المحلول بشكل مفرط. - باستخدام واجهة مستخدم الموائع الدقيقة ، قم بغرس محلول البروتين بمعدل تدفق مماثل لمعدل السحب (~ 0.01 - 0.1 مل / دقيقة). اتركيه ينقع بهذا المعدل حتى يصل محلول البروتين إلى خلية التدفق ، ثم قلل معدل التدفق إلى ≤0.001 مل / دقيقة. تحقق من مستوى الصوت والوقت على مضخة الحقنة للتأكد من تطابقهما مع الحجم المتوقع (على سبيل المثال ، دقيقة واحدة لحجم 1 مل عند 1 مل / دقيقة).
ملاحظة: يمكن حساب الحجم المطلوب لذلك بناء على حجم الأنبوب من نظام الموائع الدقيقة إلى خلية التدفق. إذا كان طول الأنبوب ومعرفه معروفين ، فيمكن استخدام آلة حاسبة عبر الإنترنت لحجم الأسطوانة. يمكن تعديل معدل التسريب حسب الرغبة ، على سبيل المثال ، >0.001 مل / دقيقة لضخ البروتين لتقليل متوسط وقت انتظار المصيدة. ومع ذلك ، ينصح بالحذر كما لو كان معدل التدفق مرتفعا جدا ، فقد يمنع ذلك البروتينات من دخول البنية النانوية.
11. جمع البيانات
- أثناء غرس محلول البروتين في خلية التدفق ، ابدأ في تسجيل بيانات إشارة APD. اضبط المحاور x و y و z حسب الضرورة باستخدام واجهة مستخدم وحدة التحكم الكهرضغطية ، حيث من المحتمل أن ينجرف النظام بمرور الوقت. آثار الاصطياد المثالية لها نمط عام متسق يتبع التتبع في الشكل 3.
- عند ملاحظة تغيير كبير في الإرسال و SD مشابه لتتبع الاصطياد النموذجي ، قم بتدوين الوقت الذي يحدث فيه هذا لفرز البيانات في المستقبل (انظر الشكل 4 ب على سبيل المثال).
ملاحظة: يمكن أن يؤدي الانجراف في النظام إلى تغييرات في ناقل الحركة وزيادة في SD ، وأحيانا فجأة تماما ، والتي يمكن الخلط بينها وبين مصيدة البروتين. تأكد من أن قفزة الإشارة تعرض نفس نمط المصيدة النموذجية وعدم وجود تداخل خارجي عند حدوث القفزة، مثل محاذاة الانجراف أو الضوضاء العالية التي يلتقطها النظام. - إذا احتاج البروتين إلى الإفراج كجزء من التجربة ، فقم بإيقاف تشغيل الليزر لمدة ~ 5 ثوان وأعد تشغيله. يجب أن يكون للتتبع تغيير كبير في الإرسال و SD أقل بكثير ، مما يشير إلى العودة إلى حالة خط الأساس.
ملاحظة: إذا لم يلاحظ تغيير كبير في انتقال العدوى و / أو SD ، أو لوحظ أثر مماثل للبروتين المحاصر ، فمن المحتمل أن يكون البروتين عالقا بسطح العينة (انظر الشكل 5 ب ، على سبيل المثال).
12. فك العينة
- بعد إجراء التجربة المطلوبة ، قم بإيقاف تشغيل الليزر ، وأخرج خلية التدفق من المرحلة المكونة من 3 محاور ، وافصل أنبوب نظام الموائع الدقيقة.
- ضع خلية التدفق على منديل نظيف بحيث تكون الطبقة الذهبية للعينة متجهة لأعلى. باستخدام مشرط ، قم بقص الغراء بعناية أسفل الغطاء الزجاجي وارفعه برفق باستخدام ملاقط مستديرة. تخلص منه في سلة الزجاج المكسورة المخصصة.
تنبيه: يمكن أن يتسبب الزجاج المكسور واستخدام الأشياء الحادة في حدوث إصابة. تأكد من ارتداء نظارات واقية وقفازات ومعطف مختبر. - أمسك خلية التدفق بزاوية مع استمرار توجيه الطبقة الذهبية لأعلى واستخدم ملاقط مستديرة لإزالة الغراء بعناية على الجانب السفلي من خلية التدفق لتحرير العينة. يسمح تكرار السيليكون بإزالة سهلة دون الإضرار بهياكل DNH.
- باستخدام ملاقط مستقيمة ، التقط العينة واشطفها جيدا باستخدام IPA ، ثم اسقها قبل التجفيف بمسدس هوائي. إذا كانت قابلة لإعادة الاستخدام ، فقم بتخزين العينة في وعاء مناسب بحيث تكون الطبقة الذهبية متجهة لأعلى.
ملاحظة: عادة ما يكون للعينات فترة قابلة للاستخدام تبلغ حوالي 1-2 أسابيع إذا تم التعامل معها بشكل صحيح ، على الرغم من أن حجم الهياكل النانوية يتغير بمرور الوقت. في حالة تلف مفرط ، قم بالتبديل إلى عينة جديدة للتجربة التالية. يمكن أن يكون الضرر في شكل خدوش موجودة على سطح الذهب بالقرب من الهياكل النانوية أو من ضعف الأداء التجريبي ، مما يشير إلى تدهور الهياكل النانوية29.
13. إعداد النظام للاستخدام المستقبلي
- استخدم مناديل العدسة المطوية لمسح الزيت عن الهدف في اتجاه واحد ، ورفعه وتكراره مع جزء آخر نظيف من الأنسجة.
ملاحظة: الأهداف عرضة للتلطخ والخدوش ، مما قد يضعف الأداء بشكل كبير. ارتد القفازات دائما أثناء التنظيف وتجنب لمس المواد العضوية. استخدم فقط مناديل تنظيف العدسة الجديدة لمنع التلوث وتنظيفها في اتجاه واحد بحركة واحدة. تجنب فرك العدسة وتنظيف المناديل ذهابا وإيابا لتقليل الضرر. إذا كان التنظيف الجاف غير كاف ، ضع كمية صغيرة من الإيثانول على المناديل ، وامسح الزيت كما ذكرنا سابقا ، وانتهي بالمناديل الجافة. - إذا تم استخدام نفس محاليل البروتين / العازلة بعد ذلك ، فقد لا تحتاج إلى تغيير الأنبوب. إذا تم استخدام محاليل مختلفة ، فاستبدل الأنبوب لتقليل مخاطر التلوث من المحاليل السابقة.
ملاحظة: لا تستخدم نفس الأنبوب لأكثر من أسبوع واحد ، حتى إذا كنت تجري تجارب بنفس الحلول ، حيث ستتسخ بمرور الوقت.
النتائج
بعد الحصول على البيانات ، يمكن إجراء تحليل البيانات على البيانات الأولية باستخدام كود MATLAB لإنشاء آثار من البيانات الأولية التي تم جمعها بواسطة APD. يصور الشكل 3 أثر محاصرة نموذجي بما في ذلك خط الأساس قبل الاصطياد ، وحدث الاصطياد حيث لوحظ تغيير كبير في الإرسال (ΔT / T0) والانحراف المعياري قبل إيقاف تشغيل الليزر لمدة 5 ثوان تقريبا قبل إعادة تشغيله. يشير انخفاض كبير في الانحراف المعياري وعودة الانتقال إلى مستويات مماثلة لخط الأساس إلى إطلاق البروتين. تتم إزالة الانجراف الخطي من التتبع باستخدام الدالة MATLAB detrend.m ، ثم تتم إضافة القيمة المتوسطة للبيانات مرة أخرى إلى التتبع الذي تم تغيير اتجاههه. من حين لآخر ، نحتاج إلى تغيير اتجاه التتبع حيث ينجرف الإعداد بمرور الوقت ، مما يتسبب في انخفاض خطي في الإرسال (انظر التتبع الرمادي في الشكل 3). ترجع التغييرات الصغيرة في تتبعات خط الأساس قبل التراكب اللوني وبعده إلى ضبط المرحلة لتحسين خط الأساس بأقل انحراف معياري، كما هو موضح في الشكل 4 أ. في بعض الأحيان ، تكون جزيئات البروتين مرئية في الأثر دون أن تكون محاصرة ، وتسمى البروتينات المارة. تظهر البروتينات التي تمر كتغيير حاد في الانتقال ، على غرار المصيدة النموذجية (الشكل 4 ب) ، ولكن بمدة أقصر بكثير ، كما هو موضح في الشكل 4 أ. تقدم الكثافة الطيفية للقدرة (PSD) تحليلا آخر لتأكيد محاصرة البروتين من خلال توفير قوة الإشارة عند ترددات مختلفة. عادة ما تظهر الحركات التوافقية للبروتين في نطاق >1 ميكرو ثانية بواسطة طرق التحليل الطيفي لجزيء واحد40. يوضح الشكل 4C أنه بالمقارنة مع خط الأساس ، فإن محاصرة البروتين يؤدي إلى قوة إشارة أعلى ، على الأقل ضمن نطاق 10 كيلو هرتز (> 100 ميكرو ثانية). كما يسلط الضوء على أهمية محاذاة المرحلة مع خط أساس محسن ، حيث يمكن أن يؤدي خط الأساس السيئ إلى زيادة الضوضاء عند الترددات بين 50-500 هرتز ، وهو نطاق تردد مغطى بحركات مطابقة للبروتين.
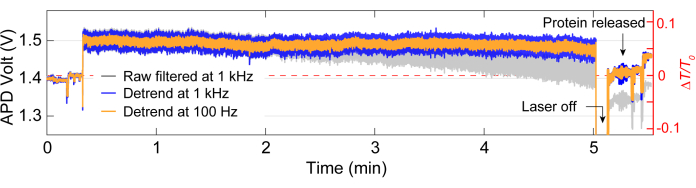
الشكل 3: تتبع الاصطياد الكامل لبروتين واحد. تتبع تمثيلي للمصيدة الكاملة ، بما في ذلك خط الأساس ، ومحاصرة البروتين ، وإطلاق البروتين. ترجع القفزات في التتبع قبل التراكب اللوني وبعده إلى المحاذاة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
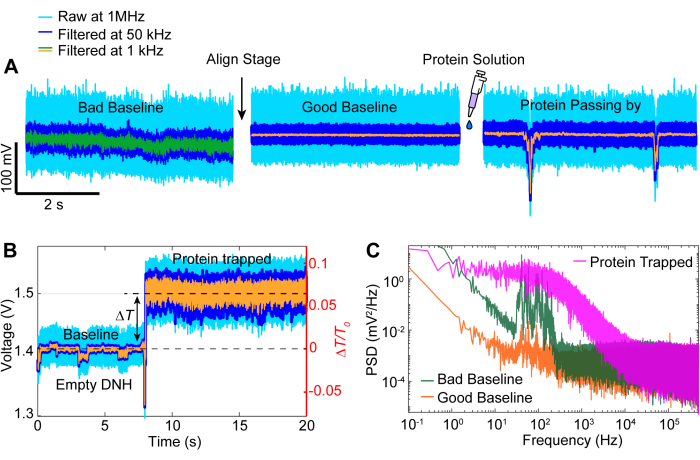
الشكل 4: أحداث التتبع الشائعة. (أ) أمثلة على المحاذاة من خط الأساس السيئ إلى الجيد والبروتين الذي يمر بالقرب من النقطة الساخنة. (ب) تتبع الانحباس الذي يوضح العملية من خط الأساس عندما تكون النقطة الساخنة DNH فارغة إلى وقت احتجاز البروتين. (ج) مخطط الكثافة الطيفية للقدرة (PSD) بين خطوط الأساس الجيدة والسيئة الموضحة في (A) والبروتين المحاصر في (B). تشير قيم PSD الأعلى إلى ضوضاء أكبر عند ترددات معينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تتبع معظم أحداث الاصطياد نفس النمط العام مثل التتبع في الشكل 3 ، على الرغم من أن مشكلات عرضية قد تنشأ أثناء التجارب. بالنسبة لمعظم التجارب ، يجب إطلاق البروتين يدويا عن طريق إيقاف تشغيل الليزر بمجرد اكتمال التجربة المطلوبة. ومع ذلك ، في بعض الحالات ، يمكن للبروتين أن يترك المصيدة دون تدخل ، كما هو موضح في الشكل 5 أ. على العكس من ذلك ، في بعض الأحيان يمكن أن تبقى البروتينات في موقع المحاصرة حتى بعد إيقاف تشغيل الليزر ، ويرجع ذلك على الأرجح إلى التصاق البروتين بالعينة. ينتج عن هذا الالتصاق أثر صاخب بعد إيقاف تشغيل الليزر وتشغيله (انظر الشكل 5 ب). يعتمد احتمال حدوث ذلك على البروتين ، حيث أن بعض البروتينات أكثر عرضة لامتصاص السطح41،42. يمكن أن يقلل استخدام طلاء مثل PEG-thiol من فرص التصاق البروتين39،43. ما لم ترغب في ذلك ، مثل دراسة تفاعلات البروتين والبروتين ، هناك مشكلة أخرى تتمثل في الاصطياد المزدوج ، حيث يتم احتجاز البروتين الثاني بعد المصيدة الأولى. يتميز هذا بزيادة حادة أخرى في انتقال العدوى ، على غرار المصيدة الأولى ، وتغيير في الانحراف المعياري (انظر الشكل 5C).
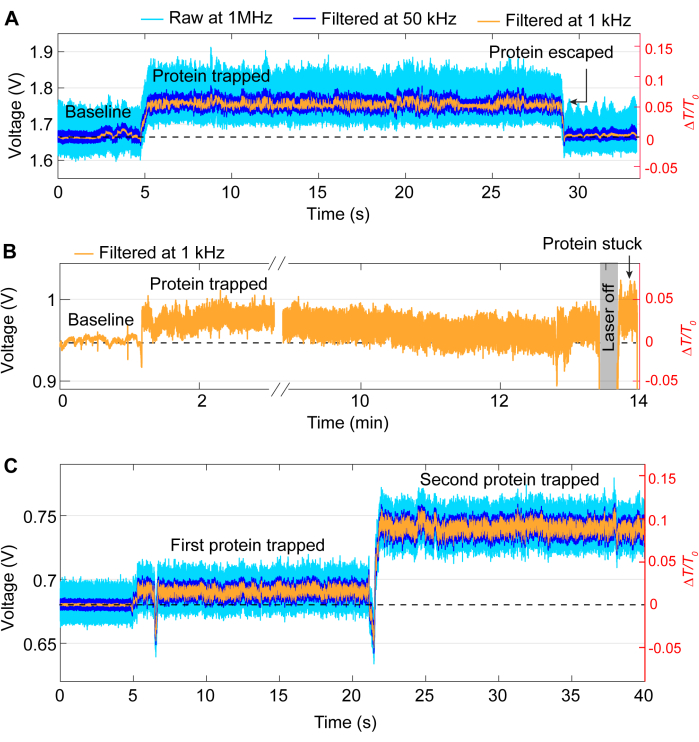
الشكل 5: أمثلة على أحداث الاصطياد غير المرغوب فيها. (أ) الإطلاق غير المقصود لبروتين من نقطة ساخنة DNH. (ب) مثال على أن البروتين أصبح عالقا على سطح العينة في نقطة ساخنة DNH. (ج) تحدث قفزة التتبع عندما يتم احتجاز بروتين ثان بينما لا يزال الأول في نقطة ساخنة DNH. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
توضح تجربة تمثيلية أجريت على تحميل الحديد في الموقع على جزيء apo-ferritin استخدام الملقطات النانوية البلازمونية كأداة للتحقيق في ديناميكيات مطابقة البروتين29. الفيريتين هو بروتين حامل للحديد موجود في حالتين: apo-ferritin، الذي لا يحتوي على الحديد، والهولو فيريتين، المملوء بالحديد44،45. يدخل الحديد الحديدي البروتين من خلال قنوات 3 أضعاف حيث يتأكسد إلى الحديد الحديدي ويخزن في قلب البروتين46. يصور الشكل 6 أ أثرا نموذجيا للاصطياد من apo-ferritin بمحلول حديدي يتم غرسه لأكثر من 20 دقيقة أثناء احتجاز البروتين. توفر آثار 20 ثانية المأخوذة على طول التتبع الكامل في النقاط b-e نظرة ثاقبة للتغيرات التي تحدث على البروتين بمرور الوقت. في الشكل 6 ب ، يتم احتجاز apo-ferritin في مخزن مؤقت قياسي ل PBS ، ولم يلاحظ أي تغييرات كبيرة في التتبع. يوضح الشكل 6C ، D التقلبات في SD للآثار ، والتي تسببها تحميل الحديد في البروتين من خلال قنواته المكونة من 3 أضعاف ، مما يؤدي إلى حالة أكثر ديناميكية (apo-) حيث تكون القنوات مفتوحة ، وحالة أكثر إحكاما (holo-) مع إغلاق القنوات. عند ملء جزيء الفيريتين بالحديد ، انتقل إلى شكله المجسم ، مما أدى إلى أثر محاصرة مستقر ، كما هو موضح في الشكل 6E. تعرض وظائف كثافة الاحتمالات (PDF) في الأشكال 6B-E التغييرات التي يمر بها البروتين عند التعرض لظروف محلول مختلفة بمرور الوقت.
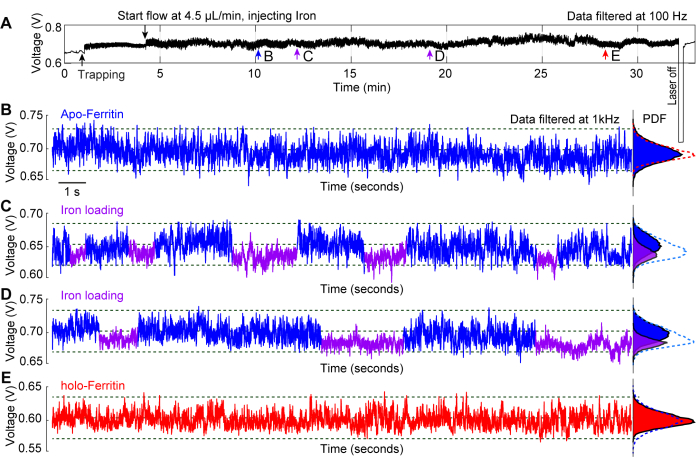
الشكل 6: تحميل الحديد في الموقع في أبوفيريتين محاصر. (أ) أثر الإرسال الكامل ل DNH مع جزيء أبوفيريتين محاصر ، متبوعا بحقن محلول حديدي في موقع الاصطياد لمراقبة التغيرات التوافقية للفيريتين المرتبطة بتحميل الحديد. (ب) أثر محاصرة 20 ثانية لأبوفيريتين محاصر قبل أن يصل المحلول الحديدي إلى النقطة الساخنة. (C ، D) آثار محاصرة 20 ثانية بعد تعرض جزيء الأبوفيريتين للمحلول الحديدي. تشير الأجزاء الزرقاء والأرجوانية إلى SD الأعلى والسفلي للتتبع ، مما يشير إلى المطابقات المرنة والصلبة للفيريتين ، على التوالي. (ه) أثر محاصرة 20 ثانية بعد تعرض الأبوفيريتين للمحلول الحديدي لمدة >20 دقيقة. تظهر مخططات دالة كثافة الاحتمالات (PDF) على اليمين توزيع الإرسال ويتم ترميزها بالألوان على الأجزاء الزرقاء والأرجوانية. تم تعديل هذا الرقم من29. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: عينة DNH ذهبية مثبتة على خلية التدفق المطبوعة ثلاثية الأبعاد. يتم وضع العينة في فتحة خاصة ويتم تلتصقها بخلية التدفق باستخدام شريط لاصق PET على الوجهين. يتم تصنيف المعلمات الرئيسية والقياسات المرتبطة بتصميم خلية التدفق الخاصة بنا. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: الجزء الخلفي من خلية التدفق مع عينة DNH ذهبية مثبتة والجدار الداخلي المسمى. يتم إغلاق العينة في خلية التدفق باستخدام السيليكون المكرر. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: رسم تخطيطي لخلية التدفق مع DNH الذهبي المثبت مع فتحات السحب والسحب المسماة. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تتمثل إحدى الخطوات الحاسمة في البروتوكول في ضمان عدم تسرب خلية التدفق قبل وضعها في المرحلة ، والتي يجب اختبارها خارج الحامل بمعدل تدفق مرتفع مسبقا. يمكن أن يؤدي التسرب بعد تركيب العينة إلى إتلاف المكونات البصرية ، ولا سيما الهدف السفلي.
قد تنحرف المحاذاة عن موضعها الأمثل بمرور الوقت أثناء التجربة ، مما يتسبب في تباين الإشارة بسبب حساسية الموضازات البلازمونية. عند حدوث ذلك ، أعد المحاذاة باستخدام عناصر التحكم الكهروإجهادية إلى أقصى إرسال والحد الأدنى من الانحراف المعياري لخط الأساس ، حيث يقلل خط الأساس الصاخب من جودة البيانات. يجب توخي الحذر لتدوين ملاحظات دقيقة عن وقت إجراء المحاذاة لإزالة مخاطر إرباك تدخل المستخدم لحدث الاصطياد. في حالة حدوث انجراف كبير ، قم بمحاذاة المرحلة برفق لتقليل مخاطر إطلاق البروتين ولاحظ وقت التعديل.
يمكن إجراء التعديلات والتعديلات على التقنية المقدمة بناء على الاحتياجات التجريبية المحددة. على سبيل المثال ، يمكن أن تساعد المرحلة التي يتم التحكم في درجة حرارتها في تبريد / تسخين العينة حسب الرغبة بدلا من استخدام التسخين بالليزر لزيادة درجة الحرارة31،33. يمكن أن توفر التقنيات الأخرى ، على سبيل المثال ، الفحص المجهري للتشتت التداخل (iSCAT) ، تداخلا للبروتين داخل مجال تشتت DNH ، مما يحصل على إشارة إضافية تتناسب مع قابلية استقطاب البروتين ، والتي ترتبط بحجم الجسيمات47،48.
المثقل النانوي البلازموني هو تقنية استشعار زمني بحتة حيث يتم تسجيل البيانات بواسطة APD (كاشف أحادي البكسل). لا توفر هذه التقنية أي معلومات مباشرة عن التغيرات الهيكلية للبروتين ، مثل مناطق البروتين التي تشارك في تغيير توافقي أو المكان الذي قد يرتبط فيه الترابط أو بروتين آخر بالبروتين. بالإضافة إلى ذلك ، تقتصر هذه التقنية على مدى زمني يبلغ >1 ميكرو ثانية بسبب معدل أخذ العينات لبطاقة الحصول على البيانات (MHz 1). بالنظر إلى تردد Nyquist ، حيث يكون أعلى نطاق ممكن نصف معدل الاستحواذ ، في هذه الحالة ، 2 ميكرو ثانية في ظل ظروف مثالية.
في هذا البروتوكول ، وصفنا عملية إعداد تجربة نسقط البلازما لاحتجاز بروتين واحد ومراقبة التغيرات في ديناميكياته التوافقية بمرور الوقت. يمكن تطوير هذه التقنية على أي مجهر محلي الصنع أو تجاري. على عكس الأساليب القائمة على التألق أو الربط ، مثل smFRET والملاقط البصرية ، يمكن لهذه التقنية أن تحبس البروتينات بدون ملصقات أو حبال ولا تزال تحقق حساسية أحادية الجزيء. يمكن تغيير ظروف المحلول أثناء احتجاز البروتين باستخدام نظام الموائع الدقيقة ، مما يسمح بالمراقبة في الوقت الفعلي لتأثير المحاليل المختلفة على البروتين. تجعل هذه الميزات من الملوثات النانوية البلازمونية أداة واعدة في مجالات الفيزياء الحيوية والاستشعار الحيوي ، خاصة بالنسبة للبروتينات التي تكافح التقنيات التقليدية لاستجوابها في حالاتها الأصلية. ستركز التطبيقات المستقبلية على فك تشفير الديناميكيات التوافقية للبروتينات الأكثر ديناميكية مثل البروتينات والبروتينات المضطربة جوهريا التي تحتوي على مناطق مضطربة جوهريا ، وبروتينات الغشاء ، التي تعصي ديناميكياتها وحتى هيكلها على التقنيات الحالية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
وتعترف س. ز. بالدعم المقدم من شراكة تدريب الدكتوراه التابعة لمجلس بحوث التكنولوجيا الأحيائية والعلوم البيولوجية (BBSRC DTP) (BB/T0083690/1). يقر المؤلفون بالتمويل من مبادرة التعليم والبحث بين المملكة المتحدة والهند (UKIERI). تقدر M.R. الدعم المقدم من الجمعية الملكية ومؤسسة وولفسون.
Materials
| Name | Company | Catalog Number | Comments |
| 100x Objective (NA = 1.25) | Olympus | PLN100XO | Clean oil only with lens cleaning tissue in one motion |
| 12-1 rotary bidirectional microfluidic valve | Elveflow | ||
| 3/2 way solenoid valve | Elveflow | ||
| 4x Objective (NA = 0.1) | Olympus | PLN4XP | |
| Airgun | RS Components | 666-6772 | |
| Avalanche photodiode (APD) | Thorlabs | APD120A/M | Do not oversaturate, 50 MHz bandwidth, static sensitive |
| Butterfly laser diode | Thorlabs | FPL852S | |
| Charge-coupled device (camera) | Hikrobot | MV-CE200-10UC | |
| Crystallising dish | VWR | 216-0065 | |
| Data acquisition card | National instruments | USB-6361 | 2 MHz sampling rate |
| Double-sided tape | Adhesive Research Inc | ARcare92712 | Cut appropriate shape for flow cell with a laser cutter |
| Ethanol | Fume hood only, use gloves | ||
| Fibreport collimator | Thorlabs | PAF2-A7B | |
| Glass microscope coverslips (thickness 0.17 mm) | |||
| Half wave plate | Thorlabs | AHWP10M-980 | |
| Ideal-tek 120 mm, stainless steel, straight tweezers | RS Components | 282-7472 | For holding sample and peeling double sided tape |
| Isopropanol (IPA) | Fume hood only, use gloves | ||
| Lens cleaning tissue | Thorlabs | MC-5 | |
| Metrosil rapid duplicating silicone parts A and B | Metrodent | MSILR/1 | |
| Microscope slides (75 mm x 26 mm) | |||
| Modular Optical Tweezers System | Thorlabs | OTKB/M-CUSTOM | |
| Objective oil | Olympus | Use gloves, store between 2oC-8oC | |
| Photodiode laser mount | Thorlabs | CLD1015 | |
| Piezoelectric controller | Thorlabs | MDT693B | |
| Piezoelectric stage | Thorlabs | Nanomax 300 | |
| Planoconcave lens (f = -50 mm) | Thorlabs | LC1715-B | |
| Planoconvex lens (f = 150 mm) | Thorlabs | LA1433-B | |
| Planoconvex lens (f = 60 mm) | Thorlabs | LA1134-B | |
| Poly(ethylene glycol) methyl ether thiol (PEG-thiol) 800 MW | Sigma Aldrich | 729108 | Store between 2oC-8oC |
| PTFE tubing (ID: 0.18 mm) | Vici Jour | JR-T-6805-M25 | |
| PTFE tubing (ID: 0.8 mm) | Cole-Parmer | WZ-21942-72 | |
| SEM-FIB | Zeiss | Crossbeam 550 | Gallium ion source |
| Shortpass dichroic mirror 805 nm | Thorlabs | DMSP805 | |
| Silver mirror | Thorlabs | PF-10-03-P01 | |
| Syringe pump | Harvard Apparatus | 70-4511 | |
| Weller Erem 120 mm stainless steel, flat, rounded tweezers | RS Components | 176-1150 | For holding glass coverslip and peeling glue from flow cell |
References
- Peter Lu, H. P. Sizing up single-molecule enzymatic conformational dynamics. Chem Soc Rev. 43 (4), 1118-1143 (2014).
- Mazal, H., Haran, G. Single-molecule FRET methods to study the dynamics of proteins at work. Curr Opin Biomed Eng. 12, 8-17 (2019).
- Ritchie, D. B., Woodside, M. T. Probing the structural dynamics of proteins and nucleic acids with optical tweezers. Curr Opin Str Biol. 34, 43-51 (2015).
- Neupane, K., Solanki, A., Sosova, I., Belov, M., Woodside, M. T. Diverse metastable structures formed by small oligomers of α-Synuclein probed by force spectroscopy. PLoS One. 9 (1), e86495(2014).
- Hughes, M. L., Dougan, L. The physics of pulling polyproteins: a review of single molecule force spectroscopy using the AFM to study protein unfolding. Rep Prog Phys. 79 (7), 076601-076601 (2016).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Schmid, S., Dekker, C. Nanopores: a versatile tool to study protein dynamics. Essays Biochem. 65 (1), 93-107 (2021).
- Van Meervelt, V., et al. Real-time conformational changes and controlled orientation of native proteins inside a protein nanoreactor. J Am Chem Soc. 139 (51), 18640-18646 (2017).
- Awasthi, S., Ying, C., Li, J., Mayer, M. Simultaneous determination of the size and shape of single α-Synuclein oligomers in solution. ACS Nano. 17 (13), 12325-12335 (2023).
- Sµnchez-Rico, C., Von Vithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of fluorophore attachment on protein conformation and dynamics studied by spFRET and NMR spectroscopy. Chemistry. 23 (57), 14267-14277 (2017).
- Yin, L., et al. How does fluorescent labeling affect the binding kinetics of proteins with intact cells. Biosens Bioelectr. 66, 412-416 (2015).
- Berkovich, R., et al. Rate limit of protein elastic response is tether dependent. Proc Natl Acad Sci. 109 (36), 14416-14421 (2012).
- Dahmardeh, M., Mirzaalian Dastjerdi, H., Mazal, H., Köstler, H., Sandoghdar, V. Self-supervised machine learning pushes the sensitivity limit in label-free detection of single proteins below 10 kDa. Nat Meth. 20 (3), 442-447 (2023).
- Becker, J., et al. A quantitative description for optical mass measurement of single biomolecules. ACS Photon. 10 (8), 2699-2710 (2023).
- Houghtaling, J., et al. Estimation of shape, volume, and dipole moment of individual proteins freely transiting a synthetic nanopore. ACS Nano. 13 (5), 5231-5242 (2019).
- Plesa, C., et al. Fast translocation of proteins through solid state nanopores. Nano Lett. 13 (2), 658-663 (2013).
- Schmid, S., Stömmer, P., Dietz, H., Dekker, C. Nanopore electro-osmotic trap for the label-free study of single proteins and their conformations. Nat Nanotechnol. 16 (11), 1244-1250 (2021).
- Shi, X., Verschueren, D. V., Dekker, C. Active delivery of single DNA molecules into a plasmonic nanopore for label-free optical sensing. Nano Lett. 18 (12), 8003-8010 (2018).
- Verschueren, D. V., et al. Label-free optical detection of DNA translocations through plasmonic nanopores. ACS Nano. 13 (1), 61-70 (2019).
- Verschueren, D., Shi, X., Dekker, C. Nano-optical tweezing of single proteins in plasmonic nanopores. Small Meth. 3 (5), 1800465(2019).
- Peri, S. S. S., et al. Quantification of low affinity binding interactions between natural killer cell inhibitory receptors and targeting ligands with a self-induced back-action actuated nanopore electrophoresis (SANE) sensor. Nanotechnology. 32 (4), 045501(2020).
- Leong, I. W., Tsutsui, M., Yokota, K., Taniguchi, M. Salt gradient control of translocation dynamics in a solid-state nanopore. Anal Chem. 93 (49), 16700-16708 (2021).
- Juan, M. L., Righini, M., Quidant, R. Plasmon nano-optical tweezers. Nat Photon. 5 (6), 349-356 (2011).
- Juan, M. L., Gordon, R., Pang, Y., Eftekhari, F., Quidant, R. Self-induced back-action optical trapping of dielectric nanoparticles. Nat Phys. 5 (12), 915-919 (2009).
- Pang, Y., Gordon, R. Optical trapping of 12 nm dielectric spheres using double-nanoholes in a gold film. Nano Lett. 11 (9), 3763-3767 (2011).
- Pang, Y., Gordon, R. Optical trapping of a single protein. Nano Lett. 12 (1), 402-406 (2012).
- Kotnala, A., Gordon, R. Quantification of high-efficiency trapping of nanoparticles in a double nanohole optical tweezer. Nano Lett. 14 (2), 853-856 (2014).
- Booth, L. S., et al. Modelling of the dynamic polarizability of macromolecules for single-molecule optical biosensing. Sci Rep. 12 (1), 1995(2022).
- Yousefi, A., et al. Optical monitoring of in situ Iron loading into single, native ferritin proteins. Nano Lett. 23 (8), 3251-3258 (2023).
- Yousefi, A., et al. Structural Flexibility and Disassembly Kinetics of Single Ferritin Molecules Using Optical Nanotweezers. ACS Nano. 18 (24), 15617-15626 (2024).
- Peters, M., et al. Energy landscape of conformational changes for a single unmodified protein. NPJ Biosens. 1 (1), 14-14 (2024).
- Peters, M., McIntosh, D., Branzan Albu, A., Ying, C., Gordon, R. Label-free tracking of proteins through plasmon-enhanced interference. ACS Nanosci Au. 4 (1), 69-75 (2024).
- Ying, C., et al. Watching single unmodified enzymes at work. arXiv. , (2021).
- Yang-Schulz, A., et al. Direct observation of small molecule activator binding to single PR65 protein. NPJ Biosensing. 2 (1), 1-10 (2025).
- Yang, W., van Dijk, M., Primavera, C., Dekker, C. FIB-milled plasmonic nanoapertures allow for long trapping times of individual proteins. iScience. 24 (11), 103237(2021).
- Koya, A. N., et al. Novel plasmonic nanocavities for optical trapping-assisted biosensing applications. Adv Optical Mater. 8 (7), 1901481(2020).
- Goswami, A., Umashankar, R., Gupta, A. K., Aravindan, S., Rao, P. V. Development of a microstructured surface using the FIB. J Micromanufact. 1 (1), 53-61 (2018).
- Onuta, T. D., Waegele, M., DuFort, C. C., Schaich, W. L., Dragnea, B. Optical field enhancement at cusps between adjacent nanoapertures. Nano Lett. 7 (3), 557-564 (2007).
- Al-Ani, A., et al. The influence of PEG-thiol derivatives on controlling cellular and bacterial interactions with gold surfaces. Appl Surf Sci. 462, 980-990 (2018).
- Schuler, B., Hofmann, H. Single-molecule spectroscopy of protein folding dynamics-expanding scope and timescales. Curr Opin Str Biol. 23 (1), 36-47 (2013).
- Kopac, T. Protein corona, understanding the nanoparticle-protein interactions and future perspectives: A critical review. Int J Biol Macromol. 169, 290-301 (2021).
- Li, X., Guo, W., Xu, R., Song, Z., Ni, T. The interaction mechanism between gold nanoparticles and proteins: Lysozyme, trypsin, pepsin, γ-globulin, and hemoglobin. Spectrochim Acta A Mol Biomol Spectrosc. 272, 120983(2022).
- Emilsson, G., et al. Strongly stretched protein resistant poly(ethylene glycol) brushes prepared by grafting-To. ACS Appl Mater Inter. 7 (14), 7505-7515 (2015).
- Theil, E. C., Liu, X. S., Tosha, T. Gated pores in the ferritin protein nanocage. Inorg Chim Acta. 361 (4), 868-874 (2008).
- Theil, E. C., et al. The ferritin iron entry and exit problem. Inorg Chim Acta. 297 (1), 242-251 (2000).
- Takahashi, T., Kuyucak, S. Functional properties of threefold and fourfold channels in Ferritin D=deduced from electrostatic calculations. Biophys J. 84 (4), 2256-2263 (2003).
- Gemeinhardt, A., et al. Label-free imaging of single proteins secreted from living cells via iSCAT microscopy. J Vis Exp. (141), e58486(2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nat Comm. 5 (1), 4495(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved