Method Article
ניטור דינמיקת קונפורמציה של חלבונים בודדים לא מותאמים באמצעות פינצטה פלזמונית
In This Article
Summary
פינצטה פלזמונית משתמשת בתהודה פלזמונית מקומית על פני השטח בננו-מבני זהב כדי ללכוד ננו-חלקיקים בודדים, כולל חלבונים, בתוך שדה אופטי בקנה מידה ננומטרי. שינויים באות המפוזר חושפים נוכחות חלבון ודינמיקה קונפורמטיבית, ומאפשרים ניטור ללא שינויים בפלואורופור או קשירת פני השטח.
Abstract
הטכניקות הנוכחיות של מולקולה בודדת לאפיון חלבונים דורשות בדרך כלל תוויות, קשירה או שימוש בתנאי תמיסה לא מקוריים. שינויים כאלה יכולים לשנות את הביופיזיקה של החלבונים ולהפחית את התועלת של הנתונים שנרכשו. פינצטה פלזמונית היא טכניקה המשתמשת בתהודה פלזמונית מקומית על פני השטח (LSPR) על ננו-מבני זהב כדי לשפר את השדה החשמלי בתוך אזור נקודה חמה מוגבל. שיפור שדה זה מאפשר שימוש בעוצמות לייזר נמוכות כדי ללכוד ננו-חלקיקים בודדים קטנים בהרבה מפינצטה אופטית קונבנציונלית, עד לקוטר של ננומטרים בודדים בלבד, כגון חלבונים בודדים. לכידה של מולקולות חלבון בודדות בתוך אזור הנקודה החמה גורמת לשינוי במקדם השבירה המקומי (nחלבון > nמים), ומשנה את פיזור האור כתוצר של יכולת הקיטוב של המולקולה, המושפעת מהנפח, האניזוטרופיה של הצורה וממקדם השבירה שלה. פוטו-דיודה מפולת (APD) אוספת את השינויים הבאים בפיזור האור. לאחר מכן ניתן לנתח שינויים אלה כדי לקבוע שינויים במולקולה הכלואה, כולל גודלה, הקונפורמציה הגלובלית והדינמיקה של שינוי קונפורמציה לאורך זמן. שילוב המיקרופלואידיקה במערכת מאפשר שינויים סביבתיים מבוקרים וניטור בזמן אמת של השפעותיהם הבאות על המולקולה. בפרוטוקול זה, אנו מדגימים את השלבים ללכידת מולקולות חלבון בודדות, שינוי תנאי התמיסה הסביבתית שלהן ומעקב אחר השינויים הקונפורמטיביים המתאימים שלהן באמצעות מערכת פינצטה פלזמונית.
Introduction
הטכניקות הנוכחיות של מולקולה בודדת לחקירת דינמיקת קונפורמציה של חלבונים כוללות שיטות מבוססות תיוג כגון העברת אנרגיה בתהודה פלואורסצנטית (FRET)1,2, גישות מבוססות קשירה כגון פינצטה אופטית 3,4 ומיקרוסקופ כוח אטומי (AFM)5, טכניקות מבוססות הפרעות כגון מיקרוסקופ פיזור הפרעות (iSCAT)6, או טכניקות מבוססות ננו-פלואידיות כגון ננו-נקבוביות7,8,9. אמנם לשיטות אלה יתרונות רבים; כמה מגבלות מרכזיות מונעות מהם לספק נתונים על דינמיקת קונפורמציה של חלבון לא שונה. FRET ופינצטה אופטית דורשים תיוג פלואורופור או קשירה למשטח, מה שעלול להשפיע על התכונות הביופיזיקליות של החלבונים 10,11,12. iSCAT, למרות שמבחינה טכנית הוא נטול תוויות, דורש גם אינטראקציה בין החלבון למשטח כדי לצפות בהפרעות שנוצרות בין השניים שעלולות להשפיע על תכונות החלבונים. יתר על כן, מוגבל על ידי יחס האות לרעש שלו, iSCAT יכול לזהות רק חלבונים >40 kDa עקב רעש ציוד ותנודות רקע דמויות כתמים13. למרות שניתן להקל על מגבלת גודל זו באמצעות למידת מכונה, רכיבי המאגר מוגבלים מכיוון שהם יכולים להשפיע על תכונות אופטיות, וכתוצאה מכך נתונים רועשים13,14. ננו-נקבוביות מציגות זמני טרנסלוקציה מהירים של חלבונים דרך הנקבוביות (בדרך כלל בטווח של 5 מיקרון), מה שהופך אותן לבלתי מסוגלות לזהות דינמיקה קונפורמציונית איטית יותר15,16, אם כי מחקר להקלה על מגבלות אלה, כגון שימוש באוריגמי DNA במלכודת אלקטרו-אוסמוטית ננו-נקבובית17 או שילוב פלסמוניקה 18,19,20,21. בנוסף, ריכוזי מלח גבוהים, בדרך כלל בסביבות 1 M, יכולים להפחית את תחולת הנתונים עבור עבודה in vivo 15,22. הטכניקה האידיאלית של מולקולה בודדת לאפיון חלבונים צריכה לנטר חלבונים בזמן אמת וללכוד דינמיקת קונפורמציה לאורך פרקי זמן ארוכים יותר (כלומר, אלפיות השנייה) ללא צורך בשינויים בחלבון או בתנאי תמיסה לא מקוריים.
פינצטה פלזמונית דומה לפינצטה אופטית קונבנציונלית, במובן זה שהם משתמשים באור כדי ללכוד חומר. פינצטה פלזמונית, לעומת זאת, משתמשת בתהודה פלזמונית מקומית על פני השטח (LSPR) כדי לשפר את השדה החשמלי בכמה סדרי גודל כדי ליצור כוח שיפוע חזק מספיק כדי ללכוד ננו-חלקיקים בודדים23. בנוסף, החלקיק הלכוד ממלא תפקיד פעיל בשיפור חוזק המלכודת, המכונה לכידת פעולה אחורית עצמית (SIBA) עבור מבני ננו-צמצם24. לכידה זו של SIBA מאפשרת לעוצמות לייזר נמוכות (כלומר, מילי-וואט) ללכוד חלקיקים קטנים בקוטר של כמה ננומטרים בלבד, כגון חלבונים 25,26,27. לכידת מולקולות חלבון בודדות באזור הנקודה החמה גורמת לשינוי במקדם השבירה המקומי (nחלבון > nמים), ומשנה את פיזור האור על סמך יכולת הקיטוב של המולקולה המושפעת מנפח החלבון, הצורה האניזוטרופית ומקדם השבירה28. לאחר מכן פוטו-דיודה מפולת (APD) מזהה מידע זה כדי לנטר את השינויים הבאים בפיזור האור. יתר על כן, פינצטה פלזמונית מאפשרת ניטור של החלבונים הלכודים בזמן אמת ללא תיוג, קשירה ותנאי תמיסה קשים לפרקי זמן ארוכים (כלומר, דקות עד שעות)29, וממלאים את הקריטריונים לטכניקה אידיאלית של מולקולה אחת לחלבונים. באמצעות מבנה ננו-חור כפול (DNH), פינצטה פלזמונית הוכיחה את יכולתה ללכוד חלבונים שונים ולהבהיר מהם מידע מפתח כולל מעברי קונפורמציה29, קינטיקה של פירוק30, נופי אנרגיה31, מעקב דיפוזיה32 וקשירת ליגנד33,34. מלבד מבני DNH, הוכח כי גיאומטריות מבנה חלופיות לוכדות חלקיקים בגודל חלקיקים קטן35,36. בפרוטוקול זה מוצגים השלבים הבסיסיים להקמה והפעלה של מערך פינצטה פלזמונית עם מערכת מיקרופלואידיקה משולבת. אנו מקווים שפרוטוקול זה יעזור להגביר את הנגישות וההבנה של פינצטה פלזמונית לחוקרים, במיוחד אלה בתחומי הביולוגיה המבנית והביופיזיקה.
Protocol
זהירות: אנא קרא את כל גיליונות נתוני הבטיחות הרלוונטיים (SDS) עבור כל הכימיקלים המשמשים והקפיד על כל נוהלי הבטיחות המתאימים, וללבוש ציוד מגן אישי (משקפי בטיחות לייזר, מעילי מעבדה, כפפות) כנדרש.
1. בניית מערך הפינצטה הפלזמונית
הערה: ההגדרה האופטית מבוססת על ערכת מערכת פינצטה אופטית מודולרית (OTKB) המשתמשת בלייזר ו-APD שונים (ראה טבלת חומרים). השתמש רק בציוד אופטי על שולחן אופטי מתאים כדי להפחית את ההשפעה של רעידות חיצוניות על המערכת. הלייזר בערכה היה 976 ננומטר אך מכיוון שאורך גל התהודה השיא לתהודה הטריז של מבני ה-DNH הוא בסביבות 740-760 ננומטר33. בחרנו בלייזר NIR (852 ננומטר) מכיוון שהוא קרוב לשיא התהודה, משרה LSPR, ויש לו גם קצב תפוקת זיהוי טוב יותר על ידי APD מבוסס סיליקון. לייזרים עם אורכי גל ארוכים יותר של20 אוקצרים יותר של 18 שימשו ללכידת ביומולקולות.
- הגדר את הלייזר בתושבת הלייזר של הפוטו-דיודה והזין אותו לקולימטור, מה שמוביל לקרן לייזר קולימציה ברוחב של 1.7 מ"מ עבור ההתקנה שלנו.
- הוסף צלחת חצי גל לנתיב האור כדי להתאים את הקיטוב. התאם באמצעות מקטב Glan-Taylor כדי להבטיח שהקיטוב האנכי (קיטוב S) הוא בעל עוצמת האור הגבוהה ביותר.
הערה: שימוש בקיטוב הנכון הוא חיוני כדי להבטיח שיפור מקסימלי של השדה החשמלי ממבני ה-DNH מכיוון שהם תלויים בקיטוב. - מקד את האור דרך מערך מרחיב אלומה המורכב מעדשה פלנו-קעורה (f = -50 מ"מ) ואחריה עדשה פלנו-קמורה (f = 150 מ"מ) כדי להגדיל את רוחב האלומה לכ-5 מ"מ כדי למלא את הצמצם האחורי המלא של המטרה התחתונה.
- השתמש במראה דיכרואית (מעבר קצר של 805 ננומטר) כדי לשקף את הלייזר למיקום הרצוי. הגדר את המצלמה (CCD) מאחוריו.
- הפנה מחדש את האור למטרה התחתונה (100x/1.25 NA) ומקם את המטרה העליונה (4x/0.1 NA) למרחק הקונפוקלי כדי לאסוף את האור המועבר.
- הוסף מראה דיכרואית נוספת (מעבר קצר של 805 ננומטר) כדי להחזיר את אור הלייזר לכיוון ה-APD דרך עדשה פלנו-קמורה הממוקמת באורך המוקד שלה כדי למקד את האור לתוך ה-APD. הוסף את מקור האור הלבן (WLS) מאחורי המראה הדיכרואית כדי שיוכל לעבור בחזרה דרך ההתקנה ולהגיע למצלמה. איור 1 מציג סכימה של מערך הפינצטה הפלזמונית המורכבת במלואה.
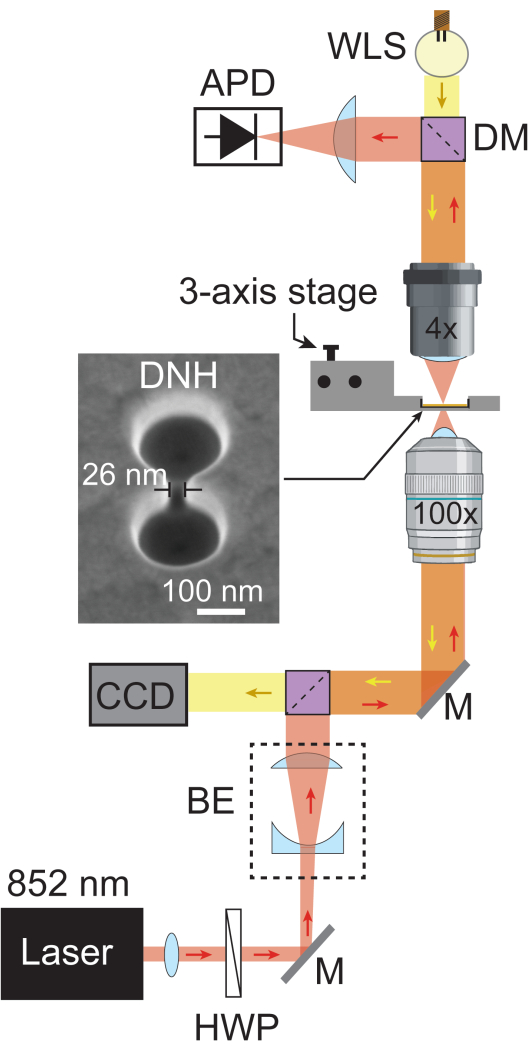
איור 1: מערך פינצטה פלזמונית. הסכימה מציגה את המסלול האופטי המלא של מערך הפינצטה הפלזמונית. קרן לייזר של 852 ננומטר (אדום) עוברת דרך קולימטור וצלחת חצי גל, ואז מורחבת על ידי מרחיב האלומה (BE) ל-~5.1 מ"מ. לאחר מכן הוא מתמקד במדגם באמצעות יעד פי 100. אור הלייזר המועבר נאסף על ידי אובייקט פי 4 ונרשם על ידי APD בקצב דגימה של 1 מגה-הרץ. אור לבן מ-WLS (צהוב) עובר דרך המטרה פי 4, הדגימה והמטרה פי 100 לפני שהוא מגיע ל-CCD, המספק תמונת שדה בהירה של הדגימה. אזורים שבהם שני נתיבי האור מצטלבים מתוארים בכתום. תמונת SEM של DNH שצולמה בהטיה של 20°. קיצורים: BE = מרחיב קרן, CCD = מכשיר מצמד מטען, DM = מראה דיכרואית, HWP = לוח חצי גל, M = מראה כסף ו-WLS = מקור אור לבן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. ייצור מבני DNH
- הפקדה של 5 ננומטר Ti ואחריה 100 ננומטר Au על פרוסת סיליקה התמזגה בעובי 550 מיקרומטר באמצעות אידוי קרן אלקטרונית כפי שתואר קודם לכן29,33. קוביות את הוופל לדגימות בגודל 1 ס"מ על 1 ס"מ מוכנות לשימוש.
הערה: אידוי קרן E נבחר מכיוון שהוא מייצר שכבת זהב עם חספוס פני שטח נמוך, ומייצר מבני DNH איכותיים עם יעילות לכידה גבוהה37. - קח את דגימת סרט הזהב הריקה והרכיב אותה במערך קרן יונים ממוקדת מיקרוסקופ אלקטרונים סורק (SEM-FIB) בטמפרטורת החדר באמצעות מקור יון גליום.
- ודא שננו-צמצמים של FIB מיושרים עם SEM כדי לייצר DNH במיקומים מדויקים.
- צור תיבת סימון באמצעות קרן יונים בעלת זרם גבוה (למשל, 100 pA). סמן זה ישמש כמדריך התייחסות לאיתור המיקום של מבני ה-DNH מתחת להגדרה האופטית.
- כדי ליצור את מבנה ה- DNH, שני מעגלים עם מרחק מרכז למרכז של 200 ננומטר וקוטר 160 ננומטר מגושרים על ידי מלבן (3 ננומטר x 40 ננומטר). עבור גודל פער של כ-20-30 ננומטר, חרוט עיגולים עם מקדם מינון של 0.09, בעוד שמינון המלבן הוא בין 0.300 ל-0.350 באמצעות אנרגיית בדיקה של 30 קילו וולט וזרם אלומה של 1 pA.
הערה: ל-SEM-FIB המשמש יש רזולוציה של 3 ננומטר באנרגיית בדיקה זו, המאפשרת ייצור אמין של DNH עם גדלי פער בין 20-30 ננומטר. לא נשתמש ברזולוציה נמוכה יותר מכיוון שהדבר ייצור גדלי רווח גדולים יותר, מה שיפחית את יעילות הלכידה של DNH. אם FIB אינו בר ביצוע, שיטה חלופית לייצור מבני DNH היא שימוש בליתוגרפיה ננוספרית פוליסטירן38. בשל הדיוק הגבוה הנדרש לייצור מבני DNH, ייתכן שאותו מתכון לא ייצר את אותו גודל פער בין שימושים ב-SEM-FIB. שנה את המינון והגובה של המלבן (מינון של 0.280 עד 0.350 וגובה של 2 עד 4 ננומטר) ומדוד את גודל הפער, במטרה לסביבות 20 ננומטר.
3. ציפוי דגימות DNH
- השתמש במיכל עמיד בפני ממסים, כגון צלחת התגבשות העשויה מזכוכית בורוסיליקט 3.3, והוסף 20 מ"ל אתנול.
זהירות: אתנול דליק מאוד ומגרה. השתמש במכסה אדים בלבד. יש לאחסן במקום קריר ומאוורר היטב. ידית עם כפפות ומעיל מעבדה. - שקלו 32 מ"ג של פולי (אתילן גליקול) מתיל אתר תיול (PEG-תיול; משקל מולקולרי ממוצע 800 גרם/מול) וערבבו אותו עם האתנול, כדי להבטיח שכל ה-PEG-תיול התמוסס כדי לייצר תמיסה בריכוז של כ-2 מ"מ כדי למקסם את הצפיפות החד-שכבתית39.
זהירות: PEG-תיול הוא חומר מגרה; טפל בזה עם PPE מתאים. - הוסף את שבבי הדגימה המכילים את הננו-מבנים לתערובת באמצעות פינצטה ישרה, כסה ודגירה למשך הלילה (~16 שעות) בטמפרטורת החדר כדי שה-PEG-thiol ייצור שכבה חד-שכבתית בהרכבה עצמית על משטח הזהב.
- לאחר הדגירה יש לשטוף דגימות על ידי החזקתן בפינצטה ישרה על מיכל מתאים במכסה האדים. השתמש בבקבוק שפריץ כדי לרסס אתנול מכל צד ביסודיות. יבש במלואו באמצעות אקדח אוויר לפני האחסון או ההרכבה שלאחר מכן בפינצטה הפלזמונית.
הערה: ניתן לאחסן דגימות בטמפרטורה של 4 מעלות צלזיוס כדי לשפר את אורך החיים מכיוון שהן עלולות להתפרק שעות נוספות.
4. הרכבת הדגימה המצופה PEG לתא זרימה
- הנח את הדגימה המצופה בתא הזרימה המודפס בתלת מימד (מודפס על ידי מדפסת טופס 2 עם שרף V4 שקוף) באמצעות פינצטה ישרה כששכבת הזהב פונה כלפי מעלה (ראה איור משלים 1 לפרמטרים וערכים מרכזיים בעיצוב תא הזרימה שלנו).
- קלף צד אחד של כיסוי הסרט הדו-צדדי מפלסטיק PET השקוף באמצעות פינצטה ישרה והנח אותו על הדגימה ותא הזרימה, וודא שהננו-מבנים וחורי היניקה/יציאה בתא הזרימה יישארו חשופים. לחץ בעדינות סביב קצוות הסרט בעזרת פינצטה מעוגלת כדי לוודא שהוא נדבק כראוי לתא הזרימה ולדגימה.
- מקלפים את הצד השני של הקלטת ומניחים בעדינות כיסוי זכוכית (עובי 0.17 מ"מ) מעל הדגימה בעזרת פינצטה מעוגלת. לחץ בעדינות סביב שולי הכיסוי בעזרת הפינצטה המעוגלת כדי לוודא שהוא נדבק כהלכה. זה יוצר תעלת נוזל (גובה = 50 מיקרומטר, נפח = 3.5 מיקרוליטר) בתוך תא הזרימה.
הערה: אל תלחץ על הכיסוי במקום שבו ממוקמים הננו-מבנים או בסמוך אליהם מכיוון שהם עלולים להינזק. אם הכיסוי מלוכלך, שטפו אותו באתנול וייבשו אותו עם אקדח אוויר לפני ההרכבה. - מערבבים חלקים שווים של A ו-B של תמיסות הסיליקון המשכפלות ביחס של 1:1 (או לפי הוראות היצרן) על שקופית מיקרוסקופ באמצעות קצה פיפטה קטן.
- מלא את הרווחים בין הכיסוי לתא הזרימה עם הסיליקון המשוכפל המעורב, ודחף אותו בעדינות מתחת לכיסוי. החזק את תא הזרימה הפוך והנח בזהירות סיליקון משוכפל סביב הדופן הפנימית של החור לפני השימוש בקצה הפיפטה כדי להזיז אותו בעדינות אל הקצוות הגלויים של החלק התחתון של הסיליקה המותכת של הדגימה (ראה איור משלים 2).
- מניחים לייבוש כששכבת הזהב פונה כלפי מעלה עד שהסיליקון המשוכפל מתייצב במלואו, לפי הוראות היצרן.
הערה: הקפד לא לאפשר לסיליקון לכסות ננו-מבנים כאשר הוא מוחל על הצד התחתון של הדגימה. הקפד לא לאלץ את הסיליקון הכפול מתחת לכיסוי מכיוון שהוא עלול להיכנס לחורי היניקה/יציאה של תא הזרימה או הננו-מבנים, שיכולים להיות קשים לניקוי (איור משלים 3).
5. חיבור מערכת המיקרופלואידיקה
הערה: הקפידו על שימוש בצינורות נקיים למערכת. כאן, צינורות PTFE ID קטנים: 0.18 מ"מ ID וצינורות PTFE ID גדולים: 0.8 מ"מ ישמשו, אך ערכי זיהוי אחרים יעבדו.
- הגדר את משאבת המזרק וחבר אותה לשסתום הסולנואיד התלת-כיווני באמצעות צינור ה-PTFE הגדול. חבר יציאה אחת של השסתום למיכל החיץ והשנייה לסליל אחיזה, בנפח של כ-1 מ"ל, העשוי מצינור הזיהוי הגדול כדי למנוע זרימה חוזרת לתוך המזרק.
הערה: ניתן לשלוט על שסתום 3/2 באמצעות בקר שסתומים, הקובע אם התמיסה מוזרקת/נשלפת ממיכל החיץ או מסליל האחזקה. - חבר את סליל האחיזה לשסתום המרכזי של השסתום המיקרופלואידי הדו-כיווני הסיבובי 12/1. חבר מכולות לפתרונות באמצעות צינורות זיהוי קטנים לדגימות נדירות או יקרות ערך וצינורות זיהוי גדולים לשאר. השתמש בשסתום אחד רק להחדרה למיכל פסולת ובאחר רק להחדרה לתא הזרימה; השתמש בצינורות זיהוי קטנים עבור שסתום עירוי תאי הזרימה.
- חבר צינורות זיהוי גדולים מהפלט של תא הזרימה למיכל הפסולת. איור 2 מציג סכימה של המערכת המיקרופלואידית המחוברת במלואה.
הערה: צינורות PTFE ID קטנים עדיפים על צריכת תא הזרימה ועל שסתומים שישמשו לעירוי חלבון בשל הנפח הקטן יותר שבו הדגימה תישאר בצינור. צינורות PTFE גדולים עדיפים על חומרים פחות יקרים או שופעים יותר כגון חוצצים. נסה להשתמש בצינורות מינימליים כדי להפחית עוד יותר את הנפח המת הזה.
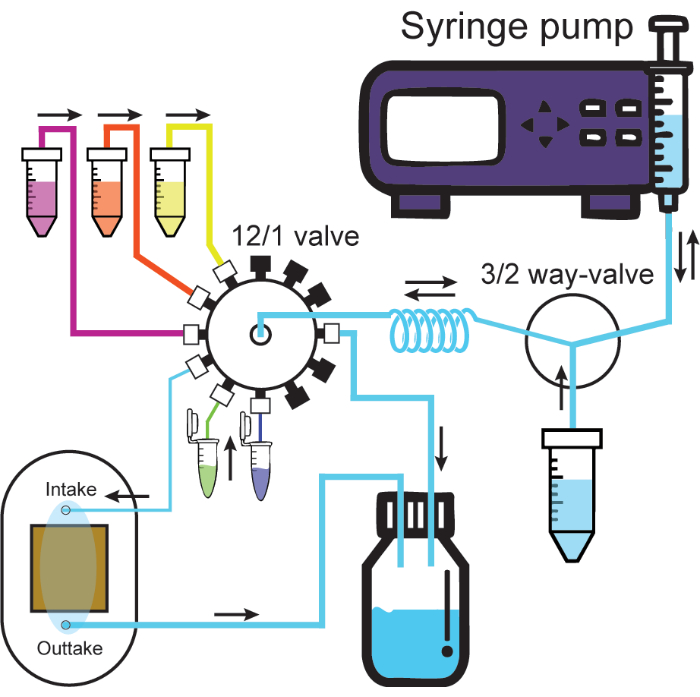
איור 2: מערכת מיקרופלואידית. סכמטי ממחיש את המערכת המיקרופלואידית. משאבת המזרק מחדירה או מושכת תמיסות דרך יציאה אחת של שסתום 3/2 כיווני, מיכל התמיסה או סליל האחיזה. פתרונות המחוברים לשסתום 12/1 עוברים תמיד דרך סליל האחיזה כאשר הם נסוגים ואז ניתן להחדיר אותם דרך הערוץ הרצוי. עירוי לתעלת היניקה המחוברת לתא הזרימה ידחוף את התמיסה מתא הזרימה למיכל הפסולת. צינורות עבים ודקים מייצגים צינורות זיהוי גדולים וקטנים מהפרוטוקול. מכסים שחורים על שסתום 12/1 מייצגים תעלות אטומות. כיווני הזרימה מסומנים בחצים שחורים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
6. הכנת מערכת מיקרופלואידיקה
- טען את ממשק המשתמש של מערכת המיקרופלואידיקה במחשב האישי ובדוק שהרכיבים מחוברים כהלכה. בחר את סמל ההפעלה לצד החוט והמפיץ כדי לפתוח את ממשק המשתמש המתאים שלהם. כדי לעקוף את השסתום התלת-כיווני, סובב את יציאה 1 בחוט.
- ודא שהשסתומים שישמשו במערכת מנוקים על ידי החדרת איזופרופנול (IPA) ולאחר מכן שטפו את הצינורות מספר פעמים עם חוצץ (ים) לבחירה או מים מזוקקים כדי להסיר אוויר ו-IPA בתוך המערכת. ניתן לבצע עירוי על ידי בחירת השסתום הרצוי בממשק המשתמש של המפיץ והפעלת משאבת המזרק, בחירת עירוי/משיכה ובחירת הנפח וקצב הזרימה הרצויים (למשל, נפח 0.5 מ"ל וקצב זרימה של 0.2 מ"ל/דקה).
הערה: אין להחדיר IPA לתאי זרימה, מכיוון שהדבר יפגע בתא ובדבק, מה שעלול להוביל לדליפות.
7. הרכבת תא זרימה לתוך פינצטה פלזמונית ובדיקת נזילות
- חבר את צינורות הכניסה והיציאה לחלק המתאים של תא הזרימה לפני הנחתם על רקמה נקייה עם שכבת זהב הפונה כלפי מעלה.
- החדירו מאגר לתא הזרימה עם קצב זרימה גבוה (~0.3 מ"ל/דקה) ובדקו שהנוזל נע על פני הדגימה בתא הזרימה ושלא נראה נוזל על תא הזרימה החיצוני או התחתון. ניתן להשתמש בקצבי זרימה גבוהים יותר, בתנאי שלא מתרחשת דליפה. אם הדגימה דולפת, פרק והרכיב מחדש.
- הוסף 1-2 טיפות שמן טבילה על המטרה פי 100 לפני הנחת תא הזרימה לשלב הפינצטה הפלזמונית כששכבת הזהב פונה כלפי מטה. הנח תפסי מתכת מעל המגנטים של תאי הזרימה ונעל את ה-stage כדי לעזור לשמור אותו במקומו.
זהירות: שמן אובייקטיבי הוא מגרה, סכנה בריאותית ורעיל לחיי המים, טפל רק בכפפות.
8. איתור ננו-מבנים על מדגם
- הפעל את מקור האור הלבן. פתח את תוכנת המצלמה והגדל את זמן הרווח והחשיפה עד שהננו-מבנים נראים לעין. הפעל את הלייזר בעוצמת לייזר גבוהה יחסית והתאם את ציר ה-z באופן ידני עד שנקודת הלייזר נראית לעין. תן עדיפות להגדלת זמן החשיפה והרווח על פני הגדלת עוצמת הלייזר למציאת נקודת הלייזר.
התראה: לייזרים מהווים סיכון פוטנציאלי חמור למשתמשים. ודא שנעשה שימוש ב-PPE מתאים כגון משקפי בטיחות לייזר עם צפיפות אופטית מספקת בטווח אורכי הגל הנדרש. - הפעל את הבקר הפיזואלקטרי ובחר את ההגדרות המתאימות עבור יציאת ה-COM והנפח המרביtage. הגדר את הערכים עבור צירי x, y ו- z למחצית המתח המקסימלי כדי לאפשר טווח טוב ליישר את השלב לכל הכיוונים.
הערה: ניתן למצוא ולשנות את יציאת ה-COM של הבקר הפיזואלקטרי במנהל ההתקנים תחת הכרטיסייה יציאות. - העבר את נקודת הלייזר לשכבת-על עם אחד מה-DNH באמצעות כפתורי הבקרה של צירי x, y ו-z של השלב הראשי. ודא שה-APD מופעל ולאחר מכן סגור בעדינות את המארז לפינצטה הפלזמונית.
הערה: שימוש בכלי סימון בתוכנת המצלמה, אם זמין, יעזור להזיז את נקודת הלייזר מעל ננו-מבנה. הגדר את הסמן למרכז נקודת הלייזר וכבה את הלייזר, אך השאר את מקור האור הלבן דולק, כדי לאפשר יישור קל יותר לננו-מבנה. ה-APD יכול להיות רווי יתר על המידה ולהינזק אם יותר מדי אור לייזר מגיע אליו. ודא שהדגימה מפריעה לנתיב הלייזר והגדל בהדרגה את עוצמת הלייזר כדי להבטיח שלא תגיע לרוויה. ניתן למקם מסנני צפיפות ניטרלית (N.D) לפני ה-APD כדי להפחית את האור שמגיע אליו במידת הצורך.
9. יישור אופטימלי של הלייזר עם הננו-מבנה הרצוי
- פתח את התוכנה המשויכת להקלטת APD, כגון Labview תוצרת בית, והגדר את תדר הניתוק ל-1 קילו-הרץ. תן שם והגדר את נתיב הקובץ הרצוי ואת פורמט השמות של הקבצים שיישמרו.
- כבה את מקור האור הלבן והפעל שוב את הלייזר. הגדר לעוצמת לייזר מתאימה (למשל, ~20 mW) והשתמש בפקדים הפיזואלקטריים כדי לכוונן את צירי ה-x, y ו-z עד שאות ה-APD יהיה גבוה ככל האפשר, תוך הימנעות מרוויית APD ועם סטיית תקן מינימלית (SD) של המעקב.
הערה: סביר להניח של-APD יהיה טווח רגישות אופטימלי לתיבת הילוכים (ראה מדריך מוצר) שהוא אידיאלי להישאר בסביבה, למשל, 1000-2000 mV. ניתן להשתמש במסנני N.D. כדי לשמור על השידור סביב טווח זה. השיקול העיקרי הוא שהשידור לא יהיה קרוב לנקודת הרוויה של APD, שכן לכידה עלולה להגדיל את השידור לגבול הרוויה, מה שמוביל לאובדן נתונים.
10. החדרת חלבונים לתא הזרימה
- כבה את הלייזר כדי לשמר את תוחלת החיים של הננו-מבנים והפעל את יחידת הבקרה של משאבת המזרק ואת ממשק המשתמש של המפיץ כדי לכוון את השסתום ולמשוך את כמות החלבון הרצויה (למשל, 30 מיקרוליטר). למשיכה באמצעות צינורות הזיהוי הקטנים, קצב זרימה נמוך יותר עוזר להבטיח שכל הפתרונות נמשכים (~0.01 - 0.1 מ"ל/דקה). ניתן להשתמש בקצבי זרימה גבוהים יותר כדי להפחית את זמן ההמתנה במידת הצורך.
הערה: נפח החלבון האופטימלי לשימוש תלוי בערכו של החלבון ובמה שהניסוי מקווה להשיג. ריכוז החלבון האופייני שאנו משתמשים בו הוא 1 מיקרומטר ונפח אליקוט של 100 מיקרוליטר. אם דגימת החלבון בשפע, ניתן להשתמש בריכוזים גבוהים יותר כדי להפחית את זמן הלכידה הממוצע. עם זאת, אם הריכוזים גבוהים מדי, הסיכון ללכוד שניים מאותם חלבונים בתוך הננו-מבנה יגדל. אם הניסוי דורש עירוי של ליגנד/חלבון אחר לאחר לכידת החלבון הראשוני, ניתן להעדיף נפח אליקוט נמוך יותר כדי למזער את הפסולת ואת הזמן שלוקח להחדיר את התמיסה הבאה. ודא שהצינורות נשארים שקועים בתמיסה כדי למנוע כניסת אוויר למערכת. יש לנקוט בזהירות מיוחדת במחירי חלבון אם הצינור אינו מגיע לתחתית המיכל או שהתמיסה נמשכת יתר על המידה. - באמצעות ממשק המשתמש של המיקרופלואידיקה, יש להחדיר את תמיסת החלבון בקצב זרימה דומה לקצב הנסיגה (~0.01 - 0.1 מ"ל/דקה). הניחו להחדיר בקצב זה עד שתמיסת החלבון תגיע לתא הזרימה, ולאחר מכן הפחיתו את קצב הזרימה ל-≤0.001 מ"ל לדקה. בדוק את עוצמת הקול והזמן של משאבת המזרק כדי לוודא שהם תואמים את הנפח הצפוי (למשל, דקה אחת לנפח של 1 מ"ל ב-1 מ"ל/דקה).
הערה: ניתן לחשב את הנפח הנדרש לכך על סמך נפח הצינור מהמערכת המיקרופלואידית לתא הזרימה. אם אורך הצינור ומזהה הצינור ידועים, ניתן להשתמש במחשבון מקוון לנפח צילינדר. ניתן לכוונן את קצב העירוי לפי הצורך, למשל, >0.001 מ"ל/דקה לעירוי חלבון כדי להפחית את זמן ההמתנה הממוצע למלכודת. עם זאת, מומלץ להיזהר מכיוון שאם קצב הזרימה גבוה מדי, הדבר עלול למנוע מחלבונים להיכנס לננו-מבנה.
11. איסוף נתונים
- בזמן שתמיסת החלבון מוזרקת לתא הזרימה, התחל להקליט נתונים של אות ה-APD. כוונן את צירי x, y ו-z לפי הצורך באמצעות ממשק המשתמש של הבקר הפיזואלקטרי, מכיוון שסביר להניח שהמערכת תיסחף עם הזמן. לעקבות השמנה אידיאליות יש תבנית כללית עקבית העוקבת אחר זו של העקבות באיור 3.
- לאחר התבוננות בשינוי גדול בשידור וב-S.D. בדומה לעקבות הלכידה לדוגמה, רשום את הזמן שבו זה מתרחש למיון נתונים עתידי (ראה איור 4B לדוגמה).
הערה: סחיפה במערכת עלולה להוביל לשינויים בהולכה ולעלייה ב-S.D., לפעמים די בפתאומיות, מה שעלול להיחשב בטעות למלכודת חלבון. ודא שקפיצת האות מציגה את אותה דפוס כמו מלכודת הדוגמה ולא הייתה הפרעה חיצונית כאשר הקפיצה התרחשה, כגון יישור סחיפה או רעשים חזקים שנקלטו על ידי המערכת. - אם יש צורך לשחרר את החלבון כחלק מהניסוי, כבה את הלייזר למשך ~5 שניות והפעל אותו מחדש. העקבות צריכות להיות בעלות שינוי גדול בהעברה ו-SD נמוך משמעותית, מה שמעיד על חזרה למצב הבסיס.
הערה: אם לא נצפה שינוי גדול בהולכה ו/או ב-S.D., או שנצפה עקבות דומה לחלבון שנלכד, סביר להניח שהחלבון דבוק למשטח הדגימה (ראה איור 5B, למשל).
12. פירוק הדגימה
- לאחר ביצוע הניסוי הרצוי, כבה את הלייזר, הוצא את תא הזרימה משלב 3 הצירים ונתק את צינורות המערכת המיקרופלואידית.
- הנח את תא הזרימה על רקמה נקייה כששכבת הזהב של הדגימה פונה כלפי מעלה. בעזרת אזמל חותכים בזהירות את הדבק מתחת לכיסוי הזכוכית ומרימים אותו בעדינות בעזרת פינצטה מעוגלת. השלך אותו לפח הזכוכית השבור המיועד.
זהירות: זכוכית שבורה ושימוש בחפצים חדים עלולים לגרום לפציעה. הקפידו ללבוש משקפי מגן, כפפות ומעיל מעבדה. - החזק את תא הזרימה בזווית כששכבת הזהב עדיין פונה כלפי מעלה והשתמש בפינצטה מעוגלת כדי להסיר בזהירות את הדבק בצד התחתון של תא הזרימה כדי לשחרר את הדגימה. שכפול סיליקון מאפשר הסרה קלה מבלי לפגוע במבני ה-DNH.
- בעזרת פינצטה ישרה, הרם את הדגימה ושטוף היטב עם IPA, ולאחר מכן השקה לפני הייבוש עם אקדח אוויר. אם ניתן לשימוש חוזר, אחסן את הדגימה במיכל מתאים כששכבת הזהב פונה כלפי מעלה.
הערה: לדגימות יש בדרך כלל טווח שמיש של כשבוע עד שבועיים אם מטפלים בהן כראוי, אם כי גודל הננו-מבנים משתנה עם הזמן. אם ניזוק יתר על המידה, עבור לדגימה טרייה לניסוי הבא. נזק יכול להיות בצורה של שריטות הקיימות על משטח הזהב ליד הננו-מבנים או מביצועים ניסויים גרועים, המעידים על השפלה של הננו-מבנים29.
13. הכנת המערכת לשימוש עתידי
- השתמש ברקמת עדשה מקופלת כדי לנגב את השמן מהאובייקט בכיוון אחד, הרם אותו וחזור עליו עם חלק נקי אחר של הרקמה.
הערה: יעדים מועדים למריחות ושריטות, מה שעלול לפגוע משמעותית בביצועים. יש ללבוש תמיד כפפות במהלך הניקוי ולהימנע מלגעת בחומר אורגני. השתמשו רק ברקמה חדשה לניקוי עדשות כדי למנוע זיהום ולנקות בכיוון אחד בתנועה אחת. הימנע משפשוף העדשה וניקוי רקמות קדימה ואחורה כדי למזער נזק. אם ניקוי יבש אינו מספיק, יש למרוח כמות קטנה של אתנול על הרקמה, לנגב את השמן כאמור ולסיים ברקמה יבשה. - אם ישתמשו באותן תמיסות חלבון/חיץ בשלב הבא, ייתכן שלא יהיה צורך להחליף את הצינור. אם משתמשים בפתרונות שונים, החלף את הצינורות כדי להפחית את הסיכון לזיהום מפתרונות קודמים.
הערה: אל תשתמש באותו צינור במשך יותר משבוע, גם אם אתה מבצע ניסויים עם אותם פתרונות, מכיוון שהוא יתלכלך עם הזמן.
תוצאות
לאחר רכישת הנתונים, ניתן לבצע ניתוח נתונים על הנתונים הגולמיים באמצעות קוד MATLAB כדי ליצור עקבות מהנתונים הגולמיים שנאספו על ידי ה-APD. איור 3 מתאר עקבות לכידה לדוגמה כולל קו הבסיס לפני הלכידה, אירוע הלכידה שבו נצפה שינוי גדול בשידור (ΔT/T0) וסטיית תקן לפני כיבוי הלייזר למשך כ-5 שניות לפני הפעלתו מחדש. ירידה משמעותית בסטיית התקן והחזרת ההעברה לרמות דומות לקו הבסיס מצביעה על שחרור חלבון. סחיפה ליניארית מוסרת מהעקבות באמצעות הפונקציה MATLAB detrend.m, ואז הערך הממוצע של הנתונים מתווסף בחזרה לעקבות המנותקות. מדי פעם, אנו צריכים להוריד את העקבות כאשר ההתקנה נסחפת עם הזמן, מה שגורם לירידה ליניארית בשידור (ראה העקבה האפורה באיור 3). שינויים קטנים בעקבות קו הבסיס לפני ואחרי הלכידה נובעים מהתאמת שלב כדי לייעל את קו הבסיס עם סטיית תקן מינימלית, המודגם באיור 4A. לפעמים, מולקולות חלבון נראות בעקבות מבלי להילכד, מה שנקרא חלבונים חולפים. חלבונים שחולפים על פניהם נראים כשינוי חד בהעברה, בדומה למלכודת טיפוסית (איור 4B), אולם עם משך זמן קצר יותר באופן משמעותי, כפי שמוצג באיור 4A. צפיפות ספקטרלית הספק (PSD) מציגה ניתוח נוסף לאישור לכידת חלבון על ידי מתן עוצמת אות בתדרים שונים. תנועות קונפורמציה של חלבונים נראות בדרך כלל בטווח של >1 מיקרומטר על ידי שיטות ספקטרוסקופיה של מולקולה בודדת40. איור 4C מדגים שבהשוואה לקו הבסיס, לכידת חלבון מובילה לעוצמת אות גבוהה יותר, לפחות בתחום של 10 קילו-הרץ (> 100 מיקרון). זה גם מדגיש את החשיבות של יישור הבמה לקו בסיס אופטימלי, שכן קו בסיס גרוע עלול להגביר את הרעש בתדרים שבין 50-500 הרץ, טווח תדרים המכוסה בתנועות קונפורמציה של חלבון.
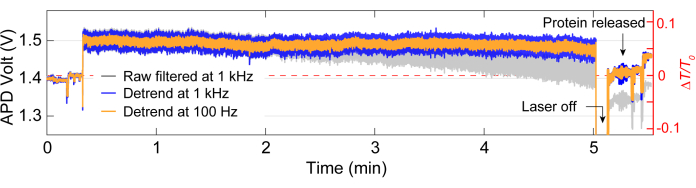
איור 3: עקבות לכידה מלאות עבור חלבון יחיד. עקבות מייצגות למלכודת מלאה, כולל קו הבסיס, לכידת חלבון ושחרור החלבון. קפיצות בעקבות לפני ואחרי ההשמנה נובעות מהיישור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
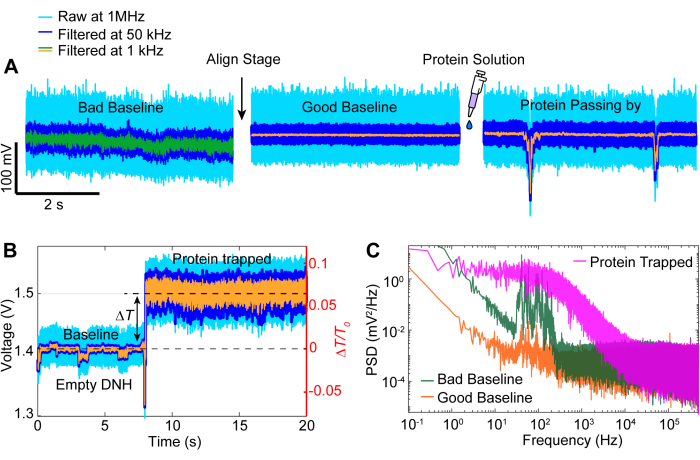
איור 4: אירועי עקבות נפוצים. (A) דוגמאות של יישור מקו בסיס גרוע לטוב וחלבון שעובר קרוב לנקודה החמה. (B) עקבות לכידה שמציגות את התהליך מקו הבסיס כאשר הנקודה החמה של הדנ"מ ריקה ועד למצב שבו החלבון לכוד. (C) תרשים צפיפות ספקטרלית של הספק (PSD) בין קווי הבסיס הטובים והרעים המתוארים ב- (A) לבין החלבון הכלוא ב -(B). ערכי PSD גבוהים יותר מצביעים על רעש גדול יותר בתדרים מסוימים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
רוב אירועי הלכידה עוקבים אחר אותו דפוס כללי כמו העקבות באיור 3, אם כי בעיות מדי פעם עשויות להתעורר במהלך ניסויים. ברוב הניסויים, יש לשחרר את החלבון באופן ידני על ידי כיבוי הלייזר לאחר השלמת הניסוי הרצוי. אולם במקרים מסוימים החלבון יכול לעזוב את המלכודת ללא התערבות, כפי שמוצג באיור 5A. לעומת זאת, לפעמים חלבונים יכולים להישאר באתר הלכידה גם לאחר כיבוי הלייזר, ככל הנראה בגלל שהחלבון נדבק לדגימה. הדבקה זו גורמת לעקבות רועשים לאחר כיבוי והדלקה של הלייזר (ראה איור 5B). הסבירות לכך תלויה בחלבון, מכיוון שחלק מהחלבונים נוטים יותר לספיחת פני השטח41,42. השימוש בציפוי כגון PEG-תיול יכול להפחית את הסיכוי לחלבון להידבק39,43. אלא אם כן רוצים, כמו חקר אינטראקציות חלבון-חלבון, נושא נוסף הוא לכידה כפולה, שבה חלבון שני נלכד לאחר המלכודת הראשונה. זה מאופיין בעלייה חדה נוספת בהדבקה, בדומה למלכודת הראשונה, ושינוי בסטיית התקן (ראה איור 5ג).
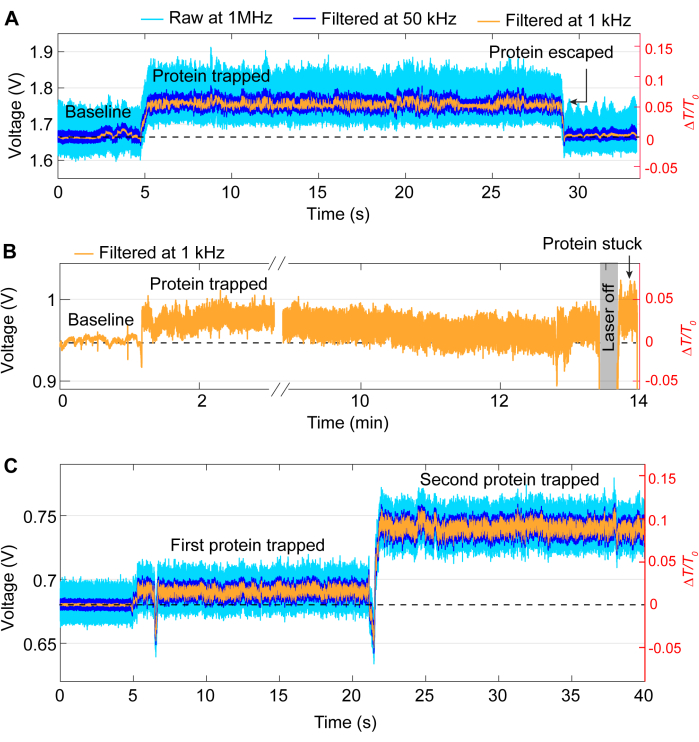
איור 5: דוגמאות לאירועי לכידה לא רצויים. (A) שחרור לא מכוון של חלבון מהנקודה החמה של DNH. (B) דוגמה לחלבון שנתקע על פני השטח של הדגימה בנקודה החמה של הדנ"ר. (C) קפיצת עקבות מתרחשת כאשר חלבון שני נלכד בזמן שהראשון עדיין נשאר בנקודה החמה של הדנ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ניסוי מייצג שבוצע על העמסת ברזל באתרה למולקולת אפו-פריטין מדגים את השימוש בפינצטה פלזמונית ככלי לחקירת דינמיקת קונפורמציה של חלבון29. פריטין הוא חלבון נשא ברזל שקיים בשני מצבים: אפו-פריטין, שאינו מכיל ברזל, והולו-פריטין, שממולא בברזל 44,45. ברזל ברזל נכנס לחלבון דרך תעלות פי 3 שם הוא מתחמצן לברזל ברזל ומאוחסן בליבת החלבון46. איור 6A מתאר עקבות לכידה אופייניים של אפו-פריטין עם תמיסת ברזל המוחדרת במשך למעלה מ-20 דקות בזמן שהחלבון לכוד. עקבות 20 השניות שנלקחו לאורך כל העקבות בנקודות b-e מספקות תובנה לגבי השינויים המתרחשים בחלבון לאורך זמן. באיור 6B, אפו-פריטין נלכד במאגר PBS סטנדרטי, ולא נצפים שינויים משמעותיים במעקב. איור 6C, D מראה תנודות ב-S.D של העקבות, הנגרמות על ידי העמסת ברזל לתוך החלבון דרך התעלות התלת-ממדיות שלו, וכתוצאה מכך מצב דינמי יותר (apo-) שבו התעלות פתוחות, ומצב קומפקטי יותר (holo-) עם התעלות סגורות. כאשר מולקולת הפריטין התמלאה בברזל, היא עברה להולופורם שלה, וכתוצאה מכך עקבות לכידה יציבים, כפי שמוצג באיור 6E. פונקציות צפיפות הסתברות (PDF) באיורים 6B-E מציגות עוד יותר את השינויים שעובר החלבון עם חשיפה לתנאי תמיסה שונים לאורך זמן.
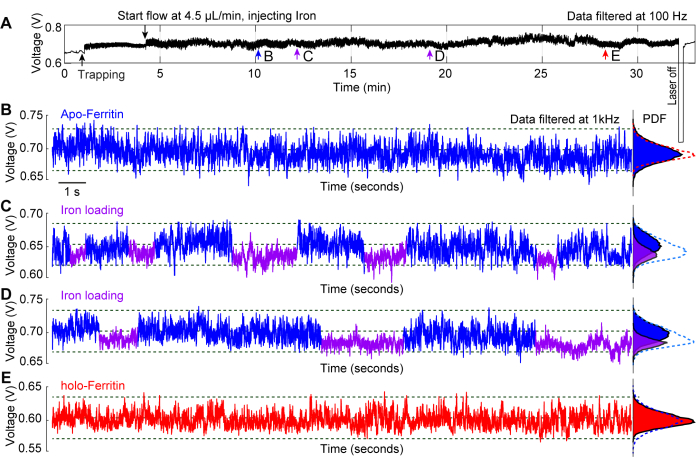
איור 6: טעינת ברזל באתרה לתוך אפופריטין לכוד. (A) עקבות העברה מלאים של DNH עם מולקולת אפופריטין כלואה, ואחריה הזרקת תמיסה ברזלית לאתר הלכידה כדי לצפות בשינויים הקונפורמטיביים של פריטין הקשורים להעמסת ברזל. (B) עקבות לכידה של 20 שניות של אפופריטין שנלכד לפני שתמיסת ברזל הגיעה לנקודה חמה. (C, D) עקבות לכידה של 20 שניות לאחר שמולקולת האפופריטין נחשפה לתמיסת הברזל. מקטעים כחולים וסגולים מסמנים את ה-S.D הגבוה והנמוך יותר של העקבות, מה שמעיד על קונפורמציות גמישות ונוקשות של פריטין, בהתאמה. (E) עקבות לכידה של 20 שניות לאחר שאפופריטין נחשף לתמיסת הברזל למשך >20 דקות. תרשימי פונקציית צפיפות ההסתברות (PDF) מימין מציגים את התפלגות השידור ומקודדים בצבע למקטעים הכחולים והסגולים. נתון זה שונהמ-29. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: דגימת DNH זהב המותקנת על תא הזרימה המודפס בתלת מימד. הדגימה מוכנסת לחריץ מיוחד ומודבקת לתא הזרימה באמצעות סרט דבק PET דו צדדי. פרמטרים מרכזיים ומדידות נלוות לעיצוב תאי הזרימה שלנו מסומנים. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: גב תא הזרימה עם דגימת DNH זהב מותקנת ודופן פנימית מסומנת. הדגימה אטומה בתא הזרימה באמצעות שכפול סיליקון. אנא לחץ כאן להורדת קובץ זה.
איור משלים 3: תרשים של תא הזרימה עם DNH זהב המותקן עם חורי יניקה ויציאה מסומנים. אנא לחץ כאן להורדת קובץ זה.
Discussion
שלב מכריע בפרוטוקול הוא להבטיח שתא הזרימה לא ידלוף לפני הכנסתו לשלבה, אותו יש לבדוק מחוץ לתושבת בקצב זרימה גבוה לפני כן. דליפה לאחר הרכבת הדגימה עלולה לפגוע ברכיבים אופטיים, בפרט במטרה התחתונה.
היישור עלול להיסחף ממיקומו האופטימלי לאורך זמן במהלך ניסוי, ולגרום לשינוי אות עקב הרגישות של הפינצטה הפלזמונית. כאשר זה קורה, יישר מחדש באמצעות הפקדים הפיזואלקטריים לשידור מקסימלי וסטיית תקן מינימלית של קו הבסיס, מכיוון שקו בסיס רועש מפחית את איכות הנתונים. יש להקפיד לרשום הערות קפדניות מתי מתבצעות יישורים כדי להסיר את הסיכון לבלבול הפרעות משתמש לאירוע לכידה. אם מתרחשת סחיפה גדולה, יישר בעדינות את השלב כדי למזער את הסיכון לשחרור החלבון ושים לב לזמן ההתאמה.
ניתן לבצע שינויים ושינויים בטכניקה המוצגת על סמך צרכים ניסיוניים ספציפיים. לדוגמה, שלב מבוקר טמפרטורה יכול לעזור לקרר/לחמם את הדגימה לפי הצורך במקום להשתמש בחימום לייזר כדי להעלות את הטמפרטורה31,33. טכניקות אחרות, למשל, מיקרוסקופ פיזור אינטרפרומטרי (iSCAT), יכולות לספק הפרעה של החלבון בתוך שדה הפיזור של ה-DNH, ולהשיג אות נוסף פרופורציונלי ליכולת הקיטוב של החלבון, הקשור לגודל החלקיקים47,48.
פינצטה פלזמונית היא אך ורק טכניקת חישה זמנית מכיוון שהנתונים נרשמים על ידי ה-APD (גלאי פיקסל יחיד). טכניקה זו אינה מספקת מידע ישיר על השינויים המבניים של חלבון, כגון אילו אזורים של החלבון מעורבים בשינוי קונפורמציה או היכן ליגנד או חלבון אחר עשויים להיקשר לחלבון. בנוסף, הטכניקה מוגבלת לתחום זמני של >1 μs בשל קצב הדגימה של כרטיס רכישת הנתונים (1 MHz). בהתחשב בתדר Nyquist, שבו הטווח הגבוה ביותר האפשרי הוא מחצית מקצב הרכישה, במקרה זה, 2 μs בתנאים מושלמים.
בפרוטוקול זה, תיארנו את תהליך הקמת ניסוי פינצטה פלזמונית כדי ללכוד חלבון בודד ולעקוב אחר שינויים בדינמיקה הקונפורמציונית שלו לאורך זמן. ניתן לפתח את הטכניקה בכל מיקרוסקופ ביתי או מסחרי. בניגוד לגישות מבוססות פלואורסצנטיות או קשירה, כגון smFRET ופינצטה אופטית, הטכניקה יכולה ללכוד חלבונים ללא תוויות או קשירה ועדיין להשיג רגישות למולקולה אחת. ניתן לשנות את תנאי התמיסה בזמן שהחלבון נלכד באמצעות מערכת מיקרופלואידיקה, המאפשרת ניטור בזמן אמת של השפעת התמיסות השונות על החלבון. תכונות אלה הופכות את הפינצטה הפלסמונית לכלי מבטיח בתחומי הביופיזיקה והביו-חישה, במיוחד עבור חלבונים שטכניקות קונבנציונליות מתקשות לחקור במצבם הטבעי. יישומים עתידיים יתמקדו בפענוח הדינמיקה הקונפורמציונית של חלבונים דינמיים יותר כגון חלבונים לא מסודרים באופן מהותי וחלבונים המכילים אזורים לא מסודרים באופן מהותי, וחלבוני ממברנה, שהדינמיקה ואפילו המבנה שלהם חומקים מהטכניקות הנוכחיות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
S.Z. מודה על תמיכתה של השותפות להכשרת דוקטורט של מועצת המחקר לביוטכנולוגיה ומדעי הביולוגיה (BBSRC DTP) (BB/T0083690/1). המחברים מודים למימון מיוזמת החינוך והמחקר של בריטניה-הודו (UKIERI). מ.ר. מעריך את תמיכת החברה המלכותית וקרן וולפסון.
Materials
| Name | Company | Catalog Number | Comments |
| 100x Objective (NA = 1.25) | Olympus | PLN100XO | Clean oil only with lens cleaning tissue in one motion |
| 12-1 rotary bidirectional microfluidic valve | Elveflow | ||
| 3/2 way solenoid valve | Elveflow | ||
| 4x Objective (NA = 0.1) | Olympus | PLN4XP | |
| Airgun | RS Components | 666-6772 | |
| Avalanche photodiode (APD) | Thorlabs | APD120A/M | Do not oversaturate, 50 MHz bandwidth, static sensitive |
| Butterfly laser diode | Thorlabs | FPL852S | |
| Charge-coupled device (camera) | Hikrobot | MV-CE200-10UC | |
| Crystallising dish | VWR | 216-0065 | |
| Data acquisition card | National instruments | USB-6361 | 2 MHz sampling rate |
| Double-sided tape | Adhesive Research Inc | ARcare92712 | Cut appropriate shape for flow cell with a laser cutter |
| Ethanol | Fume hood only, use gloves | ||
| Fibreport collimator | Thorlabs | PAF2-A7B | |
| Glass microscope coverslips (thickness 0.17 mm) | |||
| Half wave plate | Thorlabs | AHWP10M-980 | |
| Ideal-tek 120 mm, stainless steel, straight tweezers | RS Components | 282-7472 | For holding sample and peeling double sided tape |
| Isopropanol (IPA) | Fume hood only, use gloves | ||
| Lens cleaning tissue | Thorlabs | MC-5 | |
| Metrosil rapid duplicating silicone parts A and B | Metrodent | MSILR/1 | |
| Microscope slides (75 mm x 26 mm) | |||
| Modular Optical Tweezers System | Thorlabs | OTKB/M-CUSTOM | |
| Objective oil | Olympus | Use gloves, store between 2oC-8oC | |
| Photodiode laser mount | Thorlabs | CLD1015 | |
| Piezoelectric controller | Thorlabs | MDT693B | |
| Piezoelectric stage | Thorlabs | Nanomax 300 | |
| Planoconcave lens (f = -50 mm) | Thorlabs | LC1715-B | |
| Planoconvex lens (f = 150 mm) | Thorlabs | LA1433-B | |
| Planoconvex lens (f = 60 mm) | Thorlabs | LA1134-B | |
| Poly(ethylene glycol) methyl ether thiol (PEG-thiol) 800 MW | Sigma Aldrich | 729108 | Store between 2oC-8oC |
| PTFE tubing (ID: 0.18 mm) | Vici Jour | JR-T-6805-M25 | |
| PTFE tubing (ID: 0.8 mm) | Cole-Parmer | WZ-21942-72 | |
| SEM-FIB | Zeiss | Crossbeam 550 | Gallium ion source |
| Shortpass dichroic mirror 805 nm | Thorlabs | DMSP805 | |
| Silver mirror | Thorlabs | PF-10-03-P01 | |
| Syringe pump | Harvard Apparatus | 70-4511 | |
| Weller Erem 120 mm stainless steel, flat, rounded tweezers | RS Components | 176-1150 | For holding glass coverslip and peeling glue from flow cell |
References
- Peter Lu, H. P. Sizing up single-molecule enzymatic conformational dynamics. Chem Soc Rev. 43 (4), 1118-1143 (2014).
- Mazal, H., Haran, G. Single-molecule FRET methods to study the dynamics of proteins at work. Curr Opin Biomed Eng. 12, 8-17 (2019).
- Ritchie, D. B., Woodside, M. T. Probing the structural dynamics of proteins and nucleic acids with optical tweezers. Curr Opin Str Biol. 34, 43-51 (2015).
- Neupane, K., Solanki, A., Sosova, I., Belov, M., Woodside, M. T. Diverse metastable structures formed by small oligomers of α-Synuclein probed by force spectroscopy. PLoS One. 9 (1), e86495(2014).
- Hughes, M. L., Dougan, L. The physics of pulling polyproteins: a review of single molecule force spectroscopy using the AFM to study protein unfolding. Rep Prog Phys. 79 (7), 076601-076601 (2016).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Schmid, S., Dekker, C. Nanopores: a versatile tool to study protein dynamics. Essays Biochem. 65 (1), 93-107 (2021).
- Van Meervelt, V., et al. Real-time conformational changes and controlled orientation of native proteins inside a protein nanoreactor. J Am Chem Soc. 139 (51), 18640-18646 (2017).
- Awasthi, S., Ying, C., Li, J., Mayer, M. Simultaneous determination of the size and shape of single α-Synuclein oligomers in solution. ACS Nano. 17 (13), 12325-12335 (2023).
- Sµnchez-Rico, C., Von Vithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of fluorophore attachment on protein conformation and dynamics studied by spFRET and NMR spectroscopy. Chemistry. 23 (57), 14267-14277 (2017).
- Yin, L., et al. How does fluorescent labeling affect the binding kinetics of proteins with intact cells. Biosens Bioelectr. 66, 412-416 (2015).
- Berkovich, R., et al. Rate limit of protein elastic response is tether dependent. Proc Natl Acad Sci. 109 (36), 14416-14421 (2012).
- Dahmardeh, M., Mirzaalian Dastjerdi, H., Mazal, H., Köstler, H., Sandoghdar, V. Self-supervised machine learning pushes the sensitivity limit in label-free detection of single proteins below 10 kDa. Nat Meth. 20 (3), 442-447 (2023).
- Becker, J., et al. A quantitative description for optical mass measurement of single biomolecules. ACS Photon. 10 (8), 2699-2710 (2023).
- Houghtaling, J., et al. Estimation of shape, volume, and dipole moment of individual proteins freely transiting a synthetic nanopore. ACS Nano. 13 (5), 5231-5242 (2019).
- Plesa, C., et al. Fast translocation of proteins through solid state nanopores. Nano Lett. 13 (2), 658-663 (2013).
- Schmid, S., Stömmer, P., Dietz, H., Dekker, C. Nanopore electro-osmotic trap for the label-free study of single proteins and their conformations. Nat Nanotechnol. 16 (11), 1244-1250 (2021).
- Shi, X., Verschueren, D. V., Dekker, C. Active delivery of single DNA molecules into a plasmonic nanopore for label-free optical sensing. Nano Lett. 18 (12), 8003-8010 (2018).
- Verschueren, D. V., et al. Label-free optical detection of DNA translocations through plasmonic nanopores. ACS Nano. 13 (1), 61-70 (2019).
- Verschueren, D., Shi, X., Dekker, C. Nano-optical tweezing of single proteins in plasmonic nanopores. Small Meth. 3 (5), 1800465(2019).
- Peri, S. S. S., et al. Quantification of low affinity binding interactions between natural killer cell inhibitory receptors and targeting ligands with a self-induced back-action actuated nanopore electrophoresis (SANE) sensor. Nanotechnology. 32 (4), 045501(2020).
- Leong, I. W., Tsutsui, M., Yokota, K., Taniguchi, M. Salt gradient control of translocation dynamics in a solid-state nanopore. Anal Chem. 93 (49), 16700-16708 (2021).
- Juan, M. L., Righini, M., Quidant, R. Plasmon nano-optical tweezers. Nat Photon. 5 (6), 349-356 (2011).
- Juan, M. L., Gordon, R., Pang, Y., Eftekhari, F., Quidant, R. Self-induced back-action optical trapping of dielectric nanoparticles. Nat Phys. 5 (12), 915-919 (2009).
- Pang, Y., Gordon, R. Optical trapping of 12 nm dielectric spheres using double-nanoholes in a gold film. Nano Lett. 11 (9), 3763-3767 (2011).
- Pang, Y., Gordon, R. Optical trapping of a single protein. Nano Lett. 12 (1), 402-406 (2012).
- Kotnala, A., Gordon, R. Quantification of high-efficiency trapping of nanoparticles in a double nanohole optical tweezer. Nano Lett. 14 (2), 853-856 (2014).
- Booth, L. S., et al. Modelling of the dynamic polarizability of macromolecules for single-molecule optical biosensing. Sci Rep. 12 (1), 1995(2022).
- Yousefi, A., et al. Optical monitoring of in situ Iron loading into single, native ferritin proteins. Nano Lett. 23 (8), 3251-3258 (2023).
- Yousefi, A., et al. Structural Flexibility and Disassembly Kinetics of Single Ferritin Molecules Using Optical Nanotweezers. ACS Nano. 18 (24), 15617-15626 (2024).
- Peters, M., et al. Energy landscape of conformational changes for a single unmodified protein. NPJ Biosens. 1 (1), 14-14 (2024).
- Peters, M., McIntosh, D., Branzan Albu, A., Ying, C., Gordon, R. Label-free tracking of proteins through plasmon-enhanced interference. ACS Nanosci Au. 4 (1), 69-75 (2024).
- Ying, C., et al. Watching single unmodified enzymes at work. arXiv. , (2021).
- Yang-Schulz, A., et al. Direct observation of small molecule activator binding to single PR65 protein. NPJ Biosensing. 2 (1), 1-10 (2025).
- Yang, W., van Dijk, M., Primavera, C., Dekker, C. FIB-milled plasmonic nanoapertures allow for long trapping times of individual proteins. iScience. 24 (11), 103237(2021).
- Koya, A. N., et al. Novel plasmonic nanocavities for optical trapping-assisted biosensing applications. Adv Optical Mater. 8 (7), 1901481(2020).
- Goswami, A., Umashankar, R., Gupta, A. K., Aravindan, S., Rao, P. V. Development of a microstructured surface using the FIB. J Micromanufact. 1 (1), 53-61 (2018).
- Onuta, T. D., Waegele, M., DuFort, C. C., Schaich, W. L., Dragnea, B. Optical field enhancement at cusps between adjacent nanoapertures. Nano Lett. 7 (3), 557-564 (2007).
- Al-Ani, A., et al. The influence of PEG-thiol derivatives on controlling cellular and bacterial interactions with gold surfaces. Appl Surf Sci. 462, 980-990 (2018).
- Schuler, B., Hofmann, H. Single-molecule spectroscopy of protein folding dynamics-expanding scope and timescales. Curr Opin Str Biol. 23 (1), 36-47 (2013).
- Kopac, T. Protein corona, understanding the nanoparticle-protein interactions and future perspectives: A critical review. Int J Biol Macromol. 169, 290-301 (2021).
- Li, X., Guo, W., Xu, R., Song, Z., Ni, T. The interaction mechanism between gold nanoparticles and proteins: Lysozyme, trypsin, pepsin, γ-globulin, and hemoglobin. Spectrochim Acta A Mol Biomol Spectrosc. 272, 120983(2022).
- Emilsson, G., et al. Strongly stretched protein resistant poly(ethylene glycol) brushes prepared by grafting-To. ACS Appl Mater Inter. 7 (14), 7505-7515 (2015).
- Theil, E. C., Liu, X. S., Tosha, T. Gated pores in the ferritin protein nanocage. Inorg Chim Acta. 361 (4), 868-874 (2008).
- Theil, E. C., et al. The ferritin iron entry and exit problem. Inorg Chim Acta. 297 (1), 242-251 (2000).
- Takahashi, T., Kuyucak, S. Functional properties of threefold and fourfold channels in Ferritin D=deduced from electrostatic calculations. Biophys J. 84 (4), 2256-2263 (2003).
- Gemeinhardt, A., et al. Label-free imaging of single proteins secreted from living cells via iSCAT microscopy. J Vis Exp. (141), e58486(2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nat Comm. 5 (1), 4495(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved