Method Article
Мониторинг конформационной динамики одиночных немодифицированных белков с помощью плазмонного нанопинцета
В этой статье
Резюме
Плазмонные нанопинцеты используют локализованный поверхностный плазмонный резонанс в золотых наноструктурах для захвата отдельных наночастиц, включая белки, в оптическом поле нанометрового масштаба. Изменения в рассеянном сигнале выявляют присутствие белка и конформационную динамику, что позволяет проводить мониторинг без модификации флуорофоров или поверхностного связывания.
Аннотация
Современные методы определения характеристик белков с использованием одной молекулы обычно требуют меток, тросов или использования ненативных условий раствора. Такие изменения могут изменить биофизику белка и снизить полезность полученных данных. Плазмонный нанопинцет — это метод, который использует локализованный поверхностный плазмонный резонанс (LSPR) на золотых наноструктурах для усиления электрического поля в ограниченной области горячей точки. Это усовершенствование поля позволяет использовать лазеры с низкой мощностью для захвата отдельных наночастиц, гораздо меньших, чем обычные оптические пинцеты, вплоть до нескольких нанометров в диаметре, таких как отдельные белки. Захват отдельных белковых молекул в области горячей точки вызывает сдвиг локального показателя преломления (nбелка >n воды), изменяя рассеяние света как продукт поляризуемости молекулы, на которую влияют ее объем, анизотропия формы и показатель преломления. Лавинный фотодиод (АПД) собирает последующие изменения в рассеянии света. Эти изменения затем могут быть проанализированы для определения изменений в захваченной молекуле, включая ее размер, глобальную конформацию и динамику конформационных изменений с течением времени. Включение микрофлюидики в систему позволяет контролировать изменения окружающей среды и отслеживать их последующее воздействие на молекулу в режиме реального времени. В этом протоколе мы демонстрируем шаги по захвату отдельных белковых молекул, изменению условий их растворения в окружающей среде и мониторингу соответствующих конформационных изменений с помощью системы плазмонного нанопинцета.
Введение
Современные одномолекулярные методы исследования конформационной динамики белков включают методы, основанные на мечении, такие как передача энергии флуоресцентного резонанса (FRET)1,2, подходы, основанные на привязке, такие как оптический пинцет 3,4 и атомно-силовая микроскопия (АСМ)5, методы, основанные на интерференции, такие как интерференционно-рассеивающая микроскопия (iSCAT)6, или методы, основанные на нанофлюидах, такие как нанопоры7.8,9. Хотя эти методы имеют много преимуществ; Несколько ключевых ограничений не позволяют им предоставить данные о конформационной динамике немодифицированных белков. FRET и оптический пинцет требуют флуорофорной маркировки или привязки к поверхности, что может повлиять на биофизические свойства белков 10,11,12. iSCAT, хотя технически не имеет меток, также требует взаимодействия между белком и поверхностью для наблюдения интерференции, возникающей между ними, которая потенциально влияет на свойства белков. Более того, ограниченный соотношением сигнал/шум, iSCAT может обнаруживать белки только >40 кДа из-за шума оборудования и спеклоподобных фоновыхколебаний13. Хотя этот предел размера может быть смягчен с помощью машинного обучения, компоненты буфера ограничены, поскольку они могут влиять на оптические свойства, что приводит к зашумлению данных13,14. Нанопоры обеспечивают быстрое время транслокации белков через пору (обычно в пределах 5 мкс), что делает их неспособными обнаруживать более медленную конформационную динамику 15,16, хотя исследования по смягчению этих ограничений, такие как использование ДНК-оригами в нанопоровой электроосмотической ловушке 17 или включение плазмоники 18,19,20,21. Кроме того, высокие концентрации солей, обычно около 1 М, могут снизить применимость данных для работы in vivo 15,22. Идеальная одномолекулярная методика для определения характеристик белков должна осуществлять мониторинг белков в режиме реального времени и фиксировать конформационную динамику в течение более длительных периодов времени (т.е. миллисекунд) без необходимости модификации белка или условий ненативного раствора.
Плазмонные нанопинцеты похожи на обычные оптические пинцеты в том смысле, что они используют свет для захвата материи. Плазмонные нанопинцеты, однако, используют локализованный поверхностный плазмонный резонанс (LSPR) для усиления электрического поля на несколько порядков для создания градиентной силы, достаточно сильной, чтобы захватить одиночные наночастицы23. Кроме того, захваченная частица играет активную роль в повышении прочности ловушки, известной как самоиндуцированный захват обратного действия (SIBA) для наноапертурных структур24. Эта ловушка SIBA позволяет при низкой мощности лазера (т.е. милливаттах) улавливать мелкие частицы диаметром всего до нескольких нанометров, такие как белки 25,26,27. Захват отдельных молекул белка в области горячей точки вызывает сдвиг локального показателя преломления (nбелка >n воды), изменяя рассеяние света на основе поляризуемости молекулы, на которую влияют объем, анизотропия формы и показатель преломлениябелка 28. Затем лавинный фотодиод (APD) обнаруживает эту информацию для отслеживания последующих изменений в рассеянии света. Кроме того, плазмонный нанопинцет позволяет контролировать захваченные белки в режиме реального времени без мечения, связей и жестких условий раствора в течение длительных периодов времени (т.е. от нескольких минут до часов)29, что соответствует критериям идеальной одномолекулярной техники для белков. Используя структуру с двойными нанодырками (DNH), плазмонные нанопинцеты продемонстрировали свою способность захватывать различные белки и выяснять из них ключевую информацию, включая конформационные переходы29, кинетику разборки30, энергетические ландшафты31, отслеживание диффузии32 и связывание лигандов33,34. Помимо структур DNH, было продемонстрировано, что альтернативные геометрии структур улавливают частицы с малыми размерамичастиц 35,36. В этом протоколе представлены основные шаги по настройке и запуску плазмонного нанопинцета со встроенной системой микрофлюидики. Мы надеемся, что этот протокол поможет повысить доступность и понимание плазмонных нанопинцетов для исследователей, особенно в области структурной биологии и биофизики.
протокол
ВНИМАНИЕ: Пожалуйста, прочтите все соответствующие паспорта безопасности (SDS) для всех используемых химических веществ и придерживайтесь всех соответствующих мер безопасности, а также носите средства индивидуальной защиты (лазерные защитные очки, лабораторные халаты, перчатки) по мере необходимости.
1. Построение настройки плазмонного нанопинцета
ПРИМЕЧАНИЕ: Оптическая установка основана на комплекте модульной оптической системы пинцета (OTKB), в котором используется другой лазер и APD (см. Таблицу материалов). Используйте только оптическое оборудование на подходящем оптическом столе, чтобы уменьшить воздействие внешних вибраций на систему. Лазер в комплекте имел длину волны 976 нм, но так как пиковая резонансная длина волны для клинового резонанса структур DNH составляет около 740-760 нм33. Мы выбрали лазер ближнего ИК-диапазона (852 нм), так как он близок к резонансному пику, индуцирует LSPR, а также имеет лучшую скорость детектирования с помощью APD на основе кремния. Лазеры с более длинными20 или более короткими18 длинами волн использовались для захвата биомолекул.
- Устанавливаем лазер в монтировку фотодиодного лазера и подаем его в коллиматор, что приводит к коллимированному лазерному лучу шириной 1,7 мм для нашей установки.
- Добавьте полуволновую пластину к световому пути, чтобы отрегулировать поляризацию. Отрегулируйте с помощью поляризатора Глана-Тейлора, чтобы вертикальная поляризация (S-поляризация) имела самую высокую интенсивность света.
ПРИМЕЧАНИЕ: Использование правильной поляризации жизненно важно для обеспечения максимального усиления электрического поля от структур DNH, поскольку они зависят от поляризации. - Сфокусируйте свет через расширитель луча, состоящий из плосковогнутой линзы (f = -50 мм), за которой следует плоско-выпуклая линза (f = 150 мм), чтобы увеличить ширину луча примерно до 5 мм, чтобы заполнить полную заднюю апертуру нижнего объектива.
- Используйте дихроичное зеркало (короткий проход 805 нм) для отражения лазера в нужное место. Установите камеру (ПЗС) позади него.
- Перенаправьте свет на нижний объектив (100x/1,25 NA) и расположите верхний объектив (4x/0,1 NA) на конфокальном расстоянии, чтобы собрать проходящий свет.
- Добавьте еще одно дихроичное зеркало (короткий проход 805 нм), чтобы отразить лазерный свет в направлении APD через плоско-выпуклую линзу, расположенную на ее фокусном расстоянии, чтобы сфокусировать свет в APD. Добавьте источник белого света (WLS) за дихроичным зеркалом, чтобы он мог пройти через установку и добраться до камеры. На рисунке 1 показана схема полностью собранного плазмонного нанопинцета.
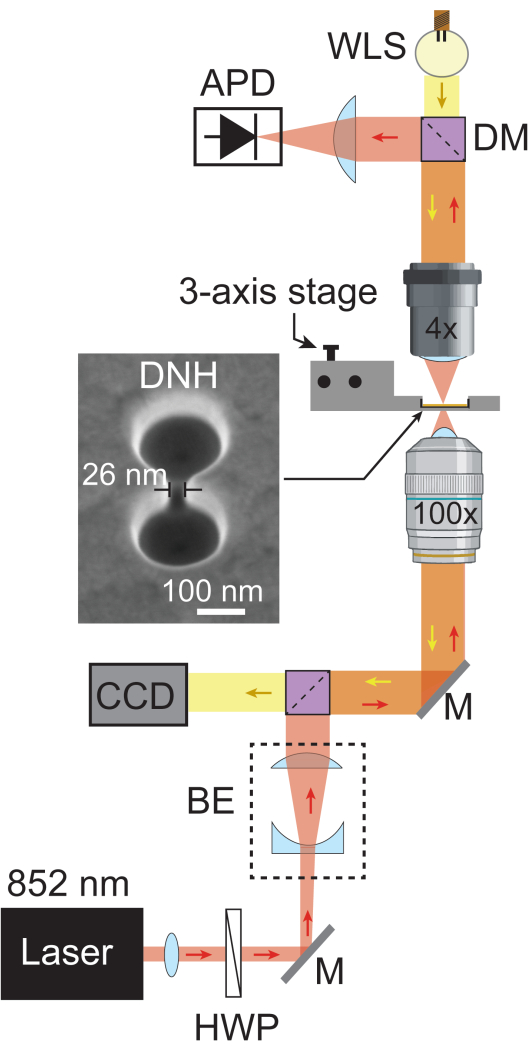
Рисунок 1: Настройка плазмонного нанопинцета. На схеме показан полный оптический путь установки плазмонного нанопинцета. Лазерный луч с длиной волны 852 нм (красный) проходит через коллиматор и полуволновую пластину, затем расширяется расширителем луча (БЭ) до ~5,1 мм. Затем он фокусируется на образце с помощью объектива 100x. Проходящий лазерный свет улавливается 4-кратным объективом и регистрируется APD с частотой дискретизации 1 МГц. Белый свет от WLS (желтый) проходит через 4-кратный объектив, образец и 100-кратный объектив, прежде чем достичь ПЗС-матрицы, которая обеспечивает яркое изображение образца. Области, где пересекаются оба световых пути, изображены оранжевым цветом. Сэм-изображение DNH, полученное под углом 20°. Сокращения: BE = расширитель луча, CCD = устройство с зарядовой связью, DM = дихроичное зеркало, HWP = полуволновая пластина, M = серебряное зеркало, и WLS = источник белого света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Изготовление конструкций DNH
- Осаждение Ti на 5 нм с последующим нанесением на 100 нм Au на пластину из плавленого кремнезема толщиной 550 мкм с использованием электронно-лучевого испарения, как описано ранее29,33. Нарежьте кубиками до образцов размером 1 см х 1 см, готовых к использованию.
ПРИМЕЧАНИЕ: Электронно-лучевое испарение было выбрано, поскольку оно создает слой золота с низкой шероховатостью поверхности, создавая высококачественные структуры DNH с высокой эффективностью улавливания37. - Возьмите чистый образец золотой пленки и установите его в установку сканирующего электронного микроскопа, сфокусированного ионным пучком (SEM-FIB) при комнатной температуре с использованием источника ионов галлия.
- Убедитесь, что наноапертуры FIB совмещены с SEM для получения DNH в точных положениях.
- Создайте маркерный ящик с помощью сильноточного ионного пучка (например, 100 пА). Этот маркер будет служить справочным ориентиром для определения положения структур DNH под оптической установкой.
- Для создания структуры DNH два круга с расстоянием между центрами 200 нм и диаметром 160 нм соединяются прямоугольником (3 нм x 40 нм). Для размера зазора около 20-30 нм протравливайте круги с коэффициентом дозы 0,09, в то время как прямоугольная доза составляет от 0,300 до 0,350, используя энергию зонда 30 кВ и ток луча 1 пА.
ПРИМЕЧАНИЕ: Используемый SEM-FIB имеет разрешение 3 нм при энергии этого датчика, что позволяет надежно изготавливать DNH с размером зазора от 20 до 30 нм. Мы не будем использовать более низкое разрешение, так как это приведет к увеличению размера зазора, что снизит эффективность захвата DNH. Если FIB невозможен, альтернативным методом получения структур DNH является использование полистирольной наносферной литографии38. Из-за высокой точности, необходимой для изготовления конструкций DNH, один и тот же рецепт может не давать одинакового размера зазора между использованием SEM-FIB. Измените дозу и высоту прямоугольника (доза от 0,280 до 0,350 и высота от 2 до 4 нм) и измерьте размер зазора, стремясь к длине волны около 20 нм.
3. Нанесение покрытий на образцы DNH
- Используйте устойчивую к растворителям емкость, такую как кристаллизационная чашка из боросиликатного стекла 3.3, и добавьте 20 мл этанола.
ВНИМАНИЕ: Этанол легко воспламеняется и является раздражающим фактором. Используйте только в вытяжном шкафу. Хранить в прохладном, хорошо проветриваемом месте. Ручка в перчатках и лабораторном халате. - Взвесьте 32 мг полиэтиленгликоля) метилового эфиртиола (ПЭГ-тиол; средняя молекулярная масса 800 г/моль) и смешайте его с этанолом, убедившись, что весь ПЭГ-тиол растворился, чтобы получить раствор с концентрацией около 2 мМ для максимизации плотности монослоя39.
ВНИМАНИЕ: ПЭГ-тиол является раздражителем; обращайтесь с ним с помощью соответствующих СИЗ. - Добавьте образцы чипов, содержащих наноструктуры, в смесь с помощью прямого пинцета, накройте крышкой и инкубируйте в течение ночи (~16 часов) при комнатной температуре, чтобы ПЭГ-тиол образовал самоорганизующийся монослой на поверхности золота.
- После инкубации промойте образцы, держа их прямым пинцетом над подходящей емкостью в вытяжном шкафу. С помощью пульверизатора тщательно распылите этанол с каждой стороны. Полностью высушите с помощью пневматического пистолета перед последующим хранением или установкой в плазмонный пинотвизет.
ПРИМЕЧАНИЕ: Образцы можно хранить при температуре 4 °C для увеличения срока службы, так как со временем они могут разрушаться.
4. Монтаж образца с покрытием PEG в проточную ячейку
- Поместите образец с покрытием в напечатанную на 3D-принтере проточную ячейку (напечатанную на принтере Form 2 с прозрачной смолой V4) с помощью прямого пинцета золотым слоем вверх (см. дополнительный рисунок 1 для основных параметров и значений в нашей конструкции проточной ячейки).
- С помощью прямого пинцета снимите одну сторону крышки из прозрачного ПЭТ-пластика с двусторонней лентой и поместите ее на проточную ячейку для образца и проточной ячейки, убедившись, что наноструктуры и впускные/выпускные отверстия в проточной ячейке остаются открытыми. Аккуратно прижмите края ленты закругленным пинцетом, чтобы убедиться, что она правильно прилегла к проточной ячейке и образцу.
- Снимите другую сторону ленты и аккуратно наденьте на образец стеклянный покровный лист (толщина 0,17 мм) с помощью закругленного пинцета. Аккуратно прижмите края покровного стекла закругленным пинцетом, чтобы убедиться, что он правильно прилег. В результате создается жидкостный канал (высота = 50 мкм, объем = 3,5 мкл) внутри проточной ячейки.
ПРИМЕЧАНИЕ: Не нажимайте на покровное стекло в месте расположения наноструктур или рядом с ним, так как они могут быть повреждены. Если покровное стекло загрязнено, промойте его этанолом и высушите с помощью пневматического пистолета перед установкой. - Смешайте равные части А и В дублирующих силиконовых растворов в соотношении 1:1 (или в соответствии с инструкцией производителя) на предметном стекле микроскопа с помощью небольшого наконечника для пипетки.
- Заполните зазоры между покровным стеклом и проточной ячейкой смешанным дублирующим силиконом, аккуратно проталкивая его под покровное стекло. Держите проточную ячейку вверх дном и осторожно поместите дубликатор силикона вокруг внутренней стенки отверстия, прежде чем использовать наконечник пипетки, чтобы аккуратно переместить его на видимые края нижней стороны образца из плавленого кремнезема (см. дополнительный рисунок 2).
- Дайте высохнуть золотым слоем вверх до полного схватывания дублирующего силикона в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Следите за тем, чтобы силикон не покрывал наноструктуры при нанесении на нижнюю сторону образца. Будьте осторожны, чтобы дублирующийся силикон не попал под защитное стекло, так как он может попасть во впускные/выпускные отверстия проточной ячейки или наноструктуры, которые может быть трудно очистить (дополнительный рисунок 3).
5. Подключение микрофлюидной системы
ПРИМЕЧАНИЕ: Убедитесь, что для системы используются чистые трубки. Здесь будут использоваться трубки из ПТФЭ с малым внутренним диаметром: внутренний диаметр 0,18 мм и трубка из ПТФЭ с большим внутренним диаметром: 0,8 мм, но будут работать и другие значения внутреннего диаметра.
- Установите шприцевой насос и подсоедините его к 3/2-ходовому электромагнитному клапану с помощью большой трубки из ПТФЭ. Подсоедините одно отверстие клапана к буферному контейнеру, а другое — к удерживающей спирали объемом около 1 мл, изготовленной из большой трубки внутреннего диаметра, чтобы предотвратить обратный поток в шприц.
ПРИМЕЧАНИЕ: Клапаном 3/2 можно управлять с помощью контроллера клапана, который определяет, вводится/выводится ли раствор из буферного контейнера или из удерживающего змеевика. - Подсоедините удерживающий змеевик к центральному клапану роторного двунаправленного микрофлюидного клапана 12/1. Соединяйте контейнеры для растворов с помощью трубок с маленьким внутренним диаметром для дефицитных или ценных образцов и трубок с большим внутренним диаметром для остальных. Используйте один клапан только для заваривания в контейнер для отходов, а другой только для заваривания в проточную камеру; используйте трубки с небольшим внутренним диаметром для инфузионного клапана проточной ячейки.
- Подсоедините трубку с большим внутренним диаметром от выхода проточной ячейки к контейнеру для отходов. На рисунке 2 показана схема полностью подключенной микрофлюидной системы.
ПРИМЕЧАНИЕ: Трубки из ПТФЭ с малым внутренним диаметром предпочтительны для забора проточной ячейки и для клапанов, которые будут использоваться для инфузии белка из-за меньшего объема, где образец будет оставаться в трубке. Трубки из ПТФЭ с большим внутренним диаметром предпочтительны для менее дорогих или более распространенных материалов, таких как буферы. Старайтесь использовать минимальное количество трубок, чтобы еще больше уменьшить этот мертвый объем.
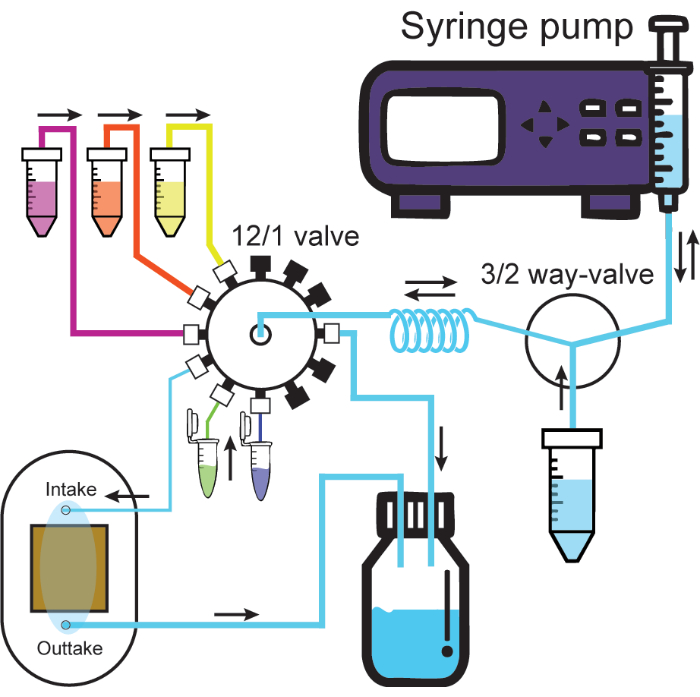
Рисунок 2: Микрофлюидная система. На схеме изображена микрофлюидная система. Шприцевой насос впрыскивает или отбирает растворы через одно отверстие 3/2-ходового клапана, либо через контейнер для раствора, либо через удерживающий змеевик. Растворы, подключенные к клапану 12/1, всегда проходят через удерживающую катушку при извлечении и затем могут быть введены через нужный канал. Инфузия во впускной канал, соединенный с проточной камерой, будет выталкивать раствор из проточной ячейки в контейнер для отходов. Толстые и тонкие трубки представляют собой большие и малые трубки с внутренним диаметром из протокола. Черные колпачки на клапане 12/1 представляют собой герметичные каналы. Направления потока обозначены черными стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Подготовка системы микрофлюидики
- Загрузите пользовательский интерфейс системы микрофлюидики на ПК и проверьте правильность подключения компонентов. Нажмите на значок воспроизведения рядом с проводом и распределителем, чтобы открыть соответствующий пользовательский интерфейс. Чтобы обойти 3/2-ходовой клапан, поверните порт 1 на проводе.
- Убедитесь, что клапаны, которые будут использоваться в системе, очищены путем введения изопропанола (IPA), а затем несколько раз промойте трубки буфером (буферами) по выбору или дистиллированной водой для удаления воздуха и изопропилового спирта внутрь системы. Инфузия может быть выполнена путем выбора нужного клапана на пользовательском интерфейсе распределителя и запуска шприцевого насоса, выбора инфузии/забора, а также выбора желаемого объема и скорости потока (например, объем 0,5 мл и скорость потока 0,2 мл/мин).
ПРИМЕЧАНИЕ: Не вводите изопропиловый спирт в проточные ячейки, так как это приведет к деградации ячейки и клея, что может привести к утечкам.
7. Монтаж проточной ячейки в плазмонный пинотец и проверка на герметичность
- Прикрепите входную и выходную трубки к соответствующей части проточной ячейки, прежде чем поместить их на чистую ткань золотым слоем вверх.
- Влейте буфер в проточную ячейку с высокой скоростью потока (~0,3 мл/мин) и убедитесь, что жидкость движется по образцу в проточной ячейке и что жидкость не видна на внешней или нижней стороне проточной ячейки. При условии отсутствия утечек можно использовать более высокие скорости потока. Если образец протекает, размонтируйте и установите снова.
- Добавьте 1-2 капли иммерсионного масла на объектив 100x перед тем, как поместить проточную ячейку в столик плазмонного нанопинцета золотым слоем вниз. Наденьте металлические зажимы на магниты проточной ячейки и зафиксируйте предметный столик, чтобы удержать его на месте.
ВНИМАНИЕ: Объективное масло является раздражителем, опасно для здоровья и токсично для водной флоры и фауны, с ним можно работать только в перчатках.
8. Локализация наноструктур на образце
- Включите источник белого света. Откройте программное обеспечение камеры и увеличьте усиление и время экспозиции, пока наноструктуры не станут видимыми. Включите лазер с относительно высокой мощностью лазера и отрегулируйте ось z вручную, пока лазерное пятно не станет видимым. Отдайте предпочтение увеличению времени экспозиции и усиления, а не увеличению мощности лазера для поиска лазерного пятна.
ВНИМАНИЕ: Лазеры представляют серьезную потенциальную опасность для пользователей. Убедитесь, что используются соответствующие СИЗ, такие как лазерные защитные очки с достаточной оптической плотностью в требуемом диапазоне длин волн. - Включите пьезоконтроллер и выберите соответствующие настройки для COM-порта и максимального напряжения. Установите значения для осей x, y и z- на половину максимального напряжения, чтобы обеспечить хороший диапазон для выравнивания столика во всех направлениях.
ПРИМЕЧАНИЕ: COM-порт пьезоэлектрического контроллера можно найти и изменить в диспетчере устройств на вкладке портов. - Переместите лазерное пятно для наложения на один из DNH с помощью ручек управления по осям X, Y и Z главного стола. Убедитесь, что APD включен, а затем осторожно закройте корпус плазмонным пинотпинцетом.
ПРИМЕЧАНИЕ: Использование инструмента маркировки в программном обеспечении камеры, если он доступен, поможет переместить лазерное пятно над наноструктурой. Установите маркер в центр лазерного пятна и выключите лазер, но оставьте включенным источник белого света, чтобы облегчить выравнивание по наноструктуре. APD может быть перенасыщен и поврежден, если на него попадает слишком много лазерного света. Убедитесь, что образец находится на пути лазерной траектории, и постепенно увеличивайте мощность лазера, чтобы не достичь насыщения. Фильтры нейтральной плотности (N.D) могут быть размещены перед APD, чтобы при необходимости уменьшить количество света, попадающего на него.
9. Оптимальное выравнивание лазера с нужной наноструктурой
- Откройте программное обеспечение, связанное с записью APD, например самодельный пользовательский интерфейс Labview, и установите частоту среза на 1 кГц. Назовите и задайте желаемый путь к файлу и формат именования файлов, которые будут сохранены.
- Выключите источник белого света и снова включите лазер. Установите соответствующую мощность лазера (например, ~20 мВт) и используйте пьезоэлектрические элементы управления для регулировки осей x, y и z до тех пор, пока сигнал APD не станет максимально высоким, избегая насыщения APD и с минимальным стандартным отклонением (S.D.) кривой.
ПРИМЕЧАНИЕ: APD, скорее всего, будет иметь оптимальный диапазон чувствительности для передачи (см. руководство по продукту), который идеально подходит для удержания, например, 1000-2000 мВ. Фильтры N.D. могут использоваться для поддержания трансмиссии в этом диапазоне. Основное соображение заключается в том, что передача не должна находиться близко к точке насыщения APD, так как перехват может увеличить передачу до предела насыщения, что приведет к потере данных.
10. Введение белков в проточную ячейку
- Выключите лазер, чтобы продлить срок службы наноструктур, и запустите блок управления насосом шприца и пользовательский интерфейс распределителя, чтобы установить клапан и извлечь желаемое количество белка (например, 30 μл). При заборе с помощью трубки с небольшим внутренним диаметром более низкий расход помогает обеспечить забор всех растворов (~0,01 - 0,1 мл/мин). При желании можно использовать более высокую скорость потока, чтобы сократить время, затрачиваемое на ожидание.
Примечание: Оптимальный объем используемого белка зависит от того, насколько ценен белок и чего надеется достичь эксперимент. Типичная концентрация белка, которую мы используем, составляет 1 мкМ, а объем аликвоты — 100 мкл. Если образец белка в большом количестве, можно использовать более высокие концентрации для сокращения среднего времени улавливания. Однако, если концентрации слишком высоки, риск захвата двух одинаковых белков внутри наноструктуры будет увеличиваться. Если эксперимент требует инфузии другого лиганда/белка после захвата исходного белка, то для минимизации отходов и времени, необходимого для введения следующего раствора, может быть предпочтительным меньший объем аликвоты. Убедитесь, что трубки остаются погруженными в раствор, чтобы предотвратить попадание воздуха в систему. Особую осторожность следует уделить белковым аликвотам, если трубка не доходит до дна контейнера или раствор слишком сильно отведен. - Используя интерфейс микрофлюидики, вводите раствор белка со скоростью, аналогичной скорости вывода (~0,01–0,1 мл/мин). Дайте настояться с этой скоростью, пока белковый раствор не достигнет проточной ячейки, затем уменьшите скорость потока до ≤0,001 мл/мин. Проверьте объем и время работы шприцевого насоса, чтобы убедиться, что они соответствуют ожидаемому объему (например, 1 минута для объема 1 мл при 1 мл/мин).
ПРИМЕЧАНИЕ: Необходимый объем для этого может быть рассчитан на основе объема трубки от микрофлюидной системы до проточной ячейки. Если длина и ID трубки известны, можно воспользоваться онлайн-калькулятором объема баллона. Скорость инфузии может быть скорректирована по желанию, например, >0,001 мл/мин для инфузии белка, чтобы сократить среднее время ожидания ловушки. Тем не менее, рекомендуется соблюдать осторожность, так как если скорость потока слишком высока, это может предотвратить попадание белков в наноструктуру.
11. Сбор данных
- В то время как белковый раствор вводится в проточную ячейку, начните запись данных сигнала APD. При необходимости отрегулируйте оси x, y и z с помощью пользовательского интерфейса пьезоэлектрического контроллера, так как система, скорее всего, будет дрейфовать со временем. Идеальные трассы треппинга имеют последовательный общий шаблон, следующий за трассой на рисунке 3.
- Наблюдая большое изменение в пропускании и S.D., аналогичное примеру трассировки захвата, отметьте время, которое это произойдет для будущей сортировки данных (см., например, Рисунок 4B ).
ПРИМЕЧАНИЕ: Дрейф в системе может привести к изменениям в передаче и увеличению S.D., иногда совершенно внезапно, что может быть ошибочно принято за белковую ловушку. Убедитесь, что скачок сигнала отображает ту же схему, что и образец ловушки, и что в момент скачка не присутствовали внешние помехи, такие как дрейф выравнивания или громкие шумы, улавливаемые системой. - Если в ходе эксперимента необходимо высвободить белок, выключите лазер на ~5 с и включите его снова. Трасса должна иметь большое изменение пропускания и значительно более низкий S.D., что указывает на возврат к исходному состоянию.
Примечание: Если значительного изменения в передаче и/или S.D. не наблюдается, или наблюдается след, аналогичный захваченному белку, белок, скорее всего, прилипает к поверхности образца (см., например, рисунок 5B).
12. Разборка образца
- После выполнения желаемого эксперимента выключите лазер, выньте проточную ячейку из 3-осевой ступени и отсоедините трубку микрофлюидной системы.
- Поместите проточную ячейку на чистую ткань золотым слоем образца вверх. С помощью скальпеля аккуратно разрежьте клей под стеклянным покровным листом и аккуратно снимите его закругленным пинцетом. Выбросьте его в специальное мусорное ведро для битого стекла.
ВНИМАНИЕ: Разбитое стекло и использование острых предметов могут привести к травме. Убедитесь, что на вас надеты защитные очки, перчатки и лабораторный халат. - Держите проточную ячейку под углом так, чтобы золотой слой все еще был направлен вверх, и с помощью закругленного пинцета осторожно удалите клей с нижней стороны проточной ячейки, чтобы освободить образец. Дублирующий силикон позволяет легко удалить его без повреждения структур DNH.
- С помощью прямого пинцета возьмите образец и тщательно промойте IPA, затем полейте перед сушкой с помощью пневматического пистолета. Если образец можно использовать повторно, храните его в подходящем контейнере золотым слоем вверх.
Примечание: При правильном обращении образцы обычно имеют полезный период около 1-2 недель, хотя размер наноструктур со временем меняется. Если он чрезмерно поврежден, переключитесь на свежий образец для следующего эксперимента. Повреждения могут быть в виде царапин, присутствующих на поверхности золота вблизи наноструктур, или от плохих экспериментальных показателей, свидетельствующих о деградации наноструктур29.
13. Подготовка системы к дальнейшему использованию
- С помощью сложенной ткани для линз вытрите масло с объектива в одном направлении, приподняв его и повторив с другой чистой частью ткани.
ПРИМЕЧАНИЕ: Объективы подвержены размазыванию и царапинам, что может значительно ухудшить производительность. Во время уборки всегда надевайте перчатки и не прикасайтесь к органическим материалам. Используйте только новую салфетку для чистки линз, чтобы предотвратить загрязнение и очищать в одном направлении одним движением. Избегайте трения линзы и чистки салфетки вперед и назад, чтобы свести к минимуму повреждение. Если сухой чистки недостаточно, нанесите небольшое количество этанола на салфетку, сотрите масло, как упоминалось ранее, и завершите сухой салфеткой. - Если в дальнейшем будут использоваться те же белковые/буферные растворы, возможно, не потребуется менять трубку. Если используются другие растворы, замените трубку, чтобы снизить риск загрязнения от предыдущих растворов.
ПРИМЕЧАНИЕ: Не используйте одну и ту же трубку более 1 недели, даже если проводите эксперименты с одними и теми же растворами, так как со временем она загрязнится.
Результаты
После сбора данных может быть выполнен анализ необработанных данных с использованием кода MATLAB для создания трассировок на основе необработанных данных, собранных APD. На рисунке 3 изображена примерная трассировка захвата, включая базовую линию до захвата, событие захвата, при котором наблюдается большое изменение пропускания (ΔT/T0) и стандартное отклонение, прежде чем лазер выключается примерно на 5 секунд перед повторным включением. Значительное снижение стандартного отклонения и возвращение передачи к уровням, аналогичным исходному, указывает на высвобождение белка. Линейный дрейф удаляется из трассировки с помощью функции MATLAB detrend.m, а затем среднее значение данных добавляется обратно к кривой без тренда. Иногда нам приходится смещать тренд с трассы по мере того, как настройка дрейфует с течением времени, что приводит к линейному снижению пропускания (см. серую кривую на рисунке 3). Небольшие изменения в трассах базовой линии до и после треппинга обусловлены корректировкой этапа для оптимизации базовой линии с минимальным стандартным отклонением, как показано на рисунке 4A. Иногда белковые молекулы видны в следе, не будучи захваченными, и называются проходящими белками. Проходящие мимо белки проявляются в виде резкого изменения в передаче, похожего на типичную ловушку (рисунок 4В), но со значительно меньшей продолжительностью, как показано на рисунке 4А. Спектральная плотность мощности (PSD) представляет собой еще один анализ, подтверждающий захват белка путем определения мощности сигнала на различных частотах. Конформационные движения белков обычно наблюдаются в диапазоне >1 мкс методами спектроскопии одиночных молекул40. На рисунке 4C показано, что по сравнению с исходным уровнем, захват белка приводит к более высокой мощности сигнала, по крайней мере, в диапазоне 10 кГц (> 100 μс). Это также подчеркивает важность выравнивания сцены по оптимизированной базовой линии, поскольку плохая базовая линия может увеличить шум на частотах от 50 до 500 Гц, частотном диапазоне, наложенном на конформационные движения белков.
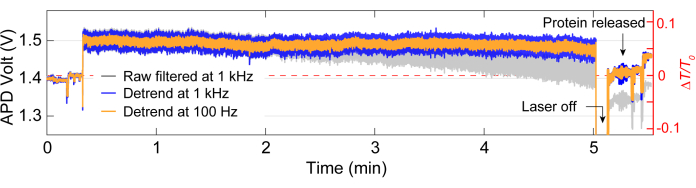
Рисунок 3: Полная трассировка ловушки для одного белка. Репрезентативная трассировка для полной ловушки, включая базовую линию, захват белка и высвобождение белка. Скачки в трассировке до и после треппинга обусловлены выравниванием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
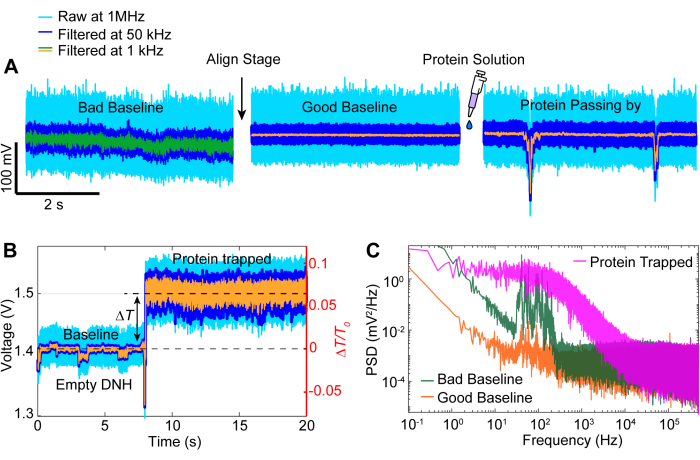
Рисунок 4: Общие события трассировки. (А) Примеры выравнивания от плохого к хорошему исходному уровню и прохождения белка вблизи горячей точки. (B) Трассировка захвата, показывающая процесс от исходного уровня, когда горячая точка DNH пуста, до момента, когда белок захвачен. (C) График спектральной плотности мощности (PSD) между хорошими и плохими базовыми линиями, изображенными на рисунке (A), и белком, захваченным на рисунке (B). Более высокие значения PSD указывают на больший шум на определенных частотах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Большинство событий треппинга следуют той же общей схеме, что и трассировка на рисунке 3, хотя иногда во время экспериментов могут возникать проблемы. В большинстве экспериментов белок следует высвобождать вручную, выключив лазер после завершения желаемого эксперимента. Однако в некоторых случаях белок может покинуть ловушку без вмешательства, как показано на рисунке 5А. И наоборот, иногда белки могут оставаться в месте захвата даже после выключения лазера, вероятно, из-за того, что белок прилипает к образцу. Это залипание приводит к появлению шумного следа после выключения и включения лазера (см. рисунок 5B). Вероятность этого зависит от белка, так как некоторые белки более склонны к поверхностной адсорбции41,42. Использование покрытия, такого как ПЭГ-тиол, может снизить вероятность прилипания белка39,43. Если этого не хочется, например, при изучении белок-белковых взаимодействий, другой проблемой является двойная ловушка, когда второй белок оказывается в ловушке после первой ловушки. Это характеризуется еще одним резким увеличением пропускания, аналогичным первой ловушке, и изменением стандартного отклонения (см. рисунок 5C).
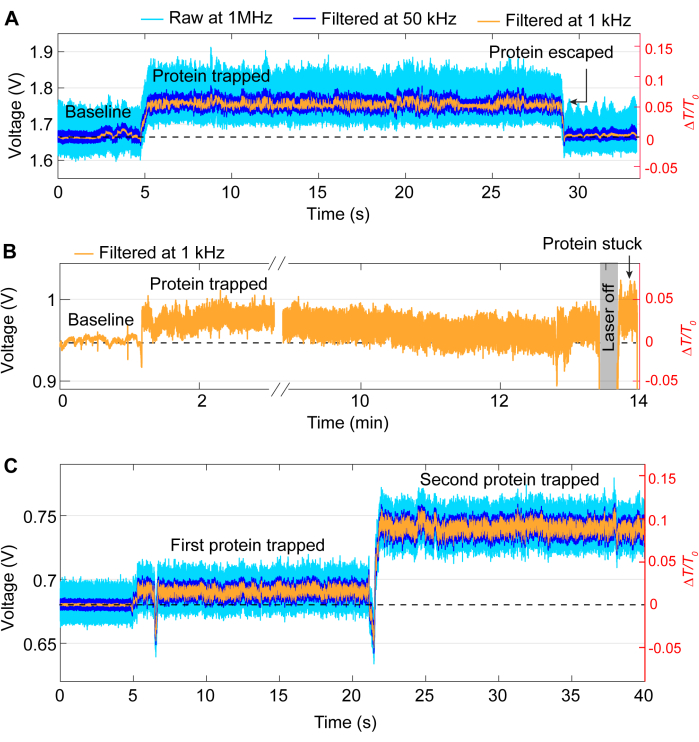
Рисунок 5: Примеры нежелательных событий перехвата. (А) Непреднамеренное высвобождение белка из горячей точки ДНГ. (B) Пример застревания белка на поверхности образца в горячей точке DNH. (В) Следный скачок происходит, когда второй белок захвачен, в то время как первый все еще остается в горячей точке ДНГ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Репрезентативный эксперимент, проведенный по нагрузке железа in situ на молекулу апоферритина, демонстрирует использование плазмонного нанопинцета в качестве инструмента для исследования конформационной динамики белков29. Ферритин является белком-переносчиком железа, который существует в двух состояниях: апо-ферритин, который не содержит железа, и голо-ферритин, который наполнен железом44,45. Двухвалентное железо поступает в белок через 3-кратные каналы, где оно окисляется до трехвалентного железа и хранится в ядре белка46. На рисунке 6А изображен типичный след захвата апоферритина с раствором железа, вводимым в течение более 20 минут, пока белок находится в ловушке. 20-секундные следы, взятые вдоль всей трассы в точках b-e, дают представление об изменениях, происходящих с белком с течением времени. На рисунке 6В апоферритин заключен в стандартный буфер PBS, и в трассе не наблюдается существенных изменений. На рисунках 6C, D показаны флуктуации S.D следов, которые вызваны загрузкой железа в белок через его 3-кратные каналы, что приводит к более динамическому состоянию (апо-), когда каналы открыты, и более компактному состоянию (голо-) с закрытыми каналами. После того, как молекула ферритина была заполнена железом, она перешла в свою голоформу, что привело к образованию стабильного следа захвата, как показано на рисунке 6E. Функции плотности вероятности (PDF) на рисунках 6B-E дополнительно демонстрируют изменения, которые претерпевает белок при воздействии различных условий раствора с течением времени.
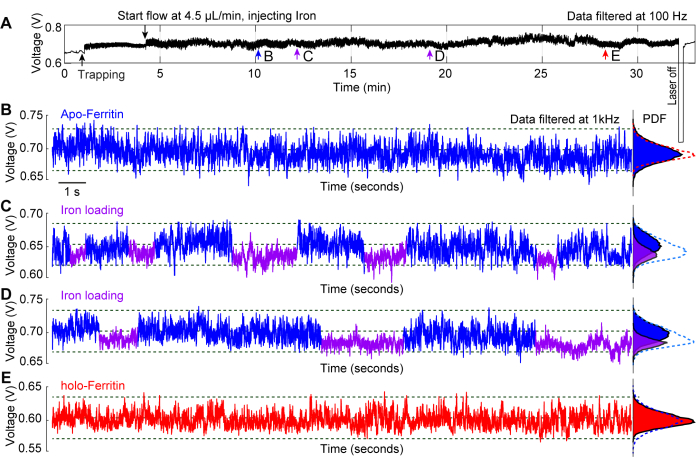
Рисунок 6: Загрузка железа in situ в захваченный апоферритин. (А) Полная трассировка пропускания ДНГ с захваченной молекулой апоферритина с последующим введением раствора ферритина в место захвата для наблюдения за конформационными изменениями ферритина, связанными с загрузкой железом. (B) 20-секундный след улавливания апоферритина, захваченный до того, как раствор ферромагнита достиг горячей точки. (C, D) 20-с следы улавливания после того, как молекула апоферритина подверглась воздействию раствора железа. Синие и фиолетовые сегменты обозначают более высокий и нижний S.D следа, указывая на гибкие и жесткие конформации ферритина соответственно. (Д) 20-секундный след захвата после того, как апоферритин подвергался воздействию раствора железа в течение >20 минут. Графики функции плотности вероятности (PDF) справа показывают распределение пропускания и имеют цветовую кодировку для синего и фиолетового сегментов. Эта цифра была изменена с29. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Образец золотого DNH, установленный на напечатанной на 3D-принтере проточной ячейке. Образец помещается в специальный паз и приклеивается к проточной ячейке с помощью двусторонней ПЭТ-клейкой ленты. Ключевые параметры и связанные с ними измерения для нашей конструкции проточной ячейки помечены. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Задняя часть проточной ячейки с установленным золотым образцом DNH и внутренней стенкой с маркировкой. Образец запечатывается в проточной ячейке с помощью дублирующего силикона. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Схема проточной ячейки с установленным золотым DNH с маркировкой впускных и выпускных отверстий. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Важным шагом в протоколе является обеспечение того, чтобы проточная ячейка не протекала перед установкой на столик, который должен быть предварительно протестирован снаружи монтировки с высокой скоростью потока. Утечка после установки образца может привести к повреждению оптических компонентов, в частности нижнего объектива.
Во время эксперимента выравнивание может смещаться от оптимального положения со временем, вызывая изменение сигнала из-за чувствительности плазмонного нанопинцета. В этом случае выполните повторную настройку с помощью пьезоэлектрических органов управления на максимальную передачу и минимальное стандартное отклонение от базовой линии, так как шумная базовая линия снижает качество данных. Следует тщательно записывать моменты выравнивания, чтобы исключить риск спутать вмешательство пользователя с событием перехвата. Если происходит значительный дрейф, аккуратно выровняйте столик, чтобы свести к минимуму риск высвобождения белка, и обратите внимание на время адаптации.
Модификации и переделки в представленную технику могут вноситься исходя из конкретных экспериментальных потребностей. Например, столик с регулируемой температурой может помочь охладить/нагреть образец по желанию вместо использования лазерного нагрева для повышения температуры31,33. Другие методы, например, интерферометрическая микроскопия рассеяния (iSCAT), могут обеспечить интерференцию белка в пределах поля рассеяния ДНХ, получая дополнительный сигнал, пропорциональный поляризуемости белка, которая связана с размером частиц47,48.
Плазмонный нанопинцет является чисто временным методом зондирования, поскольку данные записываются APD (однопиксельным детектором). Этот метод не дает прямой информации о структурных изменениях белка, например, о том, какие области белка участвуют в конформационном изменении или где лиганд или другой белок может связываться с белком. Кроме того, этот метод ограничен временным диапазоном >1 μс из-за частоты дискретизации карты сбора данных (1 МГц). Рассмотрим частоту Найквиста, где максимально возможный диапазон составляет половину скорости захвата, в данном случае 2 мкс при идеальных условиях.
В этом протоколе мы описали процесс постановки эксперимента с плазмонным нанопинцетом, чтобы поймать один белок и отслеживать изменения его конформационной динамики с течением времени. Методика может быть разработана на любом домашнем или коммерческом микроскопе. В отличие от подходов, основанных на флуоресценции или модере, таких как smFRET и оптический пинцет, этот метод может захватывать белки без меток или тросов и при этом достигать чувствительности к одной молекуле. Условия раствора могут быть изменены во время захвата белка с помощью микрофлюидной системы, позволяющей в режиме реального времени отслеживать влияние различных растворов на белок. Эти особенности делают плазмонный нанопинцет многообещающим инструментом в области биофизики и биосенсорики, особенно для белков, которые традиционные методы с трудом могут исследовать в их естественном состоянии. Будущие приложения будут сосредоточены на расшифровке конформационной динамики более динамичных белков, таких как внутренне неупорядоченные белки и белки, содержащие внутренне неупорядоченные области, а также мембранные белки, динамика и даже структура которых ускользают от современных методов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
S.Z. выражает признательность за поддержку со стороны Партнерства по подготовке докторантов Совета по биотехнологиям и биологическим наукам (BBSRC DTP) (BB/T0083690/1). Авторы признательны за финансирование со стороны Британско-индийской инициативы в области образования и исследований (UKIERI). М.Р. высоко ценит поддержку со стороны Королевского общества и Фонда Вольфсона.
Материалы
| Name | Company | Catalog Number | Comments |
| 100x Objective (NA = 1.25) | Olympus | PLN100XO | Clean oil only with lens cleaning tissue in one motion |
| 12-1 rotary bidirectional microfluidic valve | Elveflow | ||
| 3/2 way solenoid valve | Elveflow | ||
| 4x Objective (NA = 0.1) | Olympus | PLN4XP | |
| Airgun | RS Components | 666-6772 | |
| Avalanche photodiode (APD) | Thorlabs | APD120A/M | Do not oversaturate, 50 MHz bandwidth, static sensitive |
| Butterfly laser diode | Thorlabs | FPL852S | |
| Charge-coupled device (camera) | Hikrobot | MV-CE200-10UC | |
| Crystallising dish | VWR | 216-0065 | |
| Data acquisition card | National instruments | USB-6361 | 2 MHz sampling rate |
| Double-sided tape | Adhesive Research Inc | ARcare92712 | Cut appropriate shape for flow cell with a laser cutter |
| Ethanol | Fume hood only, use gloves | ||
| Fibreport collimator | Thorlabs | PAF2-A7B | |
| Glass microscope coverslips (thickness 0.17 mm) | |||
| Half wave plate | Thorlabs | AHWP10M-980 | |
| Ideal-tek 120 mm, stainless steel, straight tweezers | RS Components | 282-7472 | For holding sample and peeling double sided tape |
| Isopropanol (IPA) | Fume hood only, use gloves | ||
| Lens cleaning tissue | Thorlabs | MC-5 | |
| Metrosil rapid duplicating silicone parts A and B | Metrodent | MSILR/1 | |
| Microscope slides (75 mm x 26 mm) | |||
| Modular Optical Tweezers System | Thorlabs | OTKB/M-CUSTOM | |
| Objective oil | Olympus | Use gloves, store between 2oC-8oC | |
| Photodiode laser mount | Thorlabs | CLD1015 | |
| Piezoelectric controller | Thorlabs | MDT693B | |
| Piezoelectric stage | Thorlabs | Nanomax 300 | |
| Planoconcave lens (f = -50 mm) | Thorlabs | LC1715-B | |
| Planoconvex lens (f = 150 mm) | Thorlabs | LA1433-B | |
| Planoconvex lens (f = 60 mm) | Thorlabs | LA1134-B | |
| Poly(ethylene glycol) methyl ether thiol (PEG-thiol) 800 MW | Sigma Aldrich | 729108 | Store between 2oC-8oC |
| PTFE tubing (ID: 0.18 mm) | Vici Jour | JR-T-6805-M25 | |
| PTFE tubing (ID: 0.8 mm) | Cole-Parmer | WZ-21942-72 | |
| SEM-FIB | Zeiss | Crossbeam 550 | Gallium ion source |
| Shortpass dichroic mirror 805 nm | Thorlabs | DMSP805 | |
| Silver mirror | Thorlabs | PF-10-03-P01 | |
| Syringe pump | Harvard Apparatus | 70-4511 | |
| Weller Erem 120 mm stainless steel, flat, rounded tweezers | RS Components | 176-1150 | For holding glass coverslip and peeling glue from flow cell |
Ссылки
- Peter Lu, H. P. Sizing up single-molecule enzymatic conformational dynamics. Chem Soc Rev. 43 (4), 1118-1143 (2014).
- Mazal, H., Haran, G. Single-molecule FRET methods to study the dynamics of proteins at work. Curr Opin Biomed Eng. 12, 8-17 (2019).
- Ritchie, D. B., Woodside, M. T. Probing the structural dynamics of proteins and nucleic acids with optical tweezers. Curr Opin Str Biol. 34, 43-51 (2015).
- Neupane, K., Solanki, A., Sosova, I., Belov, M., Woodside, M. T. Diverse metastable structures formed by small oligomers of α-Synuclein probed by force spectroscopy. PLoS One. 9 (1), e86495 (2014).
- Hughes, M. L., Dougan, L. The physics of pulling polyproteins: a review of single molecule force spectroscopy using the AFM to study protein unfolding. Rep Prog Phys. 79 (7), 076601-076601 (2016).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Schmid, S., Dekker, C. Nanopores: a versatile tool to study protein dynamics. Essays Biochem. 65 (1), 93-107 (2021).
- Van Meervelt, V., et al. Real-time conformational changes and controlled orientation of native proteins inside a protein nanoreactor. J Am Chem Soc. 139 (51), 18640-18646 (2017).
- Awasthi, S., Ying, C., Li, J., Mayer, M. Simultaneous determination of the size and shape of single α-Synuclein oligomers in solution. ACS Nano. 17 (13), 12325-12335 (2023).
- Sµnchez-Rico, C., Von Vithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of fluorophore attachment on protein conformation and dynamics studied by spFRET and NMR spectroscopy. Chemistry. 23 (57), 14267-14277 (2017).
- Yin, L., et al. How does fluorescent labeling affect the binding kinetics of proteins with intact cells. Biosens Bioelectr. 66, 412-416 (2015).
- Berkovich, R., et al. Rate limit of protein elastic response is tether dependent. Proc Natl Acad Sci. 109 (36), 14416-14421 (2012).
- Dahmardeh, M., Mirzaalian Dastjerdi, H., Mazal, H., Köstler, H., Sandoghdar, V. Self-supervised machine learning pushes the sensitivity limit in label-free detection of single proteins below 10 kDa. Nat Meth. 20 (3), 442-447 (2023).
- Becker, J., et al. A quantitative description for optical mass measurement of single biomolecules. ACS Photon. 10 (8), 2699-2710 (2023).
- Houghtaling, J., et al. Estimation of shape, volume, and dipole moment of individual proteins freely transiting a synthetic nanopore. ACS Nano. 13 (5), 5231-5242 (2019).
- Plesa, C., et al. Fast translocation of proteins through solid state nanopores. Nano Lett. 13 (2), 658-663 (2013).
- Schmid, S., Stömmer, P., Dietz, H., Dekker, C. Nanopore electro-osmotic trap for the label-free study of single proteins and their conformations. Nat Nanotechnol. 16 (11), 1244-1250 (2021).
- Shi, X., Verschueren, D. V., Dekker, C. Active delivery of single DNA molecules into a plasmonic nanopore for label-free optical sensing. Nano Lett. 18 (12), 8003-8010 (2018).
- Verschueren, D. V., et al. Label-free optical detection of DNA translocations through plasmonic nanopores. ACS Nano. 13 (1), 61-70 (2019).
- Verschueren, D., Shi, X., Dekker, C. Nano-optical tweezing of single proteins in plasmonic nanopores. Small Meth. 3 (5), 1800465 (2019).
- Peri, S. S. S., et al. Quantification of low affinity binding interactions between natural killer cell inhibitory receptors and targeting ligands with a self-induced back-action actuated nanopore electrophoresis (SANE) sensor. Nanotechnology. 32 (4), 045501 (2020).
- Leong, I. W., Tsutsui, M., Yokota, K., Taniguchi, M. Salt gradient control of translocation dynamics in a solid-state nanopore. Anal Chem. 93 (49), 16700-16708 (2021).
- Juan, M. L., Righini, M., Quidant, R. Plasmon nano-optical tweezers. Nat Photon. 5 (6), 349-356 (2011).
- Juan, M. L., Gordon, R., Pang, Y., Eftekhari, F., Quidant, R. Self-induced back-action optical trapping of dielectric nanoparticles. Nat Phys. 5 (12), 915-919 (2009).
- Pang, Y., Gordon, R. Optical trapping of 12 nm dielectric spheres using double-nanoholes in a gold film. Nano Lett. 11 (9), 3763-3767 (2011).
- Pang, Y., Gordon, R. Optical trapping of a single protein. Nano Lett. 12 (1), 402-406 (2012).
- Kotnala, A., Gordon, R. Quantification of high-efficiency trapping of nanoparticles in a double nanohole optical tweezer. Nano Lett. 14 (2), 853-856 (2014).
- Booth, L. S., et al. Modelling of the dynamic polarizability of macromolecules for single-molecule optical biosensing. Sci Rep. 12 (1), 1995 (2022).
- Yousefi, A., et al. Optical monitoring of in situ Iron loading into single, native ferritin proteins. Nano Lett. 23 (8), 3251-3258 (2023).
- Yousefi, A., et al. Structural Flexibility and Disassembly Kinetics of Single Ferritin Molecules Using Optical Nanotweezers. ACS Nano. 18 (24), 15617-15626 (2024).
- Peters, M., et al. Energy landscape of conformational changes for a single unmodified protein. NPJ Biosens. 1 (1), 14-14 (2024).
- Peters, M., McIntosh, D., Branzan Albu, A., Ying, C., Gordon, R. Label-free tracking of proteins through plasmon-enhanced interference. ACS Nanosci Au. 4 (1), 69-75 (2024).
- Ying, C., et al. Watching single unmodified enzymes at work. arXiv. , (2021).
- Yang-Schulz, A., et al. Direct observation of small molecule activator binding to single PR65 protein. NPJ Biosensing. 2 (1), 1-10 (2025).
- Yang, W., van Dijk, M., Primavera, C., Dekker, C. FIB-milled plasmonic nanoapertures allow for long trapping times of individual proteins. iScience. 24 (11), 103237 (2021).
- Koya, A. N., et al. Novel plasmonic nanocavities for optical trapping-assisted biosensing applications. Adv Optical Mater. 8 (7), 1901481 (2020).
- Goswami, A., Umashankar, R., Gupta, A. K., Aravindan, S., Rao, P. V. Development of a microstructured surface using the FIB. J Micromanufact. 1 (1), 53-61 (2018).
- Onuta, T. D., Waegele, M., DuFort, C. C., Schaich, W. L., Dragnea, B. Optical field enhancement at cusps between adjacent nanoapertures. Nano Lett. 7 (3), 557-564 (2007).
- Al-Ani, A., et al. The influence of PEG-thiol derivatives on controlling cellular and bacterial interactions with gold surfaces. Appl Surf Sci. 462, 980-990 (2018).
- Schuler, B., Hofmann, H. Single-molecule spectroscopy of protein folding dynamics-expanding scope and timescales. Curr Opin Str Biol. 23 (1), 36-47 (2013).
- Kopac, T. Protein corona, understanding the nanoparticle-protein interactions and future perspectives: A critical review. Int J Biol Macromol. 169, 290-301 (2021).
- Li, X., Guo, W., Xu, R., Song, Z., Ni, T. The interaction mechanism between gold nanoparticles and proteins: Lysozyme, trypsin, pepsin, γ-globulin, and hemoglobin. Spectrochim Acta A Mol Biomol Spectrosc. 272, 120983 (2022).
- Emilsson, G., et al. Strongly stretched protein resistant poly(ethylene glycol) brushes prepared by grafting-To. ACS Appl Mater Inter. 7 (14), 7505-7515 (2015).
- Theil, E. C., Liu, X. S., Tosha, T. Gated pores in the ferritin protein nanocage. Inorg Chim Acta. 361 (4), 868-874 (2008).
- Theil, E. C., et al. The ferritin iron entry and exit problem. Inorg Chim Acta. 297 (1), 242-251 (2000).
- Takahashi, T., Kuyucak, S. Functional properties of threefold and fourfold channels in Ferritin D=deduced from electrostatic calculations. Biophys J. 84 (4), 2256-2263 (2003).
- Gemeinhardt, A., et al. Label-free imaging of single proteins secreted from living cells via iSCAT microscopy. J Vis Exp. (141), e58486 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nat Comm. 5 (1), 4495 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены