A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفحص الكيميائي المناعي المعتمد للتحديد الشامل لمستقبلات عامل نمو البشرة البشري 2 التي يتم إطلاقها من الخلايا والمرتبطة بها
In This Article
Summary
نقدم اختبار شطيرة ELISA تم التحقق من صحته باستخدام أجسام مضادة وحيدة النسيلة جديدة مضادة ل HER2. يتيح هذا الاختبار القياس الكمي الدقيق لبروتين HER2 المرتبط بالخلايا والمنطلق من الخلايا المزروعة في المختبر والعينات الأخرى ، بما في ذلك الدم والأنسجة.
Abstract
مستقبلات عامل نمو البشرة البشري 2 (HER2) هي علامة سرطان راسخة. أصبح هدفا تشخيصيا وعلاجيا ناجحا للغاية ، خاصة في سرطان الثدي وأنواع السرطان الأخرى التي تعبر عن HER2. في العيادة ، يتم استخدام طرق التشخيص الكيميائية المناعية القياسية الذهبية التي تستخدم الأجسام المضادة المحددة المضادة ل HER2 لقياس مستوى التعبير عن المستقبل المرتبط بالغشاء. يدور المجال القابل للذوبان خارج الخلية (ECD) ل HER2 الذي يتم إطلاقه من الخلايا المفرطة في التعبير في الدم ويمكن أن يعكس التعبير الأنسجيكي للمستقبل. هناك حاجة إلى فحوصات دقيقة وموثوقة لربط تركيز بروتين HER2 المتداول بالمظاهر السريرية للمرض.
قام فريقنا بتطوير والتحقق من صحة مقايسة الممتز المناعي الجديد المرتبط بإنزيم الساندويتش (ELISA) لقياس نطاق ECD المرتبط بالغشاء والخارج من الخلايا HER2. يستخدم الاختبار جسمين مضادين أحادي النسيلة فريدين خاصين ب HER2 تم تطويرهما سابقا. يشمل نطاق القياس الكمي تركيز HER2 من 1.56-100 نانوغرام / مل ، وهو أمر متوقع للخلايا السرطانية المستزرعة في المختبر ويظهر حساسية عند مستوى 0.5 نانوغرام / مل. إن دقة الفحص المرضية داخل وفيما بينها ودقة الطريقة تجعلها قابلة للتطبيق على القياس الكمي HER2 في أنواع مختلفة من العينات البيولوجية ، بما في ذلك وسط زراعة الخلايا والمصل وأنسجة الورم الصلبة. هنا ، نركز على التحديد الشامل للخلايا السرطانية المزروعة في المختبر المرتبطة والتي تفرزها. تقدم الورقة بروتوكولا خطوة بخطوة للقياس الكمي لبروتين HER2 الذي يمكن استخدامه لاختبار مجموعة متنوعة من خطوط الخلايا والدم والأنسجة.
Introduction
غالبا ما يرتبط نجاح العلاجات الحديثة بالطب الدقيق الذي يعتمد على التحديد الدقيق للمرضى الحساسينللعلاج 1. من بين هذه العلاجات الأدوية المضادة ل HER2 التي تستهدف المستقبلات التي يتم التعبير عنها بشكل مفرط في مجموعة متنوعة من الأورام ، بما في ذلك الثدي وبطانة الرحم والمعدة والرئة وغيرها. تتوفر العديد من العوامل التي تستهدف HER2 بفوائد مؤكدة في المرضى الذين يعانون من السرطانات الإيجابية HER2 ، بما في ذلك HER2 من النوعالمنخفض 2. يعد تأكيد الحالة الإيجابية HER2 أمرا بالغ الأهمية لتحديد المرضى المستجيبين المحتملين. ومع ذلك ، لا يزال يمثل تحديا ، خاصة في مجموعة HER2 المنخفضة.
تشمل الطرق القياسية الذهبية في الإعدادات السريرية ، المستخدمة بشكل روتيني لاختبار HER2 ، تعبير بروتين الكيمياء المناعية (IHC) وتضخيم جين HER2 عن طريق نهج التهجين الفلوري في الموقع (FISH). بالإضافة إلى ذلك ، يتم استخدام مقايسة Oncotype DX لتعبير HER2 mRNA. خزعة الأنسجة المطلوبة لهذه الطرق تجعل تحديد أهلية المريض للعلاج المناسب واستجابته المحتملة للعلاجات غير مؤكد. على الرغم من المبادئ التوجيهية المحدثة لعام 2018 من قبل الجمعية الأمريكية لعلم الأورام السريري (ASCO) والكلية الأمريكية لأخصائيي علم الأمراض (CAP) لتقليل التباين بين وحدات الاختبار ، يظل توافق HER2 موضوعا للتحسين3.
HER2 هو عضو أولي من الجينات الورمية في عائلة مستقبلات عامل نمو البشرة (EGFR) التي يؤدي الإفراط في التعبير والتنشيط في الحالات المرضية إلى نتيجة عدوانية أو يساهم في سوء التشخيص4. HER2 هو بروتين معياري 185 كيلو دالتون مثبت في غشاء الخلية يحتوي على تيناز التيروزين السيتوبلازمي ومجال خارج الخلية (ECD). يمكن التخلص من HER2 ECD من الخلايا ليتم إطلاقها في المصفوفة خارج الخلية5 كبروتين خال من الخلايا ، مما يؤدي إلى زيادة الدوران في الدم. قد ينعكس التعبير المتزايد عن HER2 من خلال المستوى الأعلى لاضطراب الطفولة المبكرة المنتشر ، مما يوفر علامة تنبؤية وتنبؤية قيمة6،7 ، أو علامة بديلة للاستجابة العلاجية8 ، أو كطريقة تكميلية ل IHC لتحديد المرضى المؤهلين للعلاج المضاد ل HER29. ومع ذلك ، لا يزال التحدي يتمثل في تحديد العلاقة بين تعبير HER2 للورم والمستوى الجهازي للمستقبل في الدم الذي يمكن أن يكون له معنى سريري.
يمكن قياس HER2 ECD الذي تم إصداره باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) 10. شطيرة ELISA هي طريقة تستخدم جسمين مضادين محددين يربطان حواتم مختلفة بنفس المستضد المستهدف. إنه يتيح القياس الدقيق للبروتينات القابلة للذوبان في المواد البيولوجية القائمة على الدم والسائل التي يسهل الوصول إليها (ما يسمى بالخزعة السائلة). على الرغم من وجود فحوصات معتمدة من إدارة الغذاء والدواء (FDA) ، إلا أن هناك ججلا حول فائدة تشخيصات HER2 ECD5 والقيمة النهائية لزيادة مستوى HER2 في الدم. هناك حاجة إلى مزيد من البحث باستخدام الأساليب التي تم التحقق من صحتها والعتبات المقبولة بشكل موحد لتأكيد قابلية تطبيق المقايسات11.
المكونات الحاسمة لأي ELISA هي التقاط (تجميد على اللوحة وتحديد خصوصية الفحص وحساسيته) واكتشاف الأجسام المضادة (المضافة بعد تطبيق العينات) (الشكل 1). في هذا التقرير ، نقدم بروتوكول ELISA بناء على الأجسام المضادة وحيدة النسيلة (mAb) الجديدة المضادة ل HER2 ECD التي تم إنشاؤها وتنقيتها على عمود تقارب وتوصيفها بدقة وتقديم تسلسلات فريدة12. تظهر ELISA المطورة التي تستخدم هذه الأجسام المضادة المخصصة فائدتها في القياس الكمي الدقيق لبروتين HER2 المرتبط بغشاء الخلية ويتم إطلاقه في وسط مزرعة لإجراء تقييم شامل لحالة المستقبل. يمكن استخدام الاختبار في الاختبارات قبل السريرية ولدعم البحث المستمر. تم اختبار أداء الفحص بشكل أكبر على عينات بيولوجية من أصول مختلفة ، بما في ذلك متجانسات المصل والأنسجة12 ، لإظهار الإمكانات في تطوير الأبحاث والتشخيص والعلاجات الجديدة المضادة ل HER2 في المستقبل.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. زراعة الخلايا السرطانية البشرية
- استزراع خطوط MDA-MB-231 و SK-BR-3 و SK-OV-3 في وسط النسر المعدل من Dulbecco الذي يحتوي على 4.5 جم / لتر من δ�-glucose (DMEM-HG) ، مكملة ب 2 ملي مولار ʟ-الجلوتامين و 10٪ (حجم / حجم) FBS معطل الحرارة. احتضان المزارع عند 37 درجة مئوية في جو رطب بنسبة 5٪ ثاني أكسيدالكربون.
- عندما تصل الثقافة إلى ~ 80٪ من التقاء ، افصل الخلايا عن طريق التربسين واجمعها في أنابيب مخروطية منفصلة سعة 15 مل.
- عد الخلايا ذات عداد الخلايا الأوتوماتيكي وخلايا البذور للتجربة في 12 لوحة بئر بكثافة 3 × 105 خلايا / لكل بئر في 1 مل من وسط النمو. احتضان المزارع عند 37 درجة مئوية في جو رطب بنسبة 5٪ ثاني أكسيدالكربون.
ملاحظة: قم بزرع بئر واحد في كل نقطة زمنية من التجربة. سيتم استخدام كل من وسط ما بعد الزراعة ومحللات الخلية في مزيد من التحليل.
2. جمع العينات وإعدادها
- من ثقافة 24 ساعة ، اجمع وسط الثقافة من بئر واحد من كل خط خلية في أنبوب سعة 1.5 مل.
- الطرد المركزي العينات التي تم جمعها عند 10 000 × غرام لمدة 10 دقائق عند 4 درجة مئوية. انقل المادة الطافية إلى أنبوب جديد وخزنها عند -20 درجة مئوية لتحديد مستوى ECD HER2 المفرز.
- اغسل الخلايا المتبقية على الطبق ب 1 مل من PBS البارد ، واستنشق برفق ، وتخلص من PBS.
- أضف 200 ميكرولتر من محلول RIPA (مكمل بنسبة 1٪ من مثبط الإنزيم البروتيني) في كل بئر واحتضنه لمدة 5 دقائق. اكشط الخلايا باستخدام مكشطة الخلية واخلطها عن طريق سحب العينة عدة مرات لتجانس المحللة.
- اجمع الخلايا المحللة في أنبوب جديد واستنشق ببطء في حقنة سعة 2 مل بإبرة (G21 / 0.8 مم × 40 مم). كرر خطوة الشفط 5-10 مرات لمزيد من تفكك الخلايا.
- الطرد المركزي العينات التي تم جمعها عند 10 000 × جم لمدة 10 دقائق عند 4 درجات مئوية. انقل المادة الطافية إلى أنبوب جديد وخزنها عند -20 درجة مئوية لمزيد من التحديد للجزء المرتبط بالخلية من بروتين HER2.
- كرر جمع وسط الاستزراع والمواد الخلوية ، باتباع خطوات التحضير للنقاط الزمنية المتبقية - 48 ساعة و 72 ساعة من الثقافة.
3. إجراء شطيرة ELISA لتحديد HER2
- تحضير المخازن المؤقتة.
- عازلة الطلاء: قم بإعداد محلول 0.1 M NaHCO3 عن طريق إذابة 0.42 جم من NaHCO3 في 50 مل من الماء المقطر واخلطه جيدا. اضبط الرقم الهيدروجيني إلى 9.6 مع 3 M هيدروكسيد الصوديوم.
- المخزن المؤقت للحظر: قم بإعداد 5٪ من حليب الألبان الخالي من الدسم (NFDM) في PBS عن طريق إضافة 0.5 جم من مسحوق الحليب النشاف إلى 10 مل من PBS واخلطه جيدا.
- مخزن الغسيل العازل: قم بإعداد محلول ملحي مخزن بالفوسفات مع Tween 20 (PBST) عن طريق إضافة 0.5 مل من 0.05٪ Tween-20 إلى 1000 مل من PBS واخلطه (تجنب الرغوة المفرطة).
- البيوتينيل للجسم المضاد للكشف.
- البيوتينيلات 50-200 ميكروغرام من الكشف عن الأجسام المضادة ل HER2 (استنساخ 70.21.73.67) باستخدام مجموعة ملصقات البيوتين التجارية وفقا لتعليمات الشركة المصنعة.
ملاحظة: تعتمد موثوقية وتكرار عملية البيوتينيل على قياس تركيز البروتين النهائي للجسم المضاد الناتج ومقارنة المنتج من دفعة إلى دفعة.
- البيوتينيلات 50-200 ميكروغرام من الكشف عن الأجسام المضادة ل HER2 (استنساخ 70.21.73.67) باستخدام مجموعة ملصقات البيوتين التجارية وفقا لتعليمات الشركة المصنعة.
- قم بتغطية اللوحة.
- قم بتخفيف الجسم المضاد المضاد لالتقاط HER2 (استنساخ 70.27.58) إلى تركيز 1 ميكروغرام / مل في المخزن المؤقت للطلاء. لتغطية لوحة واحدة ، استخدم 6.5 مل من محلول الجسم المضاد الملتقط.
- باستخدام ماصة متعددة القنوات، أضف 100 ميكرولتر من محلول الجسم المضاد الملتقط (المحضر في الخطوة 3.3.1) إلى كل بئر على لوحة ELISA سعة 96 بئرا.
ملاحظة: تجنب الآبار الخارجية للوحة (على سبيل المثال ، A1 ، H12) لتقليل التباين الناجم عن تأثير الحافة. يجب ملء الآبار الخارجية بالماء المقطر لضمان ظروف تفاعل مستقرة. - قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضان اللوحة طوال الليل (O / N) عند 4 درجات مئوية.
- بعد حضانة O / N ، ضع اللوحة في درجة حرارة الغرفة (RT) على شاكر أفقي دقيق (20-30 دورة في الدقيقة بزاوية إمالة 4 درجات -6 درجات) لمدة 1 ساعة.
- باستخدام غسالة صفيحة دقيقة ، قم بشفط محلول الطلاء وغسل اللوحة ثلاث مرات باستخدام مخزن مؤقت للغسيل (3 × 300 ميكرولتر من PBST لكل بئر).
- سد اللوحة .
- باستخدام ماصة متعددة القنوات، أضف 100 ميكرولتر من المخزن المؤقت للحجب (5٪ NFDM في PBS) إلى كل بئر مطلي لمنع مواقع الربط غير المحددة.
- قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضان اللوحة لمدة ساعة واحدة عند 37 درجة مئوية في غرفة الرطوبة.
- باستخدام غسالة صفيحة دقيقة ، قم بشفط محلول الطلاء وغسل اللوحة ثلاث مرات باستخدام مخزن مؤقت للغسيل (3 × 300 ميكرولتر من PBST لكل بئر).
- قم بإعداد منحنى المعايرة والتحكم الإيجابي (الشكل 2).
- قم بإعداد محلول العمل القياسي لمستضد HER2 عن طريق إضافة 2 ميكرولتر من محلول مخزون 1 مجم / مل إلى 1998 ميكرولتر من PBS للحصول على تركيز HER2 0.001 مجم / مل (1000 نانوغرام / مل).
- قم بتخفيف محلول العمل القياسي (WSS) بإضافة 200 ميكرولتر من المحلول إلى 1800 ميكرولتر من PBS للحصول على الحل القياسي 1 (STD 1).
- إعداد ستة معايير لاحقة (STD 2-STD 7) عن طريق التخفيفات التسلسلية للعدوى المنقولة بالاتصال الجنسي 1 في PBS (الشكل 2).
- STD 2: أضف 500 ميكرولتر من STD 1 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 50 نانوغرام / مل.
- STD 3: أضف 500 ميكرولتر من STD 2 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 25 نانوغرام / مل.
- STD 4: أضف 500 ميكرولتر من الأمراض المنقولة بالاتصال الجنسي 3 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 12.5 نانوغرام / مل.
- STD 5: أضف 500 ميكرولتر من STD 4 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 6.25 نانوغرام / مل.
- STD 6: أضف 500 ميكرولتر من الأمراض المنقولة بالاتصال الجنسي 5 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 3.125 نانوغرام / مل.
- STD 7: أضف 500 ميكرولتر من الأمراض المنقولة بالاتصال الجنسي 6 إلى 500 ميكرولتر من PBS واخلطها جيدا لتحضير 1.5625 نانوغرام / مل.
- STD 8: أضف 500 ميكرولتر من PBS لتحضير 0 نانوغرام / مل.
- التحكم الإيجابي: قم بتخفيف STD 1 بإضافة 100 ميكرولتر من محلول STD 1 إلى 900 ميكرولتر من PBS للحصول على محلول HER2 بتركيز بروتين 10 نانوغرام / مل.
- تحضير عينات لتجارب السنبلة والاسترداد.
- قم بإعداد عينات المصفوفة (PBS ، محللات الخلايا ، ووسط الاستزراع) المسنعة بتركيز بروتين HER2 المعروف. تحلل الخلايا المخففة 1: 2000 عن طريق إضافة 2.5 ميكرولتر من محللة الخلية المناسبة إلى 5 مل من PBS للحصول على مصفوفة عينة مع HER2 مستوى أقل من LOD للطريقة.
- استخدم WSS (1000 نانوغرام / مل) و STD1 (100 نانوغرام / مل) لعينات المصفوفة السنبلية.
- لكل مصفوفة ، قم بإعداد 6 عينات بتركيزات 0 و 2 و 5 و 10 و 30 و 50 نانوغرام / مل.
- لتحضير 0 نانوغرام / مل ، أضف 400 ميكرولتر من PBS / وسط المزرعة / محللة الخلية.
- لتحضير 2 نانوغرام / مل ، أضف 8 ميكرولتر من STD1 إلى 392 ميكرولتر من PBS / وسط المزرعة / محللة الخلية واخلطها جيدا.
- لتحضير 5 نانوغرام / مل ، أضف 20 ميكرولتر من STD1 إلى 380 ميكرولتر من PBS / وسط الثقافة / محللة الخلية واخلطها جيدا.
- لتحضير 10 نانوغرام / مل ، أضف 4 ميكرولتر من WSS إلى 396 ميكرولتر من PBS / وسط المزرعة / محللة الخلية واخلطها جيدا.
- لتحضير 30 نانوغرام / مل ، أضف 12 ميكرولتر من WSS إلى 388 ميكرولتر من PBS / وسط المزرعة / محللة الخلية واخلطها جيدا.
- لتحضير 50 نانوغرام / مل ، أضف 20 ميكرولتر من WSS إلى 380 ميكرولتر من PBS / وسط الثقافة / محللة الخلية واخلطها جيدا.
- أضف العينة ، فارغة ، وقياسية.
- باستخدام ماصة أحادية القناة، أضف 100 ميكرولتر من المعايير، فارغة (PBS)، وعينات مختبرة (محللات الخلايا ووسط الاستزراع) إلى الآبار المناسبة.
ملاحظة: ينصح بتشغيل كل عينة ثلاث نسخ. - قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضان اللوحة لمدة ساعة واحدة عند 37 درجة مئوية في غرفة الرطوبة.
- باستخدام غسالة صفيحة دقيقة ، قم بشفط محلول الطلاء وغسل اللوحة ثلاث مرات باستخدام مخزن مؤقت للغسيل (3 × 300 ميكرولتر من PBST لكل بئر).
- باستخدام ماصة أحادية القناة، أضف 100 ميكرولتر من المعايير، فارغة (PBS)، وعينات مختبرة (محللات الخلايا ووسط الاستزراع) إلى الآبار المناسبة.
- الكشف عن ارتباط الأجسام المضادة.
- تمييع الجسم المضاد للكشف عن البيوتينيل (استنساخ 70.21.73.67) في PBS إلى تركيز عمل يبلغ 1 ميكروغرام / مل. بالنسبة للوحة واحدة ، استخدم 6.5 مل من محلول عمل الأجسام المضادة للكشف عن ذلك.
- باستخدام ماصة متعددة القنوات، أضف 100 ميكرولتر من محلول عمل الجسم المضاد للكشف إلى كل بئر.
- قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضان اللوحة لمدة ساعة واحدة عند 37 درجة مئوية في غرفة الرطوبة.
- باستخدام غسالة صفيحة دقيقة ، قم بشفط محلول الطلاء وغسل اللوحة ثلاث مرات باستخدام عازل غسيل (3 × 300 ميكرولتر PBST لكل بئر).
- أضف قارن Avidin-HRP.
- قم بتخفيف قارن Avidin-HRP المتاح تجاريا 1: 40،000 بإضافة 1 ميكرولتر من المترافق الأنزيمي إلى 40 مل من PBST.
- باستخدام ماصة متعددة القنوات، أضف 100 ميكرولتر من المترافق المخفف إلى كل بئر.
- قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضان اللوحة لمدة ساعة واحدة عند 37 درجة مئوية في غرفة الرطوبة.
- باستخدام غسالة صفيحة دقيقة ، قم بشفط محلول الطلاء وغسل اللوحة ثلاث مرات باستخدام مخزن مؤقت للغسيل (3 × 300 ميكرولتر من PBST لكل بئر).
- تفاعل اللونية
- باستخدام ماصة متعددة القنوات، أضف 100 ميكرولتر من ركيزة 3،3 ′،5،5′-Tetramethylbenzidine (TMB) إلى كل بئر.
- قم بتغطية اللوحة بغشاء مانع للتسرب.
- احتضن اللوحة لمدة 1-5 دقائق عند 37 درجة مئوية بعيدا عن الضوء وراقب تطور اللون.
- عندما يصل اللون إلى المستوى المتوقع ، أضف 100 ميكرولتر من محلول التوقف لإنهاء التفاعل.
ملاحظة: يتوافق المستوى المتوقع مع اللون الأزرق الكثيف في الآبار التي تحتوي على عينات ذات تركيز عال من المادة التحليلية.
- الحصول على البيانات وتحليلها.
- قم بقياس الامتصاص عند 450 نانومتر باستخدام قارئ صفيحة دقيقة.
- باستخدام منحنى معايرة 4 معلمات ، احسب تركيز العينة بناء على معادلة المنحنى.
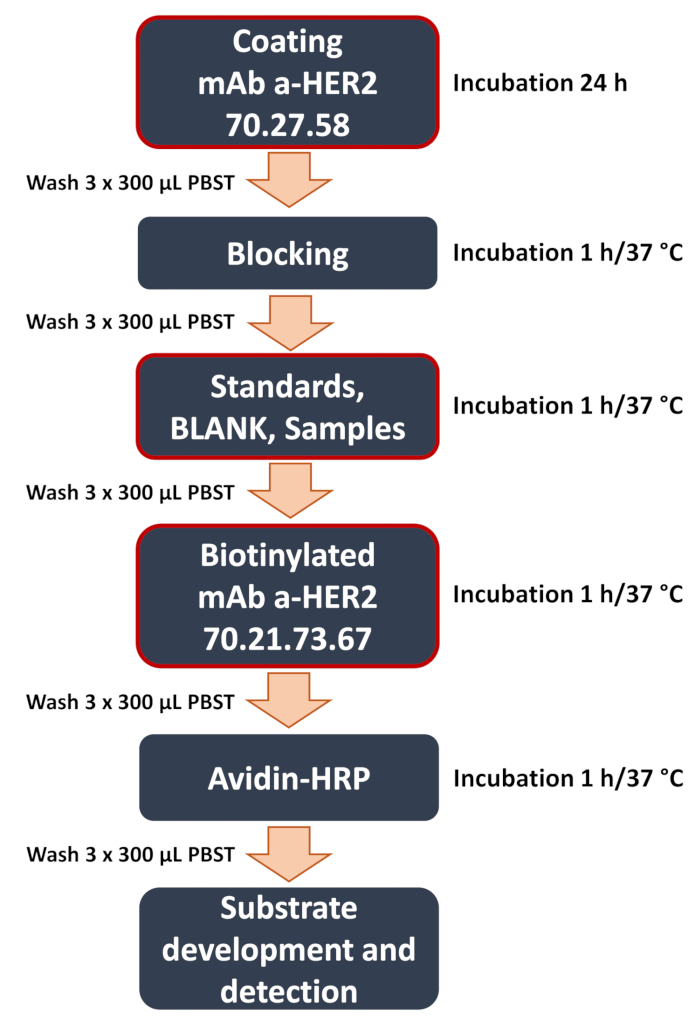
الشكل 1: رسم تخطيطي لسير عمل ELISA المطور المضاد لساندويتش HER2. نظرة عامة على الخطوات الرئيسية في إجراء شطيرة ELISA. وتشمل هذه الخطوات الحاسمة (المميزة بإطار أحمر) مثل طلاء اللوحة بالجسم المضاد المضاد ل HER2 70.27.58 ، وإضافة العينات (معايير المنحنى ، والعينات الفارغة والتجريبية من محللات الخلية أو وسط الثقافة) ، وربط الجسم المضاد للكشف عن HER2 70.21.73.67. يختتم الاختبار باكتشاف الإشارة وتحليل البيانات ، حيث يتم قياس الإشارة اللونية باستخدام قارئ صفيحة دقيقة لتحديد تركيز المستضد المستهدف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مخطط يقدم إعداد الحلول القياسية لمنحنى المعايرة. يتم تحضير التخفيفات التسلسلية للبروتين المؤتلف HER2 لتوليد منحنى معايرة في نطاق تركيز يتراوح بين 1.56-100 نانوغرام / مل (قوارير STD 1-STD 7). بالإضافة إلى ذلك ، يتم تضمين عينة التحكم السلبية بدون بروتين HER2 (STD 8). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
التحقق من صحة ساندويتش ELISA
يتطلب الاختبار المطور حديثا إجراء التحقق من الصحة. تشمل معلمات التحقق المهمة الحدود الخطية والدقة والكشف ، أي الحد الأدنى للكشف (LLOD) والحد الأعلى للكشف. في الورقة السابقة ، أجرينا التحقق الشامل من صحة الطريقة. تم اختبار خطية ELISA باستخ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
من بين المكونات الحاسمة في بناء شطيرة ELISA ، هناك التقاط الأجسام المضادة التي يتم تجميدها على اللوحة وتساهم في خصوصية الفحص وحساسيته. في الاختبار المقدم ، استخدمنا كجسم مضاد ملتقط البروتين أحادي النسيلة الجديد (HER2 / 70.27.58) الذي تم إنشاؤه وتمييزه داخليا. كان للجسم المضاد تسل...
Access restricted. Please log in or start a trial to view this content.
Disclosures
أعلنت شركة D.L.، A.A.، A.M.، M.S. عن الدعم المالي من SDS Optic SA؛ A.A, A.M., M.S. تعلن ملكية أسهم SDS Optic SA.
Acknowledgements
تم دعم الدراسة بأموال من منحة المركز الوطني للبحث والتطوير STRATEGMEDII / 269364/5 / NCBR / 2015 ومنحة الاتحاد الأوروبي ، أفق 2020 لأداة الشركات الصغيرة والمتوسطة رقم 783818.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
References
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved