É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio imunoquímico validado para determinação abrangente do receptor 2 do fator de crescimento epidérmico humano liberado e ligado às células
Neste Artigo
Resumo
Apresentamos um ensaio ELISA sanduíche validado usando novos anticorpos monoclonais anti-HER2. Este ensaio permite a quantificação precisa da proteína HER2 ligada e liberada a partir de células cultivadas in vitro e outras amostras, incluindo sangue e tecidos.
Resumo
O receptor 2 do fator de crescimento epidérmico humano (HER2) é um marcador de câncer bem estabelecido. Tornou-se um alvo diagnóstico e terapêutico muito bem-sucedido, especialmente no câncer de mama e outros tipos de câncer que expressam HER2. Na clínica, os métodos diagnósticos imuno-histoquímicos padrão-ouro que empregam os anticorpos anti-HER2 específicos são usados para medir o nível de expressão do receptor ligado à membrana. O domínio extracelular solúvel (ECD) do HER2 que é liberado das células superexpressivas circula no sangue e pode refletir a expressão tecidual do receptor. Há necessidade de ensaios precisos e validados para correlacionar a concentração da proteína HER2 circulante com as manifestações clínicas da doença.
Nossa equipe desenvolveu e validou o novo ensaio de imunoabsorção enzimática (ELISA) sanduíche para quantificação do domínio ECD ligado à membrana e liberado das células de HER2. O ensaio usa dois anticorpos monoclonais exclusivos específicos para HER2 desenvolvidos anteriormente. A faixa de quantificação inclui concentração de HER2 de 1,56-100 ng/mL, que é esperada para células cancerígenas cultivadas in vitro e mostra sensibilidade no nível de 0,5 ng/mL. A precisão e exatidão satisfatórias intra e interensaio do método o tornam aplicável para quantificação de HER2 em vários tipos de amostras biológicas, incluindo meio de cultura de células, soro e tecido tumoral sólido. Aqui, nos concentramos na determinação abrangente do receptor associado e secretado pelas células cancerígenas cultivadas in vitro . O artigo apresenta um protocolo passo a passo para a quantificação da proteína HER2 que pode ser empregado para testar uma variedade de linhagens celulares, sangue e tecidos.
Introdução
O sucesso da terapêutica moderna geralmente está relacionado à medicina de precisão, baseada na identificação precisa de pacientes sensíveis à terapia1. Entre essas terapias estão os medicamentos anti-HER2 direcionados ao receptor superexpresso em uma variedade de tumores, incluindo mama, endométrio, estômago, pulmão e outros. Vários agentes direcionados ao HER2 estão disponíveis com benefícios confirmados em pacientes com câncer HER2-positivo, incluindo HER2-low tipo2. A confirmação do status HER2-positivo é fundamental para a identificação dos pacientes potenciais que respondem; no entanto, continua sendo um desafio, especialmente no grupo HER2-low.
Os métodos padrão-ouro em ambientes clínicos, usados rotineiramente para testes de HER2, incluem a expressão da proteína imuno-histoquímica (IHC) e a amplificação do gene HER2 por abordagens de hibridização in situ fluorescente (FISH). Além disso, o ensaio Oncotype DX é usado para a expressão de mRNA de HER2. A biópsia tecidual necessária para esses métodos torna incerta a determinação da elegibilidade do paciente para o tratamento apropriado e sua potencial capacidade de resposta às terapias. Apesar das diretrizes atualizadas de 2018 pela Sociedade Americana de Oncologia Clínica (ASCO) e pelo College of American Pathologists (CAP) para reduzir a variabilidade entre as unidades de teste, a concordância do HER2 continua sendo um assunto para melhoria3.
O HER2 é um proto-oncogene membro da família dos receptores do fator de crescimento epidérmico (EGFR) que a superexpressão e ativação nos estados patológicos resultam em um desfecho agressivo ou contribuem para um mau prognóstico4. O HER2 é uma proteína modular de 185 kDa ancorada na membrana celular que contém uma tirosina quinase citoplasmática e um domínio extracelular (ECD). O HER2 ECD pode ser eliminado das células para ser liberado na matriz extracelular5 como a proteína livre de células, circulando ainda mais no sangue. O aumento da expressão de HER2 pode ser refletido pelo nível mais alto da DCE circulante, apresentando um valioso marcador preditivo e prognóstico 6,7, um marcador substituto da resposta ao tratamento8 ou como um método complementar à IHQ para identificar pacientes elegíveis para tratamento anti-HER29. No entanto, o desafio permanece em estabelecer a correlação entre a expressão do tumor HER2 e o nível sistêmico do receptor no sangue que poderia ter um significado clínico.
O HER2 ECD liberado pode ser quantificado usando ensaio imunoenzimático (ELISA)10. O ELISA sanduíche é uma abordagem que emprega dois anticorpos específicos ligando epítopos diferentes no mesmo antígeno alvo. Ele permite a medição precisa de proteínas solubilizadas no material biológico à base de sangue e líquido de fácil acesso (a chamada biópsia líquida). Apesar da presença de ensaios aprovados pela Food and Drug Administration (FDA), há controvérsia sobre a utilidade do diagnóstico de HER2 ECD5 e o valor de corte para um aumento do nível de HER2 no sangue. Mais pesquisas com os métodos validados e limiares uniformemente aceitos são necessárias para confirmar a aplicabilidade dos ensaios11.
Os componentes críticos de qualquer ELISA são a captura (imobilizada na placa e definindo a especificidade e a sensibilidade do ensaio) e a detecção de anticorpos (adicionados após a aplicação das amostras) (Figura 1). Neste relato, apresentamos o protocolo ELISA baseado nos novos anticorpos monoclonais (mAb) anti-HER2 ECD recentemente desenvolvidos que foram gerados, purificados em uma coluna de afinidade e completamente caracterizados, e apresentam sequências únicas12. O ELISA desenvolvido que emprega esses anticorpos personalizados mostra sua utilidade para a quantificação precisa da proteína HER2 associada à membrana celular e liberada em um meio de cultura para avaliação abrangente do status do receptor. O ensaio pode ser utilizado em testes pré-clínicos e para apoiar pesquisas em andamento. O desempenho do ensaio foi testado em amostras biológicas de diferentes origens, incluindo homogeneizados de soro e tecido12, para mostrar potencial no desenvolvimento de pesquisas, diagnósticos e novos tratamentos anti-HER2 no futuro.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Cultura de células cancerígenas humanas
- Cultura de linhagens MDA-MB-231, SK-BR-3 e SK-OV-3 em meio de Dulbecco Modified Eagle contendo 4,5 g/L de ᴅ-glicose (DMEM-HG), suplementado com 2 mM de ʟ-glutamina e 10% (v/v) de FBS inativado por calor. Incubar culturas a 37 °C em uma atmosfera umidificada de 5% de CO2.
- Quando a cultura atingir ~ 80% de confluência, desprenda as células por tripsinização e colete-as em tubos cônicos separados de 15 mL.
- Conte as células com um contador automático de células e células-semente para o experimento em placas de 12 poços a uma densidade de 3 × 105 células/por poço em 1 mL de meio de crescimento. Incubar culturas a 37 °C em uma atmosfera umidificada de 5% de CO2.
NOTA: Semeie um poço por cada ponto de tempo do experimento. Tanto o meio pós-cultura quanto os lisados celulares serão usados em análises posteriores.
2. Coleta e preparação de amostras
- A partir da cultura de 24 horas, colete o meio de cultura de um poço de cada linha celular em um tubo de 1,5 mL.
- Centrifugar as amostras recolhidas a 10 000 × g durante 10 min a 4 °C. Transfira o sobrenadante para um novo tubo e armazene a -20 °C para determinar melhor o nível de ECD HER2 secretado.
- Lave as células restantes na placa com 1 mL de PBS frio, aspire suavemente e descarte o PBS.
- Adicione 200 μL de tampão RIPA (suplementado com 1% de inibidor de protease) em cada poço e incube por 5 min. Raspe as células com o raspador de células e misture pipetando várias vezes para homogeneizar o lisado.
- Colete as células lisadas em um novo tubo e aspire lentamente em uma seringa de 2 mL com uma agulha (G21 / 0,8 mm × 40 mm). Repita a etapa de aspiração 5 a 10 vezes para desintegrar ainda mais as células.
- Centrifugar as amostras recolhidas a 10 000 x g durante 10 min a 4 °C. Transferir o sobrenadante para um novo tubo e conservá-lo a -20 °C para posterior determinação da fracção ligada às células da proteína HER2.
- Repita a coleta de meio de cultura e materiais celulares, seguindo as etapas de preparação para os pontos de tempo restantes - 48 h e 72 h de cultura.
3. Realizando um ELISA sanduíche para determinação de HER2
- Prepare os buffers.
- Tampão de revestimento: Prepare a solução de NaHCO3 0,1 M dissolvendo 0,42 g de NaHCO3 em 50 mL de água destilada e misture bem. Ajuste o pH para 9,6 com NaOH 3 M.
- Tampão de bloqueio: Prepare 5% de leite desnatado (NFDM) em PBS adicionando 0,5 g de leite em pó a 10 mL de PBS e misture bem.
- Tampão de lavagem: Prepare solução salina tamponada com fosfato com Tween 20 (PBST) adicionando 0,5 mL de Tween-20 a 1000 mL de PBS a 0,05% e misture (evite espuma excessiva).
- Biotinilar o anticorpo de detecção.
- Biotinilato 50-200 μg de detecção de anticorpo anti-HER2 (clone 70.21.73.67) usando um kit comercial de rotulagem de biotina de acordo com as instruções do fabricante.
NOTA: A confiabilidade e a repetibilidade do processo de biotinilação são baseadas na medição da concentração final de proteína do anticorpo resultante e na comparação lote a lote do produto.
- Biotinilato 50-200 μg de detecção de anticorpo anti-HER2 (clone 70.21.73.67) usando um kit comercial de rotulagem de biotina de acordo com as instruções do fabricante.
- Cubra o prato.
- Diluir o anticorpo de captura anti-HER2 (clone 70.27.58) até à concentração de 1 μg/ml no tampão de revestimento. Para revestir uma placa, use 6,5 mL da solução de anticorpo de captura.
- Utilizando uma pipeta multicanal, adicionar 100 μL da solução de anticorpos de captura (preparada no passo 3.3.1) a cada alvéolo numa placa ELISA de 96 poços.
NOTA: Evite os poços mais externos da placa (por exemplo, A1, H12) para reduzir a variabilidade causada pelo efeito de borda. Os poços mais externos devem ser preenchidos com água destilada para garantir condições de reação estáveis. - Cubra a placa com uma película de vedação.
- Incubar a placa durante a noite (O/N) a 4 °C.
- Após a incubação O/N, colocar a placa à temperatura ambiente (RT) num agitador horizontal de microplacas (20-30 rpm com um ângulo de inclinação de 4°-6°) durante 1 h.
- Usando uma lavadora de microplacas, aspire a solução de revestimento e lave a placa três vezes com um tampão de lavagem (3 x 300 μL de PBST por poço).
- Bloqueie a placa .
- Usando uma pipeta multicanal, adicione 100 μL de tampão de bloqueio (5% NFDM em PBS) a cada poço revestido para bloquear locais de ligação inespecíficos.
- Cubra a placa com uma película de vedação.
- Incubar a placa durante 1 h a 37 °C numa câmara de humidade.
- Usando uma lavadora de microplacas, aspire a solução de revestimento e lave a placa três vezes com um tampão de lavagem (3 x 300 μL de PBST por poço).
- Preparar uma curva de calibração e controlo positivo (figura 2).
- Preparar a solução-padrão de trabalho do antigénio HER2 adicionando 2 μL de solução-mãe de 1 mg/ml a um μl de PBS a 1998 μL de PBS para obter uma concentração de HER2 de 0,001 mg/ml (1000 ng/ml).
- Diluir a solução-padrão de trabalho (WSS) adicionando 200 μl da solução a 1800 μl de PBS para obter a solução-padrão 1 (STD 1).
- Prepare seis padrões subsequentes (STD 2-STD 7) por diluições seriadas de STD 1 em PBS (Figura 2).
- STD 2: Adicione 500 μL de STD 1 a 500 μL de PBS e misture bem para preparar 50 ng/mL.
- STD 3: Adicione 500 μL de STD 2 a 500 μL de PBS e misture bem para preparar 25 ng/mL.
- STD 4: Adicione 500 μL de STD 3 a 500 μL de PBS e misture bem para preparar 12,5 ng/mL.
- STD 5: Adicione 500 μL de STD 4 a 500 μL de PBS e misture bem para preparar 6,25 ng/mL.
- STD 6: Adicione 500 μL de STD 5 a 500 μL de PBS e misture bem para preparar 3,125 ng/mL.
- STD 7: Adicione 500 μL de STD 6 a 500 μL de PBS e misture bem para preparar 1,5625 ng / mL.
- STD 8: Adicione 500 μL de PBS para preparar 0 ng/mL.
- Controle positivo: Diluir STD 1 adicionando 100 μL da solução STD 1 a 900 μL de PBS para obter uma solução de HER2 na concentração de proteína de 10 ng/mL.
- Prepare amostras para experimentos de pico e recuperação.
- Prepare as amostras de matriz (PBS, lisados celulares e meio de cultura) enriquecidas com a concentração conhecida da proteína HER2. Dilua os lisados celulares 1:2000 adicionando 2,5 μL de lisado celular apropriado a 5 mL de PBS para adquirir uma matriz de amostra com nível de HER2 abaixo do LOD do método.
- Use WSS (1000 ng/mL) e STD1 (100 ng/mL) para aumentar as amostras de matriz.
- Para cada matriz, prepare 6 amostras com concentrações de 0, 2, 5, 10, 30 e 50 ng/mL.
- Para preparar 0 ng/ml, adicionar 400 μL de PBS/meio de cultura/lisado celular.
- Para preparar 2 ng/ml, adicione 8 μL de STD1 a 392 μL de PBS/meio de cultura/lisado celular e misture bem.
- Para preparar 5 ng/ml, adicionar 20 μL de STD1 a 380 μL de PBS/meio de cultura/lisado celular e misturar bem.
- Para preparar 10 ng/ml, adicionar 4 μL de WSS a 396 μl de PBS/meio de cultura/lisado celular e misturar bem.
- Para preparar 30 ng/ml, adicionar 12 μL de WSS a 388 μL de PBS/meio de cultura/lisado celular e misturar bem.
- Para preparar 50 ng/mL, adicione 20 μL de WSS a 380 μL de PBS/meio de cultura/lisado celular e misture bem.
- Adicione a amostra, em branco e padrão.
- Usando uma pipeta de canal único, adicione 100 μL de padrões, branco (PBS) e amostras testadas (lisados celulares e meio de cultura) aos poços apropriados.
NOTA: É aconselhável executar cada amostra em triplicado. - Cubra a placa com uma película de vedação.
- Incubar a placa durante 1 h a 37 °C numa câmara de humidade.
- Usando uma lavadora de microplacas, aspire a solução de revestimento e lave a placa três vezes com um tampão de lavagem (3 x 300 μL de PBST por poço).
- Usando uma pipeta de canal único, adicione 100 μL de padrões, branco (PBS) e amostras testadas (lisados celulares e meio de cultura) aos poços apropriados.
- Detecte a ligação de anticorpos.
- Diluir o anticorpo de detecção biotinilado (clone 70.21.73.67) em PBS até uma concentração de trabalho de 1 μg/ml. Para uma placa, use 6,5 mL de solução de trabalho de anticorpo de detecção.
- Usando uma pipeta multicanal, adicione 100 μL da solução de trabalho do anticorpo de detecção a cada poço.
- Cubra a placa com uma película de vedação.
- Incubar a placa durante 1 h a 37 °C numa câmara de humidade.
- Usando uma lavadora de microplacas, aspire a solução de revestimento e lave a placa três vezes com um tampão de lavagem (3 x 300 μL PBST por poço).
- Adicione o conjugado Avidin-HRP.
- Dilua o conjugado Avidin-HRP comercialmente disponível 1:40.000 adicionando 1 μL de conjugado enzimático a 40 mL de PBST.
- Usando uma pipeta multicanal, adicione 100 μL do conjugado diluído a cada poço.
- Cubra a placa com uma película de vedação.
- Incubar a placa durante 1 h a 37 °C numa câmara de humidade.
- Usando uma lavadora de microplacas, aspire a solução de revestimento e lave a placa três vezes com um tampão de lavagem (3 x 300 μL de PBST por poço).
- Reação colorimétrica
- Usando uma pipeta multicanal, adicione 100 μL de substrato de 3,3',5,5′-tetrametilbenzidina (TMB) a cada poço.
- Cubra a placa com uma película de vedação.
- Incube a placa por 1-5 min a 37 °C longe da luz e monitore o desenvolvimento da cor.
- Quando a cor atingir o nível esperado, adicione 100 μL de solução de parada para encerrar a reação.
NOTA: O nível esperado corresponde a uma cor azul intensa em poços contendo amostras com alta concentração do analito.
- Adquira e analise dados.
- Medir a absorvância a 450 nm utilizando um leitor de microplacas.
- Usando uma curva de calibração de 4 paramétricas, calcule a concentração da amostra com base na equação da curva.
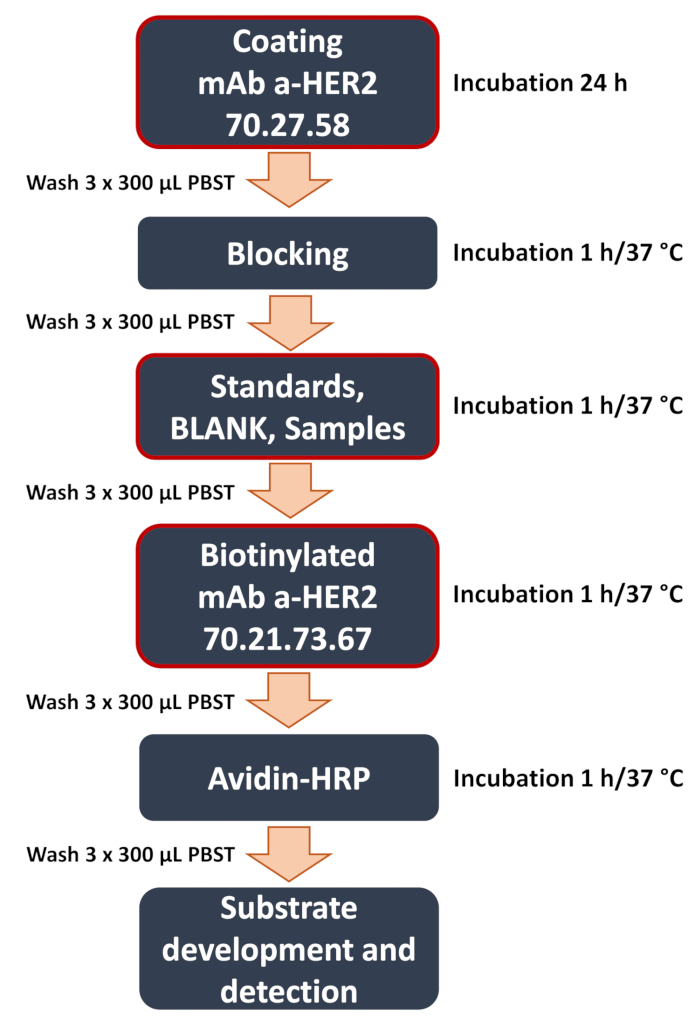
Figura 1: Diagrama esquemático do fluxo de trabalho ELISA sanduíche anti-HER2 desenvolvido. Visão geral das principais etapas do procedimento ELISA sanduíche. Isso inclui as etapas críticas (destacadas com uma moldura vermelha), como revestimento de placa com o anticorpo anti-HER2 de captura 70.27.58, a adição de amostras (padrões de curva, branco, amostras experimentais dos lisados celulares ou meio de cultura) e a ligação do anticorpo anti-HER2 de detecção 70.21.73.67. O ensaio termina com a detecção de sinal e análise de dados, onde o sinal colorimétrico é quantificado usando um leitor de microplacas para determinar a concentração do antígeno alvo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema que apresenta a preparação das soluções padrão da curva de calibração. Diluições seriadas da proteína recombinante HER2 são preparadas para gerar uma curva de calibração em uma faixa de concentração de 1,56-100 ng / mL (frascos STD 1-STD 7). Além disso, inclui-se a amostra de controlo negativo sem a proteína HER2 (STD 8). Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Validação ELISA sanduíche
O ensaio recém-desenvolvido requer um procedimento de validação. Os parâmetros de validação importantes incluem linearidade, precisão e limites de detecção, ou seja, limite inferior de detecção (LLOD) e limite superior de detecção. No artigo anterior, realizamos uma validação completa do método. A linearidade do ELISA foi testada usando as amostras simuladas para concentrações baixas (2, 5, 10 ng/mL), médias-altas (30 ng...
Access restricted. Please log in or start a trial to view this content.
Discussão
Entre os componentes críticos na construção de um ELISA sanduíche, estão os anticorpos capturadores que são imobilizados na placa e contribuem para a especificidade e sensibilidade do ensaio. No ensaio apresentado, empregamos como anticorpo capturador a nova proteína monoclonal (HER2/70.27.58) gerada e caracterizada internamente. O anticorpo possuía uma sequência única da CDR (região determinante de complementaridade) e, com base na afinidade, apresentava uma sensibilidade de ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
D.L., A.A., A.M., M.S. declaram apoio financeiro da SDS Optic S.A.; A.A, A.M., M.S. declaram a propriedade das ações da SDS Optic S.A.
Agradecimentos
O estudo foi apoiado por fundos do Centro Nacional de Pesquisa e Desenvolvimento subvenção STRATEGMEDII / 269364/5 / NCBR / 2015 e EU, Horizonte 2020 SME Instrument grant No. 783818.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
Referências
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados