È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Saggio immunochimico convalidato per la determinazione completa del recettore 2 del fattore di crescita epidermico umano rilasciato e legato alle cellule
In questo articolo
Riepilogo
Presentiamo un test ELISA sandwich convalidato utilizzando nuovi anticorpi monoclonali anti-HER2. Questo test consente una quantificazione precisa della proteina HER2 legata alle cellule e rilasciata da cellule in coltura in vitro e altri campioni, inclusi sangue e tessuti.
Abstract
Il recettore 2 del fattore di crescita epidermico umano (HER2) è un marcatore tumorale ben consolidato. È diventato un bersaglio diagnostico e terapeutico di grande successo, specialmente nel cancro al seno e in altri tipi di cancro che esprimono HER2. In clinica, i metodi diagnostici immunoistochimici gold standard che impiegano gli anticorpi specifici anti-HER2 vengono utilizzati per misurare il livello di espressione del recettore legato alla membrana. Il dominio extracellulare solubile (ECD) di HER2 che viene rilasciato dalle cellule sovraesprimenti circola nel sangue e può riflettere l'espressione tissutale del recettore. Sono necessari dosaggi accurati e convalidati per correlare la concentrazione della proteina HER2 circolante con le manifestazioni cliniche della malattia.
Il nostro team ha sviluppato e convalidato il nuovo saggio di immunoassorbimento enzimatico a sandwich (ELISA) per la quantificazione del dominio ECD di HER2 legato alla membrana e rilasciato dalle cellule. Il test utilizza due anticorpi monoclonali unici specifici per HER2 sviluppati in precedenza. L'intervallo di quantificazione include la concentrazione di HER2 da 1,56 a 100 ng/mL, che è prevista per le cellule tumorali coltivate in vitro e mostra una sensibilità a livello di 0,5 ng/mL. La soddisfacente precisione e accuratezza intra e inter-test del metodo lo rendono applicabile per la quantificazione di HER2 in vari tipi di campioni biologici, tra cui terreno di coltura cellulare, siero e tessuto tumorale solido. Qui, ci concentriamo sulla determinazione completa del recettore associato e secreto dalle cellule tumorali coltivate in vitro . L'articolo presenta un protocollo passo-passo per la quantificazione della proteina HER2 che può essere impiegato per testare una varietà di linee cellulari, sangue e tessuti.
Introduzione
Il successo delle terapie moderne è spesso correlato alla medicina di precisione che si basa sull'identificazione accurata dei pazienti sensibili alla terapia1. Tra queste terapie ci sono i farmaci anti-HER2 che prendono di mira il recettore sovraespresso su una varietà di tumori, tra cui seno, endometrio, stomaco, polmone e altri. Sono disponibili diversi agenti mirati a HER2 con benefici confermati in pazienti con tumori HER2-positivi, incluso HER2-basso di tipo2. La conferma dello stato di HER2-positivo è fondamentale per l'identificazione dei potenziali pazienti che rispondono; tuttavia, rimane una sfida, soprattutto nel gruppo HER2-basso.
I metodi gold standard in ambito clinico, utilizzati di routine per i test HER2, includono l'espressione proteica immunoistochimica (IHC) e l'amplificazione del gene HER2 mediante approcci di ibridazione in situ fluorescente (FISH). Inoltre, il test Oncotype DX viene utilizzato per l'espressione dell'mRNA di HER2. La biopsia tissutale necessaria per questi metodi rende incerta la determinazione dell'idoneità del paziente a un trattamento appropriato e della sua potenziale risposta alle terapie. Nonostante le linee guida aggiornate del 2018 dall'American Society of Clinical Oncology (ASCO) e dal College of American Pathologists (CAP) per ridurre la variabilità tra le unità di test, la concordanza di HER2 rimane un argomento di miglioramento3.
HER2 è un proto-oncogene membro della famiglia dei recettori del fattore di crescita epidermico (EGFR) la cui sovraespressione e attivazione negli stati patologici provoca un esito aggressivo o contribuisce a una prognosi infausta4. HER2 è una proteina modulare di 185 kDa ancorata nella membrana cellulare che contiene una tirosin-chinasi citoplasmatica e un dominio extracellulare (ECD). L'ECD HER2 può essere eliminato dalle cellule per essere rilasciato nella matrice extracellulare5 come proteina libera da cellule, circolando ulteriormente nel sangue. L'aumento dell'espressione di HER2 potrebbe essere riflesso dal livello più elevato dell'ECD circolante, presentando un prezioso marcatore predittivo e prognostico 6,7, un marcatore surrogato della risposta al trattamento8 o come metodo complementare all'IHC per identificare i pazienti eleggibili al trattamento anti-HER29. Tuttavia, la sfida rimane quella di stabilire la correlazione tra l'espressione tumorale di HER2 e il livello sistemico del recettore nel sangue che potrebbe avere un significato clinico.
L'ECD HER2 rilasciato può essere quantificato utilizzando il saggio di immunoassorbimento enzimatico (ELISA)10. L'ELISA a sandwich è un approccio che impiega due anticorpi specifici che legano epitopi diversi sullo stesso antigene bersaglio. Consente la misurazione accurata delle proteine solubilizzate nel materiale biologico a base di sangue e liquidi facilmente accessibile (la cosiddetta biopsia liquida). Nonostante la presenza di test approvati dalla Food and Drug Administration (FDA), c'è controversia sull'utilità della diagnostica HER2 ECD5 e sul valore di cut-off per un aumento del livello di HER2 nel sangue. Sono necessarie ulteriori ricerche con i metodi convalidati e le soglie uniformemente accettate per confermare l'applicabilità dei saggi11.
I componenti critici di qualsiasi ELISA sono la cattura (immobilizzata sulla piastra e la definizione della specificità e della sensibilità del test) e la rilevazione degli anticorpi (aggiunti dopo l'applicazione dei campioni) (Figura 1). In questo rapporto, presentiamo il protocollo ELISA basato sui nuovi anticorpi monoclonali (mAb) anti-HER2 ECD recentemente sviluppati che sono stati generati, purificati su una colonna di affinità e accuratamente caratterizzati, e presentano sequenze uniche12. L'ELISA sviluppato che impiega questi anticorpi personalizzati mostra la sua utilità per la quantificazione accurata della proteina HER2 associata alla membrana cellulare e rilasciata in un terreno di coltura per una valutazione completa dello stato del recettore. Il test può essere utilizzato nei test preclinici e per supportare la ricerca in corso. Le prestazioni del test sono state ulteriormente testate su campioni biologici di diversa origine, tra cui omogeneizzati di siero e tessuti12, per mostrare il potenziale nello sviluppo di ricerca, diagnostica e nuovi trattamenti anti-HER2 in futuro.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Coltura di cellule tumorali umane
- Colture di linee MDA-MB-231, SK-BR-3 e SK-OV-3 nel terreno Modified Eagle's di Dulbecco contenenti 4,5 g/L di ᴅ-glucosio (DMEM-HG), integrati con 2 mM di ʟ-glutammina e FBS inattivato termicamente al 10% (v/v). Incubare le colture a 37 °C in un'atmosfera umidificata al 5% di CO2.
- Quando la coltura raggiunge la confluenza di ~80%, staccare le cellule mediante tripsinizzazione e raccoglierle in provette coniche separate da 15 mL.
- Contare le cellule con un contatore automatico di cellule e seminare le cellule per l'esperimento in piastre a 12 pozzetti a una densità di 3 × 105 cellule/per pozzetto in 1 mL di terreno di crescita. Incubare le colture a 37 °C in un'atmosfera umidificata al 5% di CO2.
NOTA: Seminare un pozzetto per ogni punto temporale dell'esperimento. Sia il terreno di post-coltura che i lisati cellulari saranno utilizzati in ulteriori analisi.
2. Raccolta e preparazione dei campioni
- Dalla coltura delle 24 ore, raccogliere il terreno di coltura da un pozzetto di ciascuna linea cellulare in una provetta da 1,5 mL.
- Centrifugare i campioni raccolti a 10 000 × g per 10 minuti a 4 °C. Trasferire il surnatante in una nuova provetta e conservarlo a -20 °C per determinare ulteriormente il livello di ECD HER2 secreto.
- Lavare le cellule rimanenti sulla piastra con 1 mL di PBS freddo, aspirare delicatamente ed eliminare il PBS.
- Aggiungere 200 μL di tampone RIPA (integrato con l'1% di inibitore della proteasi) in ciascun pozzetto e incubare per 5 minuti. Raschiare le cellule con il raschietto cellulare e mescolare pipettando più volte per omogeneizzare il lisato.
- Raccogliere le cellule lisate in una nuova provetta e aspirare lentamente in una siringa da 2 ml con un ago (G21 / 0,8 mm × 40 mm). Ripetere la fase di aspirazione 5-10 volte per disintegrare ulteriormente le cellule.
- Centrifugare i campioni raccolti a 10 000 x g per 10 minuti a 4 °C. Trasferire il surnatante in una nuova provetta e conservarlo a -20 °C per un'ulteriore determinazione della frazione legata alle cellule della proteina HER2.
- Ripetere la raccolta del terreno di coltura e dei materiali cellulari, seguendo le fasi di preparazione per i restanti punti temporali - 48 ore e 72 ore di coltura.
3. Esecuzione di un ELISA a sandwich per la determinazione di HER2
- Preparare i buffer.
- Tampone di rivestimento: Preparare la soluzione 0,1 M di NaHCO3 sciogliendo 0,42 g di NaHCO3 in 50 ml di acqua distillata e mescolare accuratamente. Regolare il pH a 9,6 con 3 M NaOH.
- Tampone bloccante: Preparare il latte scremato al 5% (NFDM) in PBS aggiungendo 0,5 g di latte in polvere assorbente a 10 ml di PBS e mescolare accuratamente.
- Tampone di lavaggio: Preparare soluzione salina tamponata con fosfato con Tween 20 (PBST) aggiungendo 0,5 mL di Tween-20 allo 0,05% a 1000 mL di PBS e mescolare (evitare un'eccessiva formazione di schiuma).
- Biotinilato l'anticorpo rilevante.
- Biotinilato 50-200 μg di rilevamento dell'anticorpo anti-HER2 (clone 70.21.73.67) utilizzando un kit di marcatura della biotina commerciale secondo le istruzioni del produttore.
NOTA: L'affidabilità e la ripetibilità del processo di biotinilazione si basano sulla misurazione della concentrazione proteica finale dell'anticorpo risultante e sul confronto tra lotti del prodotto.
- Biotinilato 50-200 μg di rilevamento dell'anticorpo anti-HER2 (clone 70.21.73.67) utilizzando un kit di marcatura della biotina commerciale secondo le istruzioni del produttore.
- Rivestire il piatto.
- Diluire l'anticorpo catturante anti-HER2 (clone 70.27.58) alla concentrazione di 1 μg/mL nel tampone di rivestimento. Per rivestire una piastra, utilizzare 6,5 mL della soluzione di anticorpi catturanti.
- Utilizzando una pipetta multicanale, aggiungere 100 μl della soluzione di anticorpi catturanti (preparata al punto 3.3.1) a ciascun pozzetto su una piastra ELISA a 96 pozzetti.
NOTA: Evitare i pozzetti più esterni della piastra (ad es. A1, H12) per ridurre la variabilità causata dall'effetto bordo. I pozzetti più esterni devono essere riempiti con acqua distillata per garantire condizioni di reazione stabili. - Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per una notte (O/N) a 4 °C.
- Dopo l'incubazione O/N, posizionare la piastra a temperatura ambiente (RT) su un agitatore orizzontale per micropiastre (20-30 giri/min con un angolo di inclinazione di 4°-6°) per 1 ora.
- Utilizzando una lavatrice per micropiastre, aspirare la soluzione di rivestimento e lavare la piastra tre volte con un tampone di lavaggio (3 x 300 μl di PBST per pozzetto).
- Bloccare la piastra .
- Utilizzando una pipetta multicanale, aggiungere 100 μL di tampone bloccante (5% NFDM in PBS) a ciascun pozzetto rivestito per bloccare i siti di legame non specifici.
- Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per 1 ora a 37 °C in una camera di umidità.
- Utilizzando una lavatrice per micropiastre, aspirare la soluzione di rivestimento e lavare la piastra tre volte con un tampone di lavaggio (3 x 300 μl di PBST per pozzetto).
- Preparare una curva di calibrazione e un controllo positivo (Figura 2).
- Preparare la soluzione standard di lavoro dell'antigene HER2 aggiungendo 2 μL di soluzione madre da 1 mg/mL a 1998 μL di PBS per ottenere una concentrazione di HER2 di 0,001 mg/mL (1000 ng/mL).
- Diluire la soluzione standard di lavoro (WSS) aggiungendo 200 μl della soluzione a 1800 μl di PBS per ottenere la soluzione standard 1 (STD 1).
- Preparare i successivi sei standard (STD 2-STD 7) mediante diluizioni seriali di STD 1 in PBS (Figura 2).
- STD 2: aggiungere 500 μl di STD 1 a 500 μl di PBS e mescolare accuratamente per preparare 50 ng/mL.
- STD 3: Aggiungere 500 μL di STD 2 a 500 μL di PBS e mescolare accuratamente per preparare 25 ng/mL.
- STD 4: Aggiungere 500 μl di STD 3 a 500 μl di PBS e mescolare accuratamente per preparare 12,5 ng/mL.
- STD 5: aggiungere 500 μl di STD 4 a 500 μl di PBS e mescolare accuratamente per preparare 6,25 ng/mL.
- STD 6: aggiungere 500 μl di STD 5 a 500 μl di PBS e mescolare accuratamente per preparare 3,125 ng/mL.
- STD 7: Aggiungere 500 μl di STD 6 a 500 μl di PBS e mescolare accuratamente per preparare 1,5625 ng/mL.
- STD 8: Aggiungere 500 μL di PBS per preparare 0 ng/mL.
- Controllo positivo: diluire STD 1 aggiungendo 100 μL della soluzione STD 1 a 900 μL di PBS per ottenere una soluzione di HER2 a una concentrazione proteica di 10 ng/mL.
- Preparare i campioni per gli esperimenti di spike e recupero.
- Preparare i campioni di matrice (PBS, lisati cellulari e terreno di coltura) addizionati con la concentrazione nota della proteina HER2. Diluire i lisati cellulari 1:2000 aggiungendo 2,5 μL di lisato cellulare appropriato a 5 mL di PBS per ottenere una matrice di campione con un livello di HER2 inferiore al LOD del metodo.
- Utilizzare WSS (1000 ng/mL) e STD1 (100 ng/mL) per aumentare i campioni della matrice.
- Per ogni matrice, preparare 6 campioni con concentrazioni di 0, 2, 5, 10, 30 e 50 ng/mL.
- Per preparare 0 ng/mL, aggiungere 400 μL di PBS/terreno di coltura/lisato cellulare.
- Per preparare 2 ng/mL, aggiungere 8 μL di STD1 a 392 μL di PBS/terreno di coltura/lisato cellulare e mescolare accuratamente.
- Per preparare 5 ng/mL, aggiungere 20 μL di STD1 a 380 μL di PBS/terreno di coltura/lisato cellulare e mescolare accuratamente.
- Per preparare 10 ng/mL, aggiungere 4 μL di WSS a 396 μL di PBS/terreno di coltura/lisato cellulare e mescolare accuratamente.
- Per preparare 30 ng/mL, aggiungere 12 μL di WSS a 388 μL di PBS/terreno di coltura/lisato cellulare e mescolare accuratamente.
- Per preparare 50 ng/mL, aggiungere 20 μL di WSS a 380 μL di PBS/terreno di coltura/lisato cellulare e mescolare accuratamente.
- Aggiungere il campione, lo spazio vuoto e lo standard.
- Utilizzando una pipetta a canale singolo, aggiungere 100 μl di standard, bianco (PBS) e campioni testati (lisati cellulari e terreno di coltura) ai pozzetti appropriati.
NOTA: Si consiglia di eseguire ogni campione in triplice copia. - Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per 1 ora a 37 °C in una camera di umidità.
- Utilizzando una lavatrice per micropiastre, aspirare la soluzione di rivestimento e lavare la piastra tre volte con un tampone di lavaggio (3 x 300 μl di PBST per pozzetto).
- Utilizzando una pipetta a canale singolo, aggiungere 100 μl di standard, bianco (PBS) e campioni testati (lisati cellulari e terreno di coltura) ai pozzetti appropriati.
- Rileva il legame degli anticorpi.
- Diluire l'anticorpo rivelatore biotinilato (clone 70.21.73.67) in PBS a una concentrazione di lavoro di 1 μg/mL. Per una piastra, utilizzare 6,5 mL di soluzione di lavoro per l'anticorpo rilevante.
- Utilizzando una pipetta multicanale, aggiungere 100 μl della soluzione di lavoro dell'anticorpo di rilevamento a ciascun pozzetto.
- Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per 1 ora a 37 °C in una camera di umidità.
- Utilizzando una lavatrice per micropiastre, aspirare la soluzione di rivestimento e lavare la piastra tre volte con un tampone di lavaggio (3 x 300 μl di PBST per pozzetto).
- Aggiungere il coniugato Avidin-HRP.
- Diluire il coniugato Avidin-HRP disponibile in commercio 1:40.000 aggiungendo 1 μL di coniugato enzimatico a 40 mL di PBST.
- Utilizzando una pipetta multicanale, aggiungere 100 μl di coniugato diluito a ciascun pozzetto.
- Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per 1 ora a 37 °C in una camera di umidità.
- Utilizzando una lavatrice per micropiastre, aspirare la soluzione di rivestimento e lavare la piastra tre volte con un tampone di lavaggio (3 x 300 μl di PBST per pozzetto).
- Reazione colorimetrica
- Utilizzando una pipetta multicanale, aggiungere 100 μL di substrato di 3,3′,5,5′-tetrametilbenzidina (TMB) a ciascun pozzetto.
- Coprire la piastra con una pellicola sigillante.
- Incubare la piastra per 1-5 minuti a 37 °C al riparo dalla luce e monitorare lo sviluppo del colore.
- Quando il colore raggiunge il livello previsto, aggiungere 100 μL di soluzione di arresto per terminare la reazione.
NOTA: Il livello atteso corrisponde a un colore blu intenso nei pozzetti contenenti campioni con un'alta concentrazione dell'analita.
- Acquisisci e analizza i dati.
- Misurare l'assorbanza a 450 nm utilizzando un lettore di micropiastre.
- Utilizzando una curva di calibrazione a 4 parametri, calcolare la concentrazione del campione in base all'equazione della curva.
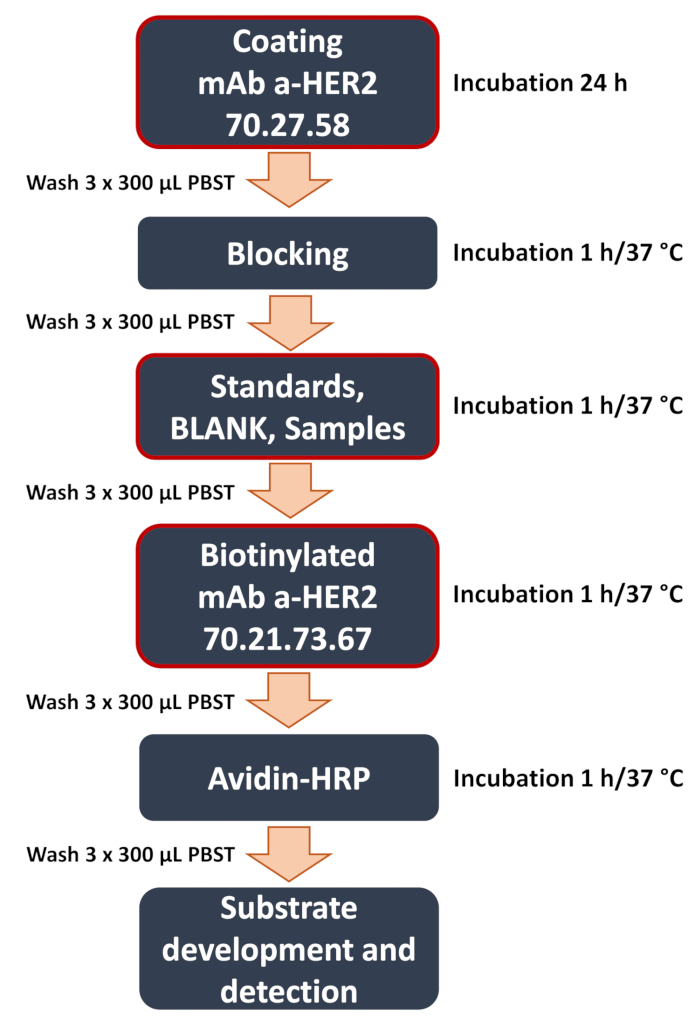
Figura 1: Diagramma schematico del flusso di lavoro ELISA a sandwich anti-HER2 sviluppato. Panoramica delle fasi chiave della procedura ELISA a sandwich. Questi includono le fasi critiche (evidenziate da una cornice rossa) come il rivestimento della piastra con l'anticorpo anti-HER2 70.27.58, l'aggiunta di campioni (standard di curva, bianco, campioni sperimentali dei lisati cellulari o del terreno di coltura) e il legame dell'anticorpo anti-HER2 70.21.73.67. Il test si conclude con il rilevamento del segnale e l'analisi dei dati, in cui il segnale colorimetrico viene quantificato utilizzando un lettore di micropiastre per determinare la concentrazione dell'antigene target. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Schema che presenta la preparazione delle soluzioni standard della curva di calibrazione. Le diluizioni seriali della proteina ricombinante HER2 sono preparate per generare una curva di calibrazione in un intervallo di concentrazione di 1,56-100 ng/mL (fiale STD 1-STD 7). Inoltre, è incluso il campione di controllo negativo senza la proteina HER2 (STD 8). Clicca qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Convalida ELISA a sandwich
Il test di nuova concezione richiede una procedura di convalida. I parametri di convalida importanti includono la linearità, la precisione e i limiti di rilevamento, ovvero il limite inferiore di rilevamento (LLOD) e il limite superiore di rilevamento. Nell'articolo precedente, abbiamo eseguito un'accurata convalida del metodo. La linearità dell'ELISA è stata testata utilizzando i campioni simulati per concentrazioni basse (2, 5, 10 ng/mL...
Access restricted. Please log in or start a trial to view this content.
Discussione
Tra i componenti critici nella costruzione di un ELISA a sandwich, ci sono gli anticorpi di cattura che vengono immobilizzati sulla piastra e contribuiscono alla specificità e alla sensibilità del saggio. Nel saggio presentato, abbiamo impiegato come anticorpo di cattura la nuova proteina monoclonale (HER2/70.27.58) generata e caratterizzata internamente. L'anticorpo aveva una sequenza unica della CDR (regione che determina la complementarità) e, in base all'affinità, presentava una ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
D.L., A.A., A.M., M.S. dichiarano il sostegno finanziario di SDS Optic S.A.; A.A., A.M., M.S. dichiarano la proprietà azionaria di SDS Optic S.A.
Riconoscimenti
Lo studio è stato sostenuto da un fondo del Centro Nazionale per la Ricerca e lo Sviluppo STRATEGMEDII/269364/5/NCBR/2015 e dall'UE, Horizon 2020 SME Instrument grant No. 783818.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
Riferimenti
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon