JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포에서 방출되고 세포에 결합하는 인간 표피 성장 인자 수용체 2의 포괄적인 측정을 위한 검증된 면역화학 분석
요약
새로운 anti-HER2 단클론 항체를 사용하여 검증된 샌드위치 ELISA 분석을 제시합니다. 이 분석을 통해 체외 배양 세포 및 혈액 및 조직을 포함한 기타 샘플에서 세포 결합 및 방출 HER2 단백질을 정밀하게 정량화할 수 있습니다.
초록
인간 표피 성장 인자 수용체 2(HER2)는 잘 정립된 암 마커입니다. 특히 유방암 및 기타 HER2 발현 암 유형에서 매우 성공적인 진단 및 치료 표적이 되었습니다. 이 임상에서는 특정 항-HER2 항체를 사용하는 최적 표준(gold standard) 면역조직화학 진단 방법을 사용하여 막 결합 수용체의 발현 수준을 측정합니다. 과발현 세포에서 방출되는 HER2의 수용성 세포외 도메인(ECD)은 혈액을 순환하며 수용체의 조직 발현을 반영할 수 있습니다. 순환하는 HER2 단백질의 농도와 질병 임상 증상의 상관관계를 파악하기 위해 정확하고 검증된 분석법이 필요합니다.
우리 팀은 HER2의 막 결합 및 세포에서 방출된 ECD 도메인의 정량화를 위해 새로운 샌드위치 효소 결합 면역 흡착 분석법(ELISA)을 개발하고 검증했습니다. 이 분석은 이전에 개발된 HER2에 특이적인 두 가지 고유한 단클론 항체를 사용합니다. 정량 범위에는 1.56-100ng/mL의 HER2 농도가 포함되며, 이는 체외 에서 배양된 암세포에 대해 예상되며 0.5ng/mL 수준의 감도를 보여줍니다. 이 방법의 만족스러운 intra- and inter-assay 정밀도와 정확성으로 인해 세포 배양 배지, 혈청 및 고형 종양 조직을 포함한 다양한 유형의 생물학적 샘플에서 HER2 정량화에 적용할 수 있습니다. 여기에서는 체외 배양된 암세포에 의해 분비되는 수용체와 관련된 물질의 포괄적인 측정에 초점을 맞춥니다. 이 논문은 다양한 세포주, 혈액 및 조직을 검사하는 데 사용할 수 있는 HER2 단백질의 정량화를 위한 단계별 프로토콜을 제시합니다.
서문
현대 치료법의 성공은 종종 치료에 민감한 환자의 정확한 식별에 기반한 정밀 의학과 관련이 있습니다1. 이러한 치료법 중에는 유방, 자궁내막, 위, 폐 등을 포함한 다양한 종양에서 과발현된 수용체를 표적으로 하는 항-HER2 약물이 있습니다. HER2 저형2형을 포함하여 HER2 양성 암 환자에서 이점이 확인된 여러 HER2 표적 제제를 사용할 수 있습니다. HER2 양성 상태의 확인은 잠재적인 반응 환자를 식별하는 데 중요합니다. 그러나 특히 HER2-low 그룹에서는 여전히 과제로 남아 있습니다.
HER2 검사에 일상적으로 사용되는 임상 환경의 황금 표준 방법에는 면역조직화학(IHC) 단백질 발현 및 형광 제자리 교잡법(FISH) 접근법에 의한 HER2 유전자 증폭이 포함됩니다. 또한 Oncotype DX assay는 HER2 mRNA 발현에 사용됩니다. 이러한 방법에 필요한 조직 생검은 환자가 적절한 치료를 받을 수 있는 적격성과 치료법에 대한 잠재적 반응성을 판단하는 것을 불확실하게 만듭니다. 미국임상종양학회(American Society of Clinical Oncology, ASCO)와 미국병리학회(College of American Pathologists, CAP)가 검사 단위 간의 변동성을 줄이기 위해 2018년에 업데이트한 지침에도 불구하고, HER2 일치는 여전히 개선의 여지가 있다3.
HER2는 표피 성장 인자 수용체(epidermal growth factor receptor, EGFR) 계열의 원발암유전자(proto-oncogene) 구성원으로, 병리학적 상태에서의 과발현 및 활성화가 공격적인 결과를 초래하거나 나쁜 예후에 기여합니다4. HER2는 세포질 티로신 키나아제(cytoplasmic tyrosine kinase)와 세포외 도메인(extracellular domain, ECD)을 포함하는 세포막에 위치한 185kDa 모듈식 단백질입니다. HER2 ECD는 세포에서 떨어져 나와 cell-free 단백질로서 세포외 기질5로 방출되어 혈액을 더 순환할 수 있습니다. HER2 발현의 증가는 순환 ECD의 수치가 높을수록 반영될 수 있으며, 이는치료 반응의 대리 마커8인 예측 및 예후 지표 6,7 또는 항 HER2치료9 자격이 있는 환자를 식별하기 위한 IHC의 보완 방법이다. 그러나 종양 HER2 발현과 임상적 의미를 가질 수 있는 혈액 내 수용체의 전신 수준 사이의 상관관계를 확립하는 것은 여전히 과제입니다.
방출된 HER2 ECD는 ELISA(Enzyme-linked immunosorbent assay)10을 사용하여 정량화할 수 있습니다. 샌드위치 ELISA는 동일한 표적 항원에 서로 다른 항원결정기와 결합하는 두 개의 특정 항체를 사용하는 접근 방식입니다. 이를 통해 쉽게 접근할 수 있는 혈액 및 액체 기반 생물학적 물질에서 용해된 단백질을 정확하게 측정할 수 있습니다(소위 액체 생검). 미국 식품의약국(FDA)의 승인을 받은 분석법이 있음에도 불구하고, HER2 ECD 진단법5의유용성과 혈 중 HER2 수치 증가에 대한 기준치에 대한 논란이 있습니다. 분석법의 적용 가능성을 확인하기 위해서는 검증된 방법과 균일하게 허용되는 임계값에 대한 추가 연구가 필요합니다11.
모든 ELISA의 중요한 구성 요소는 항체를 캡처(플레이트에 고정하고 분석 특이성 및 감도를 정의)하고 항체(샘플을 적용한 후 추가)를 검출하는 것입니다(그림 1). 본 보고서에서는 최근에 개발된 새로운 anti-HER2 ECD 단일클론항체(mAb)를 기반으로 하는 ELISA 프로토콜을 제시하고, 친화성 컬럼에서 정제하고 철저하게 특성화하여 고유한 염기서열12를 제시합니다. 이러한 맞춤형 항체를 사용하는 개발된 ELISA는 세포막과 연결되어 수용체 상태의 포괄적인 평가를 위해 배양 배지로 방출되는 HER2 단백질의 정확한 정량화에 대한 유용성을 보여줍니다. 이 분석은 전임상 테스트 및 진행 중인 연구를 지원하는 데 활용될 수 있습니다. 이 분석의 성능은 혈청 및 조직 균질산염12를 포함한 다양한 기원의 생물학적 샘플에 대해 추가 테스트를 거쳐 향후 연구, 진단 및 새로운 항-HER2 치료법 개발의 잠재력을 보여주었습니다.
프로토콜
1. 인간 암세포의 배양
- 2mM ʟ-글루타민 및 10%(v/v) 열 비활성화 FBS가 보충된 4.5g/L의 ᴅ-글루코스(DMEM-HG)를 포함하는 Dulbecco의 Modified Eagle's 배지에서 MDA-MB-231, SK-BR-3 및 SK-OV-3 라인을 배양합니다. 37 ° C에서 5 % CO2의 가습 된 분위기에서 배양물을 배양합니다.
- 배양액이 ~80% confluence에 도달하면 트립신화(trypsinization)를 통해 세포를 분리하고 별도의 15mL 원추형 튜브에 수집합니다.
- 실험을 위해 자동 세포 계수기와 시드 세포를 사용하여 1mL의 성장 배지에서 웰당 3 × 105 개의 세포의 밀도로 12웰 플레이트로 세포를 계수합니다. 37 ° C에서 5 % CO2의 가습 된 분위기에서 배양물을 배양합니다.
참고: 실험의 각 시점마다 하나의 웰을 파종합니다. 배양 후 배지와 세포 용해물은 모두 추가 분석에 사용됩니다.
2. 시료 채취 및 준비
- 24시간 배양에서 각 세포주의 1웰에서 1.5mL 튜브로 배양 배지를 수집합니다.
- 수집된 샘플을 10,000 × g 에서 4°C에서 10분 동안 원심분리합니다. 상등액을 새 튜브로 옮기고 -20°C에서 보관하여 분비된 ECD HER2 수준을 추가로 측정합니다.
- 플레이트에 남아 있는 세포를 차가운 PBS 1mL로 세척하고 부드럽게 흡인시킨 다음 PBS를 버립니다.
- 각 웰에 200μL의 RIPA 완충액(프로테아제 억제제 1% 보충)을 추가하고 5분 동안 배양합니다. 세포 스크레이퍼로 세포를 긁어내고 여러 번 피펫팅하여 용해물을 균질화하여 혼합합니다.
- 용해된 세포를 새 튜브에 모으고 바늘(G21/0.8mm × 40mm)로 2mL 주사기로 천천히 흡인합니다. 흡인 단계를 5-10회 반복하여 세포를 추가로 분해합니다.
- 수집된 샘플을 10,000 x g 에서 4°C에서 10분 동안 원심분리합니다. 상등액을 새 튜브로 옮기고 -20°C에서 보관하여 HER2 단백질의 세포 결합 분획을 추가로 측정합니다.
- 나머지 시간 지점(48시간 및 72시간 배양)에 대한 준비 단계에 따라 배양 배지 및 세포 물질의 수집을 반복합니다.
3. HER2 측정을 위한 샌드위치 ELISA 수행
- 버퍼를 준비합니다.
- 코팅 완충액 : 0.42g의NaHCO3를 증류수 50mL에 용해시켜 0.1M NaHCO3 용액을 준비하고 철저히 혼합합니다. 3M NaOH로 pH를 9.6으로 조정합니다.
- 차단 완충액: PBS 10mL에 블로팅 분유 0.5g을 첨가하여 PBS에 5% 무지방 유제품(NFDM)을 준비하고 철저히 혼합합니다.
- 세척 완충액: PBS 1000mL에 0.05% Tween-20 0.5mL를 첨가하여 Tween 20(PBST)으로 인산염 완충 식염수를 준비하고 혼합합니다(과도한 거품 발생 방지).
- 검출 항체를 비오틴화합니다.
- 제조업체의 지침에 따라 상업용 비오틴 라벨링 키트를 사용하여 anti-HER2 항체(클론 70.21.73.67)를 검출하는 50-200μg의 비오틴화.
참고: 비오틴화(biotinylation) 공정의 신뢰성과 반복성은 결과 항체의 최종 단백질 농도 측정과 제품의 배치 간 비교를 기반으로 합니다.
- 제조업체의 지침에 따라 상업용 비오틴 라벨링 키트를 사용하여 anti-HER2 항체(클론 70.21.73.67)를 검출하는 50-200μg의 비오틴화.
- 접시를 코팅하십시오.
- 항-HER2 포획 항체(클론 70.27.58)를 코팅 완충액에서 1μg/mL 농도로 희석합니다. 한 플레이트를 코팅하려면 포획 항체 용액 6.5mL를 사용합니다.
- 멀티채널 피펫을 사용하여 100μL의 포획 항체 용액(3.3.1단계에서 준비)을 96웰 ELISA 플레이트의 각 웰에 추가합니다.
알림: 가장자리 효과로 인한 변동성을 줄이기 위해 플레이트의 가장 바깥쪽 웰(예: A1, H12)을 피하십시오. 가장 바깥쪽 우물은 안정적인 반응 조건을 보장하기 위해 증류수로 채워져야 합니다. - 밀봉 필름으로 플레이트를 덮습니다.
- 플레이트를 4°C에서 하룻밤(O/N) 배양합니다.
- O/N 배양 후 수평 마이크로플레이트 셰이커(20°-30°의 기울기 각도로 4°-6rpm)에 1시간 동안 플레이트를 실온(RT)에 놓습니다.
- 마이크로플레이트 세척기를 사용하여 코팅 용액을 흡입하고 세척 버퍼(웰당 3 x 300μL의 PBST)로 플레이트를 세 번 세척합니다.
- 플레이트를 차단합니다.
- 멀티채널 피펫을 사용하여 100μL의 차단 버퍼(PBS의 경우 5% NFDM)를 각 코팅된 웰에 추가하여 비특이적 결합 부위를 차단합니다.
- 밀봉 필름으로 플레이트를 덮습니다.
- 습도 챔버에서 37 ° C에서 1 시간 동안 플레이트를 배양합니다.
- 마이크로플레이트 세척기를 사용하여 코팅 용액을 흡입하고 세척 버퍼(웰당 3 x 300μL의 PBST)로 플레이트를 세 번 세척합니다.
- 검량선과 positive control을 준비합니다(그림 2).
- 0.001 mg/mL(1000 ng/mL) HER2 농도를 얻기 위해 1 μL의 1 mg/mL 원액 1998 μL를 첨가하여 HER2 항원의 작업 표준 용액을 준비합니다.
- 용액 200μL를 PBS 1800μL에 첨가하여 작업 표준 용액(WSS)을 희석하여 표준 용액 1(STD 1)을 얻습니다.
- PBS에서 STD 1의 연속 희석을 통해 후속 6개 표준(STD 2-STD 7)을 준비합니다(그림 2).
- STD 2: 500μL의 STD 1에서 500μL의 PBS를 첨가하고 완전히 혼합하여 50ng/mL를 준비합니다.
- STD 3: 500μL의 STD 2 - 500μL의 PBS를 첨가하고 완전히 혼합하여 25ng/mL를 준비합니다.
- STD 4: 500μL의 STD 3에서 500μL의 PBS를 추가하고 완전히 혼합하여 12.5ng/mL를 준비합니다.
- STD 5: 500μL의 STD 4 - 500μL의 PBS를 첨가하고 완전히 혼합하여 6.25ng/mL를 준비합니다.
- STD 6: 500 μL의 STD 5 - 500 μL의 PBS를 첨가하고 철저히 혼합하여 3.125 ng/mL를 준비합니다.
- STD 7: 500 μL의 STD 6 - 500 μL의 PBS를 첨가하고 완전히 혼합하여 1.5625 ng/mL를 준비합니다.
- STD 8: PBS 500μL를 첨가하여 0ng/mL를 준비합니다.
- 양성 대조군: 100μL의 STD 1 용액을 900μL의 PBS에 첨가하여 STD 1을 희석하여 10ng/mL 단백질 농도에서 HER2 용액을 얻습니다.
- 스파이크 및 회수 실험을 위한 샘플을 준비합니다.
- 알려진 HER2 단백질 농도로 스파이크된 매트릭스 샘플(PBS, 세포 용해물 및 배양 배지)을 준비합니다. 2.5μL의 적절한 세포 용해물을 PBS 5mL에 첨가하여 세포 용해물을 1:2000으로 희석하여 HER2 수준이 Method의 LOD보다 낮은 샘플 매트릭스를 획득합니다.
- WSS(1000ng/mL) 및 STD1(100ng/mL)을 사용하여 매트릭스 샘플을 스파이크합니다.
- 각 매트릭스에 대해 0, 2, 5, 10, 30 및 50ng/mL 농도의 6개 샘플을 준비합니다.
- 0ng/mL를 준비하려면 PBS/배양 배지/세포 용해물 400μL를 추가합니다.
- 2 ng/mL를 준비하기 위해 8 μL의 STD1을 392 μL의 PBS/배양 배지/세포 용해물에 첨가하고 완전히 혼합합니다.
- 5ng/mL를 준비하려면 20μL의 STD1을 380μL의 PBS/배양 배지/세포 용해물에 첨가하고 완전히 혼합합니다.
- 10ng/mL를 준비하려면 PBS/배양 배지/세포 용해물 396μL에 WSS 4μL를 첨가하고 완전히 혼합합니다.
- 30ng/mL를 준비하려면 388μL의 PBS/배양 배지/세포 용해물에 12μL의 WSS를 첨가하고 완전히 혼합합니다.
- 50ng/mL를 준비하려면 380μL의 PBS/배양 배지/세포 용해물에 20μL의 WSS를 첨가하고 완전히 혼합합니다.
- 샘플, 블랭크 및 표준물질을 추가합니다.
- 단일 채널 피펫을 사용하여 100μL의 표준물질, 블랭크(PBS) 및 테스트된 샘플(세포 용해물 및 배양 배지)을 적절한 웰에 추가합니다.
참고: 각 샘플을 세 번 실행하는 것이 좋습니다. - 밀봉 필름으로 플레이트를 덮습니다.
- 습도 챔버에서 37 ° C에서 1 시간 동안 플레이트를 배양합니다.
- 마이크로플레이트 세척기를 사용하여 코팅 용액을 흡입하고 세척 버퍼(웰당 3 x 300μL의 PBST)로 플레이트를 세 번 세척합니다.
- 단일 채널 피펫을 사용하여 100μL의 표준물질, 블랭크(PBS) 및 테스트된 샘플(세포 용해물 및 배양 배지)을 적절한 웰에 추가합니다.
- 항체 결합을 검출합니다.
- PBS에서 비오틴화된 검출 항체(클론 70.21.73.67)를 1μg/mL의 작동 농도로 희석합니다. 한 플레이트의 경우 6.5mL의 검출 항체 작업 용액을 사용합니다.
- 멀티채널 피펫을 사용하여 100μL의 검출 항체 작업 용액을 각 웰에 추가합니다.
- 밀봉 필름으로 플레이트를 덮습니다.
- 습도 챔버에서 37 ° C에서 1 시간 동안 플레이트를 배양합니다.
- 마이크로플레이트 세척기를 사용하여 코팅 용액을 흡입하고 세척 버퍼(웰당 3 x 300μL PBST)로 플레이트를 세 번 세척합니다.
- Avidin-HRP 접합체를 추가합니다.
- PBST 40mL에 효소 접합체 1μL를 첨가하여 시판되는 Avidin-HRP 접합체 1:40,000을 희석합니다.
- 멀티채널 피펫을 사용하여 각 웰에 100μL의 희석된 콘주게이트를 추가합니다.
- 밀봉 필름으로 플레이트를 덮습니다.
- 습도 챔버에서 37 ° C에서 1 시간 동안 플레이트를 배양합니다.
- 마이크로플레이트 세척기를 사용하여 코팅 용액을 흡입하고 세척 버퍼(웰당 3 x 300μL의 PBST)로 플레이트를 세 번 세척합니다.
- 비색 반응
- 멀티채널 피펫을 사용하여 각 웰에 100μL의 3,3',5,5'-테트라메틸벤지딘(TMB) 기질을 추가합니다.
- 밀봉 필름으로 플레이트를 덮습니다.
- 빛에서 37 ° C에서 1-5 분 동안 플레이트를 배양하고 발색을 모니터링합니다.
- 색상이 예상 수준에 도달하면 100μL의 정지 용액을 추가하여 반응을 종료합니다.
참고: 예상 수준은 분석물 농도가 높은 샘플을 포함하는 웰의 강렬한 파란색에 해당합니다.
- 데이터를 수집하고 분석합니다.
- 마이크로플레이트 리더를 사용하여 450nm에서 흡광도를 측정합니다.
- 4-파라메트릭 보정 곡선을 사용하여 곡선 방정식을 기반으로 샘플 농도를 계산합니다.
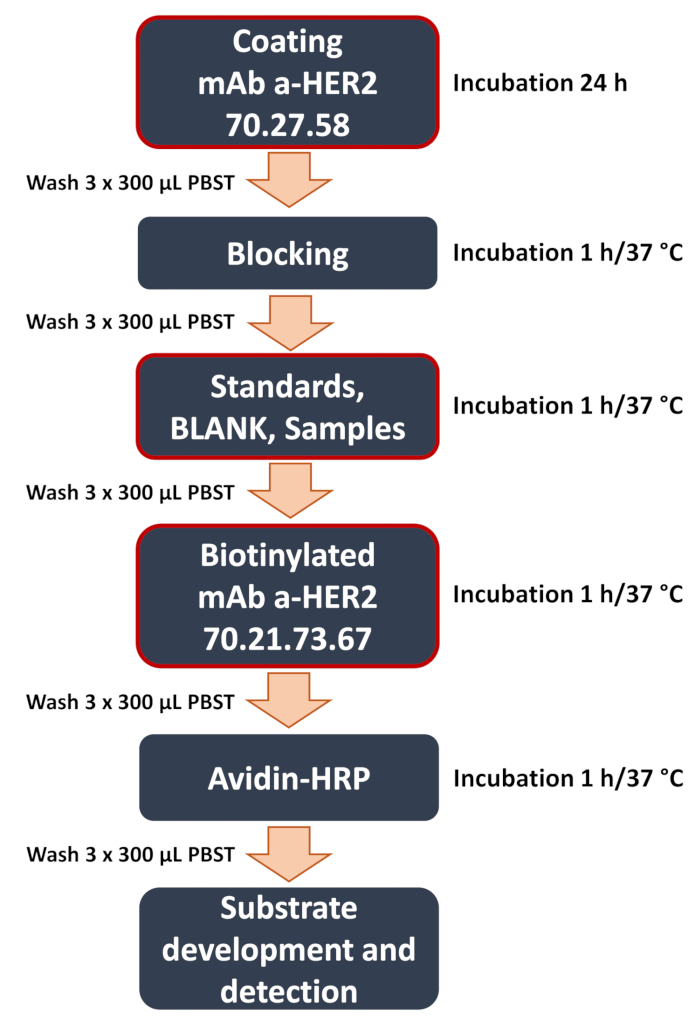
그림 1: 개발된 anti-HER2 sandwich ELISA 워크플로우의 개략도. 샌드위치 ELISA 절차의 주요 단계에 대한 개요. 여기에는 captureing anti-HER2 항체 70.27.58을 사용한 플레이트 코팅, 샘플(곡선 표준물질, 블랭크, 세포 용해물 또는 배양 배지의 실험 샘플) 추가 및 검출 anti-HER2 항체 70.21.73.67의 결합과 같은 중요한 단계가 포함됩니다. 이 분석은 신호 검출 및 데이터 분석으로 마무리되며, 여기서 표적 항원의 농도를 결정하기 위해 마이크로플레이트 리더를 사용하여 비색 신호를 정량화합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 검량선 표준물질 용액의 준비를 보여주는 계획. HER2 재조합 단백질의 연속 희석은 1.56-100ng/mL(바이알, STD 1-STD 7)의 농도 범위에서 보정 곡선을 생성하도록 준비됩니다. 또한 HER2 단백질이 없는 음성 대조군 샘플이 포함되어 있습니다(STD 8). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
샌드위치 ELISA 검증
새로 개발된 분석법에는 검증 절차가 필요합니다. 중요한 검증 파라미터에는 선형성, 정밀도 및 검출 한계, 즉 검출 하한(LLOD) 및 검출 상한이 포함됩니다. 이전 논문에서는 철저한 분석법 검증을 수행했습니다. ELISA 선형성은 PBS 및 혈청과 같은 HER2 정량화에 중요한 기타 매트릭스에 희석된 항원의 농도가 낮은(2, 5, 10 ng/mL), 중간-높음(30 ng...
토론
샌드위치 ELISA를 구성하는 데 중요한 구성 요소 중에는 플레이트에 고정되어 분석 특이성과 민감도에 기여하는 포획 항체가 있습니다. 제시된 분석법에서 우리는 사내에서 생성 및 특성화된 새로운 단클론 단백질(HER2/70.27.58)을 포획 항체로 사용했습니다. 항체는 CDR(complementarity-determining region)의 고유한 서열을 가졌으며, 친화도에 따라 0.0922nM12에서 ED50의...
공개
D.L., A.A., A.M., M.S. SDS Optic S.A.의 재정 지원 선언; A.A, A.M., M.S.는 SDS Optic S.A. 주식 소유권을 선언합니다.
감사의 말
이 연구는 National Centre for Research and Development 보조금 STRATEGMEDII/269364/5/NCBR/2015 및 EU, Horizon 2020 SME Instrument 보조금 No. 783818의 기금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
참고문헌
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E. et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748 (2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N. et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D. et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P. et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13) (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V. et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016 (2020).
- Antos, A. et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978 (2024).
- Andreasson, U. et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179 (2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020 (2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, 61031 (2020).
- Giordani, E. et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182 (2024).
- Wu, Y. et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L. et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유