このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞から放出され細胞に結合したヒト上皮成長因子受容体2の包括的な測定のための検証済み免疫化学アッセイ
要約
新規抗HER2モノクローナル抗体を用いた検証済みのサンドイッチELISAアッセイを紹介します。このアッセイにより、 in vitro 培養細胞や血液や組織などのサンプルから、細胞結合および遊離したHER2タンパク質の正確な定量が可能になります。
要約
ヒト上皮成長因子受容体2(HER2)は、がんマーカーとして確立されています。これは、特に乳がんやその他のHER2発現がんの種類において、非常に成功した診断および治療標的となりました。クリニックでは、特定の抗HER2抗体を用いたゴールドスタンダードの免疫組織化学的診断法を使用して、膜結合受容体の発現レベルを測定しています。過剰発現細胞から放出されるHER2の可溶性細胞外ドメイン(ECD)は、血液中を循環し、受容体の組織発現を反映することができます。循環するHER2タンパク質の濃度と疾患の臨床症状とを相関させるための、正確でバリデーションされたアッセイが必要です。
私たちのチームは、HER2の膜結合および細胞から放出されたECDドメインを定量するための新しいサンドイッチ酵素結合免疫吸着アッセイ(ELISA)を開発し、検証しました。 このアッセイでは、以前に開発されたHER2に特異的な2つのユニークなモノクローナル抗体を使用します。定量範囲には、 in vitro で培養されたがん細胞に予想される1.56-100 ng/mLのHER2濃度が含まれ、0.5 ng/mLのレベルの感度を示します。この分析法の満足のいくアッセイ内およびアッセイ間精度と精度により、細胞培養培地、血清、固形腫瘍組織など、さまざまな種類の生体サンプルでのHER2定量に適用できます。ここでは、 in vitro 培養がん細胞が分泌する受容体の包括的な決定に焦点を当てます。この論文では、さまざまな細胞株、血液、および組織の試験に使用できるHER2タンパク質の定量化のための段階的なプロトコルを示しています。
概要
現代の治療法の成功は、多くの場合、治療に敏感な患者の正確な特定に基づく精密医療に関連しています1。これらの治療法の中には、乳房、子宮内膜、胃、肺など、さまざまな腫瘍で過剰発現する受容体を標的とする抗HER2薬があります。HER2低2型を含むHER2陽性がん患者において、いくつかのHER2標的薬が利用可能であり、その効果が確認されています。HER2陽性の状態を確認することは、潜在的な反応を示す患者を特定するために重要です。ただし、特にHER2低グループでは、依然として課題があります。
HER2検査に日常的に使用されている臨床現場でのゴールドスタンダード法には、免疫組織化学(IHC)タンパク質発現や蛍光in situハイブリダイゼーション(FISH)アプローチによるHER2遺伝子増幅などがあります。さらに、Oncotype DXアッセイはHER2 mRNA発現に使用されます。これらの方法に必要な組織生検は、適切な治療に対する患者の適格性および治療に対する潜在的な反応性の判断を不確実なものにします。米国臨床腫瘍学会(ASCO)と米国病理学会(CAP)が2018年に改訂したガイドラインにより、検査ユニット間のばらつきを減少させたにもかかわらず、HER2の一致は依然として改善の余地があります3。
HER2は、上皮成長因子受容体(EGFR)ファミリーのがん原遺伝子メンバーであり、病理学的状態での過剰発現と活性化が積極的な結果をもたらすか、予後不良の一因となります4。HER2は、細胞膜に固定された185 kDaのモジュール式タンパク質で、細胞質チロシンキナーゼと細胞外ドメイン(ECD)が含まれています。HER2 ECDは、細胞から排出され、無細胞タンパク質として細胞外マトリックス5に放出され、さらに血液中を循環します。HER2発現の増加は、循環ECDのレベルが高いことを反映している可能性があり、貴重な予測および予後マーカー6,7、治療反応の代理マーカー8、または抗HER2治療9に適格な患者を特定するためのIHCの補完的な方法として提示されます。しかし、腫瘍のHER2発現と血液中の受容体の全身レベルとの間の相関関係を確立することは、依然として課題であり、これは臨床的意味を持つ可能性があります。
放出されたHER2 ECDは、酵素結合免疫吸着アッセイ(ELISA)10を使用して定量できます。サンドイッチELISAは、同じ標的抗原に異なるエピトープに結合する2つの特異的抗体を用いるアプローチです。これにより、簡単にアクセスできる血液および液体ベースの生体材料中の可溶化タンパク質の正確な測定が可能になります(いわゆるリキッドバイオプシー)。米国食品医薬品局(FDA)が承認したアッセイが存在するにもかかわらず、HER2 ECD診断薬5 の有用性や、血中のHER2濃度上昇のカットオフ値については論争があります。アッセイの適用性を確認するためには、検証された方法と一様に受け入れられる閾値を用いたさらなる研究が必要である11。
ELISAの重要な構成要素は、抗体の捕捉(プレートに固定化され、アッセイの特異性と感度を定義する)と検出(サンプルの適用後に添加される)抗体です(図1)。本報告では、最近開発された新しい抗HER2 ECDモノクローナル抗体(mAb)を作製し、アフィニティーカラム上で精製し、徹底的に特性評価したELISAプロトコールと、独自の配列12を紹介する。これらのカスタム抗体を用いて開発されたELISAは、細胞膜に結合し、培養培地に放出されたHER2タンパク質の正確な定量に有用であり、受容体の状態を包括的に評価することを示しています。このアッセイは、前臨床試験や進行中の研究をサポートするために利用できます。このアッセイの性能は、血清および組織ホモジネート12を含むさまざまな起源の生物学的サンプルでさらにテストされており、将来の研究、診断、および新規抗HER2治療の開発における可能性を示しています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. ヒトがん細胞の培養
- 4.5 g/L の ᴅ-グルコース (DMEM-HG) を含有し、2 mM ʟ-グルタミンと 10% (v/v) 熱不活化 FBS を添加した Dulbecco's Modified Eagle's 培地で MDA-MB-231、SK-BR-3、SK-OV-3 株を培養します。培養物を37°Cで5%CO2の加湿雰囲気でインキュベートします。
- 培養液が~80%のコンフルエントに達したら、トリプシン処理により細胞を剥離し、それらを別々の15 mLコニカルチューブに集めます。
- 自動セルカウンターで細胞をカウントし、1ウェルあたり10細胞/ウェルあたり3×5細胞/ ウェルの密度で12ウェルプレートに細胞を播種し、1mLの増殖培地でカウントします。培養物を37°Cで5%CO2の加湿雰囲気でインキュベートします。
注:実験の各時点ごとに1つのウェルを播種します。培養後培地と細胞ライセートの両方をさらなる分析に使用します。
2. サンプルの採取と調製
- 24時間培養液から、各細胞株の1ウェルから培地を1.5mLチューブに集めます。
- 収集したサンプルを10,000 × g で4°Cで10分間遠心分離します。 上清を新しいチューブに移し、-20°Cで保存して、分泌されたECD HER2レベルをさらに決定します。
- プレート上の残りの細胞を1mLの冷たいPBSで洗い、穏やかに吸引し、PBSを廃棄します。
- 200 μLのRIPAバッファー(1%のプロテアーゼ阻害剤を添加)を各ウェルに加え、5分間インキュベートします。細胞スクレーパーで細胞をこすり落とし、数回ピペッティングしてライセートを均質化して混合します。
- 溶解した細胞を新しいチューブに集め、針(G21 / 0.8 mm×40 mm)で2 mLシリンジにゆっくりと吸引します。吸引ステップを5〜10回繰り返して、細胞をさらに崩壊させます。
- 収集したサンプルを10,000 x g で4°Cで10分間遠心分離します。 上清を新しいチューブに移し、-20°Cで保存して、HER2タンパク質の細胞結合画分をさらに測定します。
- 残りの時点(48時間および72時間の培養)の準備手順に従って、培地と細胞材料の収集を繰り返します。
3. HER2測定のためのサンドイッチELISAの実施
- バッファーを準備します。
- コーティングバッファー:0.42 gのNaHCO3を50 mLの蒸留水に溶解して0.1 M NaHCO3溶液を調製し、十分に混合します。3 M NaOHでpHを9.6に調整します。
- ブロッキングバッファー:10mLのPBSに0.5gのブロッティング粉乳を加えて、PBS中の5%無脂肪乳(NFDM)を調製し、十分に混合します。
- 洗浄緩衝液:0.05% Tween-20 0.5 mL を PBS 1000 mL に加えて、Tween 20 (PBST) でリン酸緩衝生理食塩水を調製し、混合します (過度の発泡を避けてください)。
- 検出抗体をビオチン化します。
- 市販のビオチン標識キットを使用して、50-200 μgの検出抗HER2抗体(クローン70.21.73.67)を製造元の指示に従ってビオチン化します。
注:ビオチン化プロセスの信頼性と再現性は、得られた抗体の最終タンパク質濃度の測定と製品のバッチ間比較に基づいています。
- 市販のビオチン標識キットを使用して、50-200 μgの検出抗HER2抗体(クローン70.21.73.67)を製造元の指示に従ってビオチン化します。
- プレートをコーティングします。
- 抗HER2捕捉抗体(クローン70.27.58)をコーティングバッファー中の1 μg/mLの濃度に希釈します。1枚のプレートをコーティングするには、捕捉抗体溶液6.5 mLを使用します。
- マルチチャンネルピペットを使用して、捕捉抗体溶液(ステップ3.3.1で調製)100 μLを96ウェルELISAプレート上の各ウェルに加えます。
注意: プレートの最も外側のウェル(A1、H12など)は避けて、エッジ効果によるばらつきを減らします。最も外側の井戸は、安定した反応条件を確保するために蒸留水で満たす必要があります。 - プレートをシーリングフィルムで覆います。
- プレートを4°Cで一晩(O / N)インキュベートします。
- O/Nインキュベーション後、プレートを室温(RT)で水平マイクロプレートシェーカー(傾斜角4°〜6°の傾斜角で20〜30rpm)に1時間置きます。
- マイクロプレートウォッシャーを使用して、コーティング溶液を吸引し、洗浄バッファー(ウェルあたり3 x 300 μLのPBST)でプレートを3回洗浄します。
- プレートをブロックします。
- マルチチャンネルピペットを使用して、100 μLのブロッキングバッファー(PBS中の5% NFDM)を各コーティングウェルに添加し、非特異的結合部位をブロックします。
- プレートをシーリングフィルムで覆います。
- プレートを37°Cの湿度チャンバーで1時間インキュベートします。
- マイクロプレートウォッシャーを使用して、コーティング溶液を吸引し、洗浄バッファー(ウェルあたり3 x 300 μLのPBST)でプレートを3回洗浄します。
- 検量線とポジティブコントロールを準備します(図2)。
- 1998 μL の PBS に 2 μL の 1 mg/mL ストック溶液を加えて HER2 抗原の作業標準液を調製し、0.001 mg/mL (1000 ng/mL) の HER2 濃度を得ます。
- 1800 μL の PBS に 200 μL の溶液を加えて作業標準液 (WSS) を希釈し、標準液 1 (STD 1) を得ます。
- 後続の6つの標準試料(STD 2-STD 7)を、PBS中のSTD 1の段階希釈により調製します(図2)。
- STD 2:STD 1 500 μL から PBS 500 μL を加え、よく混ぜて 50 ng/mL を調製します。
- STD 3:STD 2 500 μL から PBS 500 μL を加え、よく混ぜて 25 ng/mL を調製します。
- STD 4:STD 3 500 μL から PBS 500 μL を加え、十分に混合して 12.5 ng/mL を調製します。
- STD 5:STD 4 から 500 μL の PBS 500 μL を加え、十分に混合して 6.25 ng/mL を調製します。
- STD 6:STD 500 μLを500 μLからPBS500 μLに加え、よく混ぜて3.125 ng/mLを調製します。
- STD 7:500 μL の STD 6 から 500 μL の PBS を加え、十分に混合して 1.5625 ng/mL を調製します。
- STD 8:500 μLのPBSを加えて、0 ng/mLを調製します。
- ポジティブコントロール:STD 1溶液100 μLをPBS900 μLに加えてSTD 1を希釈し、タンパク質濃度10 ng/mLのHER2溶液を得ます。
- スパイク実験と回収実験用のサンプルを調製します。
- 既知のHER2タンパク質濃度をスパイクしたマトリックスサンプル(PBS、細胞溶解物、および培地)を調製します。2.5 μL の適切な細胞ライセートを 5 mL の PBS に添加して細胞ライセートを 1:2000 に希釈し、HER2 レベルが分析法の LOD より低いサンプルマトリックスを取得します。
- WSS(1000 ng/mL)およびSTD1(100 ng/mL)を使用して、マトリックスサンプルをスパイクします。
- 各マトリックスについて、0、2、5、10、30、50 ng/mL の濃度で 6 つのサンプルを調製します。
- 0 ng/mLを調製するには、400 μLのPBS/培地/細胞溶解液を加えます。
- 2 ng/mLを調製するには、8 μLのSTD1を392 μLのPBS/培地/細胞溶解液に加え、十分に混合します。
- 5 ng/mLを調製するには、20 μLのSTD1を380 μLのPBS/培地/細胞溶解液に加え、十分に混合します。
- 10 ng/mLを調製するには、396 μLのPBS/培地/細胞溶解液に4 μLのWSSを加え、十分に混合します。
- 30 ng/mLを調製するには、12 μLのWSSを388 μLのPBS/培地/細胞溶解液に加え、十分に混合します。
- 50 ng/mLを調製するには、380 μLのPBS/培地/細胞溶解液に20 μLのWSSを加え、十分に混合します。
- サンプル、ブランク、スタンダードを追加します。
- シングルチャンネルピペットを使用して、100 μLのスタンダード、ブランク(PBS)、および試験済みサンプル(細胞溶解物および培地)を適切なウェルに加えます。
注:各サンプルをトリプリケートで分析することをお勧めします。 - プレートをシーリングフィルムで覆います。
- プレートを37°Cの湿度チャンバーで1時間インキュベートします。
- マイクロプレートウォッシャーを使用して、コーティング溶液を吸引し、洗浄バッファー(ウェルあたり3 x 300 μLのPBST)でプレートを3回洗浄します。
- シングルチャンネルピペットを使用して、100 μLのスタンダード、ブランク(PBS)、および試験済みサンプル(細胞溶解物および培地)を適切なウェルに加えます。
- 抗体結合を検出します。
- ビオチン化検出抗体(クローン70.21.73.67)をPBSで1 μg/mLの作業濃度に希釈します。1プレートにつき、6.5 mLの検出用抗体ワーキングソリューションを使用します。
- マルチチャンネルピペットを使用して、検出用抗体の作動溶液100 μLを各ウェルに加えます。
- プレートをシーリングフィルムで覆います。
- プレートを37°Cの湿度チャンバーで1時間インキュベートします。
- マイクロプレートウォッシャーを使用してコーティング溶液を吸引し、洗浄バッファー(ウェルあたり3 x 300 μL PBST)でプレートを3回洗浄します。
- アビジン-HRPコンジュゲートを添加します。
- 市販のAvidin-HRPコンジュゲートを40 mLのPBSTに1 μLの酵素コンジュゲートを添加して、40,000:1:40,000に希釈します。
- マルチチャンネルピペットを使用して、希釈したコンジュゲートを各ウェルに100 μL加えます。
- プレートをシーリングフィルムで覆います。
- プレートを37°Cの湿度チャンバーで1時間インキュベートします。
- マイクロプレートウォッシャーを使用して、コーティング溶液を吸引し、洗浄バッファー(ウェルあたり3 x 300 μLのPBST)でプレートを3回洗浄します。
- 比色反応
- マルチチャンネルピペットを使用して、100 μLの3,3′,5,5′-テトラメチルベンジジン(TMB)基質を各ウェルに加えます。
- プレートをシーリングフィルムで覆います。
- プレートを光から離れた場所で37°Cで1〜5分間インキュベートし、発色をモニターします。
- 色が予想レベルに達したら、100 μLの停止溶液を加えて反応を終了します。
注:予想されるレベルは、高濃度の分析物を含むサンプルを含むウェルの濃い青色に相当します。
- データを取得して分析します。
- マイクロプレートリーダーを使用して450nmでの吸光度を測定します。
- 4パラメトリック検量線を使用して、曲線方程式に基づいてサンプル濃度を計算します。
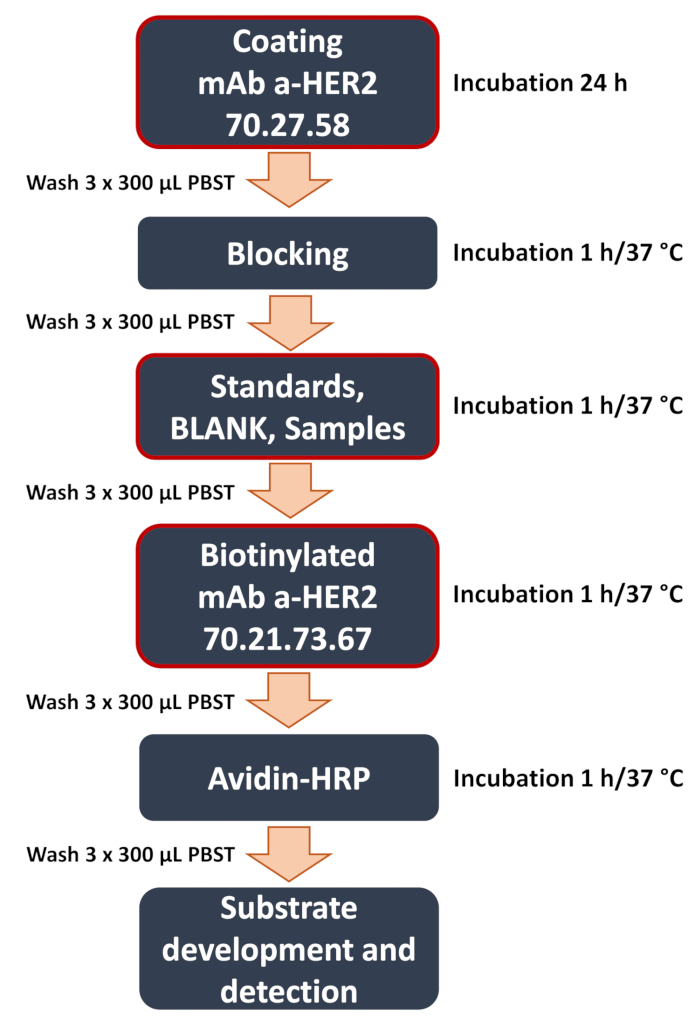
図1:開発された抗HER2サンドイッチELISAワークフローの概略図。 サンドイッチELISA手順の主な手順の概要。これには、捕捉型抗HER2抗体70.27.58によるプレートコーティング、サンプル(細胞溶解物または培養培地の曲線標準、ブランク、実験サンプル)の追加、検出用抗HER2抗体70.21.73.67の結合などの重要なステップ(赤枠部分で強調表示)が含まれます。アッセイはシグナル検出とデータ解析で終了し、マイクロプレートリーダーを使用して比色シグナルを定量化し、標的抗原の濃度を決定します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:検量線標準溶液の調製を示すスキーム。 HER2組換えタンパク質の段階希釈液を調製して、1.56〜100 ng / mLの濃度範囲で検量線を生成します(バイアルSTD 1-STD 7)。さらに、HER2タンパク質を含まないネガティブコントロールサンプルが含まれています(STD 8)。 この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
サンドイッチELISAバリデーション
新しく開発されたアッセイには、検証手順が必要です。重要な検証パラメータには、直線性、精度、検出限界、つまり検出下限(LLOD)と検出上限が含まれます。前回の論文では、徹底的なメソッド検証を行いました。ELISAの直線性は、PBSおよび血清などのHER2の定量に重要な他のマトリックスで希釈された抗原の低濃度(2?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
サンドイッチELISAを構築する上で重要なコンポーネントの中には、プレートに固定化され、アッセイの特異性と感度に寄与する捕捉抗体があります。本アッセイでは、自社で作製・特性評価した新規モノクローナルタンパク質(HER2/70.27.58)を捕捉抗体として採用しました。この抗体は、CDR(相補性決定領域)のユニークな配列を有し、その親和性に基づいて、0.0922 nM
Access restricted. Please log in or start a trial to view this content.
開示事項
D.L.、A.A.、A.M.、MS.は、SDS Optic S.A.からの財政支援を宣言します。A.A.、A.M.、M.S.は、SDS Optic S.A.の株式所有権を宣言します。
謝辞
この研究は、国立研究開発センターの助成金であるSTRATEGMEDII/269364/5/NCBR/2015およびEU、Horizon 2020 SME Instrument助成金No.783818からの資金によって支援されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
参考文献
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved