Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücrelerden Salınan ve Hücrelere Bağlanan İnsan Epidermal Büyüme Faktörü Reseptörü 2'nin Kapsamlı Belirlenmesi için Doğrulanmış İmmünokimyasal Test
Bu Makalede
Özet
Yeni anti-HER2 monoklonal antikorlar kullanılarak valide edilmiş bir sandviç ELISA testi sunuyoruz. Bu test, in vitro kültürlenmiş hücrelerden ve kan ve dokular dahil olmak üzere diğer örneklerden hücreye bağlı ve salınan HER2 proteininin hassas bir şekilde ölçülmesini sağlar.
Özet
İnsan epidermal büyüme faktörü reseptörü 2 (HER2) iyi bilinen bir kanser belirtecidir. Özellikle meme kanseri ve diğer HER2 eksprese eden kanser türlerinde çok başarılı bir tanı ve tedavi hedefi haline geldi. Klinikte, membrana bağlı reseptörün ekspresyon seviyesini ölçmek için spesifik anti-HER2 antikorlarını kullanan altın standart immünohistokimyasal tanı yöntemleri kullanılmaktadır. Aşırı eksprese eden hücrelerden salınan HER2'nin çözünür hücre dışı alanı (ECD) kanda dolaşır ve reseptörün doku ekspresyonunu yansıtabilir. Dolaşımdaki HER2 proteininin konsantrasyonunu hastalık klinik belirtileri ile ilişkilendirmek için doğru ve doğrulanmış tahlillere ihtiyaç vardır.
Ekibimiz, HER2'nin zara bağlı ve hücrelerden salınan ECD alanının miktar tayini için yeni sandviç enzime bağlı immünosorbent testini (ELISA) geliştirdi ve doğruladı. Test, daha önce geliştirilen HER2'ye özgü iki benzersiz monoklonal antikor kullanır. Kantitasyon aralığı, in vitro kültürlenen kanser hücreleri için beklenen ve 0.5 ng/mL seviyesinde duyarlılık gösteren 1.56-100 ng/mL arasındaki HER2 konsantrasyonunu içerir. Yöntemin tatmin edici tahlil içi ve tahliller arası hassasiyeti ve doğruluğu, hücre kültürü ortamı, serum ve katı tümör dokusu dahil olmak üzere çeşitli biyolojik numune türlerinde HER2 miktar tayini için uygulanabilir olmasını sağlar. Burada, in vitro kültürlenmiş kanser hücreleri tarafından salgılanan ve reseptörle ilişkili olanın kapsamlı bir şekilde belirlenmesine odaklanıyoruz. Makale, çeşitli hücre hatlarını, kanı ve dokuları test etmek için kullanılabilecek HER2 proteininin miktar tayini için adım adım bir protokol sunmaktadır.
Giriş
Modern terapötiklerin başarısı genellikle tedaviye duyarlı hastaların doğru bir şekilde tanımlanmasına dayanan hassas tıpla ilgilidir1. Bu tedaviler arasında meme, endometriyum, mide, akciğer ve diğerleri dahil olmak üzere çeşitli tümörlerde aşırı eksprese edilen reseptörü hedef alan anti-HER2 ilaçları bulunur. HER2 pozitif kanserli hastalarda, HER2 düşük tip2 dahil olmak üzere, kanıtlanmış faydaları olan çeşitli HER2 hedefleme ajanları mevcuttur. HER2 pozitif durumun doğrulanması, potansiyel yanıt veren hastaların tanımlanması için kritik öneme sahiptir; ancak, özellikle HER2 düşük grubunda bir zorluk olmaya devam ediyor.
Klinik ortamlarda rutin olarak HER2 testi için kullanılan altın standart yöntemler, immünohistokimya (IHC) protein ekspresyonu ve floresan in situ hibridizasyon (FISH) yaklaşımları ile HER2 gen amplifikasyonunu içerir. Ek olarak, HER2 mRNA ekspresyonu için Oncotype DX testi kullanılır. Bu yöntemler için gerekli olan doku biyopsisi, hastanın uygun tedavi için uygunluğunun belirlenmesini ve tedavilere potansiyel yanıtlarının belirsiz olmasını sağlar. Amerikan Klinik Onkoloji Derneği (ASCO) ve Amerikan Patologlar Koleji (CAP) tarafından test birimleri arasındaki değişkenliği azaltmak için güncellenen 2018 kılavuzlarına rağmen, HER2 uyumu iyileştirilmesi gereken bir konu olmaya devam etmektedir3.
HER2, epidermal büyüme faktörü reseptörü (EGFR) ailesinin bir proto-onkogen üyesidir ve patolojik durumlarda aşırı ekspresyon ve aktivasyon agresif bir sonuca neden olur veya kötü prognoza katkıda bulunur4. HER2, bir sitoplazmik tirozin kinaz ve bir hücre dışı alan (ECD) içeren hücre zarına sabitlenmiş 185 kDa'lık modüler bir proteindir. HER2 ECD, kanda daha fazla dolaşan hücre dışı protein olarak hücre dışı matriks5'e salınmak üzere hücrelerden dökülebilir. Artmış HER2 ekspresyonu, dolaşımdaki ECD'nin daha yüksek seviyesi ile yansıtılabilir, değerli bir prediktif ve prognostik belirteç 6,7, tedavi yanıtının vekil bir belirteci 8 veya anti-HER2 tedavisi9 için uygun hastaları belirlemek için IHC'ye tamamlayıcı bir yöntem olarak sunulabilir. Bununla birlikte, tümör HER2 ekspresyonu ile kandaki reseptörün sistemik seviyesi arasında klinik bir anlamı olabilecek korelasyonun kurulmasında zorluk devam etmektedir.
Serbest bırakılan HER2 ECD, Enzime bağlı immünosorbent testi (ELISA)10 kullanılarak ölçülebilir. Sandviç ELISA, aynı hedef antijene farklı epitopları bağlayan iki spesifik antikor kullanan bir yaklaşımdır. Kolayca erişilebilen kan ve sıvı bazlı biyolojik materyaldeki (sıvı biyopsi olarak adlandırılır) çözünmüş proteinlerin doğru ölçümünü sağlar. Gıda ve İlaç Dairesi (FDA) onaylı tahlillerin varlığına rağmen, HER2 ECD teşhisinin5 faydası ve kandaki artmış HER2 seviyesi için kesme değeri konusunda tartışmalar vardır. Tahlillerin uygulanabilirliğini doğrulamak için doğrulanmış yöntemler ve tek tip olarak kabul edilen eşiklerle daha fazla araştırmaya ihtiyaç vardır11.
Herhangi bir ELISA'nın kritik bileşenleri, antikorun yakalanması (plaka üzerinde hareketsiz hale getirilmesi ve test özgüllüğünün ve duyarlılığının tanımlanması) ve antikorların (numuneler uygulandıktan sonra eklenir) tespit edilmesidir (Şekil 1). Bu raporda, yakın zamanda geliştirilen yeni anti-HER2 ECD monoklonal antikorlarına (mAb) dayanan, üretilen, bir afinite sütunu üzerinde saflaştırılan ve kapsamlı bir şekilde karakterize edilen ve benzersiz diziler sunan ELISA protokolünü sunuyoruz12. Bu özel antikorları kullanan gelişmiş ELISA, hücre zarı ile ilişkili HER2 proteininin doğru bir şekilde ölçülmesi için faydasını gösterir ve reseptör durumunun kapsamlı bir şekilde değerlendirilmesi için bir kültür ortamına salınır. Tahlil, klinik öncesi testlerde ve devam eden araştırmaları desteklemek için kullanılabilir. Testin performansı, gelecekte araştırma, teşhis ve yeni anti-HER2 tedavilerinin geliştirilmesinde potansiyel göstermek için serum ve doku homojenatları12 dahil olmak üzere farklı kökenlerden biyolojik numuneler üzerinde daha fazla test edilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. İnsan kanser hücrelerinin kültürlenmesi
- Dulbecco'nun Modifiye Eagle ortamındaki MDA-MB-231, SK-BR-3 ve SK-OV-3 hatlarını, 2 mM ʟ-glutamin ve% 10 (h / h) ısıyla etkisiz hale getirilmiş FBS ile desteklenmiş 4.5 g / L ᴅ-glikoz (DMEM-HG) içerir. Kültürleri 37 °C'de% 5 CO2 nemlendirilmiş bir atmosferde inkübe edin.
- Kültür ~% 80 birleşmeye ulaştığında, hücreleri tripsinizasyon ile ayırın ve bunları ayrı 15 mL konik tüplere toplayın.
- Deney için hücreleri otomatik bir hücre sayacı ve tohum hücreleri ile 1 mL büyüme ortamında 3 ×10 5 hücre / kuyu başına 12 oyuklu plakalar halinde sayın. Kültürleri 37 °C'de% 5 CO2 nemlendirilmiş bir atmosferde inkübe edin.
NOT: Deneyin her zaman noktası için bir kuyu tohumlayın. Daha ileri analizlerde hem kültür sonrası ortam hem de hücre lizatları kullanılacaktır.
2. Numune toplama ve hazırlama
- 24 saatlik kültürden, her hücre hattının bir oyuğundan kültür ortamını 1.5 mL'lik bir tüpe toplayın.
- Toplanan numuneleri 10.000 × g'da 4 °C'de 10 dakika santrifüjleyin. Süpernatanı yeni bir tüpe aktarın ve salgılanan ECD HER2 seviyesini daha fazla belirlemek için -20 °C'de saklayın.
- Plakada kalan hücreleri 1 mL soğuk PBS ile yıkayın, nazikçe aspire edin ve PBS'yi atın.
- Her oyuğa 200 μL RIPA tamponu (%1 proteaz inhibitörü ile desteklenmiş) ekleyin ve 5 dakika inkübe edin. Hücreleri hücre sıyırıcı ile kazıyın ve lizatı homojenize etmek için birkaç kez pipetleyerek karıştırın.
- Parçalanmış hücreleri yeni bir tüpe toplayın ve bir iğne ile 2 mL şırıngaya yavaşça aspire edin (G21 / 0.8 mm × 40 mm). Hücreleri daha fazla parçalamak için aspirasyon adımını 5-10 kez tekrarlayın.
- Toplanan numuneleri 10 000 x g'da 4 °C'de 10 dakika santrifüjleyin. Süpernatanı yeni bir tüpe aktarın ve HER2 proteininin hücreye bağlı fraksiyonunun daha fazla belirlenmesi için -20 ° C'de saklayın.
- Kalan zaman noktaları için hazırlık adımlarını izleyerek kültür ortamı ve hücresel materyallerin toplanmasını tekrarlayın - 48 saat ve 72 saat kültür.
3. HER2 tayini için sandviç ELISA yapılması
- Tamponları hazırlayın.
- Kaplama tamponu: 0.42 g NaHCO3'ü 50 mL damıtılmış su içinde çözerek 0.1 M NaHCO3 çözeltisi hazırlayın ve iyice karıştırın. 3 M NaOH ile pH'ı 9,6'ya ayarlayın.
- Tamponu bloke etme: 10 mL PBS'ye 0,5 g kurutma sütü tozu ekleyerek PBS'de% 5 yağsız süt sütü (NFDM) hazırlayın ve iyice karıştırın.
- Yıkama tamponu: 0,5 mL %0,05 Tween-20 ila 1000 mL PBS ekleyerek Tween 20 (PBST) ile fosfat tamponlu tuzlu su hazırlayın ve karıştırın (aşırı köpürmeyi önleyin).
- Tespit edilen antikoru biyotinile edin.
- Üreticinin talimatlarına göre ticari bir biyotin etiketleme kiti kullanılarak 50-200 μg tespit edici anti-HER2 antikoru (klon 70.21.73.67) biyotinilat.
NOT: Biyotinilasyon işleminin güvenilirliği ve tekrarlanabilirliği, elde edilen antikorun nihai protein konsantrasyonunun ölçümüne ve ürünün partiden partiye karşılaştırmasına dayanmaktadır.
- Üreticinin talimatlarına göre ticari bir biyotin etiketleme kiti kullanılarak 50-200 μg tespit edici anti-HER2 antikoru (klon 70.21.73.67) biyotinilat.
- Plakayı kaplayın.
- Anti-HER2 yakalama antikorunu (klon 70.27.58) kaplama tamponunda 1 μg/mL konsantrasyonuna seyreltin. Bir plakayı kaplamak için, 6.5 mL yakalama antikor çözeltisi kullanın.
- Çok kanallı bir pipet kullanarak, 96 oyuklu bir ELISA plakası üzerindeki her bir oyuğa 100 μL yakalama antikor çözeltisi (adım 3.3.1'de hazırlanır) ekleyin.
NOT: Kenar etkisinin neden olduğu değişkenliği azaltmak için plakanın en dış kuyularından (örn. A1, H12) kaçının. Kararlı reaksiyon koşullarını sağlamak için en dıştaki kuyular damıtılmış su ile doldurulmalıdır. - Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı gece boyunca (O/H) 4 °C'de inkübe edin.
- O/N inkübasyonundan sonra, plakayı oda sıcaklığında (RT) 1 saat boyunca yatay bir mikro plaka çalkalayıcı (20 ° -30 ° eğim açısıyla 4-6 rpm) üzerine yerleştirin.
- Bir mikroplaka yıkayıcı kullanarak, kaplama solüsyonunu aspire edin ve plakayı bir yıkama tamponu ile üç kez yıkayın (oyuk başına 3 x 300 μL PBST).
- Plakayı bloke edin.
- Çok kanallı bir pipet kullanarak, spesifik olmayan bağlanma bölgelerini bloke etmek için kaplanmış her bir oyuğa 100 μL bloke edici tampon (PBS'de% 5 NFDM) ekleyin.
- Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı bir nem odasında 37 ° C'de 1 saat inkübe edin.
- Bir mikroplaka yıkayıcı kullanarak, kaplama solüsyonunu aspire edin ve plakayı bir yıkama tamponu ile üç kez yıkayın (oyuk başına 3 x 300 μL PBST).
- Bir kalibrasyon eğrisi ve pozitif kontrol hazırlayın (Şekil 2).
- 0.001 mg / mL (1000 ng / mL) HER2 konsantrasyonu elde etmek için 1998 μL PBS'ye 2 μL 1 mg / mL stok çözeltisi ekleyerek HER2 antijeninin çalışma standart çözeltisini hazırlayın.
- Standart çözelti 1'i (STD 1) elde etmek için 1800 μL PBS'ye 200 μL çözelti ekleyerek çalışma standart çözeltisini (WSS) seyreltin.
- PBS'de STD 2'in seri seyreltmeleriyle sonraki altı standardı (STD 7-STD 1) hazırlayın (Şekil 2).
- STD 2: 500 μL STD 1 ila 500 μL PBS ekleyin ve 50 ng / mL hazırlamak için iyice karıştırın.
- STD 3: 500 μL STD 2 ila 500 μL PBS ekleyin ve 25 ng / mL hazırlamak için iyice karıştırın.
- STD 4: 500 μL STD 3 ila 500 μL PBS ekleyin ve 12.5 ng / mL hazırlamak için iyice karıştırın.
- STD 5: 500 μL STD 4 ila 500 μL PBS ekleyin ve 6.25 ng / mL hazırlamak için iyice karıştırın.
- STD 6: 500 μL STD 5 ila 500 μL PBS ekleyin ve 3.125 ng / mL hazırlamak için iyice karıştırın.
- STD 7: 500 μL STD 6 ila 500 μL PBS ekleyin ve 1.5625 ng / mL hazırlamak için iyice karıştırın.
- STD 8: 0 ng / mL hazırlamak için 500 μL PBS ekleyin.
- Pozitif kontrol: 10 ng / mL protein konsantrasyonunda bir HER2 çözeltisi elde etmek için 900 μL PBS'ye 100 μL STD 1 çözeltisi ekleyerek STD 1'i seyreltin.
- Ani yükselme ve kurtarma deneyleri için numuneler hazırlayın.
- Bilinen HER2 protein konsantrasyonu ile çivilenmiş matris örneklerini (PBS, hücre lizatları ve kültür ortamı) hazırlayın. Yöntemin LOD'sinin altında HER2 seviyesine sahip bir numune matrisi elde etmek için 5 mL PBS'ye 2.5 μL uygun hücre lizatı ekleyerek hücre lizatlarını 1:2000 seyreltin.
- Matris örneklerini yükseltmek için WSS (1000 ng/mL) ve STD1 (100 ng/mL) kullanın.
- Her matris için 0, 2, 5, 10, 30 ve 50 ng/mL konsantrasyonlarda 6 numune hazırlayın.
- 0 ng / mL hazırlamak için 400 μL PBS / kültür ortamı / hücre lizatı ekleyin.
- 2 ng / mL hazırlamak için, 392 μL PBS / kültür ortamı / hücre lizatına 8 μL STD1 ekleyin ve iyice karıştırın.
- 5 ng / mL hazırlamak için, 380 μL PBS / kültür ortamı / hücre lizatına 20 μL STD1 ekleyin ve iyice karıştırın.
- 10 ng/mL hazırlamak için, 396 μL PBS/kültür ortamı/hücre lizatına 4 μL WSS ekleyin ve iyice karıştırın.
- 30 ng / mL hazırlamak için, 388 μL PBS / kültür ortamı / hücre lizatına 12 μL WSS ekleyin ve iyice karıştırın.
- 50 ng / mL hazırlamak için, 380 μL PBS / kültür ortamı / hücre lizatına 20 μL WSS ekleyin ve iyice karıştırın.
- Örneği, boş ve standardı ekleyin.
- Tek kanallı bir pipet kullanarak, uygun kuyucuklara 100 μL standart, boş (PBS) ve test edilmiş numuneler (hücre lizatları ve kültür ortamı) ekleyin.
NOT: Her numunenin üç kopya halinde çalıştırılması tavsiye edilir. - Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı bir nem odasında 37 ° C'de 1 saat inkübe edin.
- Bir mikroplaka yıkayıcı kullanarak, kaplama solüsyonunu aspire edin ve plakayı bir yıkama tamponu ile üç kez yıkayın (oyuk başına 3 x 300 μL PBST).
- Tek kanallı bir pipet kullanarak, uygun kuyucuklara 100 μL standart, boş (PBS) ve test edilmiş numuneler (hücre lizatları ve kültür ortamı) ekleyin.
- Antikor bağlanmasını tespit edin.
- PBS'deki biyotinile tespit edici antikoru (klon 70.21.73.67) 1 μg / mL'lik bir çalışma konsantrasyonuna seyreltin. Bir plaka için 6.5 mL tespit edici antikor çalışma solüsyonu kullanın.
- Çok kanallı bir pipet kullanarak, her bir oyuğa 100 μL tespit edici antikor çalışma solüsyonu ekleyin.
- Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı bir nem odasında 37 ° C'de 1 saat inkübe edin.
- Bir mikroplaka yıkayıcı kullanarak, kaplama solüsyonunu aspire edin ve plakayı bir yıkama tamponu ile üç kez yıkayın (oyuk başına 3 x 300 μL PBST).
- Avidin-HRP eşleniği ekleyin.
- Ticari olarak temin edilebilen Avidin-HRP konjugatını 1: 40.000 oranında seyreltin, 40 mL PBST'ye 1 μL enzimatik konjuge ekleyin.
- Çok kanallı bir pipet kullanarak, her oyuğa 100 μL seyreltilmiş konjugat ekleyin.
- Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı bir nem odasında 37 ° C'de 1 saat inkübe edin.
- Bir mikroplaka yıkayıcı kullanarak, kaplama solüsyonunu aspire edin ve plakayı bir yıkama tamponu ile üç kez yıkayın (oyuk başına 3 x 300 μL PBST).
- Kolorimetrik reaksiyon
- Çok kanallı bir pipet kullanarak, her oyuğa 100 μL 3,3",5,5" -Tetrametilbenzidin (TMB) substratı ekleyin.
- Plakayı bir sızdırmazlık filmi ile örtün.
- Plakayı ışıktan 37 ° C'de 1-5 dakika inkübe edin ve renk gelişimini izleyin.
- Renk beklenen seviyeye ulaştığında, reaksiyonu sonlandırmak için 100 μL durdurma çözeltisi ekleyin.
NOT: Beklenen seviye, yüksek konsantrasyonda analit içeren numuneler içeren kuyucuklarda yoğun bir mavi renge karşılık gelir.
- Verileri toplayın ve analiz edin.
- Bir mikroplaka okuyucu kullanarak absorbansı 450 nm'de ölçün.
- 4 parametrik bir kalibrasyon eğrisi kullanarak, eğri denklemine dayalı olarak numune konsantrasyonunu hesaplayın.
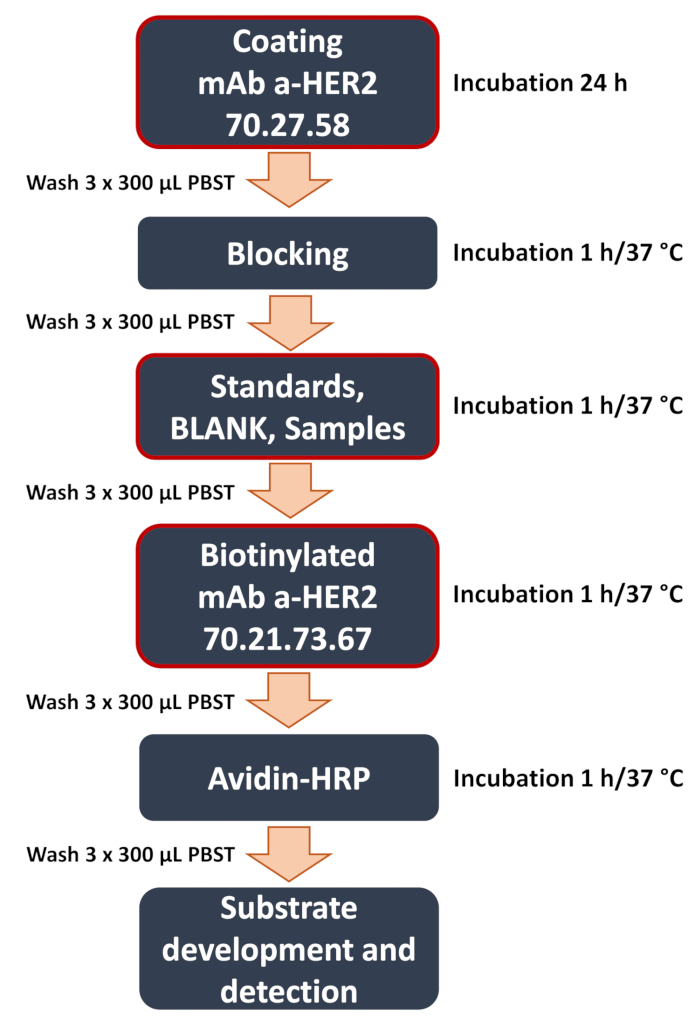
Şekil 1: Geliştirilen anti-HER2 sandviç ELISA iş akışının şematik diyagramı. Sandviç ELISA prosedüründeki temel adımlara genel bakış. Bunlar, yakalayan anti-HER2 antikoru 70.27.58 ile plaka kaplaması, numunelerin eklenmesi (eğri standartları, boş, hücre lizatlarının veya kültür ortamının deneysel numuneleri) ve tespit edilen anti-HER2 antikorunun bağlanması gibi kritik adımları (kırmızı bir çerçeve ile vurgulanmıştır) içerir 70.21.73.67. Tahlil, hedef antijenin konsantrasyonunu belirlemek için kolorimetrik sinyalin bir mikroplaka okuyucu kullanılarak ölçüldüğü sinyal algılama ve veri analizi ile sona erer. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kalibrasyon eğrisi standart çözeltilerinin hazırlanmasını sunan şema. HER2 rekombinant proteininin seri dilüsyonları, 1.56-100 ng / mL'lik bir konsantrasyon aralığında bir kalibrasyon eğrisi oluşturmak için hazırlanır (şişeler STD 1-STD 7). Ek olarak, HER2 proteini içermeyen negatif kontrol numunesi dahil edilir (STD 8). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Sandviç ELISA doğrulaması
Yeni geliştirilen tahlil, bir doğrulama prosedürü gerektirir. Önemli doğrulama parametreleri arasında doğrusallık, kesinlik ve algılama limitleri, yani alt tespit limiti (LLOD) ve üst tespit limiti bulunur. Önceki makalede, kapsamlı bir yöntem doğrulaması gerçekleştirdik. ELISA doğrusallığı, PBS ve serum gibi HER2'nin miktar tayini için önemli olan diğer matrislerde seyreltilmiş antijenin düşük (2, 5, 10 ng/mL)...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bir sandviç ELISA yapımında kritik bileşenler arasında, plaka üzerinde hareketsiz hale getirilen ve tahlil özgüllüğüne ve duyarlılığına katkıda bulunan yakalama antikorları vardır. Sunulan testte, yakalama antikoru olarak kendi bünyemizde üretilen ve karakterize edilen yeni monoklonal proteini (HER2/70.27.58) kullandık. Antikor, benzersiz bir CDR dizisine (tamamlayıcılık belirleyici bölge) sahipti ve afiniteye bağlı olarak, 0.0922 nM12'de
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
D.L., A.A., A.M., M.S., SDS Optic S.A.'dan mali destek beyan etti; A.A, A.M., M.S., SDS Optic S.A.'nın hisse senedi sahibi olduğunu beyan etti.
Teşekkürler
Çalışma, Ulusal Araştırma ve Geliştirme Merkezi hibesi STRATEGMEDII/269364/5/NCBR/2015 ve AB, Horizon 2020 KOBİ Aracı hibesi No. 783818'den bir fon ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
Referanslar
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır