Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Валидированный иммунохимический анализ для комплексного определения рецептора 2 эпидермального фактора роста человека, высвобождаемого из клеток и связанного с ними
В этой статье
Резюме
Мы представляем валидированный сэндвич-тест ИФА с использованием новых моноклональных антител против HER2. Этот анализ позволяет точно количественно определить связанный с клетками и высвобожденный белок HER2 из культивируемых in vitro клеток и других образцов, включая кровь и ткани.
Аннотация
Рецептор эпидермального фактора роста человека 2 (HER2) является хорошо известным маркером рака. Он стал очень успешной диагностической и терапевтической мишенью, особенно при раке молочной железы и других типах рака, экспрессирующих HER2. В клинике для измерения уровня экспрессии мембраносвязанного рецептора используются стандартные иммуногистохимические методы диагностики с использованием специфических анти-HER2 антител. Растворимый внеклеточный домен (ECD) HER2, который высвобождается из сверхэкспрессирующих клеток, циркулирует в крови и может отражать тканевую экспрессию рецептора. Существует потребность в точных и валидированных анализах для корреляции концентрации циркулирующего белка HER2 с клиническими проявлениями заболевания.
Наша команда разработала и валидировала новый иммуноферментный анализ (ИФА) для количественной оценки мембраносвязанного и высвобождаемого из клеток ECD-домена HER2. В анализе используются два уникальных моноклональных антитела, специфичных к HER2, разработанных ранее. Диапазон количественного определения включает концентрацию HER2 в диапазоне от 1,56 до 100 нг/мл, которая ожидаема для раковых клеток, культивируемых in vitro, и показывает чувствительность на уровне 0,5 нг/мл. Удовлетворительная внутри- и межанализная точность и аккуратность метода делают его применимым для количественного определения HER2 в различных типах биологических образцов, включая среду для культивирования клеток, сыворотку и солидную опухолевую ткань. Здесь мы сосредоточимся на комплексном определении рецептор-ассоциированных и секретируемых культивируемыми раковыми клетками in vitro . В статье представлен пошаговый протокол количественной оценки белка HER2, который может быть использован для тестирования различных клеточных линий, крови и тканей.
Введение
Успех современной терапии часто связан с прецизионной медициной, основанной на точнойидентификации пациентов, чувствительных к терапии. Среди этих методов лечения есть анти-HER2 препараты, нацеленные на рецептор, сверхэкспрессирующийся при различных опухолях, включая рак молочной железы, эндометрий, желудок, легкие и другие. Доступны несколько агентов, нацеленных на HER2, с подтвержденными преимуществами у пациентов с HER2-положительным раком, включая HER2-низкий тип2. Подтверждение HER2-положительного статуса имеет решающее значение для идентификации потенциальных ответивших пациентов; тем не менее, это остается проблемой, особенно в группе с низким уровнем HER2.
К золотым стандартным методам в клинических условиях, обычно используемым для тестирования HER2, относятся иммуногистохимическая экспрессия белка (ИГХ) и амплификация гена HER2 методами флуоресцентной гибридизации in situ (FISH). Кроме того, для экспрессии мРНК HER2 используется анализ Oncotype DX. Биопсия ткани, необходимая для этих методов, делает неопределенным определение права пациента на соответствующее лечение и его потенциальную реакцию на терапию. Несмотря на обновленные рекомендации 2018 года Американского общества клинической онкологии (ASCO) и Коллегии американских патологов (CAP) по снижению вариабельности между единицами тестирования, согласованность HER2 остается предметом для улучшения3.
HER2 является протоонкогеном, входящим в семейство рецепторов эпидермального фактора роста (EGFR), чрезмерная экспрессия и активация которых при патологических состояниях приводят к агрессивному исходу или способствуют неблагоприятному прогнозу4. HER2 представляет собой модульный белок с массой 185 кДа, закрепленный в клеточной мембране, который содержит цитоплазматическую тирозинкиназу и внеклеточный домен (ECD). HER2 ECD может выделяться из клеток и высвобождаться во внеклеточный матрикс5 в виде бесклеточного белка, далее циркулируя в крови. Повышенная экспрессия HER2 может отражаться в более высоком уровне циркулирующего ECD, представляя собой ценный прогностический и прогностический маркер 6,7, суррогатный маркер ответа на лечение8, или в качестве дополнительного метода к ИГХ для выявления пациентов, подходящих для лечения анти-HER29. Тем не менее, остается проблемой установление корреляции между экспрессией HER2 опухоли и системным уровнем рецептора в крови, которая могла бы иметь клиническое значение.
Высвобожденный HER2 ECD может быть количественно определен с помощью иммуноферментного анализа (ИФА)10. Сэндвич-ИФА — это подход, в котором используются два специфических антитела, связывающих разные эпитопы на одном и том же антигене-мишени. Он позволяет точно измерять солюбилизированные белки в легкодоступном биологическом материале на основе крови и жидкости (так называемая жидкая биопсия). Несмотря на наличие анализов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), существуют разногласия по поводу полезности диагностики HER2 ECD5 и порогового значения для повышенного уровня HER2 в крови. Необходимы дополнительные исследования с использованием валидированных методов и единообразно принятых пороговых значений для подтверждения применимости анализов11.
Важнейшими компонентами любого иммуноферментного анализа являются антитела (иммобилизованные на планшете и определяющие специфичность и чувствительность анализа) и обнаруживающие антитела (добавляемые после применения образцов) (Рисунок 1). В этом отчете мы представляем протокол ИФА, основанный на недавно разработанных новых моноклональных антителах (mAb) против HER2 ECD, которые были получены, очищены на аффинной колонке и тщательно охарактеризованы, а также представляют уникальные последовательности12. Разработанный ИФА, в котором используются эти специальные антитела, показывает свою полезность для точного количественного определения белка HER2, связанного с клеточной мембраной и высвобождаемого в культуральную среду для всесторонней оценки статуса рецептора. Анализ может быть использован в доклинических испытаниях и для поддержки текущих исследований. Эффективность анализа была дополнительно проверена на биологических образцах различного происхождения, включая гомогенаты сыворотки и тканей12, чтобы продемонстрировать потенциал в развитии исследований, диагностики и новых методов лечения анти-HER2 в будущем.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Культивирование раковых клеток человека
- Культивировать линии MDA-MB-231, SK-BR-3 и SK-OV-3 в среде Dulbecco's Modified Eagle's, содержащей 4,5 г/л ᴅ-глюкозы (DMEM-HG), с добавлением 2 мМ ʟ-глутамина и 10% (v/v) термоинактивированного FBS. Инкубируйте культуры при температуре 37 °C во влажной атмосфере с содержаниемCO2 5%.
- Когда культура достигнет ~80% конфлюенции, отделите клетки методом трипсинизации и соберите их в отдельные конические пробирки объемом 15 мл.
- Подсчитайте клетки с автоматическим счетчиком клеток и затравочные ячейки для эксперимента в 12-луночные планшеты с плотностью 3 × 105 клеток/на лунку в 1 мл питательной среды. Инкубируйте культуры при температуре 37 °C во влажной атмосфере с содержаниемCO2 5%.
ПРИМЕЧАНИЕ: Засеивайте по одной лунке в каждый момент эксперимента. В дальнейшем анализе будут использоваться как посткультуральная среда, так и клеточные лизаты.
2. Сбор и подготовка образцов
- Из культуры в течение 24 ч сбора соберите питательную среду из одной лунки каждой клеточной линии в пробирку объемом 1,5 мл.
- Собранные образцы центрифугируют при 10 000 × г в течение 10 мин при 4 °C. Перенесите надосадочную жидкость в новую пробирку и храните при температуре -20 °C для дальнейшего определения уровня секретируемого ECD HER2.
- Промойте оставшиеся на тарелке клетки 1 мл холодного PBS, осторожно аспирируйте и выбросьте PBS.
- Добавьте 200 мкл буфера RIPA (с добавлением 1% ингибитора протеазы) в каждую лунку и инкубируйте в течение 5 минут. Соскребите клетки скребком для клеток и перемешайте путем пипетирования несколько раз для гомогенизации лизата.
- Соберите лизированные клетки в новую пробирку и медленно аспирируйте в шприц объемом 2 мл с иглой (G21 / 0,8 мм × 40 мм). Повторите шаг аспирации 5-10 раз для дальнейшего распада клеток.
- Собранные образцы центрифугируют при давлении 10 000 x g в течение 10 мин при 4 °C. Перенесите надосадочную жидкость в новую пробирку и храните при температуре -20 °C для дальнейшего определения связанной с клетками фракции белка HER2.
- Повторите сбор питательных сред и клеточных материалов, следуя этапам подготовки для остальных временных точек - 48 ч и 72 ч посева.
3. Проведение сэндвич-ИФА для определения HER2
- Подготовьте буферы.
- Буфер для покрытия: Приготовьте 0,1 М раствора NaHCO3 , растворив 0,42 г NaHCO3 в 50 мл дистиллированной воды, и тщательно перемешайте. Отрегулируйте pH до 9,6 с помощью 3 М NaOH.
- Блокирующий буфер: Приготовьте 5% обезжиренное молочное молоко (NFDM) в PBS, добавив 0,5 г сухого промокательного молока к 10 мл PBS и тщательно перемешайте.
- Буфер для стирки: Приготовьте фосфатно-солевой буфер с Tween 20 (PBST), добавив 0,5 мл 0,05% Tween-20 на 1000 мл PBS и перемешайте (избегайте чрезмерного пенообразования).
- Биотинилат – детектирующее антитело.
- Биотинилат 50-200 мкг детектирования антител к HER2 (клон 70.21.73.67) с использованием коммерческого набора для маркировки биотина согласно инструкции производителя.
ПРИМЕЧАНИЕ: Надежность и повторяемость процесса биотинилирования основаны на измерении конечной концентрации белка полученного антитела и сравнении продукта от партии к партии.
- Биотинилат 50-200 мкг детектирования антител к HER2 (клон 70.21.73.67) с использованием коммерческого набора для маркировки биотина согласно инструкции производителя.
- Нанесите мазок на тарелку.
- Разбавляют анти-HER2 захватывающее антитело (клон 70.27.58) до концентрации 1 мкг/мл в буфере покрытия. Для покрытия одной пластины используйте 6,5 мл раствора захватывающего антитела.
- С помощью многоканальной пипетки добавьте по 100 мкл раствора захватывающего антитела (приготовленного на шаге 3.3.1) в каждую лунку на 96-луночном планшете для ИФА.
ПРИМЕЧАНИЕ: Избегайте самых внешних отверстий пластины (например, A1, H12), чтобы уменьшить изменчивость, вызванную краевым эффектом. Крайние лунки должны быть заполнены дистиллированной водой для обеспечения стабильных условий реакции. - Накройте тарелку герметизирующей пленкой.
- Инкубируйте планшет на ночь (O/N) при 4 °C.
- После инкубации O/N поместите планшет при комнатной температуре (RT) на горизонтальный встряхиватель микропланшетов (20-30 об/мин с углом наклона 4°-6°) на 1 ч.
- С помощью промывочной машины для микропланшетов отсадите раствор для покрытия и трижды промойте пластину с помощью промывочного буфера (3 x 300 μL PBST на лунку).
- Заблокируйте пластину.
- С помощью многоканальной пипетки добавьте 100 мкл блокирующего буфера (5% NFDM в PBS) в каждую лунку с покрытием, чтобы блокировать неспецифические сайты связывания.
- Накройте тарелку герметизирующей пленкой.
- Инкубировать планшет в течение 1 ч при температуре 37 °C в камере с влажностью.
- С помощью промывочной машины для микропланшетов отсадите раствор для покрытия и трижды промойте пластину с помощью промывочного буфера (3 x 300 μL PBST на лунку).
- Подготовьте калибровочную кривую и положительный контроль (рисунок 2).
- Приготовьте рабочий стандартный раствор антигена HER2, добавив 2 мкл 1 мг/мл стокового раствора к 1998 мкл PBS для получения 0,001 мг/мл (1000 нг/мл) концентрации HER2.
- Разбавляют рабочий стандартный раствор (WSS) путем добавления 200 мкл раствора к 1800 мкл PBS для получения стандартного раствора 1 (STD 1).
- Подготовьте последующие шесть стандартов (STD 2-STD 7) путем последовательного разведения STD 1 в PBS (рис. 2).
- STD 2: Добавьте 500 μL STD 1 до 500 μL PBS и тщательно перемешайте до получения 50 нг/мл.
- STD 3: Добавьте 500 μL STD 2 к 500 μL PBS и тщательно перемешайте до получения 25 нг/мл.
- STD 4: Добавьте 500 мкл STD 3 до 500 мкл PBS и тщательно перемешайте до получения 12,5 нг/мл.
- STD 5: Добавьте 500 мкл STD 4 до 500 мкл PBS и тщательно перемешайте до получения 6,25 нг/мл.
- STD 6: Добавьте 500 μL STD 5 до 500 μL PBS и тщательно перемешайте до получения 3,125 нг/мл.
- STD 7: Добавьте 500 μL STD 6 к 500 μL PBS и тщательно перемешайте до получения 1,5625 нг/мл.
- STD 8: Добавьте 500 мкл PBS для приготовления 0 нг/мл.
- Положительный контроль: Разбавляйте STD 1 путем добавления 100 мкл раствора STD 1 к 900 мкл PBS для получения раствора HER2 с концентрацией белка 10 нг/мл.
- Подготовьте образцы для экспериментов по спайку и восстановлению.
- Подготовьте образцы матрицы (PBS, клеточные лизаты и питательная среда) с известной концентрацией белка HER2. Разбавляют клеточные лизаты в соотношении 1:2000 путем добавления 2,5 мкл соответствующего клеточного лизата к 5 мл PBS для получения матрицы образца с уровнем HER2 ниже LOD метода.
- Используйте WSS (1000 нг/мл) и STD1 (100 нг/мл) для образцов матрицы спайков.
- Для каждой матрицы готовят по 6 образцов с концентрациями 0, 2, 5, 10, 30 и 50 нг/мл.
- Для приготовления 0 нг/мл добавьте 400 мкл PBS/культуральная среда/лизат клеток.
- Для приготовления 2 нг/мл добавьте 8 мкл STD1 к 392 мкл PBS/культуральная среда/лизат клеток и тщательно перемешайте.
- Для приготовления 5 нг/мл добавьте 20 мкл STD1 к 380 мкл PBS/культуральная среда/лизат клеток и тщательно перемешайте.
- Для приготовления 10 нг/мл добавьте 4 мкл WSS к 396 мкл PBS/культуральная среда/лизат клеток и тщательно перемешайте.
- Для приготовления 30 нг/мл добавьте 12 мкл WSS к 388 мкл PBS/питательной среды/лизата клеток и тщательно перемешайте.
- Для приготовления 50 нг/мл добавьте 20 мкл WSS к 380 мкл PBS/культуральная среда/лизат клеток и тщательно перемешайте.
- Добавьте образец, пустой и стандартный.
- С помощью одноканальной пипетки добавьте в соответствующие лунки 100 мкл стандартных, бланковых (PBS) и испытуемых образцов (клеточных лизатов и питательной среды).
ПРИМЕЧАНИЕ: Рекомендуется запускать каждый образец в трех экземплярах. - Накройте тарелку герметизирующей пленкой.
- Инкубировать планшет в течение 1 ч при температуре 37 °C в камере с влажностью.
- С помощью промывочной машины для микропланшетов отсадите раствор для покрытия и трижды промойте пластину с помощью промывочного буфера (3 x 300 μL PBST на лунку).
- С помощью одноканальной пипетки добавьте в соответствующие лунки 100 мкл стандартных, бланковых (PBS) и испытуемых образцов (клеточных лизатов и питательной среды).
- Обнаружение связывания антител.
- Развести биотинилированное детектирующее антитело (клон 70.21.73.67) в PBS до рабочей концентрации 1 мкг/мл. На одну пластину используют 6,5 мл рабочего раствора для обнаружения антител.
- С помощью многоканальной пипетки добавьте в каждую лунку по 100 мкл рабочего раствора детектирующего антитела.
- Накройте тарелку герметизирующей пленкой.
- Инкубировать планшет в течение 1 ч при температуре 37 °C в камере с влажностью.
- С помощью промывочной машины для микропланшетов отсадите раствор для покрытия и трижды промойте пластину с помощью промывочного буфера (3 x 300 μL PBST на лунку).
- Добавьте конъюгат Авидин-HRP.
- Разбавьте коммерчески доступный конъюгат Авидин-HRP в соотношении 1:40000 путем добавления 1 мкл ферментативного конъюгата к 40 мл PBST.
- С помощью многоканальной пипетки добавьте по 100 мкл разведенного конъюгата в каждую лунку.
- Накройте тарелку герметизирующей пленкой.
- Инкубировать планшет в течение 1 ч при температуре 37 °C в камере с влажностью.
- С помощью промывочной машины для микропланшетов отсадите раствор для покрытия и трижды промойте пластину с помощью промывочного буфера (3 x 300 μL PBST на лунку).
- Колориметрическая реакция
- С помощью многоканальной пипетки добавьте в каждую лунку по 100 мкл субстрата 3,3',5,5'-тетраметилбензидина (ТМБ).
- Накройте тарелку герметизирующей пленкой.
- Инкубируйте пластину в течение 1-5 минут при температуре 37 °C вдали от света и следите за развитием цвета.
- Когда цвет достигнет ожидаемого уровня, добавьте 100 мкл стоп-раствора, чтобы завершить реакцию.
ПРИМЕЧАНИЕ: Ожидаемый уровень соответствует интенсивному синему цвету в лунках, содержащих образцы с высокой концентрацией аналита.
- Собирайте и анализируйте данные.
- Измерьте поглощение на длине волны 450 нм с помощью считывателя микропланшетов.
- Используя 4-параметрическую калибровочную кривую, рассчитайте концентрацию образца на основе уравнения кривой.
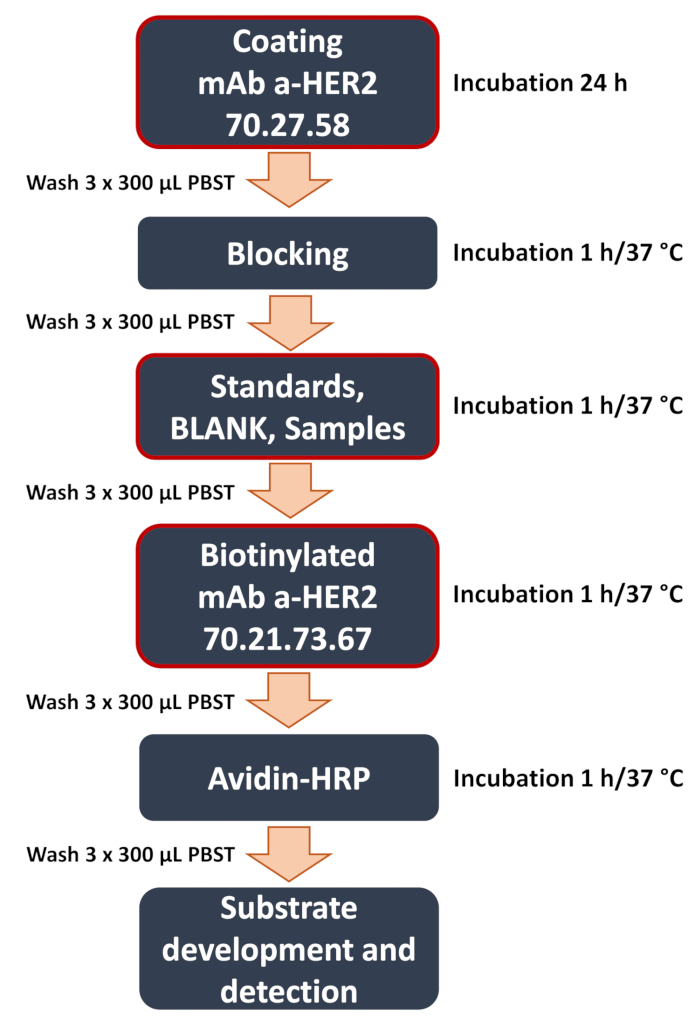
Рисунок 1: Принципиальная схема разработанного рабочего процесса анти-HER2 сэндвич-ИФА. Обзор ключевых этапов процедуры сэндвич-ИФА. К ним относятся критические этапы (выделены красной рамкой), такие как покрытие пластины захватывающим анти-HER2 антителом 70.27.58, добавление образцов (стандартов кривой, бланка, экспериментальных образцов клеточных лизатов или питательной среды) и связывание детектирующего анти-HER2 антитела 70.21.73.67. Анализ завершается обнаружением сигнала и анализом данных, где колориметрический сигнал количественно оценивается с помощью считывателя микропланшетов для определения концентрации целевого антигена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Схема представления подготовки калибровочной кривой стандартных растворов. Серийные разведения рекомбинантного белка HER2 подготавливают для получения калибровочной кривой в диапазоне концентраций 1,56-100 нг/мл (флаконы STD 1-STD 7). Кроме того, включается отрицательный контрольный образец без белка HER2 (STD 8). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Валидация ИФА для сэндвичей
Недавно разработанный анализ требует процедуры валидации. Важными параметрами валидации являются линейность, точность и пределы обнаружения, т. е. нижний предел обнаружения (LLOD) и верхний предел обнаружения. В предыдущей статье ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Среди критических компонентов при построении сэндвич-ИФА выделяют захватывающие антитела, которые иммобилизуются на планшете и способствуют специфичности и чувствительности анализа. В представленном анализе мы использовали в качестве захватывающего антитела нов?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
D.L., A.A., A.M., M.S. заявляют о финансовой поддержке со стороны SDS Optic S.A.; A.A, A.M., M.S. заявляют о праве собственности на акции SDS Optic S.A.
Благодарности
Исследование было поддержано грантом Национального центра исследований и разработок STRATEGMEDII/269364/5/NCBR/2015 и грантом ЕС Horizon 2020 SME Instrument No 783818.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
Ссылки
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены