A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקה אימונוכימית מאומתת לקביעה מקיפה של קולטן גורם הגדילה האפידרמלי האנושי 2 המשתחרר מהתאים וקשור אליהם
In This Article
Summary
אנו מציגים בדיקת ELISA מאומתת של סנדוויץ' באמצעות נוגדנים חד שבטיים חדשים נגד HER2. בדיקה זו מאפשרת כימות מדויק של חלבון HER2 הקשור לתאים ומשתחרר מתאים מתורבתים במבחנה ודגימות אחרות, כולל דם ורקמות.
Abstract
קולטן גורם גדילה אפידרמלי אנושי 2 (HER2) הוא סמן סרטן מבוסס היטב. זה הפך למטרה אבחנתית וטיפולית מוצלחת מאוד, במיוחד בסרטן השד וסוגי סרטן אחרים המבטאים HER2. במרפאה, נעשה שימוש בשיטות האבחון האימונוהיסטוכימיות בתקן הזהב המשתמשות בנוגדנים הספציפיים נגד HER2 כדי למדוד את רמת הביטוי של הקולטן הקשור לממברנה. התחום החוץ-תאי המסיס (ECD) של HER2 המשתחרר מהתאים המבטאים יתר על המידה מסתובב בדם ויכול לשקף את ביטוי הרקמה של הקולטן. יש צורך בבדיקות מדויקות ומאומתות כדי לתאם את ריכוז חלבון HER2 במחזור עם ביטויים קליניים של מחלה.
הצוות שלנו פיתח ואימת את הבדיקה האימונוסורבנטית המקושרת לאנזים סנדוויץ' (ELISA) לכימות תחום ה-ECD הקשור לממברנה ומשתחרר מהתאים של HER2. הבדיקה משתמשת בשני נוגדנים חד-שבטיים ייחודיים ספציפיים ל-HER2 שפותחו בעבר. טווח הכימות כולל ריכוז HER2 בין 1.56-100 ננוגרם/מ"ל, הצפוי לתאים סרטניים שגודלו במבחנה ומראה רגישות ברמה של 0.5 ננוגרם/מ"ל. הדיוק והדיוק התוך-ובין הבדיקות המשביעות רצון של השיטה הופכים אותה לרלוונטית לכימות HER2 בסוגים שונים של דגימות ביולוגיות, כולל מדיום תרבית תאים, סרום ורקמת גידול מוצקה. כאן, אנו מתמקדים בקביעה המקיפה של הקולטן הקשור ומופרש על ידי תאי הסרטן המתורבתים במבחנה . המאמר מציג פרוטוקול שלב אחר שלב לכימות חלבון HER2 שניתן להשתמש בו לבדיקת מגוון קווי תאים, דם ורקמות.
Introduction
הצלחתם של טיפולים מודרניים קשורה לעתים קרובות לרפואה מדויקת המבוססת על זיהוי מדויק של חולים רגישים לטיפול1. בין הטיפולים הללו ניתן למנות את התרופות האנטי-HER2 המכוונות לקולטן המתבטא יתר על המידה במגוון גידולים, כולל שד, רירית הרחם, קיבה, ריאות ואחרים. מספר תרופות ממוקדות HER2 זמינות עם יתרונות מוכחים בחולים עם סרטן חיובי ל-HER2, כולל HER2-low type2. אישור הסטטוס החיובי ל-HER2 הוא קריטי לזיהוי החולים המגיבים הפוטנציאליים; עם זאת, זה עדיין מאתגר, במיוחד בקבוצה עם HER2 נמוך.
שיטות תקן הזהב במסגרות קליניות, המשמשות באופן שגרתי לבדיקת HER2, כוללות ביטוי חלבון אימונוהיסטוכימיה (IHC) והגברת גנים HER2 על ידי גישות פלואורסצנטיות הכלאה באתרה (FISH). בנוסף, בדיקת Oncotype DX משמשת לביטוי mRNA HER2. ביופסיית רקמות הנדרשת לשיטות אלה הופכת את קביעת זכאות המטופל לטיפול מתאים ואת היענותו הפוטנציאלית לטיפולים לבלתי ודאית. למרות ההנחיות המעודכנות משנת 2018 על ידי האגודה האמריקאית לאונקולוגיה קלינית (ASCO) והמכללה האמריקאית לפתולוגים (CAP) להפחתת השונות בין יחידות הבדיקה, קונקורדנציה HER2 נותרה נושא לשיפור3.
HER2 הוא חבר פרוטו-אונקוגן ממשפחת קולטני גורם הגדילה האפידרמלי (EGFR) שביטוי יתר והפעלה במצבים פתולוגיים מביאים לתוצאה אגרסיבית או תורמים לפרוגנוזה גרועה4. HER2 הוא חלבון מודולרי של 185 kDa המעוגן בקרום התא המכיל טירוזין קינאז ציטופלזמי ותחום חוץ-תאי (ECD). ניתן לשפוך את ה-HER2 ECD מהתאים כדי להשתחרר למטריצה החוץ-תאית5 כחלבון נטול תאים, המסתובב עוד יותר בדם. ביטוי מוגבר של HER2 עשוי לבוא לידי ביטוי ברמה גבוהה יותר של ECD במחזור הדם, המציג סמן ניבוי ופרוגנוסטי בעל ערך 6,7, סמן חלופי לתגובה לטיפול8, או כשיטה משלימה ל-IHC לזיהוי חולים המתאימים לטיפול נגד HER29. עם זאת, האתגר נותר בקביעת המתאם בין ביטוי הגידול HER2 לרמה המערכתית של הקולטן בדם שיכולה להיות בעלת משמעות קלינית.
ניתן לכמת את ה-HER2 ECD ששוחרר באמצעות בדיקת אימונוסורבנט מקושר לאנזים (ELISA)10. הכריך ELISA הוא גישה המשתמשת בשני נוגדנים ספציפיים הקושרים אפיטופים שונים על אותו אנטיגן מטרה. הוא מאפשר מדידה מדויקת של חלבונים מסיסים בחומר הביולוגי הנגיש בקלות על בסיס דם ונוזל (מה שנקרא ביופסיה נוזלית). למרות נוכחותן של בדיקות שאושרו על ידי מינהל המזון והתרופות (FDA), קיימת מחלוקת לגבי התועלת של אבחון HER2 ECD5 וערך החיתוך לעלייה ברמת HER2 בדם. יש צורך במחקר נוסף עם השיטות המתוקפות והספים המקובלים באופן אחיד כדי לאשר את ישימות הבדיקות11.
המרכיבים הקריטיים של כל ELISA הם לכידה (משותק על הצלחת והגדרת הספציפיות והרגישות של הבדיקה) וזיהוי נוגדנים (שנוספו לאחר יישום הדגימות) נוגדנים (איור 1). בדוח זה, אנו מציגים את פרוטוקול ELISA המבוסס על הנוגדנים החד-שבטיים החדשים שפותחו לאחרונה נגד HER2 ECD (mAb) שנוצרו, טוהרו על עמודת זיקה ואופיינו ביסודיות, ומציגים רצפים ייחודיים12. ה-ELISA שפותח המשתמש בנוגדנים מותאמים אישית אלה מראה את התועלת שלו לכימות מדויק של חלבון HER2 הקשור לקרום התא ומשוחרר למדיום תרבית להערכה מקיפה של מצב הקולטן. ניתן להשתמש בבדיקה בבדיקות פרה-קליניות וכדי לתמוך במחקר מתמשך. ביצועי הבדיקה נבדקו עוד על דגימות ביולוגיות ממקורות שונים, כולל סרום והומוגנטים של רקמות12, כדי להראות פוטנציאל בפיתוח מחקר, אבחון וטיפולים חדשניים נגד HER2 בעתיד.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. תרבית תאים סרטניים אנושיים
- תרבית MDA-MB-231, SK-BR-3 ו-SK-OV-3 במדיום הנשר המותאם של Dulbecco המכיל 4.5 גרם/ליטר של ᴅ-גלוקוז (DMEM-HG), בתוספת 2 מ"מ ʟ-גלוטמין ו-10% (v/v) FBS מומת חום. דגירה של תרביות בטמפרטורה של 37 מעלות צלזיוס באווירה לחה של 5% CO2.
- כאשר התרבית מגיעה למפגש של ~80%, נתק תאים על ידי טריפסיניזציה ואסוף אותם לצינורות חרוטיים נפרדים של 15 מ"ל.
- ספרו את התאים עם מונה תאים אוטומטי ותאי זרעים לניסוי לצלחות של 12 בארות בצפיפות של 3 × 105 תאים לבאר ב-1 מ"ל של מצע גידול. דגירה של תרביות בטמפרטורה של 37 מעלות צלזיוס באווירה לחה של 5% CO2.
הערה: זרע באר אחת לכל נקודת זמן של הניסוי. גם מדיום לאחר תרבית וגם ליזאטים תאים ישמשו בניתוח נוסף.
2. איסוף והכנה של דוגמאות
- מהתרבית של 24 שעות, אסוף מדיום תרבית מבאר אחת של כל קו תאים לתוך צינור של 1.5 מ"ל.
- צנטריפוגה את הדגימות שנאספו ב-10,000 × גרם למשך 10 דקות ב-4 מעלות צלזיוס. העבירו את הסופרנטנט לצינור חדש ואחסנו בטמפרטורה של -20 מעלות צלזיוס כדי לקבוע עוד יותר את רמת ה-ECD HER2 המופרשת.
- שוטפים את התאים הנותרים בצלחת עם 1 מ"ל PBS קר, שואפים בעדינות וזורקים את ה- PBS.
- הוסף 200 מיקרוליטר של מאגר RIPA (בתוספת 1% של מעכב פרוטאז) לכל באר ודגר למשך 5 דקות. מגרדים את התאים בעזרת מגרד התאים ומערבבים על ידי פיפטינג מספר פעמים כדי להומוגניזציה של הליזאט.
- אוספים את התאים הליזים לצינור חדש ושואבים לאט למזרק של 2 מ"ל בעזרת מחט (G21 / 0.8 מ"מ × 40 מ"מ). חזור על שלב השאיפה 5-10 פעמים כדי לפרק תאים עוד יותר.
- צנטריפוגה את הדגימות שנאספו ב-10,000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס. העבירו את הסופרנטנט לצינור חדש ואחסנו בטמפרטורה של -20 מעלות צלזיוס לקביעה נוספת של החלק הקשור לתא של חלבון HER2.
- חזור על איסוף של מדיום תרבית וחומרים סלולריים, בעקבות שלבי ההכנה לנקודות הזמן הנותרות - 48 שעות ו -72 שעות של תרבית.
3. ביצוע סנדוויץ' ELISA לקביעת HER2
- הכן את המאגרים.
- מאגר ציפוי: הכן תמיסת NaHCO3 של 0.1 M על ידי המסת 0.42 גרם NaHCO3 ב-50 מ"ל מים מזוקקים וערבב היטב. התאם את ה-pH ל-9.6 עם 3 M NaOH.
- חיץ חוסם: הכינו חלב חלב דל שומן 5% (NFDM) ב-PBS על ידי הוספת 0.5 גרם אבקת חלב סופג ל-10 מ"ל PBS וערבבו היטב.
- מאגר כביסה: הכן תמיסת מלח עם חוצץ פוספט עם Tween 20 (PBST) על ידי הוספת 0.5 מ"ל של 0.05% Tween-20 עד 1000 מ"ל PBS וערבב (הימנע מקצף מוגזם).
- ביוטינילאט, הנוגדן המגלה.
- ביוטינילט 50-200 מיקרוגרם של גילוי נוגדנים נגד HER2 (שיבוט 70.21.73.67) באמצעות ערכת תיוג ביוטין מסחרית על פי הוראות היצרן.
הערה: האמינות והחזרתיות של תהליך הביוטינילציה מבוססות על מדידת ריכוז החלבון הסופי של הנוגדן שנוצר והשוואה בין אצווה לאצווה של המוצר.
- ביוטינילט 50-200 מיקרוגרם של גילוי נוגדנים נגד HER2 (שיבוט 70.21.73.67) באמצעות ערכת תיוג ביוטין מסחרית על פי הוראות היצרן.
- מצפים את הצלחת.
- יש לדלל את הנוגדן הלוכד נגד HER2 (שיבוט 70.27.58) לריכוז של 1 מיקרוגרם/מ"ל במאגר הציפוי. לציפוי צלחת אחת, השתמש ב-6.5 מ"ל של תמיסת הנוגדנים הלוכדים.
- בעזרת פיפטה רב-ערוצית, הוסף 100 מיקרוליטר מתמיסת הנוגדנים הלוכדים (שהוכנה בשלב 3.3.1) לכל באר על צלחת ELISA של 96 בארות.
הערה: הימנע מהבארות החיצוניות ביותר של הצלחת (למשל, A1, H12) כדי להפחית את השונות הנגרמת על ידי אפקט הקצה. יש למלא את הבארות החיצוניות ביותר במים מזוקקים כדי להבטיח תנאי תגובה יציבים. - מכסים את הצלחת בסרט איטום.
- דגירה של צלחת לילה (O/N) ב-4 מעלות צלזיוס.
- לאחר דגירה של O/N, הנח את הצלחת בטמפרטורת החדר (RT) על שייקר מיקרופלייט אופקי (20-30 סל"ד עם זווית הטיה של 4°-6°) למשך שעה.
- בעזרת מכונת כביסה מיקרופלייט, שאפו את תמיסת הציפוי ושטפו את הצלחת שלוש פעמים עם מאגר כביסה (3 x 300 מיקרוליטר PBST לבאר).
- חסום את הצלחת .
- בעזרת פיפטה רב-ערוצית, הוסף 100 מיקרוליטר של מאגר חוסם (5% NFDM ב-PBS) לכל באר מצופה כדי לחסום אתרי קשירה לא ספציפיים.
- מכסים את הצלחת בסרט איטום.
- דגרו את הצלחת למשך שעה בטמפרטורה של 37 מעלות צלזיוס בתא לחות.
- בעזרת מכונת כביסה מיקרופלייט, שאפו את תמיסת הציפוי ושטפו את הצלחת שלוש פעמים עם מאגר כביסה (3 x 300 מיקרוליטר PBST לבאר).
- הכינו עקומת כיול ובקרה חיובית (איור 2).
- הכן את התמיסה הסטנדרטית לעבודה של אנטיגן HER2 על ידי הוספת 2 מיקרוליטר של תמיסת מלאי של 1 מ"ג/מ"ל ל-1998 מיקרוליטר של PBS כדי להשיג ריכוז HER2 של 0.001 מ"ג/מ"ל (1000 ננוגרם/מ"ל).
- לדלל את הפתרון הסטנדרטי לעבודה (WSS) על ידי הוספת 200 μL של התמיסה ל- 1800 μL של PBS כדי לקבל את הפתרון הסטנדרטי 1 (STD 1).
- הכן את ששת התקנים הבאים (STD 2-STD 7) על ידי דילול סדרתי של STD 1 ב-PBS (איור 2).
- STD 2: הוסף 500 מיקרוליטר של STD 1 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 50 ננוגרם/מ"ל.
- STD 3: הוסף 500 מיקרוליטר של STD 2 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 25 ננוגרם/מ"ל.
- STD 4: הוסף 500 מיקרוליטר של STD 3 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 12.5 ננוגרם/מ"ל.
- STD 5: הוסף 500 מיקרוליטר של STD 4 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 6.25 ננוגרם/מ"ל.
- STD 6: הוסף 500 מיקרוליטר של STD 5 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 3.125 ננוגרם/מ"ל.
- STD 7: הוסף 500 מיקרוליטר של STD 6 עד 500 מיקרוליטר של PBS וערבב היטב להכנת 1.5625 ננוגרם/מ"ל.
- STD 8: הוסף 500 מיקרוליטר של PBS להכנת 0 ננוגרם/מ"ל.
- בקרה חיובית: דילול STD 1 על ידי הוספת 100 מיקרוליטר של תמיסת STD 1 ל-900 מיקרוליטר של PBS כדי לקבל תמיסה של HER2 בריכוז חלבון של 10 ננוגרם/מ"ל.
- הכן דגימות לניסויי ספייק והתאוששות.
- הכן את דגימות המטריצה (PBS, ליזטים של תאים ומדיום תרבית) עם ריכוז חלבון HER2 הידוע. דילול תאים 1:2000 על ידי הוספת 2.5 מיקרוליטר של ליזאט תאים מתאים ל-5 מ"ל של PBS כדי לרכוש מטריצת דגימה עם רמת HER2 מתחת ל-LOD של השיטה.
- השתמש ב-WSS (1000 ננוגרם/מ"ל) ו-STD1 (100 ננוגרם/מ"ל) כדי להגדיל דגימות מטריצה.
- עבור כל מטריצה, הכינו 6 דגימות בריכוזים של 0, 2, 5, 10, 30 ו-50 ננוגרם/מ"ל.
- להכנת 0 ננוגרם/מ"ל, הוסף 400 מיקרוליטר של PBS/מדיום תרבית/ליזאט תאים.
- להכנת 2 ננוגרם/מ"ל, הוסף 8 מיקרוליטר של STD1 ל-392 מיקרוליטר של PBS/תרבית מדיום/ליזאט תאים וערבב היטב.
- להכנת 5 ננוגרם/מ"ל, הוסף 20 מיקרוליטר של STD1 ל-380 מיקרוליטר של PBS/תרבית מדיום/ליזאט תאים וערבב היטב.
- להכנת 10 ננוגרם/מ"ל, הוסף 4 מיקרוליטר של WSS ל-396 מיקרוליטר של PBS/מדיום תרבית/ליזאט תאים וערבב היטב.
- להכנת 30 ננוגרם/מ"ל, הוסיפו 12 מיקרוליטר של WSS ל-388 מיקרוליטר של PBS/תרבית מדיום/ליזאט תאים וערבבו היטב.
- להכנת 50 ננוגרם/מ"ל, הוסיפו 20 מיקרוליטר של WSS ל-380 מיקרוליטר של PBS/מדיום תרבית/ליזאט תאים וערבבו היטב.
- הוסף את הדוגמה, הריק והרגיל.
- בעזרת פיפטה חד-ערוצית, הוסף 100 מיקרוליטר של תקנים, ריקים (PBS) ודגימות שנבדקו (ליזטים של תאים ומדיום תרבית) לבארות מתאימות.
הערה: מומלץ להריץ כל דגימה בשלוש עותקים. - מכסים את הצלחת בסרט איטום.
- דגרו את הצלחת למשך שעה בטמפרטורה של 37 מעלות צלזיוס בתא לחות.
- בעזרת מכונת כביסה מיקרופלייט, שאפו את תמיסת הציפוי ושטפו את הצלחת שלוש פעמים עם מאגר כביסה (3 x 300 מיקרוליטר PBST לבאר).
- בעזרת פיפטה חד-ערוצית, הוסף 100 מיקרוליטר של תקנים, ריקים (PBS) ודגימות שנבדקו (ליזטים של תאים ומדיום תרבית) לבארות מתאימות.
- זיהוי קשירת נוגדנים.
- יש לדלל את הנוגדן המזהה ביוטיניל (שיבוט 70.21.73.67) ב-PBS לריכוז עבודה של 1 מיקרוגרם/מ"ל. עבור צלחת אחת, השתמש ב-6.5 מ"ל של תמיסת זיהוי נוגדנים.
- בעזרת פיפטה רב-ערוצית, הוסף 100 מיקרוליטר מתמיסת הנוגדן המגלה לכל באר.
- מכסים את הצלחת בסרט איטום.
- דגרו את הצלחת למשך שעה בטמפרטורה של 37 מעלות צלזיוס בתא לחות.
- בעזרת מכונת כביסה מיקרופלייט, שאפו את תמיסת הציפוי ושטפו את הצלחת שלוש פעמים עם מאגר כביסה (3 x 300 מיקרוליטר PBST לבאר).
- הוסף מצומד Avidin-HRP.
- לדלל את מצומד Avidin-HRP הזמין מסחרית 1:40,000 על ידי הוספת 1 מיקרוליטר של מצומד אנזימטי ל-40 מ"ל של PBST.
- בעזרת פיפטה רב-ערוצית מוסיפים 100 מיקרוליטר מהמצומד המדולל לכל באר.
- מכסים את הצלחת בסרט איטום.
- דגרו את הצלחת למשך שעה בטמפרטורה של 37 מעלות צלזיוס בתא לחות.
- בעזרת מכונת כביסה מיקרופלייט, שאפו את תמיסת הציפוי ושטפו את הצלחת שלוש פעמים עם מאגר כביסה (3 x 300 מיקרוליטר PBST לבאר).
- תגובה קולורימטרית
- בעזרת פיפטה רב-ערוצית, הוסף 100 מיקרוליטר של מצע 3,3′,5,5′-Tetramethylbenzidine (TMB) לכל באר.
- מכסים את הצלחת בסרט איטום.
- דגרו את הצלחת למשך 1-5 דקות בטמפרטורה של 37 מעלות צלזיוס הרחק מהאור ועקבו אחר התפתחות הצבע.
- כאשר הצבע מגיע לרמה הצפויה, הוסף 100 מיקרוליטר של תמיסת עצירה כדי לסיים את התגובה.
הערה: הרמה הצפויה תואמת צבע כחול עז בבארות המכילות דגימות עם ריכוז גבוה של האנליט.
- רכוש ונתח נתונים.
- מדוד את הספיגה ב-450 ננומטר באמצעות קורא מיקרו-פלטות.
- באמצעות עקומת כיול בת 4 פרמטרים, חשב את ריכוז הדגימה על סמך משוואת העקומה.
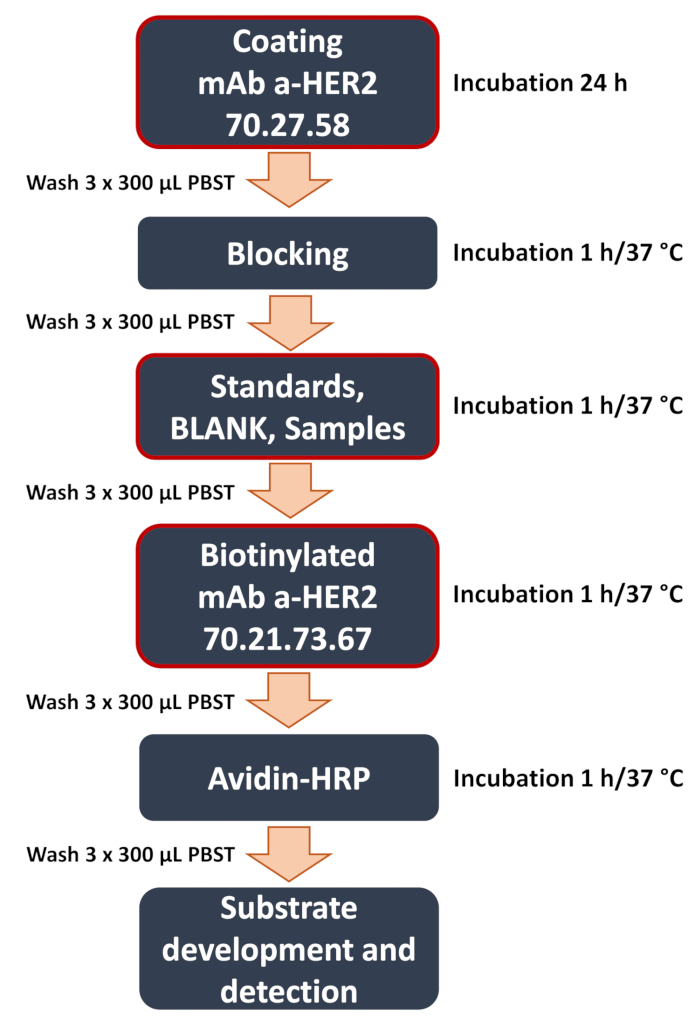
איור 1: דיאגרמה סכמטית של זרימת עבודה מפותחת של כריך אנטי-HER2 ELISA. סקירה כללית של השלבים העיקריים בהליך ELISA של כריך. אלה כוללים את השלבים הקריטיים (מודגשים במסגרת אדומה) כמו ציפוי צלחת עם נוגדן אנטי-HER2 לוכד 70.27.58, הוספת דגימות (תקני עקומה, ריקים, דגימות ניסיוניות של ליזאט התא או מדיום התרבית), וקשירה של נוגדן הזיהוי נגד HER2 70.21.73.67. הבדיקה מסתיימת בזיהוי אותות וניתוח נתונים, כאשר האות הקולורימטרי מכומת באמצעות קורא מיקרו-פלטות כדי לקבוע את ריכוז אנטיגן המטרה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: סכמה המציגה את הכנת הפתרונות הסטנדרטיים של עקומת הכיול. דילולים סדרתיים של החלבון הרקומביננטי HER2 מוכנים ליצירת עקומת כיול בטווח ריכוזים של 1.56-100 ננוגרם/מ"ל (בקבוקונים STD 1-STD 7). בנוסף, נכללת דגימת הבקרה השלילית ללא חלבון HER2 (STD 8). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
אימות סנדוויץ' ELISA
הבדיקה החדשה שפותחה דורשת הליך אימות. פרמטרי האימות החשובים כוללים גבולות ליניאריות, דיוק וזיהוי, כלומר, גבול זיהוי תחתון (LLOD) וגבול עליון של זיהוי. במאמר הקודם, ביצענו אימות שיטה יסודי. הליניאריות של ELISA נבדקה על ידי שימוש בדגימות הנלעגות עבו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
בין המרכיבים הקריטיים בבניית סנדוויץ' ELISA, ישנם נוגדנים לוכדים המשותקים על הצלחת ותורמים לספציפיות ולרגישות הבדיקה. בבדיקה שהוצגה, השתמשנו כנוגדן הלוכד את החלבון החד-שבטי החדש (HER2/70.27.58) שנוצר ואפיין בבית. לנוגדנים היה רצף ייחודי של ה-CDR (אזור קובע משלימות), ובהתבסס על הזיק?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
D.L., A.A., A.M., M.S. מצהירים על תמיכה כספית מ-SDS Optic S.A.; A.A, A.M., M.S. מצהירים על בעלות על מניות SDS Optic S.A.
Acknowledgements
המחקר נתמך על ידי כספים ממענק המרכז הלאומי למחקר ופיתוח STRATEGMEDII/269364/5/NCBR/2015 ומענק האיחוד האירופי, Horizon 2020 SME Instrument מס' 783818.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
References
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved