需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
经验证的免疫化学检测试剂盒,用于全面测定从细胞中释放并结合到细胞的人表皮生长因子受体 2
摘要
我们提出了一种使用新型抗 HER2 单克隆抗体的经过验证的夹心 ELISA 测定法。该检测试剂盒能够对 体外 培养细胞和其他样品(包括血液和组织)中细胞结合和释放的 HER2 蛋白进行精确定量。
摘要
人表皮生长因子受体 2 (HER2) 是一种公认的癌症标志物。它成为一个非常成功的诊断和治疗靶点,尤其是在乳腺癌和其他表达 HER2 的癌症类型中。在临床上,采用特异性抗 HER2 抗体的金标准免疫组织化学诊断方法用于测量膜结合受体的表达水平。从过表达细胞释放的 HER2 的可溶性胞外结构域 (ECD) 在血液中循环,可以反映受体的组织表达。需要准确且经过验证的检测方法,以将循环 HER2 蛋白的浓度与疾病临床表现相关联。
我们的团队开发并验证了新型夹心酶联免疫吸附测定 (ELISA),用于定量 HER2 的膜结合和从细胞释放的 ECD 结构域。 该检测使用先前开发的两种独特的 HER2 特异性单克隆抗体。定量范围包括 1.56-100 ng/mL 的 HER2 浓度,这对于体外培养的癌细胞来说是预期的, 并且在 0.5 ng/mL 水平上显示出敏感性。该方法令人满意的批内和批间精密度和准确度使其适用于各种类型生物样品(包括细胞培养基、血清和实体瘤组织)中的 HER2 定量。在这里,我们专注于综合测定 体外 培养的癌细胞的受体相关和分泌。该论文提出了一种定量 HER2 蛋白的分步方案,可用于检测各种细胞系、血液和组织。
引言
现代疗法的成功通常与精准医疗有关,而精准医疗的基础是准确识别对治疗敏感的患者1。这些疗法包括针对在各种肿瘤(包括乳腺癌、子宫内膜、胃、肺等)上过表达的受体的抗 HER2 药物。几种 HER2 靶向药物已证实对 HER2 阳性癌症患者有益,包括 HER2 低2 型。确认 HER2 阳性状态对于识别潜在反应患者至关重要;然而,这仍然是一个挑战,尤其是在 HER2 低组中。
临床环境中通常用于 HER2 检测的金标准方法包括免疫组织化学 (IHC) 蛋白表达和通过荧光原位杂交 (FISH) 方法进行 HER2 基因扩增。此外,Oncotype DX 检测用于 HER2 mRNA 表达。这些方法所需的组织活检使得确定患者是否适合适当治疗以及他们对治疗的潜在反应变得不确定。尽管美国临床肿瘤学会 (ASCO) 和美国病理学家学会 (CAP) 于 2018 年更新了指南以减少检测单位之间的差异,但 HER2 一致性仍然是一个需要改进的主题3。
HER2 是表皮生长因子受体 (EGFR) 家族的原癌基因成员,在病理状态下过表达和激活会导致侵袭性结果或导致不良预后4。HER2 是一种锚定在细胞膜中的 185 kDa 模块化蛋白,包含细胞质酪氨酸激酶和细胞外结构域 (ECD)。HER2 ECD 可以从细胞中脱落,作为无细胞蛋白释放到细胞外基质5 中,进一步在血液中循环。HER2 表达的增加可能反映在循环 ECD 的较高水平上,呈现有价值的预测和预后标志物 6,7,治疗反应的替代标志物8,或作为 IHC 的补充方法来识别符合抗 HER2 治疗条件的患者9。然而,确定肿瘤 HER2 表达与血液中受体的全身水平之间的相关性仍然存在挑战,这可能具有临床意义。
释放的 HER2 ECD 可以使用酶联免疫吸附测定 (ELISA) 进行定量10。夹心 ELISA 是一种采用两种特异性抗体结合同一靶抗原上不同表位的方法。它能够准确测量易于获取的血液和液体生物材料中的溶解蛋白质(所谓的液体活检)。尽管存在美国食品和药物管理局 (FDA) 批准的检测方法,但关于 HER2 ECD 诊断5 的效用以及血液中 HER2 水平升高的临界值仍存在争议。需要对经过验证的方法和统一接受的阈值进行更多研究,以确认检测的适用性11。
任何 ELISA 的关键组成部分都是捕获(固定在板上并确定检测特异性和灵敏度)和检测抗体(在应用样品后添加)抗体(图 1)。在本报告中,我们介绍了基于最近开发的新型抗 HER2 ECD 单克隆抗体 (mAb) 的 ELISA 方案,这些抗体是在亲和柱上生成、纯化并彻底表征的,并呈现了独特的序列12。使用这些定制抗体开发的 ELISA 显示出其用于准确定量与细胞膜相关的 HER2 蛋白的实用性,并将其释放到培养基中以全面评估受体状态。该检测可用于临床前测试并支持正在进行的研究。该测定的性能已在不同来源的生物样本(包括血清和组织匀浆12)上进行了进一步测试,以显示出在未来开发研究、诊断和新型抗 HER2 治疗的潜力。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 人类癌细胞的培养
- 在含有 4.5 g/L ᴅ-葡萄糖 (DMEM-HG),补充有 2 mM ʟ-谷氨酰胺和 10% (v/v) 热灭活 FBS 的 Dulbecco 改良 Eagle 培养基中培养 MDA-MB-231、SK-BR-3 和 SK-OV-3 细胞系。在 37 °C 下在 5% CO2 的潮湿气氛中孵育培养物。
- 当培养物达到 ~80% 汇合时,通过胰蛋白酶消化分离细胞,并将其收集到单独的 15 mL 锥形管中。
- 用自动细胞计数器计数细胞,并将用于实验的细胞以 3 × 105 个细胞/孔的密度接种到 12 孔板中,溶于 1 mL 生长培养基中。在 37 °C 下在 5% CO2 的潮湿气氛中孵育培养物。
注意:实验的每个时间点播种一个孔。培养基后和细胞裂解物都将用于进一步分析。
2. 样品采集和制备
- 从 24 小时培养物中,从每个细胞系的一个孔中收集培养基到 1.5 mL 管中。
- 将收集的样品在 4 °C 下以 10 000 × g 离心 10 分钟。 将上清液转移到新管中并储存在 -20 °C 以进一步测定分泌的 ECD HER2 水平。
- 用 1 mL 冷 PBS 洗涤板上的剩余细胞,轻轻吸出,然后丢弃 PBS。
- 向每个孔中加入 200 μL RIPA 缓冲液(补充有 1% 蛋白酶抑制剂)并孵育 5 分钟。用细胞刮刀刮擦细胞,并通过移液数次混合以匀浆裂解物。
- 将裂解的细胞收集到新试管中,然后用针头(G21 / 0.8 mm × 40 mm)缓慢吸入 2 mL 注射器中。重复抽吸步骤 5-10 次以进一步分解细胞。
- 将收集的样品在 4 °C 下以 10 000 x g 离心 10 分钟。 将上清液转移到新管中并储存在 -20 °C,以进一步测定 HER2 蛋白的细胞结合部分。
- 按照剩余时间点的准备步骤 - 培养的 48 小时和 72 小时,重复收集培养基和细胞材料。
3. 进行夹心 ELISA 测定 HER2
- 准备缓冲液。
- 包被缓冲液:将 0.42 g NaHCO3 溶解在 50 mL 蒸馏水中,制备 0.1 M NaHCO3 溶液,并充分混合。用 3 M NaOH 将 pH 调节至 9.6。
- 封闭缓冲液:在 10 mL PBS 中加入 0.5 g 印迹奶粉,在 PBS 中制备 5% 脱脂牛奶 (NFDM),并充分混合。
- 洗涤缓冲液:通过添加 0.5 mL 0.05% Tween-20 到 1000 mL PBS 中,制备含有 Tween 20 (PBST) 的磷酸盐缓冲盐水并混合(避免过度起泡)。
- 对检测抗体进行生物素化。
- 根据制造商的说明,使用市售生物素标记试剂盒对 50-200 μg 检测抗 HER2 抗体(克隆 70.21.73.67)进行生物素化。
注:生物素化过程的可靠性和可重复性基于所得抗体的最终蛋白质浓度的测量和产品的批次间比较。
- 根据制造商的说明,使用市售生物素标记试剂盒对 50-200 μg 检测抗 HER2 抗体(克隆 70.21.73.67)进行生物素化。
- 涂覆盘子。
- 在包被缓冲液中将抗 HER2 捕获抗体(克隆 70.27.58)稀释至 1 μg/mL 的浓度。包被一块板时,使用 6.5 mL 捕获抗体溶液。
- 使用多通道移液器,向 96 孔 ELISA 板的每个孔中加入 100 μL 捕获抗体溶液(在步骤 3.3.1 中制备)。
注意:避免板的最外层孔(例如 A1、H12),以减少边缘效应引起的可变性。最外层的井应装满蒸馏水,以确保反应条件稳定。 - 用密封膜盖住板。
- 在 4 °C 下孵育板过夜 (O/N)。
- O/N 孵育后,将板在室温 (RT) 下放在卧式微孔板振荡器(20-30 rpm,倾斜角为 4°-6°)上 1 小时。
- 使用洗板机,吸出涂层溶液,并用洗涤缓冲液(每孔 3 x 300 μL PBST)洗涤板 3 次。
- 堵板 .
- 使用多通道移液器,向每个包被孔中加入 100 μL 封闭缓冲液(PBS 中的 5% NFDM)以封闭非特异性结合位点。
- 用密封膜盖住板。
- 将板在 37 °C 下在湿度室中孵育 1 小时。
- 使用洗板机,吸出涂层溶液,并用洗涤缓冲液(每孔 3 x 300 μL PBST)洗涤板 3 次。
- 准备校准曲线和阳性对照(图 2)。
- 向 1998 μL PBS 中加入 2 μL 1 mg/mL 储备液,制备 HER2 抗原的工作标准溶液,以获得 0.001 mg/mL (1000 ng/mL) 的 HER2 浓度。
- 将 200 μL 溶液添加到 1800 μL PBS 中,稀释工作标准溶液 (WSS),得到标准溶液 1 (STD 1)。
- 通过在 PBS 中连续稀释 STD 1 来制备后续的六种标准品 (STD 2-STD 7)(图 2)。
- STD 2:向 500 μL PBS 中加入 500 μL STD 1 并充分混合,制备 50 ng/mL。
- STD 3:向 500 μL PBS 中加入 500 μL STD 2 并充分混合以制备 25 ng/mL。
- STD 4:加入 500 μL STD 3 至 500 μL PBS 中,充分混合以制备 12.5 ng/mL。
- STD 5:加入 500 μL STD 4 至 500 μL PBS 中,并充分混合以制备 6.25 ng/mL。
- STD 6:加入 500 μL STD 5 至 500 μL PBS 中,充分混合,制备 3.125 ng/mL。
- STD 7:加入 500 μL STD 6 至 500 μL PBS 中,充分混合以制备 1.5625 ng/mL。
- STD 8:添加 500 μL PBS 以制备 0 ng/mL。
- 阳性对照:通过将 100 μL STD 1 溶液添加到 900 μL PBS 中来稀释 STD 1,以获得 10 ng/mL 蛋白质浓度的 HER2 溶液。
- 准备用于加标和回收实验的样品。
- 制备加标已知 HER2 蛋白浓度的基质样品(PBS、细胞裂解物和培养基)。向 5 mL PBS 中加入 2.5 μL 适当的细胞裂解物,以 1:2000 稀释细胞裂解物,以获得 HER2 水平低于该方法 LOD 的样品基质。
- 使用 WSS (1000 ng/mL) 和 STD1 (100 ng/mL) 对基质样品进行加标。
- 对于每种基质,制备 6 个浓度为 0、2、5、10、30 和 50 ng/mL 的样品。
- 要制备 0 ng/mL,添加 400 μL PBS/培养基/细胞裂解物。
- 要制备 2 ng/mL,将 8 μL STD1 添加到 392 μL PBS/培养基/细胞裂解物中,并充分混合。
- 要制备 5 ng/mL,将 20 μL STD1 添加到 380 μL PBS/培养基/细胞裂解物中,并充分混合。
- 要制备 10 ng/mL,将 4 μL WSS 添加到 396 μL PBS/培养基/细胞裂解物中,并充分混合。
- 要制备 30 ng/mL,将 12 μL WSS 添加到 388 μL PBS/培养基/细胞裂解物中,并充分混合。
- 要制备 50 ng/mL,请将 20 μL WSS 添加到 380 μL PBS/培养基/细胞裂解物中,并充分混合。
- 添加 sample、blank 和 standard。
- 使用单通道移液器,向适当的孔中加入 100 μL 标准品、空白 (PBS) 和测试样品(细胞裂解物和培养基)。
注意:建议一式三份运行每个样品。 - 用密封膜盖住板。
- 将板在 37 °C 下在湿度室中孵育 1 小时。
- 使用洗板机,吸出涂层溶液,并用洗涤缓冲液(每孔 3 x 300 μL PBST)洗涤板 3 次。
- 使用单通道移液器,向适当的孔中加入 100 μL 标准品、空白 (PBS) 和测试样品(细胞裂解物和培养基)。
- 检测抗体结合。
- 在 PBS 中将生物素化检测抗体(克隆 70.21.73.67)稀释至 1 μg/mL 的工作浓度。对于一个板,使用 6.5 mL 检测抗体工作溶液。
- 使用多通道移液器,向每个孔中加入 100 μL 检测抗体工作溶液。
- 用密封膜盖住板。
- 将板在 37 °C 下在湿度室中孵育 1 小时。
- 使用洗板机吸出涂层溶液,并用洗涤缓冲液(每孔 3 x 300 μL PBST)洗涤板 3 次。
- 添加亲和素-HRP 偶联物。
- 通过将 1 μL 酶偶联物添加到 40 mL PBST 中,以 1:40,000 稀释市售的亲和素-HRP 偶联物。
- 使用多通道移液器,向每个孔中加入 100 μL 稀释的偶联物。
- 用密封膜盖住板。
- 将板在 37 °C 下在湿度室中孵育 1 小时。
- 使用洗板机,吸出涂层溶液,并用洗涤缓冲液(每孔 3 x 300 μL PBST)洗涤板 3 次。
- 比色反应
- 使用多通道移液器,向每个孔中加入 100 μL 3,3′,5,5′-四甲基联苯胺 (TMB) 底物。
- 用密封膜盖住板。
- 将板在 37 °C 避光孵育 1-5 分钟并监测颜色发展。
- 当颜色达到预期水平时,加入 100 μL 终止液以终止反应。
注:预期水平对应于含有高浓度分析物样品的孔中的深蓝色。
- 采集和分析数据。
- 使用酶标仪测量 450 nm 处的吸光度。
- 使用 4 参数校准曲线,根据曲线方程计算样品浓度。
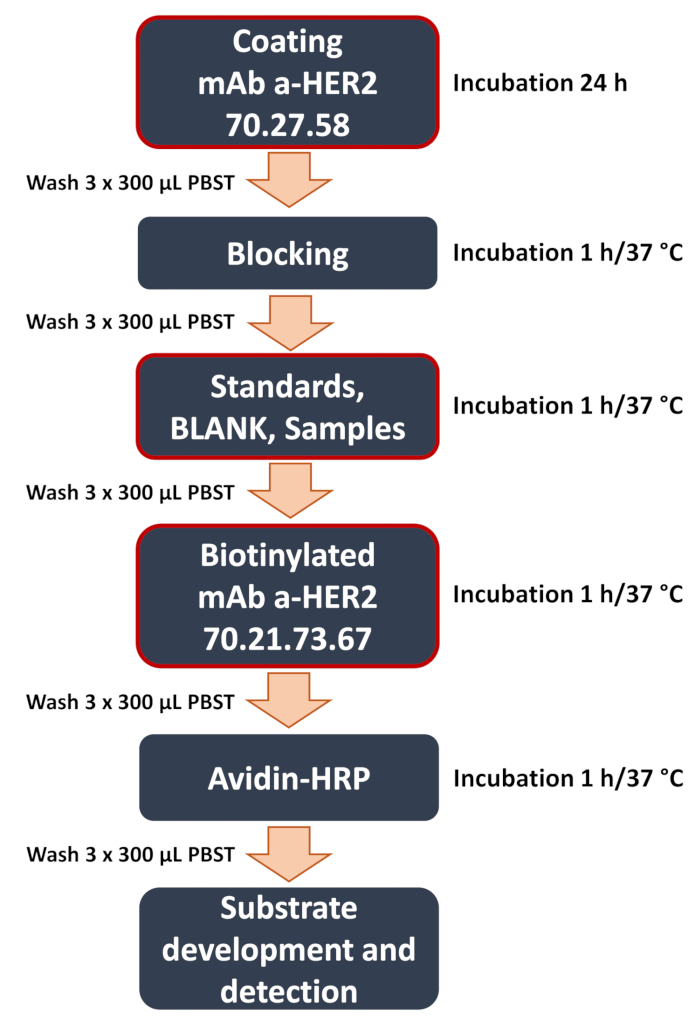
图 1:开发的抗 HER2 夹心 ELISA 工作流程示意图。 夹心 ELISA 程序中的关键步骤概述。这些步骤包括关键步骤(用红框突出显示),例如用捕获抗 HER2 抗体 70.27.58 进行板包被,添加样品(曲线标准品、空白、细胞裂解物或培养基的实验样品)以及检测抗 HER2 抗体 70.21.73.67 的结合。该测定以信号检测和数据分析结束,其中使用酶标仪定量比色信号以确定靶抗原的浓度。 请单击此处查看此图的较大版本。

图 2:显示校准曲线标准溶液制备的方案。 制备 HER2 重组蛋白的梯度稀释液,以产生浓度范围为 1.56-100 ng/mL(小瓶 STD 1-STD 7)的校准曲线。此外,还包括不含 HER2 蛋白的阴性对照样品 (STD 8)。 请单击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
夹心 ELISA 验证
新开发的检测方法需要一个验证程序。重要的验证参数包括线性、精密度和检测限,即检测下限 (LLOD) 和检测上限。在上一篇文章中,我们进行了全面的方法验证。使用模拟样品检测低浓度(2、5、10 ng/mL)、中高浓度 (30 ng/mL) 和显著增加浓度 (50 ng/mL) 的 ELISA 线性,这些抗原在 PBS 和其他对 HER2 定量很重要的基质(如血清)中稀释。 <...
Access restricted. Please log in or start a trial to view this content.
讨论
在构建夹心 ELISA 的关键组分中,有固定在板上的捕获抗体,这些抗体有助于检测的特异性和灵敏度。在所提出的测定中,我们采用内部生成和表征的新型单克隆蛋白 (HER2/70.27.58) 作为捕获抗体。该抗体具有独特的 CDR (互补决定区) 序列,根据亲和力,它在 0.0922 nM12 时的灵敏度为 ED50。夹心 ELISA 特异性由不结合不相关抗原的捕获抗体的特异性反映,?...
Access restricted. Please log in or start a trial to view this content.
披露声明
D.L.、A.A.、A.M.、M.S. 申报 SDS Optic S.A. 的财政支持;A.A、A.M.、M.S. 宣布 SDS Optic S.A. 的股票所有权。
致谢
该研究得到了国家研发中心拨款 STRATEGMEDII/269364/5/NCBR/2015 和欧盟 Horizon 2020 SME Instrument 拨款第 783818 号的资金支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
参考文献
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E., et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748(2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N., et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D., et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P., et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13), (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V., et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016(2020).
- Antos, A., et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978(2024).
- Andreasson, U., et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179(2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020(2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, e61031(2020).
- Giordani, E., et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182(2024).
- Wu, Y., et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L., et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191(2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。