需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测绘激光扫描Photostimulation抑制神经回路
摘要
本文介绍了激光扫描photostimulation在表达绿色荧光蛋白在有限的抑制性神经元的人口的转基因小鼠的全细胞记录相结合的方法。该技术可以广泛的测绘和定量分析当地具体的抑制皮层神经元的突触电路。
摘要
抑制性神经元皮质功能的关键。他们皮层神经元的整个人口约占20%,还可以进一步细分到他们的免疫组化,形态和生理特性1-4为基础的多元化亚型。虽然以前的研究发现,个别类型的抑制性神经元的内在属性,对他们的局部电路连接知识还比较有限3,5,6。由于每一个人的神经元的功能是通过其兴奋性和抑制性突触内皮层电路输入形,我们已经使用激光扫描photostimulation者(LSP)地图的本地电路连接到特定的抑制细胞类型。 LSP的与传统的电刺激或谷氨酸粉扑刺激相比,具有独特的优势,允许广泛的测绘和定量分析的功能单独记录的神经元3,7-9当地投入。激光通过谷氨酸uncaging photostimulation选择性激活的神经元perisomatically,不激活的情况下通过轴突或远端树突,以确保子层的映射决议。非常适合皮质电路分析的灵敏度和效率,从在一个大区域的许多刺激站点的映射输入的LSP。
在这里,我们引进的技术,并结合本地抑制电路映射,全细胞膜片夹紧的LSP。有针对性的具体的抑制细胞类型的录音方便使用在有限的抑制神经元群表达绿色荧光蛋白(GFP)的转基因小鼠皮层3,10,使记录的细胞类型一致的抽样针对性的细胞类型,并明确识别。由于LSP的映射,我们概述系统仪器,描述实验过程和数据采集,和鼠标初级躯体感觉皮层的电路映射的例子。在我们的实验显示,笼谷氨酸在脑片的紫外激光光解空间限制的区域被激活;同时电压钳记录允许photostimulation诱发的突触反应的检测。无论是兴奋性或抑制性突触输入有针对性的神经元的生成地图,通过扫描激光束激发数百个潜在的突触前网站。因此,选择LSP可以经过反复实验撞击到特定类型的抑制性神经元的突触输入的详细地图的建设。两者合计,photostimulation为基础的技术提供神经学家确定的局部皮层电路功能组织一个强大的工具。
研究方案
1。脑片制备
- 深深麻醉与戊巴比妥钠(> 100毫克/千克,IP)的转基因小鼠,迅速断头,他们的大脑中提取到一个冷冻和含氧的裁剪解决方案。
- 用于视觉画面,如果老鼠大脑确实表达绿色荧光蛋白GFP的护目镜。
- 400微米厚的初级躯体感觉皮层部分削减在vibratome蔗糖,含有人工脑脊液(ACSF)。片首先在培养蔗糖含学联在32℃,30分钟到1小时后最初的潜伏期,在室温下转移到录音学联。在整个孵化和录音,切片不断冒泡的95%O 2 -5%CO 2。
2。设备启动
整个系统实现如图1所示。
- 激光冷却系统和电源供应器打开,激光准备。
- photostimulation控制(包括扫描镜系统,光调制器,电子快门和一个光电二极管输入放大器)相关的所有硬件打开。
- 电设备(包括一个Multiclamp 700B放大器和micromanipulators)开启。电生理记录,photostimulation,成像和切片准备做切片灌注室安装在显微镜的机动阶段。
- 成像相机(Retiga 2000 Q -成像,美国德克萨斯州奥斯汀)打开。片红外微分干涉对比(DIC)和通过外延荧光光学成像系统的直立显微镜(BW51X奥林巴斯)的可视化。
- 基于Matlab的EPHUS软件和Q - 捕捉摄像头软件启动。一个Ephus软件(Ephus,在提供定制修改后的版本https://openwiki.janelia.org/ )是用来控制photostimulation协议,并获得photostimulation数据。
- 系统后,应检查看看激光photostimulation系统的工作状态。由于4倍的显微镜下的目标是提供谷氨酸uncaging UV闪烁,一张白纸可以把下观察激光扫描模式,而系统的运行。
3。设置切片灌注
- 打开一个加压灌注系统送入切片室录音学联。护理是采取措施,确保恒定的2.0毫米的流体在会议厅内片以上的水平。
- MNI的笼谷氨酸原液等分添加到25毫升循环学联为0.2毫米笼谷氨酸浓度。请注意,将被刷新后5-6 h的试验,沐浴液和MNI的谷氨酸。
- 脑片移入录音室。一个可以运行的成像系统检查切片质量和解剖学定位初级躯体感觉区。然后切片是挂靠一个特制的弦乐器铂金戒指。注意不要把打算录音的大脑区域的锚。
4。全细胞膜片钳记录
- 玻璃电极(4-6MΩ的电阻)被拉到和充满内部含有0.1%的生物胞素细胞标记和形态学鉴定的解决方案。
- 要执行修补程序记录,细胞在60X目标可视化。首次发现抑制细胞类型,并选定一个DIC /奥林巴斯荧光显微镜下基于可视化表达GFP;随后通过红外DIC视频监控辅助视觉控制下进行录音。请注意,DIC和荧光模式之间切换几次要确认GFP细胞的位置,而接近电极的靶细胞。
- 传统的膜片钳技术的应用。电极是充满积极的压力,移动到细胞表面附近建立后,有针对性的细胞膜明显的酒窝;然后负压迅速应用到形成一个gigaseal和突破,同时在视频监视器上的电流注入反应监测。
- 打破后,在DIC和荧光模式下的60X的细胞图像上线验证。收集的photostimulation数据之前,超极化和去极化电流脉冲注入到每个细胞的基本电生理特性的研究。
- 一旦稳定的全细胞记录,取得了良好的接入电阻(通常<20MΩ),显微镜下的目标是从60X切换到激光扫描photostimulation 4倍。在4X的切片图像的收购,将用于指导和登记photostimulation网站。
5。激光SCAnning photostimulation
- photostimulation和数据采集参数设置激活Ephus配置交换机模块。通常情况下,1毫秒的激光与刺激间隔为1秒(20兆瓦)是用于photostimulation映射。在10 kHz采样1秒的数据跟踪收购。
- Ephus映射器模块加载到4X切片图像。是指细胞胞体的位置,和一个16x16的模式(80微米× 80微米间距)photostimulation网站设立周围的细胞位置,涵盖所有的皮质层。
- 研究应对photostimulation扣球的位置,在电流钳模式记录神经元的激发轮廓映射。我们的用户友好的软件上线的显示功能,方便的映射实验。
- 本地兴奋电路连接映射检测记录细胞的兴奋性突触后电流(EPSC),同时在不同地点的激光扫描。细胞是举行-70毫伏电压钳模式检测外来的兴奋性电流。 EPSC地图photostimulation模式旋转重复2-3次,或翻转。
- 可选:本地抑制电路连接,也可以映射在接近0毫伏电压钳模式记录细胞检测离港抑制电流的抑制性突触后电流(IPSC)的检测。请注意,这是最好使用的IPSC映射铯取代钾电极内部的解决方案。
- 毕竟生理检测完成后,电极轻轻地从录制的细胞。脑片取出,并在4%多聚甲醛固定过夜。对生物胞素染色细胞。焦或落射荧光显微镜,这也印证了每个记录的细胞的确是原本有针对性的表达GFP的中间神经细胞形态研究。
6。 Photostimulation数据分析
我们新开发的方法和软件实施 11适用于在原始数据的地图photostimulation诱发的突触事件的检测和测量。例如图2,彩色编码图的构造说明记录神经元的突触输入的模式。
7。代表性的成果:
电生理记录和photostimulation映射的示例结果如图2所示。具体抑制细胞类型的有针对性的录音成为可能使用在已知的抑制细胞类型表达绿色荧光蛋白的转基因小鼠。由于抑制interneurons的多样性,GFP的表达,内在的电生理和形态特征(图2A)分析相结合,得出最终的细胞类型分类。图2B - C的说明,激光扫描photostimulation允许局部皮层电路连接到单一的抑制性神经元的广泛映射。原始数据图显示在图2C。直接的uncaging反应,从数据分析(图2C)被排除在外。定量输入地图颜色编码,在图2D - F所示。例如快速扣球抑制interneurons收到强烈的兴奋性突触输入(EPSCs),从第4层和深层。有关细胞的突触输入组织定义的皮层通路,我们可以推断其可能发挥的作用(例如,反馈和前馈抑制)在皮层信息处理。
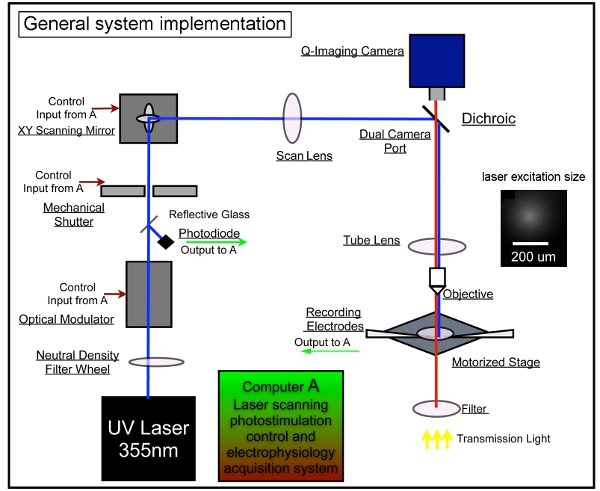
图1。激光扫描photostimulation一般系统工具 ,我们的整个系统的组成photostimulation控制,视频影像,电生理记录系统。我们采用的LSP系统的设计前面描述 7,17 。一个激光装置是用来产生355纳米紫外激光谷氨酸uncaging。激光束直接通过我们的系统的光路。持续时间短的激光闪烁(例如,1 - 3 MS)控制使用的电光调制器(即,普克尔斯盒)和机械快门。激光束的功率是由中立的密度梯度轮调制和挪用玻璃盖玻片一个光电二极管的激光束的一小部分的监测。激光扫描系统包括一个对扫描镜,扫描镜头,管镜头,物镜的XY。镜提供的激光束通过扫描镜头,然后光束通过分色镜进入显微镜,重点是由一个特制的紫外线发射管镜头。梁底部填充回的显微镜物镜孔径提供更柱状(而不是锥形)照明光束,二维尽可能减少轴向分辨率的映射。 4倍的目标下,激光束形成uncaging点,每个approximati吴高斯分布与横向焦平面(插入)153微米的宽度。各种激光刺激的位置,可以实现通过检流驱动的XY扫描镜,镜子和回光圈的客观共轭平面镜职位翻译成不同的扫描物镜焦平面的位置。 uncaging期间,一个图案的网站,涵盖了整场的数目可变顺序在一个nonraster刺激,非随机的顺序,以避免重新最近刺激的地点附近。更详细的信息,请参阅徐等人 (2010) 。
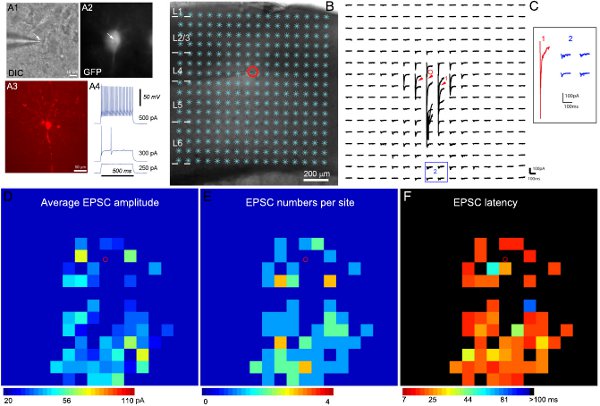
图2。本地兴奋电路连接映射的GFP表达在小鼠初级感觉皮层第4层的快速扣球中间神经。A1和A2显示下60X目标针对性的细胞活脑切片的DIC和GFP荧光图像,而A3显示揭示生物胞素染色后的记录,固定片的细胞形态。 A4纸显示记录的GFP细胞,快速扣球抑制性的特点,intrasomatic目前注射不同的优势,射击模式。 B显示的切片图像叠加16 X16 photostimulation的网站(*)。单元格的位置是由红色的小圆圈表示。 C显示了一个数组photostimulation诱发B所示的刺激位置的反应痕迹,而细胞在-70 mV的检测外来的兴奋性电流。 photostimulation反应的不同形式说明1和2的位置,这是扩大和单独显示在插入的痕迹。跟踪1是一个直接反应(红色箭头表示),以谷氨酸的胞体和promximal树突上uncaging的例子。 2其他的痕迹,是典型的兴奋性突触输入的响应(蓝色)例子。直接反应和突触输入,可以区分其振幅和响应延迟。 D,E和F的平均EPSC幅值的彩色编码图(16x16的网站),EPSC的号码,并首次发现每个站点EPSC延迟,分别为平均每输入幅度在C所示的原始数据映射刺激的部位是在分析窗口的平均EPSCs幅度,从同一站点photostimulation响应中减去基线自发响应。 EPSCs和到达时间或延迟首次发现每个站点EPSC的数量也测量和绘制。有关详细信息,请参阅(石等,2010)。
讨论
Photostimulation基础测绘技术已有效地应用于分析皮质电路。激光扫描photostimulation全细胞记录相结合,使高分辨率的映射到单个神经元突触前输入源层分布的,因为从突触后神经元的突触前神经元在许多不同的地点的集群photostimulation同步录音提供兴奋性的空间分布的定量措施或抑制性输入。使用在已知的抑制细胞类型表达绿色荧光蛋白的转基因小鼠资助这种技术大大促进了我们目前的工作,对阐明...
披露声明
没有利益冲突的声明。
致谢
陈德良Huynh,安德鲁杰里林圣安东尼奥,我们感谢他们的技术援助。这项工作是由国家卫生赠款研究院DA023700和DA023700 - 04S1至第XX
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 转基因小鼠线 | 杰克逊实验室或其他来源 | 请参阅徐和Callaway(2009) | |
| GFP的护目镜 | BLS的有限公司,匈牙利 | ||
| vibratome | 徕卡系统 | VT1200S | |
| MNI的笼中的谷氨酸(4 - 甲氧基- 7 - nitroindolinyl笼L -谷氨酸) | Tocris生物科学,Ellisville,莫 | 猫号1490 | |
| 生物胞素 | B4261 | ||
| 电极拉马 | 萨特仪器,诺瓦托,CA | P - 97 | |
| 使电极的玻璃试管 | BF150 - 86 - 10 | ||
| Multiclamp 700B放大器 | 分子器件,加利福尼亚州桑尼维尔, | Multiclamp 700B | |
| 数字CCD相机 | Q -成像,美国德克萨斯州奥斯汀 | Retiga 2000 | |
| 研究显微镜 | 奥林巴斯,东京,日本 | BW51X | |
| 紫外激光装置 | DPSS激光器,加利福尼亚州圣克拉拉 | 模型3501 | |
| 其他设备激光扫描phostimulation | 请参考Xu 等 (2010) |
解决方案:
- 含蔗糖片切割的人工脑脊液(ACSF)(单位:mm:85氯化钠,75蔗糖,2.5氯化钾,25葡萄糖,1.25的NaH 2 PO 4,4,0.5 MgCl 2的氯化钙2,和24 碳酸氢钠 3) 。
- 拍摄学联(单位:mm:126氯化钠,2.5氯化钾,26碳酸氢钠3,2 2 2氯化钙,氯化镁,1.25的NaH 2 PO 4和10葡萄糖)
- 电极内部解决方案(单位:mm:126的K -葡萄糖,4氯化钾,10 HEPES,4个ATP镁,0.3 GTP娜和10磷酸,pH值7.2,300 mOsm)。
参考文献
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。