É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Mapeamento Inibitória Circuitos Neuronal por Laser Scanning fotoestimulação
Neste Artigo
Resumo
This paper introduces an approach of combining laser scanning photostimulation with whole cell recordings in transgenic mice expressing GFP in limited inhibitory neuron populations. The technique allows for extensive mapping and quantitative analysis of local synaptic circuits of specific inhibitory cortical neurons.
Resumo
Inhibitory neurons are crucial to cortical function. They comprise about 20% of the entire cortical neuronal population and can be further subdivided into diverse subtypes based on their immunochemical, morphological, and physiological properties1-4. Although previous research has revealed much about intrinsic properties of individual types of inhibitory neurons, knowledge about their local circuit connections is still relatively limited3,5,6. Given that each individual neuron's function is shaped by its excitatory and inhibitory synaptic input within cortical circuits, we have been using laser scanning photostimulation (LSPS) to map local circuit connections to specific inhibitory cell types. Compared to conventional electrical stimulation or glutamate puff stimulation, LSPS has unique advantages allowing for extensive mapping and quantitative analysis of local functional inputs to individually recorded neurons3,7-9. Laser photostimulation via glutamate uncaging selectively activates neurons perisomatically, without activating axons of passage or distal dendrites, which ensures a sub-laminar mapping resolution. The sensitivity and efficiency of LSPS for mapping inputs from many stimulation sites over a large region are well suited for cortical circuit analysis.
Here we introduce the technique of LSPS combined with whole-cell patch clamping for local inhibitory circuit mapping. Targeted recordings of specific inhibitory cell types are facilitated by use of transgenic mice expressing green fluorescent proteins (GFP) in limited inhibitory neuron populations in the cortex3,10, which enables consistent sampling of the targeted cell types and unambiguous identification of the cell types recorded. As for LSPS mapping, we outline the system instrumentation, describe the experimental procedure and data acquisition, and present examples of circuit mapping in mouse primary somatosensory cortex. As illustrated in our experiments, caged glutamate is activated in a spatially restricted region of the brain slice by UV laser photolysis; simultaneous voltage-clamp recordings allow detection of photostimulation-evoked synaptic responses. Maps of either excitatory or inhibitory synaptic input to the targeted neuron are generated by scanning the laser beam to stimulate hundreds of potential presynaptic sites. Thus, LSPS enables the construction of detailed maps of synaptic inputs impinging onto specific types of inhibitory neurons through repeated experiments. Taken together, the photostimulation-based technique offers neuroscientists a powerful tool for determining the functional organization of local cortical circuits.
Protocolo
1. Preparação fatia do cérebro
- Camundongos transgênicos estão profundamente anestesiados com pentobarbital sódico (> 100 mg / kg, ip) e rapidamente decapitados, e seus cérebros extraídos para uma solução de corte congelados e oxigenado.
- Óculos de GFP são usados para visualmente tela se o cérebro de camundongo na verdade expressa GFP.
- Cortical somatossensorial primário seções de 400 mm de espessura são cortados com uma vibratome em sacarose contendo líquido cefalorraquidiano artificial (ACSF). Fatias são os primeiros incubados em sacarose contendo ACSF por 30 min a 1 h em 32 ° C, e após o período de incubação inicial, transferido para ACSF gravação em temperatura ambiente. Todo o período de incubação e de gravação, as fatias são continuamente aeradas com 95% O 2 -5% CO 2.
2. Equipamentos de inicialização
A implementação total do sistema é ilustrada na Figura 1.
- O sistema de resfriamento a laser e fornecedor de energia é ligada, recebendo o laser pronto.
- Todo o hardware relacionados ao controle fotoestimulação (incluindo o sistema de varredura do espelho, um modulador óptico, um obturador eletrônico e um amplificador de entrada fotodiodo) está ligado.
- O equipamento eletrofisiológicos (incluindo um amplificador Multiclamp 700B e micromanipuladores) é ligado. Gravações eletrofisiológicas, fotoestimulação e imagens dos preparativos fatia é feito em uma câmara de perfusão fatia montada no palco motorizado do microscópio.
- A câmera de imagem (Retiga 2000, Q-imagem, Austin, TX) é ligado. Fatias são visualizados com o microscópio vertical (BW51X, Olympus) com contraste de infravermelho interferência diferencial (DIC) e epi-fluorescente óptica através do sistema de imagem.
- O Matlab baseado em software EPHUS e Q captura de software da câmera são iniciado. A versão personalizada modificada da Ephus software (Ephus, disponível em https://openwiki.janelia.org/ ) é usado para controlar protocolos fotoestimulação e adquirir dados fotoestimulação.
- Depois que o sistema está ligado, deve-se verificar para ver se o sistema de fotoestimulação laser é em um estado de funcionamento. Como a objetiva do microscópio 4x é utilizado para enviar flashes UV para uncaging glutamato, um pedaço de papel branco pode ser colocado sob a observar o padrão de varredura a laser, enquanto o sistema é executado.
3. Criação de perfusão fatia
- Um sistema de perfusão pressurizado é ligada para alimentar a ACSF gravação na câmara de fatia. Cuidado é tomado para garantir um nível de fluido constante de 2,0 mm acima da fatia na câmara.
- Uma alíquota da solução estoque de MNI-enjaulado-glutamato é adicionado a 25 ml de circulação ACSF para uma concentração de 0,2 mM glutamato enjaulado. Por favor note que após 5-6 h de experimentação, a solução de banho e MNI-glutamato será atualizada.
- A fatia do cérebro é movido para dentro da câmara de gravação. Pode-se executar o sistema de imagem para verificar a qualidade fatia e anatomicamente localizar a área somatossensorial primário. Em seguida, a fatia está ancorado com um anel de platina custom-made de cordas. Tenha cuidado para não colocar a âncora sobre a região do cérebro destinada para as gravações.
4. Patch-fixação de células inteiras de gravação
- Eletrodos de vidro (4-6 mohms resistência) são puxados e preenchido com uma solução interna contendo biocytin 0,1% para a rotulagem e identificação de células morfológica.
- Para executar a gravação patch, as células são visualizadas no objetivo 60x. Tipos de células inibitórias são os primeiros identificados e seleccionados com base na visualização de expressão GFP sob um microscópio Olympus DIC / fluorescentes; gravações são posteriormente executados sob controle visual, auxiliada pela monitorização de vídeo infravermelho DIC. Por favor note que algumas vezes de alternar entre os modos de DIC e fluorescentes é necessário para confirmar a localização de células GFP quando se aproxima o eletrodo para a célula-alvo.
- Técnicas convencionais de patch-fixação são aplicadas. O eletrodo é preenchido com pressão positiva, mudou-se perto da superfície da célula para estabelecer uma ondulação perceptível sobre a membrana da célula alvo, e então a pressão negativa é aplicada rapidamente para formar um gigaseal e quebrar em monitorar as respostas ao mesmo tempo de injeção de corrente no monitor de vídeo.
- Ao romper dentro, as imagens da célula em 60x sob os modos de DIC e fluorescentes são levados para a verificação on-line. Antes da coleta de dados fotoestimulação, hiperpolarizante e despolarizante pulsos de corrente são injetados para examinar cada célula básica propriedades eletrofisiológicas.
- Uma vez estável gravações de células inteiras são alcançados com a resistência de bons acessos (geralmente <20 mohms), a objetiva do microscópio é alternado de 60x para 4x para o laser fotoestimulação digitalização. A imagem fatia em 4x é adquirido e será utilizado para orientar e registrar os sites fotoestimulação.
5. Laser scanning fotoestimulação
- Os parâmetros de aquisição fotoestimulação e os dados são definidos pela ativação do módulo de switch de configuração de Ephus. Normalmente, 1 ms laser (20 mW) com um intervalo de estímulo de um segundo é utilizado para o mapeamento fotoestimulação. Dados os traços de um segundo amostrados a 10 kHz são adquiridos.
- A imagem fatia 4x é carregado no módulo de mapeador de Ephus. A localização da soma das células é definido e sites fotoestimulação de um padrão 16x16 (80 mM mM espaçamento x 80) são criados em torno da localização da célula, abrangendo todas as camadas corticais.
- O perfil de excitação do neurônio gravado é mapeado através do exame dos locais spiking em resposta a fotoestimulação no modo de fixação atual. Nosso software user-friendly com os recursos on-line facilita a visualização dos experimentos de mapeamento.
- Ligações locais circuito excitatório são mapeados pela detecção de correntes excitatórias pós-sinápticas (EPSC) a partir da célula gravado durante a varredura a laser em diferentes locais. A célula é mantida a -70 mV no modo braçadeira de tensão para detectar dentro correntes excitatórias. Os mapas são repetidas EPSC 2-3 vezes com o padrão de fotoestimulação girado ou invertido.
- Opcional: Local conexões do circuito inibitório também pode mapeado pela detecção de correntes pós-sináptico inibitório (IPSC) a partir da célula registrado realizada no próximo a 0 mV no modo braçadeira de tensão para detectar as correntes exteriores inibitória. Note-se que o melhor é usar a solução interna do eletrodo com o potássio substituído com césio para o mapeamento de IPSC.
- Depois de todos os ensaios fisiológicos são concluídas, o eletrodo é delicadamente retirado da célula gravada. A fatia do cérebro é retirado e fixado em paraformaldeído a 4% durante a noite. As células gravado é manchada contra biocytin. Morfologia das células é examinada com confocal ou epi-fluorescente de microscopia, o que também confirma que cada célula registrada é de fato o interneurônio expressando GFP-originalmente-alvo.
6. Fotoestimulação análise de dados
Nossa metodologia recentemente desenvolvida e implementação de software 11 é aplicada à detecção e medição de fotoestimulação evocadas eventos sinápticos nos mapas de dados brutos. Como exemplificado na Figura 2, codificados por cores mapas são construídos para ilustrar o padrão de entrada sináptica para o neurônio gravado.
7. Resultados representativos:
Exemplo de resultados de gravação eletrofisiológico e mapeamento fotoestimulação são mostrados na Figura 2. Gravações alvo de tipos específicos de células inibitórias são possíveis usando camundongos transgênicos expressando GFP em conhecidos tipos de células inibitórias. Dada a diversidade de interneurônios inibitórios, análises de expressão GFP, eletrofisiologia intrínseca e características morfológicas (Figura 2A) são combinados para chegar à classificação final célula tipo. Figura 2B-C ilustrar que fotoestimulação de varredura a laser permite mapeamento extensivo de ligações locais circuito cortical a única neurônios inibitórios. O mapa de dados brutos é mostrada na Figura 2C. As respostas uncaging directos são excluídos da análise de dados (Figura 2C). Os mapas de entrada quantitativas são codificados por cores, mostrado na Figura 2D-F. O exemplo fast-spiking interneurônios inibitórios recebeu forte entrada excitatórios sinápticos (EPSCs) de camada 4 e camadas mais profundas. Ao relacionar a organização da célula entradas sinápticas definido vias corticais, somos capazes de inferir o seu papel possível (por exemplo, feedback e inibição feedforward) no processamento da informação cortical.
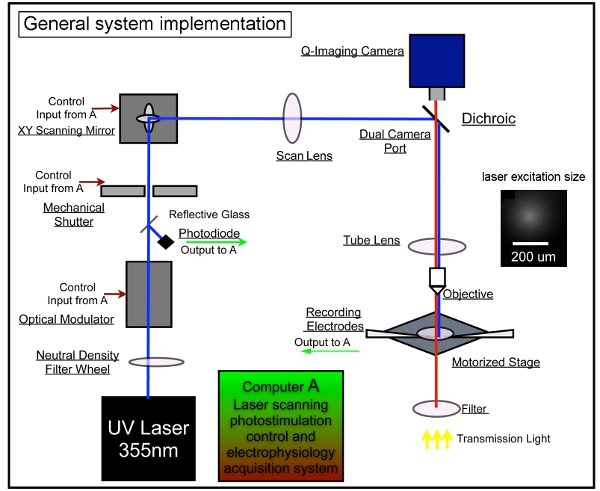
Figura 1. Instrumentação sistema geral de fotoestimulação laser de varredura. Nosso sistema completo é composto de controle fotoestimulação, imagem, vídeo e sistemas de gravação eletrofisiológico. Adotamos o projeto do sistema de LSPs descrito anteriormente 7,17. A unidade de laser é usado para gerar 355 nm laser UV para uncaging glutamato. O feixe de laser é direcionado através do caminho óptico do nosso sistema. Curta duração das ondas de laser (por exemplo, 1-3 ms) são controlados por meio de um modulador eletro-óptico (isto é, células Pockels) e um obturador mecânico. Laser potência do feixe é modulado por uma roda de densidade neutra gradiente e monitorado por desviar uma pequena fração do feixe de laser com uma lamela de vidro para um fotodiodo. O sistema de varredura a laser inclui um par XY de espelhos scan, a lente de digitalização, a lente do tubo, ea lente objetiva. Os espelhos entregar o feixe de laser através de uma lente de digitalização, em seguida, o feixe entra no microscópio por meio de um espelho dicróico e é focalizado por uma lente do tubo custom-made UV-transmissão. O feixe underfills a abertura parte de trás da objetiva do microscópio para fornecer um colunar mais (em oposição a cônicas) feixe de iluminação, mantendo o mapeamento bidimensional quanto possível, reduzindo a resolução axial. No âmbito do objectivo de 4x, o feixe de laser formas spots uncaging, cada approximating um perfil Gaussiano com uma largura de 153 M lateralmente no plano focal (ver a inserção). Posições diversas estimulação laser pode ser alcançado através de galvanômetros-driven espelhos de varredura XY, como os espelhos ea abertura de trás do objetivo são em planos conjugados, traduzindo posições espelho em diferentes localizações de varredura no plano focal da lente objetiva. Durante uncaging, um número variável de sites padronizados que cobre todo o campo são estimulados em seqüência em um nonraster, seqüência não aleatória para evitar revisitar as proximidades de locais recentemente estimulada. Por favor, consulte Xu et al. (2010) para obter informações mais detalhadas.
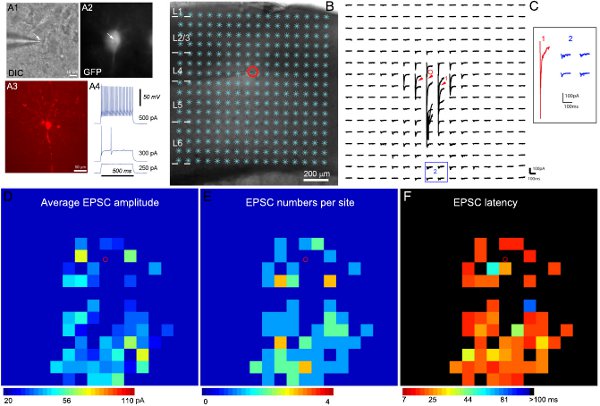
Figura 2. Mapeamento local conexões do circuito de excitação a uma expressando GFP-interneurônio fast-spiking na camada 4 do córtex sensorial primário do mouse. A1 e A2 mostram as imagens DIC e GFP fluorescente da célula-alvo no âmbito do objectivo 60x no fatia cérebro vivo, enquanto mostra A3 a morfologia celular revelado pela coloração biocytin no pós-gravação, fatia fixa. A4 mostra os padrões de disparo das células GFP gravado, característica de um fast-interneurônio spiking inibitória, em resposta a intrassomáticas injeções de corrente de forças diferentes. B mostra a imagem sobreposta com a fatia de 16 sites fotoestimulação x16 (*). A localização da célula é indicada por um pequeno círculo vermelho. C mostra uma série de fotoestimulação evocadas traços de resposta dos locais de estimulação mostrado na B, enquanto a célula foi realizada a -70 mV para detectar dentro correntes excitatórias. Diferentes formas de respostas fotoestimulação são ilustrados pelos traços em locais de 1 e 2, que são expandidos e de forma separada na inserção. O traço 1 é um exemplo das respostas diretas (indicado por setas a vermelho) para glutamato uncaging no corpo celular e dendritos promximal. Outros vestígios em 2 são exemplos típicos de respostas excitatórias entrada sináptica (azul). Respostas diretas e entradas sinápticas podem ser distinguidos por suas amplitudes e latências de resposta. D, E e F são os mapas com código de cores (16x16 sites) da média EPSC amplitude, os números EPSC, ea latência detectados primeiro EPSC por site, respectivamente, para os dados brutos mapa mostrado na C. A amplitude média de entrada de cada local de estimulação é a amplitude média de EPSCs na janela de análise, com a resposta inicial espontânea subtraída da resposta fotoestimulação do mesmo site. O número de EPSCs ea hora de chegada ou latência do EPSC detectado pela primeira vez por site também são medidos e plotados. Por favor, consulte (Shi et al., 2010) para obter mais detalhes.
Discussão
Photostimulation-based mapping techniques have been effectively applied for analyzing cortical circuits. Laser scanning photostimulation combined with whole cell recording allows high resolution mapping of laminar distributions of presynaptic input sources to single neurons, because the simultaneous recording from a postsynaptic neuron with photostimulation of clusters of presynaptic neurons at many different locations provides quantitative measures of spatial distribution of excitatory or inhibitory inputs. This tech...
Divulgações
No conflicts of interest declared.
Agradecimentos
We thank Tran Huynh, Andrew San Antonio, Jerry Lin for their technical assistance. This work was funded by the National Institutes of Health grants DA023700 and DA023700-04S1 to X.X.
Materiais
| Name | Company | Catalog Number | Comments |
| transgenic mouse lines | Jackson lab or other sources | Please refer to Xu and Callaway (2009) | |
| GFP goggles | BLS Ltd., Hungary | ||
| vibratome | Leica Systems | VT1200S | |
| MNI caged glutamate (4-methoxy-7-nitroindolinyl-caged l-glutamate) | Tocris Bioscience, Ellisville, MO | Cat No. 1490 | |
| biocytin | B4261 | ||
| electrode puller | Sutter Instrument, Novato, CA | P-97 | |
| glass tubes for making electrodes | BF150-86-10 | ||
| Multiclamp 700B amplifier | Molecular Devices, Sunnyvale, CA | Multiclamp 700B | |
| digital CCD camera | Q-imaging, Austin, TX | Retiga 2000 | |
| Research microscope | Olympus, Tokyo, Japan | BW51X | |
| UV laser unit | DPSS Lasers, Santa Clara, CA | model 3501 | |
| Other equipment for Laser scanning phostimulation | Please refer to Xu et al. (2010) | ||
Solutions: | |||
| |||
Referências
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados