È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Mappatura dei circuiti neuronali inibitori da fotostimolazione scansione laser
In questo articolo
Riepilogo
Questo documento introduce un approccio di combinare fotostimolazione scansione laser con registrazioni cellula intera in topi transgenici che esprimono GFP in popolazioni limitate neuroni inibitori. La tecnica permette per la mappatura estesa e analisi quantitativa dei locali circuiti sinaptici di specifici neuroni inibitori corticali.
Abstract
Neuroni inibitori sono cruciali per la funzione corticale. Essi comprendono circa il 20% dell'intera popolazione neuronale corticale e può essere ulteriormente suddiviso in sottotipi diversi in base alle loro proprietà immunochimica, morfologiche, fisiologiche e 1-4. Sebbene precedenti ricerche hanno rivelato molto sulle proprietà intrinseche dei singoli tipi di neuroni inibitori, la conoscenza sulle loro connessioni circuito locale è ancora relativamente limitato 3,5,6. Dato che la funzione di ogni singolo neurone è plasmato da suo input eccitatori e inibitori sinaptica nei circuiti corticali, abbiamo usato scansione laser fotostimolazione (LSP) per le connessioni del circuito mappa locale a specifici tipi di cellule inibitorie. Rispetto alle tradizionali stimolazione elettrica o stimolazione sfoglia glutammato, LSP ha vantaggi unici consentendo la mappatura estesa e analisi quantitativa di locali funzionali alla ingressi individualmente registrato neuroni 3,7-9. Fotostimolazione laser tramite uncaging glutammato attiva selettivamente i neuroni perisomatically, senza attivare gli assoni di passaggio o dendriti distali, che assicura una risoluzione sub-laminare mappatura. La sensibilità e l'efficienza di LSP per gli ingressi mappatura da molti siti di stimolazione su una regione di grandi dimensioni sono adatte per l'analisi dei circuiti corticali.
Qui vi presentiamo la tecnica di LSP combinato con whole-cell patch di bloccaggio per la mappatura dei locali del circuito inibitorio. Registrazioni mirata di specifici tipi di cellule inibitorie sono facilitate con l'uso di topi transgenici che esprimono proteine verde fluorescente (GFP) in popolazioni limitate neuroni inibitori nella corteccia 3,10, che consente di campionamento coerente del tipi di cellule bersaglio e una chiara identificazione dei tipi di cellule registrato . Per quanto riguarda la mappatura LSP, delineiamo la strumentazione del sistema, descrivere la procedura sperimentale e acquisizione dati, e presentare esempi di mappatura circuito corteccia somatosensoriale primaria del mouse. Come illustrato nei nostri esperimenti, glutammato in gabbia si attiva in una regione nello spazio ristretto della fetta cervello fotolisi laser UV; simultanea voltage-clamp registrazioni consentono di individuare fotostimolazione evocati risposte sinaptica. Mappe di ingresso sia sinaptica eccitatoria o inibitoria al neurone bersaglio sono generati dalla scansione del fascio laser di stimolare centinaia di potenziali siti presinaptici. Così, LSP consente la costruzione di mappe dettagliate di ingressi sinaptici che influiscono su particolari tipi di neuroni inibitori attraverso esperimenti ripetuti. Nel loro insieme, la fotostimolazione tecnica basata neuroscienziati offre un potente strumento per determinare l'organizzazione funzionale dei locali dei circuiti corticali.
Protocollo
1. Cervello fetta preparazione
- Topi transgenici sono profondamente anestetizzati con sodio pentobarbital (> 100 mg / kg, ip) e rapidamente decapitati, ei loro cervelli estratti in una soluzione di taglio congelato e ossigenato.
- Occhiali GFP sono usati per lo screening visivo se il cervello di topo esprime davvero GFP.
- Sezioni della corteccia somatosensoriale primaria di 400 micron di spessore vengono tagliate con un vibratome in saccarosio-contenente artificiale liquido cerebrospinale (ACSF). Fette vengono prima incubati in saccarosio-contenente ACSF per 30 minuti a 1 ora a 32 ° C, e dopo il periodo di incubazione iniziale, trasferito ACSF registrazione a temperatura ambiente. In tutta l'incubazione e la registrazione, le fette sono continuamente bolle con il 95% O 2 -5% di CO 2.
2. Attrezzature di avvio
L'implementazione del sistema complessivo è illustrato nella figura 1.
- Il sistema di raffreddamento laser e alimentatore è acceso, ricevendo il laser pronto.
- Tutto l'hardware relative al controllo fotostimolazione (compreso il sistema specchio di scansione, un modulatore ottico, un otturatore elettronico e un amplificatore di ingresso fotodiodo) è acceso.
- L'attrezzatura di elettrofisiologia (tra cui un amplificatore Multiclamp 700B e micromanipolatori) è acceso. Le registrazioni elettrofisiologiche, fotostimolazione, e di imaging delle preparazioni fetta sono fatte in una camera di perfusione fetta montato sul palco motorizzato del microscopio.
- La telecamera di imaging (Retiga 2000, Q-imaging, Austin, TX) è acceso. Fette sono visualizzate con il microscopio in posizione verticale (BW51X, Olympus) con un contrasto a infrarossi interferenza differenziale (DIC) e epi-fluorescenza ottica attraverso il sistema di imaging.
- Il software basato su Matlab EPHUS e Q-capture software della fotocamera sono state create. Un'usanza modificati versione del software Ephus (Ephus, disponibile a https://openwiki.janelia.org/ ) è utilizzato per controllare i protocolli fotostimolazione e acquisire i dati fotostimolazione.
- Dopo che il sistema è acceso, si dovrebbe verificare se il sistema fotostimolazione laser è in uno stato di lavoro. Poiché l'obiettivo 4x microscopio viene utilizzato per fornire i lampi di raggi UV uncaging glutammato, un pezzo di carta bianca può essere messo sotto per osservare il modello di scansione laser, mentre il sistema funziona.
3. La creazione di perfusione fetta
- Un sistema di perfusione pressione è acceso per alimentare il ACSF registrazione nella camera fetta. La cura è presa per assicurare un livello costante del liquido di 2,0 mm al di sopra della fetta nella camera.
- Un'aliquota della soluzione madre di MNI-gabbia-glutammato viene aggiunto a 25 ml di circolazione ACSF per una concentrazione di 0,2 mM glutammato in gabbia. Si prega di notare che dopo 5-6 ore di sperimentazione, la soluzione bagno e MNI-glutammato sarà aggiornata.
- Una fetta cervello è spostato nella camera di registrazione. Si può eseguire il sistema di imaging per verificare la qualità e la fetta anatomicamente individuare l'area somatosensoriale primaria. Poi la fetta è ancorato con una misura anello in platino a corda. Fare attenzione a non mettere l'ancora sopra la regione del cervello destinata per le registrazioni.
4. Cellula intera patch-bloccaggio di registrazione
- Elettrodi di vetro (4-6 MΩ resistenza) sono tirati e riempito con una soluzione interna contenente 0,1% biocitina per l'etichettatura e identificazione morfologica delle cellule.
- Per eseguire la registrazione delle patch, le cellule vengono visualizzati in l'obiettivo 60x. Tipi di cellule inibitorie sono prima individuati e selezionati sulla base di visualizzazione di espressione GFP sotto un microscopio DIC / a fluorescenza Olympus, le registrazioni vengono poi eseguiti sotto il controllo visivo aiutato dal monitoraggio video a infrarossi DIC. Si prega di notare che un paio di volte di passare tra le modalità DIC e fluorescenza è necessario per confermare la posizione della cella GFP mentre si avvicina l'elettrodo alla cella di destinazione.
- Tradizionali tecniche di patch-bloccaggio vengono applicati. L'elettrodo viene riempito con pressione positiva, si è trasferito vicino alla superficie della cellula per stabilire una fossetta visibile sulla membrana delle cellule bersaglio, e poi la pressione negativa viene applicata rapidamente per formare un gigaseal e rottura durante il monitoraggio delle risposte iniezione di corrente sul monitor video.
- Al momento di rottura in, le immagini della cellula a 60x in modalità DIC e fluorescenza sono presi per la verifica on-line. Prima raccolta di dati fotostimolazione, iperpolarizzante e impulsi di corrente depolarizzante vengono iniettate per esaminare le proprietà elettrofisiologiche di base di ogni cella.
- Una volta che le registrazioni stabili cellula intera si ottengono con una buona resistenza di accesso (di solito <20 MΩ), l'obiettivo microscopio passa da 60x a 4x per fotostimolazione scansione laser. L'immagine fetta a 4x è acquisito e sarà utilizzato per la guida e la registrazione di siti fotostimolazione.
5. Laser scanning fotostimolazione
- I parametri di acquisizione dati e fotostimolazione è fissato dal attivando il modulo switch di configurazione Ephus. Normalmente, 1 ms laser (20 mW), con un intervallo di stimolo di 1 secondo viene utilizzato per la mappatura fotostimolazione. Tracce di dati di 1 secondo campionato a 10 kHz vengono acquisiti.
- L'immagine fetta 4x viene caricata nel modulo mapper di Ephus. La posizione del soma cellulare è definito, e siti fotostimolazione di uno schema 16x16 (80 micron x 80 micron spaziatura) sono costituiti intorno alla posizione della cella, che copre tutti gli strati corticali.
- Il profilo di eccitazione del neurone registrato è mappata esaminando le posizioni spiking in risposta alla fotostimolazione alla modalità morsetto corrente. Il nostro software user-friendly con l'on-line funzioni di visualizzazione facilita gli esperimenti di mappatura.
- Locali collegamenti del circuito eccitatorio sono mappati dal rilevamento di correnti post-sinaptici eccitatori (EPSC) dalla cella registrato mentre scansione laser in luoghi diversi. La cella è tenuto a -70 mV in modalità morsetto tensione verso l'interno per rilevare le correnti eccitatorie. Le mappe EPSC si ripetono 2-3 volte con il modello fotostimolazione ruotato o capovolto.
- Opzionale: Locale collegamenti del circuito inibitorio può anche mappati con il rilevamento delle correnti post-sinaptiche inibitorie (IPSC) dalla cella registrata presso vicino a 0 mV in modalità morsetto tensione verso l'esterno per rilevare correnti inibitorie. Si noti che è meglio usare la soluzione interna elettrodo con potassio sostituito con cesio per la mappatura IPSC.
- Dopo tutte le analisi fisiologiche sono state completate, l'elettrodo viene delicatamente rimosso dalla cella registrati. La fetta cervello è portato fuori e fissate in 4% paraformaldeide notte. Le cellule registrato è macchiato contro biocitina. Morfologia cellulare viene esaminato con confocale o epi-microscopia a fluorescenza, che conferma anche che ogni cellula è infatti registrato il GFP che esprimono interneurone originariamente mirati.
6. Fotostimolazione analisi dei dati
La nostra metodologia di nuova concezione e realizzazione di software 11 è applicato alla rilevazione e misura di fotostimolazione-sinaptici evocati eventi nelle mappe di dati grezzi. Come esemplificato nella figura 2, codice colore mappe sono costruite per illustrare il modello di ingresso sinaptico al neurone registrato.
7. Rappresentante dei risultati:
Risultati Esempio di registrazione elettrofisiologica e la mappatura fotostimolazione sono illustrati nella Figura 2. Registrazioni mirata di specifici tipi di cellule inibitorie sono rese possibili utilizzando topi transgenici che esprimono GFP nel noto tipi di cellule inibitorie. Data la diversità di interneuroni inibitori, analisi di espressione GFP, intrinseche caratteristiche morfologiche e di elettrofisiologia (Figura 2A) si combinano per arrivare alla classifica finale tipo di cellula. Figura 2B-C mostrano che fotostimolazione scansione laser consente la mappatura completa di connessioni locali circuito corticale a singoli neuroni inibitori. La mappa di dati grezzi è mostrato in Figura 2C. Le risposte uncaging diretti sono esclusi dalle analisi dei dati (Figura 2C). Le mappe di input quantitativi sono color-coded, mostrato in Figura 2D-F. Il fast-spiking interneuroni esempio inibitori ricevuto un forte ingresso sinaptica eccitatoria (EPSCs) da livello 4 e strati più profondi. Mettendo in relazione l'organizzazione sinaptica ingresso della cellula di definire percorsi corticali, siamo in grado di inferire il suo possibile ruolo (ad esempio, le risposte e l'inibizione feedforward) in elaborazione delle informazioni corticale.
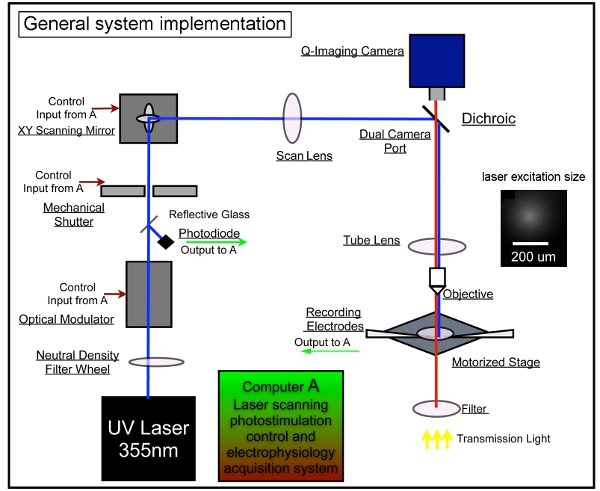
Figura 1. Strumentazione sistema generale di fotostimolazione scansione laser. Il nostro sistema complessivo è costituito da controllo fotostimolazione, immagini video e sistemi di registrazione elettrofisiologica. Abbiamo adottato la progettazione del sistema LSP descritto in precedenza 7,17. Una unità laser è usato per generare laser UV 355 nm per uncaging glutammato. Il raggio laser viene indirizzato attraverso il percorso ottico del nostro sistema. Brevi periodi di lampi laser (per esempio, 1 - 3 ms) sono controllati tramite un modulatore elettro-ottico (ad esempio, la cella di Pockels) e un otturatore meccanico. Potenza del fascio laser è modulato da una ruota gradiente di densità neutrale e monitorato deviando una piccola frazione del fascio laser con un coprioggetto di vetro per un fotodiodo. Il sistema di scansione laser include una coppia XY di specchi di scansione, la lente di acquisizione, la lente del tubo, e la lente obiettiva. Gli specchi consegnare il raggio laser attraverso una lente di acquisizione, poi il raggio entra nel microscopio attraverso uno specchio dicroico e si concentra da una misura permeabile ai raggi UV lente del tubo. Il raggio underfill l'apertura posteriore del microscopio obiettivo di fornire più un colonnare (al contrario di forma conica) fascio illuminante, mantenendo la mappatura bidimensionale come possibile riducendo la risoluzione assiale. Sotto l'obiettivo 4x, il raggio laser forme punti uncaging, ogni approximating un profilo gaussiano con una larghezza di 153 micron lateralmente al piano focale (vedi inserto). Varie posizioni di stimolazione laser può essere raggiunto attraverso galvanometri-driven specchi di scansione XY, come gli specchi e l'apertura posteriore dell'obiettivo sono su piani coniugati, traducendo posizioni specchio in diverse posizioni di scansione sul piano focale lente dell'obiettivo. Durante uncaging, un numero variabile di siti fantasia che copre tutto il campo vengono stimolati in modo sequenziale in una nonraster, la sequenza non casuale al fine di evitare rivisitazione prossimità di siti di recente stimolato. Si prega di fare riferimento a Xu et al. (2010) per informazioni più dettagliate.
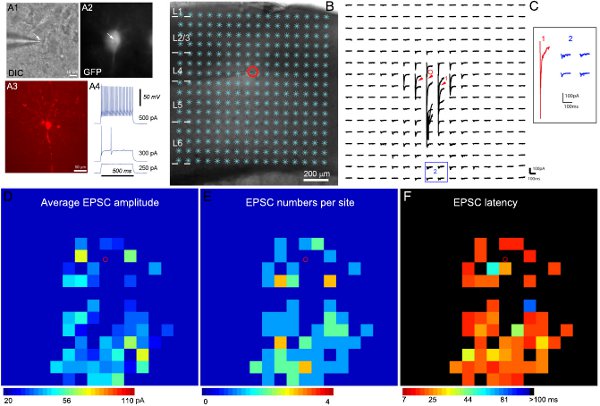
Figura 2. Mappatura locali collegamenti del circuito eccitatori ad un GFP che esprimono fast-spiking interneuroni nel livello 4 del topo corteccia sensoriale primaria. A1 e A2 mostrare le immagini DIC e fluorescente GFP della cellula bersaglio a titolo dell'obiettivo 60x nella fetta cervello vivente, mentre la A3 mostra la morfologia delle cellule rivelato da colorazione biocitina nel post-registrazione, fetta fisso. A4 mostra i modelli di tiro della cellula GFP registrato, caratteristica di un fast-spiking interneurone inibitorio, in risposta alle iniezioni intrasomatica attuale dei punti di forza diversi. B mostrano l'immagine fetta sovrapposti con i 16 siti fotostimolazione x16 (*). La posizione della cella è indicato dal cerchietto rosso. C mostra una serie di fotostimolazione evocati tracce risposta dalle posizioni stimolo mostrato in B, mentre la cella si è tenuta a -70 mV per rilevare le correnti verso l'interno eccitatori. Le diverse forme di risposte fotostimolazione sono illustrati dalle tracce in luoghi di 1 e 2, che vengono espansi e distinto nel inserto. La traccia 1 è un esempio delle risposte dirette (indicato dalla frecce rosse) al glutammato uncaging sul corpo cellulare e dendriti promximal. Altre tracce in 2 sono tipici esempi di risposte ingresso sinaptica eccitatoria (blu). Risposte dirette e ingressi sinaptici si distinguono per le loro ampiezze e latenze di risposta. D, E e F sono i colori mappe (16x16 siti) EPSC di media ampiezza, i numeri EPSC, e il primo latenza rilevato EPSC per sito, rispettivamente, per i dati grezzi mappa mostrato in C. L'ampiezza media di ingresso di ogni sito stimolazione è l'ampiezza media delle EPSCs nella finestra di analisi, con la risposta di base spontanea sottratto dalla risposta fotostimolazione del sito stesso. Il numero di EPSCs e l'orario di arrivo o di latenza della EPSC prima rilevazione per ogni sito sono inoltre misurati e tracciati. Si prega di fare riferimento a (Shi et al., 2010) per maggiori dettagli.
Discussione
Fotostimolazione a base di tecniche di mappatura sono state effettivamente applicate per l'analisi dei circuiti corticali. Fotostimolazione scansione laser combinato con registrazione cellula intera consente la mappatura ad alta risoluzione della distribuzione laminare di sorgenti di ingresso presinaptico di singoli neuroni, in quanto la registrazione simultanea da un neurone postsinaptico with fotostimolazione di cluster di neuroni presinaptici in molti luoghi diversi fornisce misure quantitative della distribuzion...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo Tran Huynh, Andrew San Antonio, Jerry Lin per la loro assistenza tecnica. Questo lavoro è stato finanziato dal National Institutes of concede Salute DA023700 e DA023700-04S1 al XX
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| topo transgenico linee | Jackson laboratorio o altre fonti | Si prega di fare riferimento a Xu e Callaway (2009) | |
| GFP occhiali | BLS Ltd., Ungheria | ||
| vibratome | Leica Sistemi | VT1200S | |
| MNI glutammato in gabbia (4-metossi-7-nitroindolinyl gabbia-l-glutammato) | Bioscience Tocris, Ellisville, MO | Cat. No. 1490 | |
| biocitina | B4261 | ||
| elettrodo estrattore | Sutter Instrument, Novato, CA | P-97 | |
| tubi di vetro per fare elettrodi | BF150-86-10 | ||
| Multiclamp amplificatore 700B | I dispositivi molecolari, Sunnyvale, CA | Multiclamp 700B | |
| fotocamera digitale CCD | Q-imaging, Austin, TX | Retiga 2000 | |
| Ricerca microscopio | Olympus, Tokyo, Giappone | BW51X | |
| UV laser dell'unità | I laser DPSS, Santa Clara, CA | modello 3501 | |
| Altre attrezzature per phostimulation scansione laser | Si prega di fare riferimento a Xu et al (2010). |
Soluzioni:
- Saccarosio-contenente artificiale liquido cerebrospinale (ACSF) per il taglio fetta (in mm: 85 NaCl, 75 saccarosio, 2.5 KCl, 25 di glucosio, 1,25 NaH 2 PO 4, 4 MgCl 2, 0,5 CaCl 2, e 24 NaHCO 3).
- Registrazione ACSF (in mm: 126 NaCl, 2.5 KCl, 26 NaHCO 3, 2 CaCl 2, 2 MgCl 2, 1,25 NaH 2 PO 4, e 10 di glucosio)
- Elettrodo soluzione interna (in mm: 126 K-gluconato, 4 KCl, 10 HEPES, 4 ATP-Mg, 0.3 GTP-Na, e 10 fosfocreatina, pH 7,2, 300 mOsm).
Riferimenti
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon