Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lazer Tarama Photostimulation tarafından inhibitör nöronal devreler Haritalama
Bu Makalede
Özet
Bu kağıt sınırlı inhibitör nöron toplulukları GFP ifade transgenik farelerin tüm hücre kayıtları ile photostimulation lazer tarama birleştiren bir yaklaşım getirmektedir. Tekniği spesifik inhibitör kortikal nöronların yerel sinaptik devrelerin kapsamlı haritalama ve kantitatif analiz için izin verir.
Özet
İnhibitör nöronlar kortikal fonksiyonu için çok önemlidir. Onlar tüm kortikal nöronal nüfusunun yaklaşık% 20 oluşturmaktadır ve daha 1-4 onların immunokimyasal, morfolojik ve fizyolojik özelliklerine göre farklı alt gruba ayrılabilir. Önceki araştırma inhibitör nöronların tek tek türleri içsel özellikleri hakkında çok şey ortaya olmasına rağmen, kendi yerel devre bağlantıları ile ilgili bilgi hala 3,5,6 oldukça sınırlıdır. Her nöron fonksiyonu kortikal devrelerde dahilinde eksitatör ve inhibitör sinaptik giriş şekillenmekte olduğu göz önüne alındığında, biz özel baskılayıcı hücre türleri için harita yerel devre bağlantıları için lazer tarama photostimulation (LSP) kullanıyoruz. Konvansiyonel elektrik stimülasyonu veya glutamat puf uyarımı ile karşılaştırıldığında, LSP'ler ayrı ayrı kaydedilmesi nöronlar 3,7-9 kapsamlı haritalama ve yerel fonksiyonel girdi kantitatif analiz için izin benzersiz avantajlara sahiptir. Lazer Fotoğrafglutamat uncaging yoluyla uyarılması seçici geçit veya bir alt-laminer haritalama çözünürlük sağlar distal dendrit ve aksonlar aktive olmadan, perisomatically nöronları aktive eder. Büyük bir bölge üzerinde birçok uyarılması sitelerinden eşleme girişleri için LSP'lerinin hassasiyeti ve verimliliği de kortikal devre analizi için uygundur.
Burada tam hücreli yama yerel inhibitör devresi haritalama için sıkıştırma ile birlikte LSP'lerinin teknik tanıtmak. Özel baskılayıcı hücre tipleri Hedefli kayıtları hedeflenen hücre tipleri tutarlı örnekleme ve kaydedilen hücre tiplerinin kesin kimlik sağlayan korteks 3,10, sınırlı inhibitör nöron toplulukları yeşil floresan protein (GFP) ifade transgenik farelerin kullanımı kolaylaştırdı . LSP'ler haritalama gelince, biz, sistemin enstrümantasyon anahat deneysel işlem ve veri toplama tanımlamak, ve fare primer somatose devre haritalama bugünkü örneklerinsory korteks. Olarak bizim deneylerde gösterildiği, kafesli glutamat UV lazer fotoliz ile beyin dilim bir mekansal kısıtlı bölgede aktif hale gelir; eş zamanlı voltaj-klemp kayıtları photostimulation-uyarılmış sinaptik yanıtların tespitine izin verir. Hedeflenen nörona eksitatör veya inhibitör ya sinaptik giriş Haritalar potansiyeli presinaptik siteleri yüzlerce uyarmak için lazer ışını tarama tarafından oluşturulur. Böylece, LSP'ler tekrarlanan deneyler aracılığıyla inhibitör nöronların belirli türleri üzerine çarpışan sinaptik girişlerin detaylı haritaların yapımı sağlar. Birlikte ele alındığında, photostimulation tabanlı tekniği nörologlar lokal kortikal devrelerin fonksiyonel organizasyon belirlemek için güçlü bir araç sunuyor.
Protokol
1. Beyin dilim hazırlık
- Transgenik fareler sodyum pentobarbital (> 100 mg / kg, ip) ile anestezi uygulanmış ve son derece hızlı bir şekilde öldürülmüş ve beyinleri bir dondurulmuş ve oksijenli kesme çözelti içine ekstrakte edildi.
- GFP gözlük fare beyni GFP ifade eden, görsel olarak taranması için kullanılır.
- Kalınlığında 400 mikron İlköğretim somatosensoriyel kortikal bölümden sakkaroz içeren yapay beyin omurilik sıvısı (ACSF) bir vibratome ile kesilir. Dilimler önce 32 ° C 'de 30 dakika ila 1 saat için sakaroz içeren ACSF içinde inkübe edildi, ve ilk inkübasyon döneminden sonra, oda sıcaklığında kayıt ACSF aktarılır. İnkübasyon ve kayıt boyunca, dilimler sürekli olarak% 95 O2 5% CO2 ile kabarmış edilir.
2. Ekipman başlangıç
Toplam sistem uygulama Şekil 1 'de gösterilmiştir.
- Lazer soğutma sistemi ve elektrik tedarikçisi turne ised üzerinde lazer hazırlanıyordu.
- Photostimulation kontrolü (tarama ayna sistemi, optik modülatör, elektronik obtüratör ve fotodiyot girişi amplifikatör dahil) ile ilgili tüm donanım açıktır.
- Elektrofizyolojik teçhizatı (Multiclamp 700B amplifikatör ve mikromanipülatörler dahil) açıktır. Elektrofizyolojik kayıtlar, photostimulation ve dilim hazırlıkları görüntüleme mikroskop motorlu sahne üzerine monte edilmiş bir dilim perfüzyon odasında yapılır.
- Görüntüleme kamerası (Retiga 2000, S-görüntüleme, Austin, Teksas) açıktır. Dilimler kızılötesi diferansiyel girişim kontrast (DIC) ve görüntüleme sistemi ile epi-floresan optikler ile dik mikroskop (BW51X, Olympus) ile görüntülenmiştir.
- Matlab tabanlı EPHUS yazılım ve Q-yakalama kamera yazılımı başladı. Ephus yazılımının bir özel modifiye versiyonu (Ephus, mevcut https://openwiki.janelia.org/ </ A>) photostimulation protokolleri kontrol ve photostimulation verileri elde etmek için kullanılır.
- Sistemin açık olduğu sonra bir lazer photostimulation sistemi çalışan bir devlet de olup olmadığını görmek için kontrol etmelisiniz. 4x mikroskop objektif glutamat uncaging için UV yanıp teslim için kullanıldığı gibi, beyaz bir kağıt parçası sistem çalışırken lazer tarama desen gözlemlemek altında toplayabiliriz.
3. Dilim perfüzyon ayarlama
- Bir basınçlı perfüzyon sistemi dilim odasına kayıt ACSF beslemek için açıktır. Bakım odasında dilim yukarıda 2.0 mm sabit bir sıvı seviyesi sağlamak için alınır.
- MNI-kafesli-glutamat stok çözeltisi bir kısım 0.2 mM glutamata kafesli bir konsantrasyon için ACSF dolaşan 25 mL ilave edilir. Deneme 5-6 saat sonra, banyo solüsyonu ve MNI-glutamat tazelenmiş olacak unutmayın.
- Bir beyin dilim kayıt odasına taşınır. Bir görüntüleme s çalıştırabilirsinizistem dilim kalite kontrol ve anatomik birincil somatosensorial alan bulmak. Sonra dilim ısmarlama telli platin yüzük ile demirlemiş olan. Kayıtları için tasarlanmış beyin bölgesi üzerinde çapa koymak için dikkatli olun.
4. Tüm hücre yama klemp kayıt
- Cam elektrotlar (4-6 MΩ direnci) hücre etiketleme ve morfolojik tanımlama için% 0.1 biocytin içeren bir iç çözümü ile çekti ve doldurulur.
- Yama kayıt gerçekleştirmek için, hücrelerin 60x objektif de görüntülenmiştir. İnhibitör hücre tipleri ilk tespit ve floresan / DIC Olympus mikroskop altında GFP ifade görselleştirme göre seçilir; kayıtlar sonradan kızılötesi DIC video izleme destekli görsel kontrol altında gerçekleştirilir. DIC ve floresan modları arasında geçiş birkaç kez hedef hücreye elektrot yaklaşırken GFP hücre konumu onaylamak için gerekli olduğunu unutmayın.
- Konvansiyonel patch-klemp teknikleri uygulanır. Elektrot pozitif basınç ile doldurulur, hedef hücre zarı üzerinde fark edilebilir bir gamze kurmak için yakın bir hücre yüzeyine taşınır, ve daha sonra hızlı bir şekilde negatif basınç oluşturan bir gigaseal ve video monitörü üzerinde akım enjeksiyon yanıtları izlemek süre içinde kırmak için uygulanır.
- Içinde kırılma üzerine, DIC ve floresan modları altında 60x de hücre görüntüleri on-line doğrulanması için alınmaktadır. Photostimulation verilerin toplanması önce hiperpolarizan ve akım darbeleri depolarizan her hücrenin temel elektrofizyolojik özelliklerini incelemek için enjekte edilir.
- Sonra stabil bütün hücre kayıtları iyi erişim direnci (genellikle MΩ <20) ile elde edilir, mikroskop objektif 60x lazer tarama photostimulation 4x getirilir. 4x dilim görüntü elde edilir ve photostimulation siteler rehberlik ve tescil etmek için kullanılacaktır.
5. Lazer scaphotostimulation nning
- Photostimulation ve veri toplama parametreleri Ephus yapılandırma anahtarı modülü aktive ederek ayarlanır. Normal olarak, 1 saniye aralığında bir uyarıcı ile 1 ms lazer (20 mW) photostimulation eşleme için kullanılır. 10 kHz'de örneklenmiş 1 saniye Veri izleri elde edilir.
- 4x dilim görüntü Ephus arasında mapper modülünün içine yüklenir. Hücre soma konumu tanımlanır ve 16x16 desen (80 mikron x 80 mikron aralık) arasında photostimulation siteleri tüm kortikal katmanları kapsayan hücre konumu etrafında kurulur.
- Kaydedilen nöronun uyarma profil akım kelepçe modunda photostimulation cevap olarak çivilenmesi yerle incelenmesi ile eşleştirilir. On-line ekran özellikleri ile Bizim kullanıcı dostu yazılım haritalama deneyler kolaylaştırır.
- Lazer farklı azından tararken Yerel eksitatör devre bağlantıları kaydedildi hücreden eksitatör postsinaptik akımlar (EPSC) saptanması ile eşleştirilirkonumları. Hücre içe eksitatör akımları algılamak için gerilim kelepçe modunda -70 mV gerçekleştirildi. EPSC haritalar photostimulation desen döndürülmüş ile 2-3 kez tekrarlanır veya çevrileceği.
- Opsiyonel: Yerel inhibitör devre bağlantıları da dışa inhibitör akımları algılamak için gerilim kelepçe modunda yakın 0 mV düzenlenen Kaydedilen hücreden inhibitör postsinaptik akımlar (IPSC) saptanması ile eşlenebilir. IPSC haritalama için sezyum yerine potasyum ile elektrot iç çözüm kullanmak en iyi olduğunu unutmayın.
- Tüm fizyolojik deneyler tamamlandıktan sonra, elektrot yavaşça kaydedilen hücre kaldırılır. Beyin dilim gecede% 4 paraformaldehid dışarı alınır ve sabittir. Kaydedilen hücreler biocytin karşı lekeli. Hücre morfolojisi de Kaydedilen her hücre aslında başlangıçta hedeflenen GFP ifade internöron olduğunu onaylar konfokal veya epi-floresan mikroskobu ile incelenmiştir.
6. Photostimulatiyon veri analizi
Bizim yeni geliştirilen metodoloji ve yazılım uygulaması 11 ham veri haritalarında photostimulation-uyarılmış sinaptik olayların tespiti ve ölçümü uygulanır. Şekil 2'de örnek, renk kodlu haritalar Kaydedilen nörona sinaptik giriş deseni göstermek için inşa edilir.
7. Temsilcisi Sonuçlar:
Elektrofizyolojik kayıt ve photostimulation eşleme Örnek sonuçlar, Şekil 2'de gösterilmiştir. Spesifik hücre tipleri inhibitör Hedefli kayıtları bilinen inhibitör hücre tiplerinde GFP ifade eden transjenik farelerin kullanılması ile mümkün kılınmıştır. Inhibitör internöron çeşitliliği göz önüne alındığında, GFP, intrinsik elektrofizyoloji ve morfolojik özellikleri (Şekil 2A) analizi nihai hücre tipi sınıflandırma ulaşmak için birleştirilir. Şekil 2B-C lazer tarama photostimulation yerel cortic geniş eşleme için izin verdiğini göstermektedirTek inhibitör nöronlar al devre bağlantıları. Ham veri haritası Şekil 2C'de gösterilmiştir. Doğrudan uncaging cevaplar veri analizi (Şekil 2C) dışındadır. Kantitatif giriş haritaları, renk kodlu Şekil 2D-F 'de gösterilmiştir. Örneğin hızlı çivileme inhibitör internöron katman 4 ve daha derin katmanları güçlü eksitatör sinaptik girişi (EPSCs) aldı. Tanımlanmış kortikal yolları için hücrenin sinaptik giriş organizasyonu ile, biz kortikal bilgi işleme, muhtemel rolünü (örneğin, geri ve ileri beslemeli inhibisyon) anlaması mümkün.
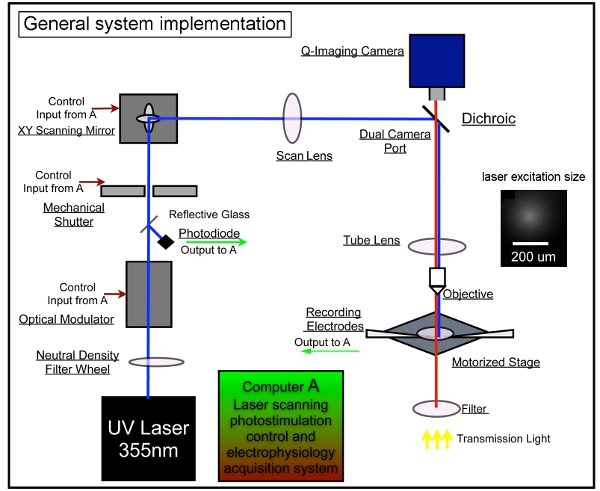
Şekil 1. Lazer tarama photostimulation Genel sistem enstrümantasyon. Bizim genel sistem photostimulation kontrolü, video görüntüleme ve elektrofizyolojik kayıt sistemleri oluşur. Bu LSP'ler sisteminin tasarımı daha önce tarif 7,17 kabul etmiştir. Bir lazer ünitesi 355 nm UV las oluşturmak için kullanılırglutamat uncaging için er. Lazer ışını sistemimizin optik yol üzerinden yönlendirilir. Lazer yanıp söner (örneğin, 1 - 3 ms) Kısa süreler bir elektro-optik modülatör (yani, Pockels hücre) ve mekanik bir deklanşör kullanarak kontrol edilir. Lazer ışını güç bir nötr yoğunluk gradiyenti tekerleği ile modüle ve fotodiyot bir cam lamel ile lazer ışını küçük bir kısmını yönlendirme tarafından izlenir. Lazer tarama sistemi tarama aynalar, tarama lens, tüp objektif ve objektif lens bir XY çifti içerir. Aynalar bir tarama lens aracılığıyla lazer ışını teslim, sonra kiriş dikroik ayna aracılığıyla mikroskop girer ve ısmarlama bir UV-vericisi tüp mercek tarafından odaklanır. Bir kiriş daha sütunlu aksiyal çözünürlük azaltılması mümkün olduğu kadar iki-boyutlu olarak haritalama tutarak, aydınlatma huzme (konik olarak aksine) sağlamak üzere hedef bir mikroskop arka açıklığı underfills. 4x hedefi kapsamında, lazer ışını uncaging noktalar, her yaklaşmak oluştururng odak düzlemi (insert bakınız) yanal 153 mikron genişliğinde bir Gauss profili. Aynalar ve objektif arka diyafram objektif lens odak düzlemi farklı tarama yerlerde içine ayna konumları tercüme, eşlenik uçaklar olduğu gibi çeşitli lazer stimülasyon pozisyonları, galvanometre tahrikli XY tarama aynalar yoluyla elde edilebilir. Uncaging sırasında, tüm alanı kapsayan desenli siteleri değişken bir dizi son zamanlarda uyarılmış sitelerin civarı revisiting önlemek için nonraster, tesadüfi olmayan sırayla sırayla uyarılır. Daha ayrıntılı bilgi için Xu ve diğ. (2010) bakınız.
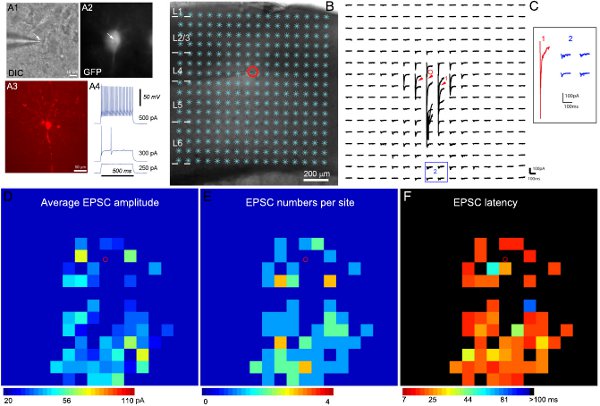
Şekil 2. Fare primer duyusal korteks tabakası 4 bir GFP ifade hızlı çivileme interneuron yerel eksitatör devre bağlantıları haritalanması. A1 ve A2 60x altında hedeflenen hücrenin DIC ve GFP floresan görüntüleri göstermekyaşam beyin dilim objektif, A3 post-kayıt, sabit dilim biocytin boyama ile ortaya hücre morfolojisi gösterirken. A4, çeşitli güçlü intrasomatic akım enjeksiyon yanıt olarak hızlı çivileme inhibitör interneuron karakteristik kaydedilen GFP hücresi, bir ateşleme modellerini gösterir. B 16 x16 photostimulation siteleri (*) ile bindirilmiş dilim görüntü göstermek. Hücre konumu küçük kırmızı bir daire ile gösterilir. C hücre uyarıcı içe doğru akım tespit etmek için -70 mV tutulurken, B 'de gösterilen uyarım konumlardan photostimulation ile uyarılan tepki izleri bir dizi gösterilmektedir. Photostimulation yanıtların farklı formları genişletilmiş ve ayrı ayrı eklemek de gösterilmiştir 1 ve 2 lokasyonlarda izleri ile örneklendirilmiştir. Izleme 1 hücre gövdesi ve promximal dendritler üzerinde uncaging glutamat yanıtlar doğrudan bir örneği (kırmızı ok uçları ile gösterilir). 2. Diğer izleri eksitatör sinaptik tipik örnekleridiryanıtları (mavi) koymak. Doğrudan yanıtları ve sinaptik girdi onların genlikleri ve yanıt latansı ile ayırt edilebilir. D, E ve F ham verilerin her birinden ortalama girdi genlik C'de gösterildiği map için sırasıyla ortalama EPSC genlik renk kodlu haritalar (16x16 siteleri), EPSC numaraları ve site başına ilk tespit EPSC gecikme, vardır stimülasyon sitesi aynı sitenin photostimulation yanıtı çıkarılır bazal spontan tepki ile, analiz penceresinde EPSCs arasında ortalama genlik. EPSCs ve varış zamanı veya site başına ilk tespit EPSC latans sayısı da ölçülür ve çizilir. Daha fazla bilgi için (Shi ve diğ., 2010) bakınız.
Tartışmalar
Photostimulation tabanlı haritalama teknikleri etkin kortikal devrelerde analiz uygulanmıştır. Birçok farklı yerlerde presinaptik nöron kümeleri photostimulation ile postsinaptik nöron aynı anda kayıt eksitatör mekansal dağılımının kantitatif tedbirler sağladığından tüm hücre kayıt ile birlikte Lazer tarama photostimulation, tek nöronlara presinaptik giriş kaynaklarından laminer dağılımlarının yüksek çözünürlüklü haritalama sağlar veya inhibitör girdiler. Bilinen inhibitör hücr...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz onların teknik yardım için Tran Huynh, Andrew San Antonio, Jerry Lin ederim. Bu çalışma Sağlık hibe DA023700 Ulusal Sağlık Enstitüleri tarafından finanse edilen ve XX DA023700-04S1 edildi
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| transgenik fare çizgiler | Jackson laboratuvar veya diğer kaynaklardan | Xu ve Callaway (2009) 'e bakınız | |
| GFP gözlük | TYD Ltd, Macaristan | ||
| vibratome | Leica Sistemleri | VT1200S | |
| MNI kafesli glutamat (4-metoksi-7-nitroindolinyl-kafesli L-glutamat) | Bioscience Tocris, Ellisville, MO | Cat No 1490 | |
| biocytin | B4261 | ||
| elektrot çektirmesi | Sutter Instrument, Novato, CA | P-97 | |
| elektrotlar yapmak için cam tüpler | BF150-86-10 | ||
| 700B amplifikatör Multiclamp | Molecular Devices, Sunnyvale, | 700B Multiclamp | |
| dijital CCD kamera | Q-görüntüleme, Austin | Retiga 2000 | |
| Araştırma mikroskobu | Olympus, Tokyo, Japonya | BW51X | |
| UV lazer ünitesi | DPSS Lazerler, Santa Clara, CA | modeli 3501 | |
| Lazer tarama phostimulation İçin Diğer Ekipmanlar | Xu ve ark bakın. (2010) |
Çözümler:
- Sakaroz-içeren dilim kesme için suni serebrospinal sıvı (ACSF) (mM: NaCl 85, 75 sakaroz, 2.5 KCl, 25 glikoz, 1.25 NaH 2 PO 4, 4 MgCl2, 0.5 CaCl2, 24 NaHCO 3).
- Kayıt ACSF (mM olarak: 126 NaCl, 2.5 KCl, 26 NaHCO 3, 2 CaCI2, 2 MgCl2, 1.25 NaH 2 PO 4 ve 10 glikoz)
- Elektrot iç solüsyonu (mM olarak: 126 K-glukonat, 4 KCl, 10 HEPES, 4 ATP-Mg, 0.3 GTP-Na ve 10 fosfokreatin, pH 7.2, 300 mOsm).
Referanslar
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır