A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיפוי מעגלים עצביים מעכבים ידי Photostimulation סריקת הליזר
In This Article
Summary
נייר זה מציג את גישה של שילוב סריקת הליזר photostimulation עם הקלטות תא שלמות בעכברים מהונדסים המבטאים GFP באוכלוסיות נוירון מעכבות מוגבלות. הטכניקה מאפשרת מיפוי מקיף וניתוח כמותי של מעגלים סינפטיים המקומיים של נוירונים בקליפת המוח מעכבים ספציפיים.
Abstract
הנוירונים מעכבים הם קריטיים לתפקוד של קליפת מוח. הם מהווים כ 20% מהאוכלוסייה העצבית בקליפת המוח כולו וניתן לסווג נוסף לתוך תת מגוונים המבוסס על immunochemical, הצורני שלהם, והתכונות פיסיולוגיות 1-4. למרות שמחקרים קודמים גילו הרבה על תכונות פנימיות של סוגים שונים של תאי עצב מעכבים, ידע על קשרי המעגלים המקומיים שלהם הוא עדיין מצומצם יחסית 3,5,6. בהתחשב בכך שהפונקציה של כל נוירון בודד מעוצבת על ידי הקלט המעורר והמעכב הסינפטית בתוך מעגלי קליפת מוח, היינו באמצעות ליזר סריקת photostimulation (LSPS) לחיבורים במעגל מקומיים המפה לסוגי תאים מעכבים ספציפיים. בהשוואה לגירוי חשמלי קונבנציונלי או גירוי עלים גלוטמט, LSPS יש יתרונות ייחודיים המאפשרים מיפוי מקיף וניתוח כמותי של תשומות פונקציונליות מקומיות לנוירונים 3,7-9 נרשמו בנפרד. ליזר תמונהגירוי באמצעות משחרר רפרוף גלוטמט סלקטיבי מפעיל נוירונים perisomatically, ללא הפעלת האקסונים של מעבר או דנדריטים הדיסטליים, אשר מבטיח רזולוצית מיפוי תת מינרית. הרגישות והיעילות של LSPS לתשומות מיפוי מאתרי גירוי רבים על פני אזור גדול מתאימות גם לניתוח מעגל קליפת מוח.
כאן אנו מציגים טכניקה של LSPS שילוב עם תיקון כל תאי clamping למיפוי מעגל מעכב מקומי. הקלטות ממוקדות של סוגי תאים מעכבים ספציפיים בהנחייתם של שימוש בעכברים מהונדסים המבטאים חלבוני ניאון ירוקים (GFP) באוכלוסיות נוירון מעכבות מוגבלות בקליפת 3,10, המאפשרת דגימה עקבית של סוגי התאים הממוקדים וזיהוי חד משמעי של סוגי התאים נרשמו . באשר למיפוי LSPS, אנו מתארים את מכשור המערכת, לתאר את הליך הניסוי ורכישת נתונים, ודוגמאות נוכחיות של מיפוי מעגל בעכבר העיקרי somatosensory קליפת המוח. כפי שהודגם בניסויים שלנו, גלוטמט כלוב מופעל באזור מרחב מוגבל של פרוסת המוח על ידי photolysis הליזר UV; הקלטות בו זמנית מתח מהדק לאפשר זיהוי של תגובות הסינפטי photostimulation-עוררו. מפות של קלט הסינפטי או מעכב או מעורר לנוירון הממוקד נוצרות על ידי סריקת קרן הליזר כדי לעורר מאה אתרים presynaptic פוטנציאליים. לפיכך, LSPS מאפשר הבנייה של מפות מפורטות של תשומות סינפטיים impinging על סוגים מסוימים של נוירונים מעכבים באמצעות ניסויים חוזרים ונשנים. יחדיו, הטכניקה photostimulation המבוססת מציעה מדעני המוח כלי רב עצמה לקביעת הארגון הפונקציונלי של מעגלי קליפת מוח המקומיים.
Protocol
1. הכנת פרוסת המוח
- עכברים מהונדסים הם עמוקים מורדמים בנתרן פנטוברביטל (> 100 מ"ג / ק"ג, ip) ומהירות ערופה, והמוח שלהם חולצו בפתרון חיתוך קפוא וחומץ.
- משקפי GFP משמשים ראייה למסך אם מוח העכבר אמנם מבטא את ה-GFP.
- חלקים בקליפת מוח חושיים ראשוניים של 400 מיקרומטר העבה לחתוך עם vibratome בנוזל המכיל סוכרוז המלאכותי השדרתי (ACSF). פרוסות מודגרת ראשון בסוכרוז המכיל ACSF למשך 30 דקות עד 1 שעות ב 32 ° C, ואחרי תקופת הדגירה הראשונית, הועברו לACSF הקלטה בטמפרטורת חדר. במהלך הדגירה וההקלטה, בפרוסות בעבעו ברציפות עם 95% 2% -5 O CO 2.
2. הפעלת ציוד
היישום הכולל של המערכת בא לידי ביטוי באיור 1.
- מערכת קירור הליזר וספק כוח היא אל תדליקד ב, מקבל הליזר מוכן.
- כל החומרה הקשורה לשליטת photostimulation (כולל מערכת סריקת המראה, אפנן אופטי, תריס אלקטרוני ומגבר קלט photodiode) מופעלת.
- ציוד אלקטרו (כולל מגבר 700B Multiclamp וmicromanipulators) מופעל. הקלטות אלקטרו, photostimulation, והדמיה של ההכנות הפרוסות נעשות בתא זלוף פרוסה הועלה על הבימה הממונעת של מיקרוסקופ.
- מצלמת ההדמיה (Retiga 2000, ש-הדמיה, אוסטין, טקסס) מופעלת. פרוסות דמיינו עם מיקרוסקופ הזקוף (BW51X, אולימפוס) עם ניגוד אינפרא אדום הפרש התערבות (DIC) ואופטיקה עלית ניאון באמצעות מערכת ההדמיה.
- תוכנת Matlab מבוססת EPHUS ותוכנת מצלמה ש-לכידה הם התחילו. גרסה מותאמת עדכון של תוכנת Ephus (Ephus, זמין בhttps://openwiki.janelia.org/ </>) משמש לשליטת פרוטוקולי photostimulation ולרכוש נתוני photostimulation.
- לאחר שהמערכת מופעלת, צריך לבדוק אם מערכת photostimulation הליזר היא במצב עבודה. כאובייקטיבי מיקרוסקופ 4x משמש להעברה את הבזקי UV למשחרר רפרוף גלוטמט, פיסת נייר לבן ניתן לשים תחת להתבונן דפוס סריקת ליזר תוך המערכת פועלת.
3. הגדרת זלוף פרוסה
- מערכת זלוף לחץ מופעלת להאכיל ACSF ההקלטה לתוך חדר הפרוסה. טיפול נלקח על מנת להבטיח רמת נוזל קבועה של 2.0 מ"מ מעל הפרוסה בבית הבליעה.
- Aliquot של פתרון המניות של משרד תשתיות הלאומיים, בכלוב-גלוטמט הוא הוסיף 25 מ"ל של מחזורי ACSF לריכוז של 0.2 מ"מ גלוטמט בכלוב. שים לב שאחרי 5-6 שעות של ניסויים, פתרון האמבטיה וMNI-גלוטמט יהיה רעננים.
- פרוסת מוח מועברת לתא ההקלטה. אפשר להפעיל את ההדמיה שלystem כדי לבדוק את האיכות והפרוסה אנטומית לאתר את האזור החושי הראשוני. אז הפרוסה מעוגנת בטבעת פלטינת מייתר בהזמנה אישית. יש להיזהר שלא לשים את העוגן על האזור במוח המיועד להקלטות.
4. הקלטת תא כל תיקון clamping-
- אלקטרודות זכוכית (MΩ 4-6 התנגדות) הם משכו ומלאים בפתרון פנימי המכיל biocytin 0.1% לתיוג תא וזיהוי מורפולוגי.
- כדי לבצע הקלטת תיקון, תאים הם דמיינו במטרת 60x. סוגי תאים מעכבים מזוהים ראשון ונבחרו על סמך הדמיה של ביטוי של GFP תחת מיקרוסקופ אולימפוס דסק"ש / ניאון; הקלטות לאחר מכן מתבצעות תחת בקרה חזותית בעזרת ניטור וידאו דסק"ש אינפרא אדום. שים לב כמה פעמים במעבר בין מצבי DIC וניאון יש צורך לאשר את מיקום תא GFP עת שהתקרב לאלקטרודה לתא המטרה. טכניקות קונבנציונליות תיקון clamping-מוחל. האלקטרודה מלאה בלחץ חיובי, עבר בסמוך לתא השטח להקמת גומה נראית לעין על קרום תא המטרה, ולאחר מכן לחץ שלילי מיושם במהירות כדי ליצור gigaseal ולפרוץ תוך המעקב אחר תגובות ההזרקה הנוכחית על צג וידאו.
- עם השבירה ב, התמונות של התא ב60x תחת מצבי DIC וניאון נלקחות לאימות באופן מקוון. לפני איסוף נתוני photostimulation, hyperpolarizing וdepolarizing פולסים נוכחיים הזריק לבחון תכונות אלקטרו הבסיסיות של כל תא.
- אחרי תאים שלמים ברגע יציב מושגות עם התנגדות גישה טובה (בדרך כלל <20 MΩ), מטרת מיקרוסקופ מופעלת מ60x ל4x לphotostimulation סריקת הליזר. התמונה הפרוסה ב4x נרכשה ותשמש להדרכה ורישום אתרי photostimulation.
5. הליזר SCAnning photostimulation
- את הפרמטרים לרכישת photostimulation ונתונים נקבעים על ידי הפעלת מודול מתג התצורה של Ephus. בדרך כלל, 1 MS ליזר (20 mW) עם מרווח גירוי של 1 שני משמש למיפוי photostimulation. עקבות נתונים של 1 שני נדגמו ב 10 קילוהרץ הם נרכשים.
- תמונת פרוסת 4x נטענת למודול הממפה של Ephus. המיקום של סומה תא מוגדר, ואתרי photostimulation של תבנית בגודל 16x16 (80 מיקרומטר 80 מיקרומטר ריווח x) מוגדרים סביב מיקום התא, מכסים את כל שכבות בקליפת המוח.
- פרופיל העירור של נוירון נרשם ממופה על ידי בחינת מיקומי תקיעת המסמר בתגובה לphotostimulation במצב הנוכחי המהדק. התוכנה הידידותית למשתמש שלנו עם תכונות התצוגה מקוונות מאפשרת ניסויי המיפוי.
- חיבורי מעגלים מעוררים מקומיים ממופים זיהוי של זרמי postsynaptic מעוררים (EPSC) מהתא נרשם בזמן סריקת ליזר בשונהמקומות. התא מתקיים ב -70 mV במצב מהדק מתח כדי לזהות זרמים מעוררים פנימה. מפות EPSC חוזרות 2-3 פעמים עם מסובב דפוס photostimulation או התהפכו.
- אופציונלי: חיבורי מעגלים מעכבים מקומיים יכולים גם ממופים על ידי זיהוי של זרמי postsynaptic מעכבים (iPSC) מהתא המוקלט שנערך על קרוב ל 0 mV במצב מהדק מתח כדי לזהות זרמים מעכבים חיצוניים. שים לב שהדרך טובה ביותר הוא להשתמש בפתרון הפנימי אלקטרודה עם אשלגן הוחלף בצזיום למיפוי iPSC.
- אחרי כל המבחנים הפיסיולוגיים סקרים, אלקטרודה מוסרת בעדינות מהתא המוקלט. פרוסת המוח נלקחת החוצה וקבוע בparaformaldehyde 4% בין הלילה. התאים נרשמו מוכתמים נגד biocytin. מורפולוגיה תא נבדקה עם מיקרוסקופיה confocal או עלית הניאון, שגם מאשר שכל תא הוא אכן נרשם interneuron GFP להביע ממוקד במקור.
6. Photostimulatניתוח נתוני יון
מתודולוגיה חדשה שפותחה שלנו ויישום תוכנה 11 מוחלת על זיהוי והמדידה של photostimulation-עוררו אירועים הסינפטי במפות הנתונים הגולמיות. כפי שהודגם באיור 2, מפות צבעוניות שנבנות על מנת להמחיש את הדפוס של קלט הסינפטי לנוירון נרשם.
7. נציג תוצאות:
תוצאות לדוגמה של הקלטה ומיפוי אלקטרו photostimulation מוצגות באיור 2. הקלטות ממוקדות של סוגי תאים מעכבים ספציפיים מתאפשרות באמצעות עכברים מהונדסים המבטאים GFP בסוגי תאים מעכבים ידועים. בהינתן המגוון של interneurons המעכב, ניתוחים של ביטוי של GFP, אלקטרו הפנימי ומאפיינים מורפולוגיים (איור 2 א) משולבים להגיע לסיווג סוג התא הסופי. תרשים 2B-C להמחיש שphotostimulation סריקת הליזר מאפשר מיפוי מקיף של cortic המקומיal חיבורי מעגלים להנוירונים מעכבים יחידים. מפת הנתונים הגולמית שמוצגת באיור 2 ג. את התגובות משחררות רפרוף הישירות אינן נכללות בניתוח נתונים (האיור 2C). מפות הקלט כמותיים מסומנות בצבעים, שמוצגות באיור 2D-F. את interneurons המעכב מהיר spiking הדוגמא קבל קלט הסינפטי מעורר חזק (EPSCs) משכבה 4 ושכבות עמוקות יותר. על ידי הנוגע לארגון הקלט הסינפטי של התא למסלולים קורטיקליים מוגדרים, אנו יכולים להסיק התפקיד האפשרי שלו (למשל, משוב ועיכוב feedforward) בעיבוד מידע בקליפת המוח.
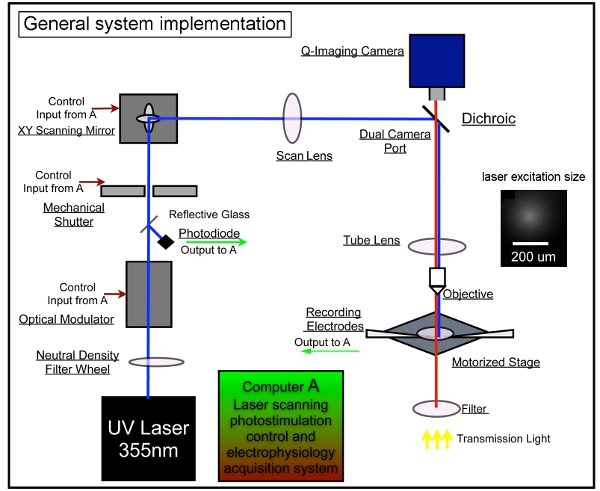
איור 1. מכשור כללי למערכת photostimulation סריקת הליזר. המערכת הכוללת שלנו מורכב משליטת photostimulation, הדמית וידאו, ומערכות הקלטת אלקטרו. אנחנו אמצנו את העיצוב של מערכת LSPS תואר קודם 7,17. יחידת ליזר משמשת לייצור 355 ננומטר UV אסאה למשחרר רפרוף גלוטמט. קרן הליזר מכוון דרך הנתיב האופטי של המערכת שלנו. משכי זמן קצרים של הבזקי ליזר (למשל, 1 - 3 ms) נשלטים על ידי שימוש במאפנן אלקטרו אופטי (כלומר, pockels תא) וצמצם מכאני. כוח קרן הליזר הוא מווסת על ידי גלגל שיפוע צפיפות ניטראלית ופיקוח על ידי הסטת חלק קטן של קרן הליזר עם coverslip זכוכית לphotodiode. מערכת סריקת הליזר כוללת זוג XY של מראות סריקה, סריקת העדשה, עדשות הצינור, ועדשה האובייקטיבית. המראות לספק קרן הליזר דרך עדשת סריקה, ולאחר מכן את הקרן נכנסה למיקרוסקופ באמצעות מראה Dichroic וממוקד על ידי עדשת מחוייט UV-העברת צינור. קרן underfills הצמצם האחורי של מטרת מיקרוסקופ כדי לספק יותר עמודים (בניגוד לצורה חרוטה) קרן מאירה, שמירה על המיפוי כדו ממדים שניתן על ידי הקטנת הרזולוציה הצירית. תחת מטרת 4x, קרן הליזר יוצרת כתמים משחררים רפרוף, כל approximating פרופיל Gaussian ברוחב של 153 מיקרומטר הרוחבי במישור המוקד (ראה מסגרת). עמדות גירוי ליזר שונות יכולות להיות מושגות באמצעות מראות סריקת XY galvanometers מונחה, כמו המראות והצמצם האחורי של המטרה הן במטוסים המצומד, לתרגם עמדות המראה למקומות שונים בסריקת מישור המוקד של העדשה האובייקטיבית. במהלך משחרר רפרוף, מספר משתנה של אתרי דוגמת שמכסים את כל השדה מומרצים רצף בnonraster, רצף אקראי, כדי למנוע מחודש קרבת אתרי מגורה לאחרונה. אנא עיין בשו et al. (2010) לקבלת מידע מפורט יותר.
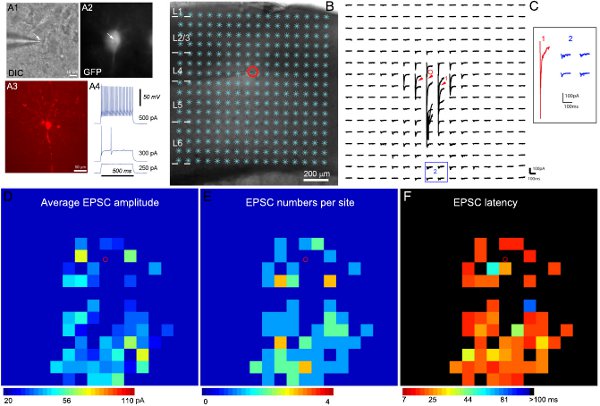
איור 2. מיפוי קשרי מעגלים מעוררים מקומיים לinterneuron GFP מבטא מהיר spiking בשכבת 4 של קליפת מוח התחושתית עכבר עיקרית. A1 ו-A2 להראות את תמונות DIC וGFP ניאון של התא הממוקד תחת 60xמטרה בפרוסת המוח החייה, ואילו A3 מציג את המורפולוגיה של התאים שהתגלתה על ידי הצביעה בbiocytin לאחר הקלטת פרוסה, הקבועה. A4 מציג את דפוסי הירי של התא המוקלט GFP, האופייני לinterneuron המעכב המהיר spiking, בתגובה לזריקות נוכחיות intrasomatic של עוצמות שונות. B מציג את התמונה על גבי הפרוסה עם 16 אתרי photostimulation x16 (*). מיקום התא מסומן בעיגול האדום הקטן. C מראה מערך של עקבות תגובה photostimulation עורר-ממקומות הגירוי מוצגים בB, ואילו התא התקיים ב -70 mV לאתר זרמים מעוררים פנימה. צורות שונות של תגובות photostimulation מומחשות באמצעות העקבות במקומות 1 ו 2, שהתרחבו ובנפרד מוצגים בכנס. עקבות 1 היא דוגמה לתשובות ישירות (שמצוין על ידי ראשי החץ האדומים) לגלוטמאט משחרר רפרוף על גוף התא ודנדריטים promximal. עקבות אחרות ב2 הן דוגמאות טיפוסיות של הסינפטי מעורר בלשים תגובות (כחול). תשובות ישירות ותשומות סינפטיים יכולים להיות מכובדות על ידי אמפליטודות שלהם, וזמן תגובת תגובה. D, E ו-F הן מפות בצבעים (16x16 אתרים) של ממוצע EPSC משרעת, מספרי EPSC והשהית EPSC התגלתה לראשונה לאתר, בהתאמה, עבור הנתונים הגולמיים המפה מוצגת בג משרעת הקלט ממוצע מכל אתר הוא גירוי המשרעת הממוצעת של EPSCs בחלון הניתוח, בתגובה הספונטנית הבסיסית נגרעה מתגובת photostimulation של אותו האתר. מספר EPSCs ואת זמן ההגעה או ההשהיה של EPSC התגלה לראשונה לאתר גם מדד וזמם. אנא עיין ב( השי et al., 2010) לקבלת פרטים נוספים.
Discussion
טכניקות מיפוי Photostimulation מבוססות כבר מיושם ביעילות לניתוח מעגלים בקליפת מוח. photostimulation סריקת הליזר בשילוב עם הקלטת תא שלמה מאפשר מיפוי ברזולוציה גבוה של הפצות עלעלים של מקורות קלט presynaptic לנוירונים בודדים, כי ההקלטה סימולטנית מנוירון postsynaptic עם photostimulation של צבירי נוירונ?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים טראן הוין, אנדרו סן אנטוניו, ג'רי לין לסיוע הטכני שלהם. עבודה זו מומנה על ידי המכונים הלאומיים לבריאות מענקי DA023700 וDA023700-04S1 לXX
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | תגובות |
| קווי עכבר מהונדסים | ג'קסון מעבדה או מקורות אחרים | אנא עיין בשו וCallaway (2009) | |
| GFP משקפים | BLS בע"מ, הונגרי | ||
| vibratome | מערכות יקה | VT1200S | |
| משרד התשתיות הלאומי גלוטמט כלוב (4-methoxy-7-nitroindolinyl כלוב-L-גלוטמט) | Tocris Bioscience, Ellisville, MO | מק"ט 1490 | |
| biocytin | B4261 | ||
| חולץ אלקטרודה | סאטר Instrument, Novato, קליפורניה | P-97 | |
| צינורות זכוכית להכנת אלקטרודות | BF150-86-10 | ||
| Multiclamp מגבר 700B | התקנים מולקולריים, Sunnyvale, CA | Multiclamp 700B | |
| דיגיטלית מצלמת CCD | Q-הדמיה, אוסטין, טקסס | Retiga 2000 | |
| מיקרוסקופ מחקר | אולימפוס, טוקיו, יפן | BW51X | |
| יחידת הליזר UV | DPSS לייזרים, סנט קלרה, קליפורניה | מודל 3501 | |
| ציוד אחר לphostimulation סריקת הליזר | אנא עיין בשו et al. (2010) |
פתרונות:
- סוכרוז המכיל נוזל השדרתי מלאכותי (ACSF) לחיתוך פרוס (במ"מ: 85 NaCl, 75 סוכרוז, 2.5 KCl, 25 גלוקוז, 1.25 nah 2 PO 4, 4 MgCl 2, 0.5 CaCl 2, ו24 3 NaHCO).
- ההקלטה ACSF (במ"מ: 126 NaCl, KCl 2.5, 26 3 NaHCO, 2 CaCl 2, 2 MgCl 2, 1.25 nah 2 PO 4, ו 10 גלוקוז)
- פתרון האלקטרודה פנימי (במ"מ: 126 K-גלוקונאט, 4 KCl, 10 HEPES, 4 ATP-Mg, 0.3 GTP-Na, ו 10 phosphocreatine; pH 7.2, 300 mOsm).
References
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved