Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сопоставление ингибирующих нейронов схем с Фотостимуляция лазерного сканирования
В этой статье
Резюме
Эта статья представляет подход объединения лазерного сканирования фотостимуляции с целой записи ячейки в трансгенных мышей, экспрессирующих GFP в ограниченном ингибирующее популяций нейронов. Методика позволяет для широкого отображения и количественного анализа местных синаптических схемы конкретных ингибирующих нейронов коры.
Аннотация
Inhibitory neurons are crucial to cortical function. They comprise about 20% of the entire cortical neuronal population and can be further subdivided into diverse subtypes based on their immunochemical, morphological, and physiological properties1-4. Although previous research has revealed much about intrinsic properties of individual types of inhibitory neurons, knowledge about their local circuit connections is still relatively limited3,5,6. Given that each individual neuron's function is shaped by its excitatory and inhibitory synaptic input within cortical circuits, we have been using laser scanning photostimulation (LSPS) to map local circuit connections to specific inhibitory cell types. Compared to conventional electrical stimulation or glutamate puff stimulation, LSPS has unique advantages allowing for extensive mapping and quantitative analysis of local functional inputs to individually recorded neurons3,7-9. Laser photostimulation via glutamate uncaging selectively activates neurons perisomatically, without activating axons of passage or distal dendrites, which ensures a sub-laminar mapping resolution. The sensitivity and efficiency of LSPS for mapping inputs from many stimulation sites over a large region are well suited for cortical circuit analysis.
Here we introduce the technique of LSPS combined with whole-cell patch clamping for local inhibitory circuit mapping. Targeted recordings of specific inhibitory cell types are facilitated by use of transgenic mice expressing green fluorescent proteins (GFP) in limited inhibitory neuron populations in the cortex3,10, which enables consistent sampling of the targeted cell types and unambiguous identification of the cell types recorded. As for LSPS mapping, we outline the system instrumentation, describe the experimental procedure and data acquisition, and present examples of circuit mapping in mouse primary somatosensory cortex. As illustrated in our experiments, caged glutamate is activated in a spatially restricted region of the brain slice by UV laser photolysis; simultaneous voltage-clamp recordings allow detection of photostimulation-evoked synaptic responses. Maps of either excitatory or inhibitory synaptic input to the targeted neuron are generated by scanning the laser beam to stimulate hundreds of potential presynaptic sites. Thus, LSPS enables the construction of detailed maps of synaptic inputs impinging onto specific types of inhibitory neurons through repeated experiments. Taken together, the photostimulation-based technique offers neuroscientists a powerful tool for determining the functional organization of local cortical circuits.
протокол
1. Подготовка среза мозга
- Трансгенные мыши, глубоко анестезировали фенобарбиталом натрия (> 100 мг / кг, внутрибрюшинно) и быстро обезглавлены, и их мозг извлекается в замороженном и кислородом резки решение.
- GFP очки, которые используются для визуального экрана, если мозг мыши действительно выражает GFP.
- Первичной соматосенсорной корковых участков 400 мкм толщиной разрезать vibratome в сахарозу, содержащие искусственные цереброспинальной жидкости (ACSF). Ломтики сначала инкубировали в сахароза-содержащих ACSF в течение 30 мин до 1 часа при 32 ° C, и после начального периода инкубации, переданы записи ACSF при комнатной температуре. На протяжении инкубации и записи, ломтиками постоянно пропускают с 95% O 2 -5% CO 2.
2. Оборудование запуске
В целом внедрение системы показана на рисунке 1.
- Лазерная система охлаждения и питания поставщик турнег о, получив лазерный готовы.
- Все оборудование, связанные с фотостимуляции контроля (в том числе сканирование системы зеркал, оптического модулятора, электронного затвора и усилитель фотодиода ввода) включен.
- Электрофизиологического оборудования (в том числе Multiclamp 700B усилитель и микроманипуляторами) включен. Электрофизиологические записи, фотостимуляции, и изображение среза препараты производятся в камере кусочек перфузии установленных на моторизованных этапе микроскопом.
- Камера (Retiga 2000 году, Q-изображений, Austin, TX) включен. Ломтики визуализируются с вертикальным микроскопом (BW51X, Olympus) с инфракрасным отличие вмешательства дифференциал (ДВС-синдром) и эпи-флуоресцентного оптики через системы визуализации.
- Matlab на основе EPHUS программного обеспечения и Q-захвата камерой программное обеспечение запускается. Специально модифицированную версию программного обеспечения Ephus (Ephus, доступно на https://openwiki.janelia.org/ </>) Используется для управления фотостимуляции протоколов и приобрести фотостимуляции данных.
- После того, как система работает, необходимо проверить, чтобы убедиться, что система лазерной фотостимуляции находится в рабочем состоянии. Как 4x цель микроскоп используется для доставки УФ-вспышки для глутамата uncaging, лист белой бумаги может быть поставлена под соблюдать лазерного сканирования картины в то время как система работает.
3. Настройка кусочек перфузии
- Давление системы перфузии включен кормить записи ACSF в срезе камеры. Принимаются меры для обеспечения постоянного уровня жидкости 2,0 мм выше среза в камере.
- Аликвоты исходного раствора MNI-клетке-глутамат добавляют 25 мл циркулирующей ACSF для концентрации 0,2 мМ глутамата в клетках. Пожалуйста, обратите внимание, что после 5-6 часов экспериментов, решение ванны и MNI-глутамата будет обновлен.
- Среза мозга перемещается в записи камеры. Можно работать с изображениямиystem, чтобы проверить качество среза и анатомически найти первичной соматосенсорной области. Тогда срез на якорь с заказной струнный кольца платины. Будьте осторожны, чтобы не поставить якорь на область мозга, предназначенная для записи.
4. Всего ячейки патч-зажимной записи
- Стеклянные электроды (4-6 МОм сопротивления) берутся и заполнен внутренний раствор, содержащий 0,1% biocytin для маркировки клеток и морфологическое идентификации.
- Для выполнения патча записи, клетки визуализируются на 60x цели. Ингибирующее типов клеток, сначала определены и выбраны на основе визуализации выражения GFP под DIC / флуоресцентного микроскопа Olympus, записи, впоследствии проводится под визуальным контролем помогает инфракрасный DIC видеонаблюдения. Обратите внимание, что в несколько раз переключаться между ОПК и флуоресцентные режима необходимо подтвердить расположение GFP клетки при приближении электрода к клетке-мишени.
- Обычные патч-зажимной методы применяются. Электрод заполнен с положительным давлением, приблизился к поверхности клетки, чтобы создать заметное углубление на целевые клеточные мембраны, а затем отрицательное давление быстро применяться для формирования gigaseal и ворваться в процессе мониторинга текущей ответы инъекций на видео монитор.
- После взлома, изображения ячейки на 60x под DIC и флуоресцентные режимов, принятых для онлайн-проверки. Перед коллекции фотостимуляции данных, гиперполяризующего и деполяризующих импульсов тока вводится для изучения основных электрофизиологических каждой ячейке свойства.
- После стабилизации целом записей ячейки достигается с хорошим сопротивлением доступа (обычно <20 МОм), объектива микроскопа переключается с 60x 4x для лазерного сканирования фотостимуляции. Кусочек изображения на 4х приобретена и будет использоваться для управления и регистрации фотостимуляции сайтов.
5. Лазерная SCAnning фотостимуляции
- Параметры фотостимуляции и сбора данных устанавливается путем активации конфигурации модуля выключателя Ephus. Обычно, 1 мс лазерных (20 мВт) с стимула интервалом в 1 секунду используется для отображения фотостимуляции. Данные следы 1 секунду дискретизации 10 кГц приобретения.
- 4x изображение среза загружается в картографа модуль Ephus. Расположение клетки сомы определен, и фотостимуляции участки 16x16 модель (80 мкм х 80 мкм интервал) устанавливается вокруг адресом ячейки, охватывающей все слои коры.
- Возбуждение профиль записал нейрон переходит при рассмотрении пики местах в ответ на фотостимуляции в текущем режиме зажим. Наше удобное программное обеспечение с онлайн-функции дисплея облегчает отображение экспериментов.
- Местные возбуждающие схемы подключения отображаются по обнаружению возбуждающих постсинаптических токов (EPSC) с записанной ячейки при лазерном сканировании в различныхмест. Ячейке проводится при -70 мВ в режиме напряжения зажим для обнаружения внутренней возбуждающих токов. EPSC карты повторяют 2-3 раза с повернутой фотостимуляции узор или переворачивается.
- Дополнительно: Местные тормозных связей схема может также отображаться при обнаружении тормозных постсинаптических токов (IPSC) от записанной ячейки состоялась в близкой к 0 мВ в режиме напряжения зажим для обнаружения внешним ингибирующее токов. Обратите внимание, что лучше всего использовать электрод внутреннее решение калия заменили цезия для IPSC отображения.
- Ведь физиологические тесты будут завершены, электрод осторожно удалить из записанных клетки. Среза мозга вынимают и фиксировали в 4% параформальдегид в течение ночи. Записанных клетки окрашиваются в отношении biocytin. Морфология клеток рассматривается с конфокальной или эпи-флуоресцентной микроскопии, которая также подтверждает, что каждая клетка записали действительно GFP-экспрессирующих интернейронов первоначально.
6. Photostimulatионный анализ данных
Наш недавно разработанной методологии и внедрение программного обеспечения 11 применяется для обнаружения и измерения фотостимуляции-синаптические вызвали события в сырье карты данных. Как показано на рисунке 2, цветные карты строятся для иллюстрации картины синаптических входа записал нейрона.
7. Представитель Результаты:
Пример результатов электрофизиологических записи и отображения фотостимуляции показано на рисунке 2. Целевые записи конкретных ингибирующего типов клеток стало возможным с помощью трансгенных мышей, экспрессирующих GFP в известной ингибирующего типов клеток. Учитывая разнообразие тормозных интернейронов, анализ GFP выражение, присущее электрофизиологических и морфологических характеристик (рис. 2A) объединяются, чтобы прийти к окончательной классификации типов клеток. Рисунок 2B-C показывают, что лазерное сканирование позволяет фотостимуляции для широкого отображения местного corticАль схема подключения к одной тормозных нейронов. Сырые данные карты показан на рисунке 2C. Прямые ответы uncaging исключены из анализа данных (рис. 2). Количественный карты ввода цветом, как показано на рисунке 2D-F. Например быстро пики ингибирующее интернейроны получил сильный возбуждающих синаптических входов (EPSCS) из слоя 4 и более глубокие слои. По касающиеся организации синаптических входа клетки в определенный корковые пути, мы можем сделать вывод о его возможной роли (например, обратная связь и упреждающего торможения) в корковой обработки информации.
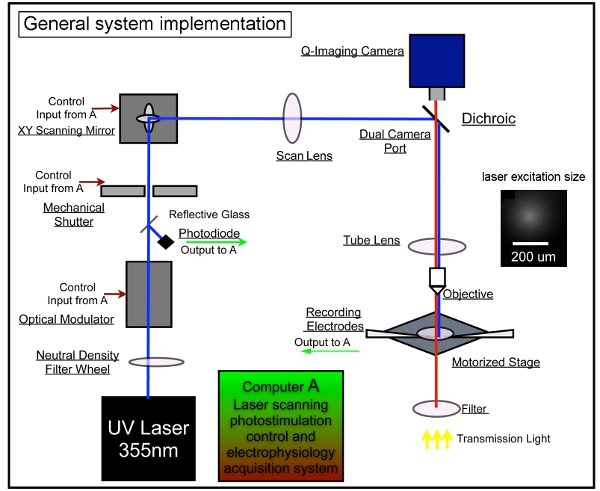
Рисунок 1. Генеральный измерительной системы для лазерного сканирования фотостимуляции. Наша общая система состоит из фотостимуляции контроль, видео изображений, и электрофизиологических систем записи. Мы приняли конструкции системы LSP, описанных выше 7,17. Лазерный прибор используется для генерации 355 нм УФ-лас-э для uncaging глутамата. Луч лазера направляется через оптический путь нашей системе. Короткая продолжительность вспышек лазеров (например, 1 - 3 мс) управляются с помощью электро-оптического модулятора (например, ячейки Поккельса) и механический затвор. Лазерный луч мощность модулируется нейтральной колеса градиента плотности и мониторинг, отвлекая небольшая часть лазерного пучка с покровным стеклом на фотодиод. Система лазерного сканирования включает в себя пару XY сканирования зеркала, линзы сканирования, трубка линзы и линзы объектива. Зеркала доставки лазерного луча через линзу сканирования, а затем луч входит в микроскоп через дихроичное зеркало и фокусируется на заказ УФ-передающей трубки объектива. Луч underfills задней апертурой объектива микроскопа, чтобы обеспечить более столбчатые (в отличие от конической) освещающего пучка, сохраняя отображение как двумерный возможно за счет уменьшения осевого резолюции. В соответствии с 4x цели, лазерный луч формирует uncaging пятна, каждый approximatiнг гауссовым профилем шириной 153 мкм боков в фокальной плоскости (см. вставку). Различные позиции лазерной стимуляции может быть достигнуто путем гальванометрами управляемые зеркала XY сканирования, как зеркала и задний отверстия объектива в сопряженных плоскостях, переводя зеркало позиции в различных местах сканирования в объектив фокальной плоскости. Во время uncaging, переменное число узорные сайтов, которая охватывает все поле стимулируются последовательно в nonraster, неслучайной последовательности, чтобы избежать пересмотра близости от недавно стимулировали сайтов. Пожалуйста, обратитесь к Xu и соавт. (2010) для более подробной информации.
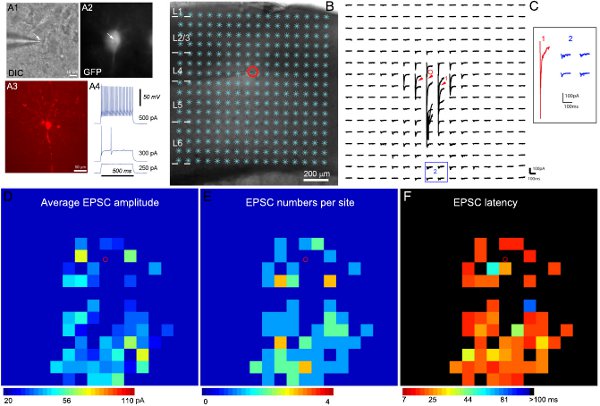
Рисунок 2. Отображение местного возбуждающие соединения цепи GFP-экспрессирующих быстро пики интернейронов в слое 4 мыши первичной сенсорной коры. А1 и А2 показать DIC и GFP флуоресцентные изображения целевого ячейку под 60xЦель в жизни срез головного мозга, в то время как A3 показывает морфологии клеток выявлены biocytin окрашивание в пост-записи, фиксированная часть. A4 показывает стрельбы моделей записанные ячейки GFP, характерные для быстрого пики ингибирующее интернейронов, в ответ на intrasomatic текущего инъекций различной силы. B показать кусочек изображения накладываются с 16 x16 сайтов фотостимуляции (*). Сотой указывает маленький красный круг. C показывает массив фотостимуляции-ответ вызвал следы от стимуляции местах, показанных на B, в то время как клетка была проведена при -70 мВ для обнаружения внутренней возбуждающих токов. Различные формы фотостимуляции ответы свидетельствуют следы на местах 1 и 2, которые расширили и отдельно показано на вставке. Следа 1 является примером прямого ответа (обозначены красными стрелками) на глутамат uncaging на тело клетки и дендриты promximal. Другие следы в 2 являются типичными примерами возбуждающих синаптических вположить ответов (синий). Прямые ответы и синаптические входы можно отличить по их амплитуды и задержки ответа. D, E и F являются цветные карты (16x16 сайтов) средней EPSC амплитуды, EPSC числа, и впервые обнаружен EPSC задержки для каждого сайта, соответственно, для исходных данных показан на карте C. средней амплитуды входного друг от стимулирование сайт средней амплитудой EPSCS в окне анализа, с базовой спонтанных ответов вычитается из фотостимуляции ответ одного и того же сайта. Число EPSCS и время прибытия или задержки впервые обнаружен в EPSC сайте также измеряются и отображаются. Пожалуйста, обратитесь к (Shi соавт., 2010) для более подробной информации.
Обсуждение
Фотостимуляция на основе методов картирования были эффективно применены для анализа корковых цепей. Лазерное сканирование фотостимуляции в сочетании с все записи ячейки обеспечивает высокое разрешение отображения ламинарного распределения пресинаптических источники входного сиг...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Tran Huynh, Эндрю Сан-Антонио, Джерри Линь за их техническую помощь. Эта работа финансировалась Национальным институтом здравоохранения грантов DA023700 и DA023700-04S1 в XX
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| трансгенной линии мышей | Джексон лаборатории или других источников | Пожалуйста, обратитесь к Сюй и Callaway (2009) | |
| GFP очки | BLS Ltd, Венгрия | ||
| vibratome | Leica системы | VT1200S | |
| MNI клетке глутамата (4-метокси-7-nitroindolinyl-клетках L-глутамата) | Tocris Bioscience, Ellisville, MO | Cat № 1490 | |
| biocytin | B4261 | ||
| электрод съемник | Sutter Instrument, Novato, CA | P-97 | |
| стеклянных трубок для изготовления электродов | BF150-86-10 | ||
| Multiclamp 700B Усилитель | Molecular Devices, Саннивейл, Калифорния | Multiclamp 700B | |
| цифровой ПЗС-камеры | Q-изображений, Austin, TX | Retiga 2000 | |
| Исследования микроскоп | Olympus, Токио, Япония | BW51X | |
| УФ лазерной установки | DPSS лазеры, Санта-Клара, Калифорния | Модель 3501 | |
| Другое оборудование для phostimulation лазерного сканирования | Пожалуйста, обратитесь к Xu и соавт. (2010) |
Решения:
- Сахароза содержащих искусственные цереброспинальной жидкости (ACSF) для ломтик резки (в мм: 85 NaCl, 75 сахарозы, 2,5 KCl, 25 глюкозы, 1,25 NaH 2 4 PO, 4 2 MgCl, 0,5 CaCl 2, и 24 NaHCO 3).
- Запись ACSF (в мМ: 126 NaCl, 2,5 KCl, 26 3 NaHCO, 2 2 CaCl, MgCl 2 2, 1,25 NaH 2 PO 4 и 10 глюкозы)
- Электрод внутреннее решение (в мм: 126 K-глюконат, 4 KCl, 10 HEPES, 4 АТФ-Mg, 0,3 GTP-Na, и 10 фосфокреатина, рН 7,2, 300 мосм).
Ссылки
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены