Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cartographie inhibitrice circuits neuronaux par balayage laser photostimulation
Dans cet article
Résumé
Cet article présente une approche consistant à combiner photostimulation à balayage laser avec des enregistrements de cellules entières dans des souris transgéniques exprimant la GFP dans les populations limitées neurone inhibiteur. La technique permet de cartographie étendue et l'analyse quantitative des locaux des circuits synaptiques inhibitrices spécifiques des neurones corticaux.
Résumé
Les neurones inhibiteurs sont cruciaux pour la fonction corticale. Ils représentent environ 20% de toute la population neuronale corticale et peut être subdivisée en sous-types différents en fonction de leurs propriétés immunochimiques, morphologiques, physiologiques et 1-4. Bien que des recherches antérieures ont révélé beaucoup sur les propriétés intrinsèques des différents types de neurones inhibiteurs, les connaissances sur leurs connexions circuit local est encore relativement limitée 3,5,6. Étant donné que la fonction de chaque neurone individuel est façonné par son entrée synaptique excitateurs et inhibiteurs dans les circuits corticaux, nous avons eu recours à balayage laser photostimulation (LSP) pour les connexions locales au plan du circuit des types spécifiques de cellules inhibitrices. Comparé à une stimulation électrique conventionnel ou la stimulation de glutamate feuilletée, LSPS a des avantages uniques permettant la cartographie étendue et l'analyse quantitative des locaux fonctionnels pour les entrées enregistrés individuellement neurones 3,7-9. Photostimulation laser via uncaging glutamate active sélectivement les neurones perisomatically, sans activer les axones de passage ou de dendrites distales, ce qui assure une résolution de cartographie sous-laminaire. La sensibilité et l'efficacité de LSP pour les entrées de cartographie à partir de nombreux sites de stimulation sur une vaste région sont bien adaptées pour l'analyse des circuits corticaux.
Ici, nous introduisons la technique de LSP combinée avec la cellule entière patch clamp pour la cartographie des circuits locaux inhibiteurs. Enregistrements spécifiques ciblées sur des types de cellules inhibitrices sont facilitées par l'utilisation de souris transgéniques exprimant des protéines vertes fluorescentes (GFP) dans des populations limitées neurone inhibiteur du cortex 3,10, ce qui permet l'échantillonnage uniforme des types de cellules ciblées et d'identifier sans ambiguïté les types de cellules enregistrées . Comme pour la cartographie des LSP, nous décrivons l'instrumentation du système, décrire la procédure expérimentale et acquisition de données, et présente des exemples de cartographie circuit principal de la souris cortex somatosensoriel. Comme illustré dans nos expériences, le glutamate est activé en cage dans une région géographiquement limitée de la tranche de cerveau par photolyse laser UV; simultanée voltage-clamp enregistrements permettent la détection de photostimulation évoqués réponses synaptiques. Cartes d'entrée soit excitateurs ou inhibiteurs synaptiques du neurone cible sont générés par la numérisation du faisceau laser pour stimuler des centaines de sites potentiels présynaptiques. Ainsi, les LSP permet la construction de cartes détaillées des entrées synaptiques empiéter sur des types spécifiques de neurones inhibiteurs par des expériences répétées. Pris ensemble, la technique basée sur la photostimulation offre neuroscientifiques un outil puissant pour déterminer l'organisation fonctionnelle des locaux circuits corticaux.
Protocole
1. La préparation de tranches de cerveau
- Les souris transgéniques sont profondément anesthésiés avec du pentobarbital de sodium (> 100 mg / kg, ip) et rapidement décapité, et leurs cerveaux extraits dans une solution de découpe congelés et oxygéné.
- Lunettes de GFP sont utilisés pour visuel écran si le cerveau de souris exprime bien la GFP.
- Somatosensoriel primaire sections corticales de 400 um d'épaisseur sont coupées avec un vibratome de saccharose contenant le liquide céphalorachidien artificiel (ACSF). Les tranches sont d'abord incubées dans le saccharose contenant ACSF pendant 30 min à 1 h à 32 ° C, et après la période d'incubation initiale, transféré à l'ACSF enregistrement à la température ambiante. Tout au long de l'incubation et l'enregistrement, les tranches sont en permanence à barboter avec 95% d'O 2 -5% CO 2.
2. Équipement de démarrage
La mise en œuvre globale du système est illustrée dans la Figure 1.
- Le système de refroidissement laser et fournisseur d'énergie est activée, le laser se prête.
- Tout le matériel lié au contrôle photostimulation (y compris le système de miroir de balayage, un modulateur optique, d'un obturateur électronique et un amplificateur d'entrée de photodiodes) est allumé.
- L'équipement d'électrophysiologie (y compris un amplificateur Multiclamp 700B et micromanipulateurs) est allumé. Enregistrements électrophysiologiques, photostimulation et l'imagerie de la préparation tranche sont fait dans une chambre de perfusion tranche monté sur la platine motorisée du microscope.
- La caméra d'imagerie (Retiga 2000, Q-imagerie, Austin, TX) est allumé. Les tranches sont visualisées avec le microscope droit (BW51X, Olympus) avec un contraste interférentiel différentiel infrarouge (DIC) et épi-fluorescence optique à travers le système d'imagerie.
- Le logiciel Matlab basée EPHUS et logiciel de la caméra capture sont Q-démarré. Une version personnalisée du logiciel modifié de Ephus (Ephus, disponible à https://openwiki.janelia.org/ ) est utilisé pour contrôler les protocoles photostimulation et acquérir des données photostimulation.
- Après que le système est allumé, il faut vérifier si le système photostimulation laser est moins un état de travail. Comme l'objectif du microscope 4x est utilisé pour remettre les flashs UV pour uncaging glutamate, un morceau de papier blanc peut être mis sous d'observer le balayage laser tandis que le système fonctionne.
3. Mise en place d'une perfusion tranche
- Un système de perfusion sous pression est activé pour nourrir les ACSF d'enregistrement dans la chambre tranche. Il est pris soin d'assurer un niveau de liquide constant de 2,0 mm au-dessus de la tranche dans la chambre.
- Une aliquote de la solution stock de l'INM-cage-glutamate est ajouté à 25 ml de circulation ACSF, pour une concentration de 0,2 mM de glutamate en cage. S'il vous plaît noter que après 5-6 h de l'expérimentation, la solution du bain et de l'INM-glutamate sera rafraîchie.
- Une tranche de cerveau est déplacé dans la chambre d'enregistrement. On peut exécuter le système d'imagerie pour vérifier la qualité de coupe et de localiser la zone anatomiquement somatosensoriel primaire. Puis la tranche est ancré avec une bague sur-mesure en platine cordes. Soyez prudent de ne pas mettre l'ancre sur la région du cerveau destinés aux enregistrements.
4. Patch-clamp de cellules entières d'enregistrement
- Électrodes de verre (4-6 MQ résistance) sont retirés et rempli d'une solution interne contenant biocytine 0,1% pour l'étiquetage et l'identification morphologique des cellules.
- Pour effectuer l'enregistrement de patch, les cellules sont visualisées à l'objectif 60x. Types de cellules inhibitrices sont d'abord identifiés et sélectionnés sur la base de visualisation de l'expression de la GFP sous un microscope DIC / fluorescentes Olympe; enregistrements sont ensuite réalisées sous contrôle visuel aidée par la surveillance vidéo infrarouge DIC. S'il vous plaît noter que quelques temps de commutation entre les modes de DIC et fluorescents est nécessaire pour confirmer l'emplacement de la cellule GFP en approchant l'électrode de la cellule cible.
- Les techniques classiques de patch-clamp sont appliquées. L'électrode est rempli avec une pression positive, déplacé près de la surface cellulaire pour établir une fossette visible sur la membrane de la cellule cible, puis la pression négative est appliquée rapidement pour former un gigaseal et rupture tout en surveillant les réactions d'injection de courant sur le moniteur vidéo.
- Après effraction, les images de la cellule à 60x sous les modes de DIC et fluorescents sont prises pour la vérification en ligne. Avant la collecte de données photostimulation, hyperpolarisante et dépolarisants impulsions de courant sont injectés pour examiner base de chaque cellule des propriétés électrophysiologiques.
- Une fois les enregistrements stables de cellules entières sont obtenus avec la résistance d'un bon accès (généralement <20 MW), l'objectif du microscope est commutée de 60x à 4x pour les photostimulation à balayage laser. L'image tranche à 4x est acquis et sera utilisé pour le guidage et d'enregistrer les lieux photostimulation.
5. Laser SCAnning photostimulation
- Les paramètres d'acquisition photostimulation et les données sont mis en activant le module commutateur de configuration du Ephus. Normalement, 1 ms au laser (20 mW) avec un intervalle de relance de 1 seconde est utilisée pour la cartographie de photostimulation. Des traces de données de 1 seconde échantillonné à 10 kHz sont acquises.
- L'image tranche de 4x est chargé dans le module mappeur du Ephus. L'emplacement du corps cellulaire est défini, et les sites photostimulation d'un modèle 16x16 (80 um um espacement x 80) sont mis en place autour de l'emplacement de la cellule, couvrant toutes les couches corticales.
- Le profil d'excitation du neurone enregistré est mappé en examinant les lieux de dopage en réponse à la photostimulation à la mode courant imposé. Notre logiciel convivial avec les fonctions d'affichage en ligne facilite les expériences de cartographie.
- Local connexions du circuit excitateur sont mappés par la détection de courants postsynaptiques excitateurs (RPEC) de la cellule enregistrée alors à balayage laser à différents endroits. La cellule est maintenue à -70 mV en mode voltage pour détecter l'intérieur des courants excitateurs. Les cartes sont RPEC répétée 2-3 fois avec le modèle de rotation photostimulation ou basculé.
- En option: Local connexions inhibitrices du circuit peut également cartographié par la détection de courants postsynaptiques inhibiteurs (CISP) de la cellule enregistrée lieu à près de 0 mV en mode voltage imposé à détecter les courants extérieurs inhibitrices. Notez qu'il est préférable d'utiliser la solution électrode interne avec le potassium remplacé par du césium pour la cartographie de l'IPSC.
- Après tous les tests physiologiques sont terminées, l'électrode est délicatement retiré de la cellule enregistrée. La tranche de cerveau est sorti et fixés dans du paraformaldéhyde 4% pendant la nuit. Les cellules enregistrées est taché contre biocytine. Morphologie des cellules est examinée avec confocale ou épi-fluorescence microscopique, ce qui confirme également que chaque cellule enregistrée est en effet l'interneurone exprimant la GFP initialement visés.
6. Photostimulation d'analyse de données
Notre méthodologie nouvellement développés et 11 la mise en œuvre du logiciel est appliquée à la détection et la mesure de la photostimulation évoqués événements synaptiques dans les cartes de données brutes. Comme le montre la figure 2, des cartes couleur sont construits pour illustrer le modèle d'entrée synaptique au neurone enregistré.
7. Les résultats représentatifs:
Exemple de résultats d'enregistrement électrophysiologiques et la cartographie sont photostimulation montre la figure 2. Enregistrements spécifiques ciblées sur des types de cellules inhibitrices sont rendues possibles par l'utilisation de souris transgéniques exprimant la GFP dans des cellules inhibitrices des types connus. Étant donné la diversité des interneurones inhibiteurs, des analyses d'expression GFP, intrinsèque électrophysiologie et les caractéristiques morphologiques (figure 2A) sont combinés pour arriver à la classification des types de cellules finale. Figure 2B-C montrent que photostimulation laser à balayage pour la cartographie permet étendu de connexions locales circuits corticaux aux simples neurones inhibiteurs. La carte de données brutes est montré dans la figure 2C. Les réponses uncaging directs sont exclus de l'analyse de données (figure 2C). Les cartes d'entrée quantitatives sont codés par couleur, figure 2D-F. L'exemple rapide de dopage interneurones inhibiteurs reçus forte entrée synaptique excitatrice (EPSCs) de la couche 4 et les couches plus profondes. En portant organisation de la cellule d'entrée synaptic pour définir les voies corticales, nous sommes en mesure de déduire de son rôle possible (par exemple, de rétroaction et d'inhibition feedforward) dans le traitement des informations corticales.
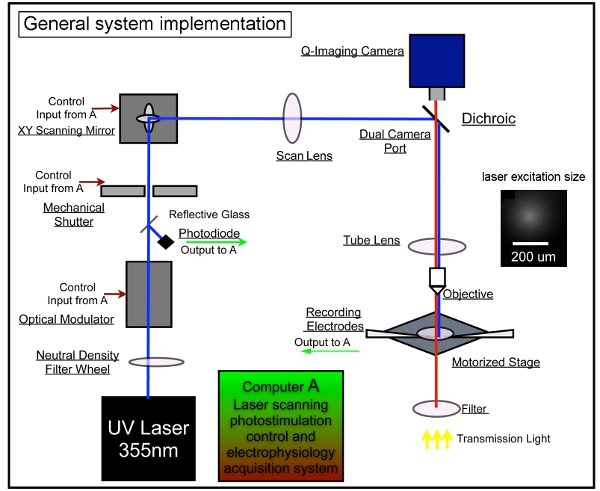
Figure 1. L'instrumentation du système général de photostimulation à balayage laser. Notre système global de contrôle se compose de photostimulation, l'imagerie vidéo et les systèmes d'enregistrement électrophysiologiques. Nous avons adopté la conception du système décrit précédemment LSPS 7,17. Une unité laser est utilisé pour générer 355 nm laser UV pour uncaging glutamate. Le faisceau laser est dirigé par le chemin optique de notre système. De courtes durées d'impulsions laser (par exemple, 1 - 3 ms) sont contrôlés en utilisant un modulateur électro-optique (par exemple, la cellule de Pockels) et un obturateur mécanique. Le faisceau laser de puissance est modulée par une roue gradient de densité neutre et surveillé en détournant une petite fraction du faisceau laser avec une lamelle de verre à une photodiode. Le système de balayage laser comprend une paire XY de miroirs de balayage, la lentille de balayage, la lentille de tube, et l'objectif. Les miroirs livrer le faisceau laser à travers une lentille de balayage, puis le faisceau pénètre dans le microscope par un miroir dichroïque et est focalisé par une lentille sur-mesure tube UV-transmission. Le faisceau underfills l'ouverture arrière de l'objectif du microscope à fournir plus une colonnaire (par opposition aux coniques) faisceau d'éclairage, en gardant la cartographie à deux dimensions que possible en réduisant la résolution axiale. Sous l'objectif 4x, le faisceau laser forme des taches uncaging, chaque approximating un profil gaussien avec une largeur de 153 um latéralement dans le plan focal (voir l'encart). Différentes positions de la stimulation par laser peut être réalisé par des galvanomètres axée miroirs de balayage XY, comme les miroirs et l'ouverture arrière de l'objectif sont dans des plans conjugués, traduisant des positions miroir dans différents endroits de balayage dans le plan focal objectif. Pendant uncaging, un nombre variable de sites de motifs qui couvre tout le champ sont stimulés de manière séquentielle dans une nonraster, séquence non aléatoire pour éviter de revoir la proximité des sites récemment stimulée. S'il vous plaît se référer à Xu et al. (2010) pour des informations plus détaillées.
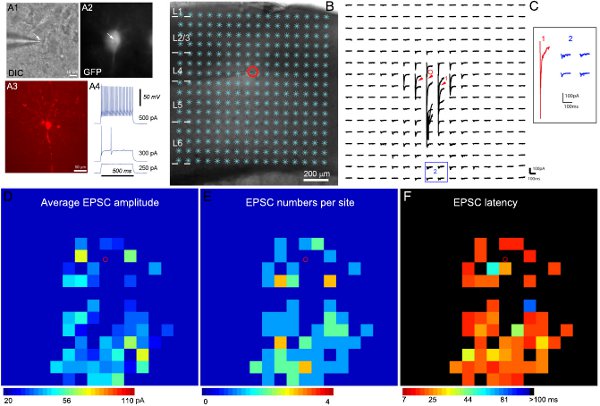
Figure 2. Cartographie locales connexions du circuit excitateur à une exprimant la GFP rapide dopage interneurone dans la couche 4 de la souris cortex sensoriel primaire. A1 et A2 montrent les images DIC et GFP fluorescentes de la cellule cible sous l'objectif 60x dans les tranches de cerveau de vie, tout montre A3 la morphologie des cellules révélées par coloration biocytine dans le post-enregistrement, tranche fixe. A4 montre les schémas de tir de la cellule de la GFP a enregistré, caractéristique d'un interneurone inhibiteur rapide de dopage, en réponse à intrasomatic injections de courant de différentes forces. B montrent l'image superposée à la tranche de 16 sites photostimulation x16 (*). L'emplacement de la cellule est indiqué par le petit cercle rouge. C montre un tableau de photostimulation évoqués traces de réponse à partir des emplacements de stimulation montré en B, tandis que la cellule a été tenue à -70 mV pour détecter l'intérieur des courants excitateurs. Différentes formes de réponses photostimulation sont illustrés par les traces dans des endroits de 1 et 2, qui sont développées et distincte dans l'insert. La trace 1 est un exemple des réponses directes (indiqué par les flèches rouges) au glutamate uncaging sur le corps cellulaire et les dendrites promximal. D'autres traces dans les 2 sont des exemples typiques de réponses excitatrices entrée synaptique (en bleu). Réponses directes et des entrées synaptiques peuvent être distingués par leurs amplitudes et des latences de réponse. D, E et F sont les cartes de couleur (16x16 sites) de la moyenne RPEC amplitude, le nombre de RPEC, et le premier temps de latence détecté RPEC par site, respectivement, pour les données brutes carte montrée dans C. L'amplitude moyenne de chaque entrée site de la stimulation est l'amplitude moyenne de EPSCs dans la fenêtre d'analyse, avec la réponse de base spontanée soustraite de la réponse photostimulation du même site. Le nombre de EPSCs et l'heure d'arrivée ou de latence de l'EPSC détecté pour la première par site sont également mesurées et tracées. S'il vous plaît se référer à (Shi et al., 2010) pour plus de détails.
Discussion
Techniques de cartographie basée sur photostimulation ont été effectivement appliquées pour l'analyse des circuits corticaux. Photostimulation balayage laser combinée avec l'enregistrement de cellules entières permet de cartographier à haute résolution des distributions laminaires des sources d'entrée pour les neurones présynaptiques unique, car l'enregistrement simultané d'un neurone postsynaptique avec photostimulation d'amas de neurones présynaptiques à différents endroits fourni...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Tran Huynh, Andrew San Antonio, Jerry Lin pour leur assistance technique. Ce travail a été financé par les National Institutes of Health DA023700 subventions et de DA023700-04S1 à XX
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| lignées de souris transgéniques | Jackson laboratoire ou d'autres sources | S'il vous plaît se référer à Xu et Callaway (2009) | |
| GFP lunettes | BLS SA, en Hongrie | ||
| vibratome | Systèmes Leica | VT1200S | |
| Glutamate INM en cage (4-méthoxy-7-nitroindolinyl-cage L-glutamate) | Bioscience Tocris, Ellisville, MO | Cat n ° 1490 | |
| biocytine | B4261 | ||
| Extracteur d'électrode | Sutter Instrument, Novato, CA | P-97 | |
| tubes de verre pour faire des électrodes | BF150-86-10 | ||
| Multiclamp ampli 700B | Molecular Devices, Sunnyvale, CA | Multiclamp 700B | |
| La caméra CCD numérique | Q-imagerie, Austin, TX | Retiga 2000 | |
| Microscope à la recherche | Olympus, Tokyo, Japon | BW51X | |
| Unité laser UV | DPSS Lasers, Santa Clara, Californie | le modèle 3501 | |
| Autres équipements pour la numérisation laser phostimulation | S'il vous plaît se référer à Xu et al (2010). |
Solutions:
- Contenant du saccharose liquide céphalo-rachidien artificiel (ACSF) pour couper une tranche (en mM: NaCl 85, 75 de saccharose, 2,5 KCl, 25 de glucose, 1,25 NaH 2 PO 4, 4 MgCl 2, 0,5 CaCl2, et 24 NaHCO 3).
- Enregistrement ACSF (en mM: NaCl 126, KCl 2,5, 26 NaHCO 3, 2 CaCl 2, MgCl 2 2, 1,25 NaH 2 PO 4, et 10 de glucose)
- Solution électrode interne (en mM: 126 K-gluconate, 4 KCl, HEPES 10, 4 ATP-Mg, 0,3 GTP-Na, et 10 phosphocréatine; pH 7,2, 300 mOsm).
Références
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon