このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
レーザースキャニングの光刺激によって抑制神経回路のマッピング
要約
本稿では、限られた抑制性ニューロン集団でGFPを発現するトランスジェニックマウスにおける細胞全体の録音でレーザ走査光刺激を組み合わせたアプローチを紹介します。手法は特異的な阻害皮質ニューロンの局所シナプス回路の広範なマッピングと定量分析が可能になります。
要約
抑制性ニューロンは皮質機能に不可欠である。彼らは、全体の大脳皮質の神経人口の約20%を構成し、さらに1月4日 、その免疫化学的、形態学的および生理学的特性に基づいて多様なサブタイプに細分化することができます。以前の研究では、抑制性ニューロンの個々のタイプの固有の特性についてはあまり明らかになってきたが、地元の回路接続に関する知識はまだ3,5,6比較的限られている。個々のニューロンの機能は皮質回路内での興奮性と抑制性シナプス入力によって形作られていることを考えると、我々は特定の抑制性細胞型へのマップローカル回線接続にレーザースキャニング光刺激(LSP)を使用してきました。従来の電気刺激やグルタミン酸パフ刺激に比べて、LSPは個別に記録されたニューロン3,7-9への広範なマッピングおよびローカル機能入力の定量分析を可能にするユニークな利点を持っています。レーザー写真グルタミン酸アンケージング経由刺激が選択的に通過またはサブ層マッピング分解能を保証遠位樹状突起、軸索を活性化することなく、perisomaticallyニューロンを活性化する。広い地域に比べて多くの刺激部位からの入力をマッピングするためのLSPsの感度と効率がよく皮質回路解析に適しています。
ここでは、地元の抑制回路マッピングするためのクランプホールセルパッチと組み合わせたLSPsのテクニックをご紹介します。標的細胞の種類と記録された細胞型の明確な同定の一貫したサンプリングを可能にする特異的な阻害細胞タイプの標的録音皮質3,10の限られた抑制性ニューロン集団における緑色蛍光タンパク質(GFP)を発現するトランスジェニックマウスを使用することによって促進され、 。 LSPは、マッピングのように、我々は、システム装置の概要を説明実験の手順及びデータ収集を説明し、マウス初代somatoseにおける回路マッピングの現在の例nsory皮質。我々の実験で示されているように、かごに入れられたグルタミン酸は、UVレーザー光分解による脳切片の空間的に限定された領域で活性化され、同時に電圧クランプ記録は、光刺激誘発シナプス応答の検出を可能にする。標的ニューロンへの興奮性または抑制性シナプス入力のどちらかのマップは、潜在的なシナプス前の数百のサイトを促進するために、レーザビームを走査することによって生成されます。したがって、LSPは繰り返し実験を通じて抑制性神経細胞の特定の種類に当たるシナプス入力の詳細な地図の構築を可能にします。一緒になって、光刺激ベースの手法は、神経科学者の大脳皮質の局所回路の機能的な組織を決定するための強力なツールを提供しています。
プロトコル
1。脳スライス標本
- トランスジェニックマウスは、ペントバルビタールナトリウム(> 100 mg / kgを腹腔内)と深く麻酔し、急速に断頭し、自分の脳は、凍結と酸素切断溶液中に抽出。
- GFPのゴーグルは、マウスの脳は確かにGFPを発現した場合視覚的にスクリーニングするために使用されています。
- 厚さ400μmの一次体性感覚皮質のセクションはスクロース含有人工脳脊髄液(ACSF)でビブラトームで切断されています。スライスは、最初の32°Cで30分〜1時間スクロース含有ACSF中でインキュベートし、初期の潜伏期間の後、室温で記録ACSFに転送されます。インキュベーションと記録を通して、スライスが連続して95%O 2 -5%CO 2で泡立てています。
2。装置の起動
全体的なシステムの実装は、図1に示されている。
- レーザー冷却システムと電力供給者はturneですdに、レーザーが準備。
- 光刺激コントロール(走査ミラーシステム、光変調器、電子シャッターとフォトダイオード入力アンプを含む)に関連するすべてのハードウェアがオンになっています。
- 電気生理学機器(Multiclamp 700Bアンプとマイクロマニピュレータを含む)が有効になっています。電気生理学的記録、光刺激、そしてスライス標本のイメージング顕微鏡の電動ステージに搭載されたスライスの灌流チャンバーで行われます。
- 撮像カメラ(Retiga 2000、Qイメージング、テキサス州オースティン)がオンになっています。スライスは、赤外線微分干渉コントラスト(DIC)およびイメージングシステムを介したエピ蛍光光学系と正立顕微鏡(BW51X、オリンパス)で可視化されています。
- MATLABベース山なりの投球ソフトウェアとQキャプチャカメラソフトウェアが起動されます。山なりの投球ソフトウェアのカスタム修飾されたバージョン(山なりの投球で入手できるhttps://openwiki.janelia.org/ </>)は、光刺激プロトコルを制御し、光刺激データを取得するために使用されます。
- システムがオンになった後、1つは、レーザー光刺激システムが稼動状態であるかどうかを確認する必要があります。 4倍顕微鏡対物がグルタミン酸アンケージング用UV点滅を送達するために使用されているように、白い紙は、システムの実行中にレーザ走査パターンを観察するために下に置くことができます。
3。スライス潅流を設定
- 加圧された灌流システムはスライス室に記録ACSFを養うためにオンになっています。ケアは、チャンバー内のスライス上2.0mmの一定の流体レベルを確保するために取られる。
- MNI-ケージド-グルタミン酸のストック溶液のアリコートを0.2mMのケージドグルタミン酸の濃度をACSFを循環させる25ミリリットルに追加されます。実験の5-6時間後、浴溶液とMNI-グルタミン酸がリフレッシュされますのでご注意ください。
- 脳切片は、記録室に移動されます。一つは、イメージングsを実行することができますスライスの品質をチェックして、解剖学的に一次体性感覚野を見つけるためystem。その後、スライスはカスタムメイド弦楽器プラチナリングで固定されています。記録のために意図された脳の領域の上にアンカーをかけないように注意してください。
4。全細胞パッチクランプ記録
- ガラス電極(4-6MΩの抵抗)が細胞標識および形態学的同定には0.1%のビオシチンを含む内部溶液を引っ張られ、満たされている。
- パッチ記録を実行するには、細胞が60倍対物レンズで可視化する。抑制性細胞型が最初に同定され、蛍光/ DICオリンパス顕微鏡下でGFP発現の可視化に基づいて選択され;録音が続いて赤外線DICのビデオ監視によって助け視覚制御下で実行される。標的細胞に電極を接近しながら、DICと蛍光灯モードの切り替えの数回は、GFPセルの位置を確認する必要があることに注意してください。
- は従来のパッチクランプ技術が適用されます。電極は正圧で満たされており、標的細胞膜時に識別可能なディンプルを確立するために近い細胞表面へ移動し、その後負圧が素早くギガシールを形成し、ビデオモニタに注入電流応答を監視しながら慣らすには適用されます。
- で破壊すると、DICと蛍光モード下60Xにあるセルの画像が上のオンライン検証のために取られています。光刺激データの収集前に、電流パルスを過分極と脱分極は、各セルの基本的な電気生理学的特性を調べるために注入される。
- 一度安定した全細胞記録は良いアクセス抵抗(通常MΩ<20)で達成されており、顕微鏡の対物レンズは60倍からレーザ走査光刺激が4xに切り替えられます。 4倍速でのスライス画像が取得され、光刺激のサイトを案内して登録するために使用されます。
5。レーザーSCAnning光刺激
- 光刺激やデータ収集パラメータが山なりの投球のコンフィギュレーションスイッチモジュールを活性化することによって設定されます。通常、1秒の刺激間隔と1ミリ秒レーザー(20 mW)を光刺激マッピングに使用されます。 10kHzでサンプリングされた1秒のデータ·トレースが取得される。
- 4xのスライス画像は山なりの投球のマッパーモジュールにロードされます。細胞体の位置が定義されており、16×16のパターン(80μmの×80μmの間隔)の光刺激部位は、すべての皮質層をカバーし、セルの位置の周りに設定されています。
- 記録されたニューロンの励起プロファイルは電流クランプモードでの光刺激に応答して、スパイクの位置を調べることによってマップされています。上のラインの表示機能を備えた当社のユーザーフレンドリーなソフトウェアは、マッピング実験を容易にします。
- レーザーは異なるで走査しながら、ローカル興奮回路接続は記録細胞から興奮性シナプス後電流(EPSC)の検出によってマッピングされ場所。セルは内側興奮電流を検出する電圧クランプモードで-70 mVで開催されます。 EPSCマップは光刺激パターンの回転で2〜3回繰り返しまたは反転されています。
- オプション:ローカル抑制回路の接続にも外側に抑制電流を検出する電圧クランプモードで0に近いmVで開催された記録された細胞からの抑制性シナプス後電流(IPSC)の検出によってマップすることができます。 IPSCのマッピングのためのセシウムに置き換えカリウムと電極内部液を使用するのが最適であることに注意してください。
- 全ての生理学的アッセイが完了した後、電極を優しく記録されたセルから削除されます。脳切片を取り出し、一晩4%パラホルムアルデヒド中で固定されています。記録された細胞は、ビオシチンに対して染色されている。細胞形態はまた、各記録セルは確かに当初目標GFP発現介在ニューロンであることを確認または共焦点落射蛍光顕微鏡で検査されています。
6。 Photostimulatイオンデータ解析
今回開発した方法論とソフトウェア実装11は生データマップで光刺激誘発シナプス事象の検出および測定に適用されます。図2に例示するように、色分けされたマップが記録されたニューロンへのシナプス入力のパターンを説明するために構築されています。
7。代表的な結果:
電気生理学的記録と光刺激マッピングの結果の例を図2に示します。特定の抑制性細胞の種類の対象と録音が知られている抑制性の細胞種でGFPを発現するトランスジェニックマウスを用いて実現されています。抑制性介在ニューロンの多様性を考えると、GFP発現の分析は、本質的な電気生理学的および形態学的特徴(図2A)は最終的な細胞タイプの分類に到着するように結合されます。図2B-Cは、レーザ走査光刺激がローカルcorticの広範なマッピングを可能にすることを示して単一の抑制性ニューロンへアル回路接続。生データマップを図2Cに示されている。直接アンケージング応答はデータ解析(図2C)から除外されます。定量的な入力マップは、色分けされた図2D-Fに示されている。例速いスパイク抑制性介在層4は、より深い層から強い興奮性シナプス入力(EPSCS)を受け取った。定義された皮質経路と細胞のシナプス入力の組織を関連付けることにより、我々は、大脳皮質の情報処理でその役割の可能性(例えば、フィードバックとフィードフォワード抑制)を推測することができます。
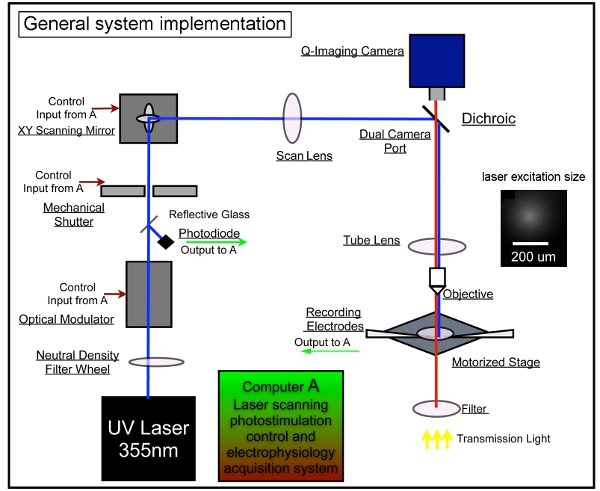
図1。レーザ走査型光刺激のための一般的なシステムの計装。当社の全体的なシステムは、光刺激制御、ビデオイメージング、電気生理学的記録システムから構成されています。我々は以前に7,17を説明LSPは、システムの設計を採用しました。レーザーユニットは、355nmの紫外·ラスを生成するために使用されグルタミン酸アンケージングのためのER。レーザービームは、我々のシステムの光路を通って導かれる。レーザーが点滅し、短い期間(例えば、1から3ミリ)は電気光学変調器(すなわち、ポッケルスセル)と、メカニカルシャッタを使用することによって制御されます。レーザービームパワーは中性密度勾配ホイールで変調され、フォトダイオードへのカバーガラスのレーザ光のごく一部を流用して監視されています。レーザスキャニングシステムは、スキャンミラー、走査レンズ、チューブレンズ、対物レンズのXYのペアが含まれています。ミラーはスキャンレンズを通してレーザービームを実現してから、ビームは、ダイクロイックミラーを介して顕微鏡に入り、カスタムメイドのUV透過チューブレンズにより集光される。ビームは軸方向の解像度を減らすことによって、可能な限り二次元のようなマッピングを維持し、より円柱状(円錐形としてではなく)照射ビームを提供するために、顕微鏡の対物レンズの背面開口部をアンダーフィル。 4xの目的の下で、レーザビームはアンケージングスポット、各approximatiを形成ngの焦点面(挿入を参照)で横方向に153μmの幅を持つガウス分布。ミラーと客観の背面開口部は、対物レンズ焦点面に異なるスキャン位置にミラー位置を翻訳し、共役平面にあるように、様々なレーザー刺激の位置は、ガルバノメータ駆動型XY走査ミラーによって達成することができます。アンケージング中に、フィールド全体を覆っているパターン化されたサイトの数が可変は最近刺激を受けた部位の近傍を再訪避けるためnonraster、非ランダムシーケンスで順次刺激される。詳細情報については、Xu ら (2010)を参照してください。
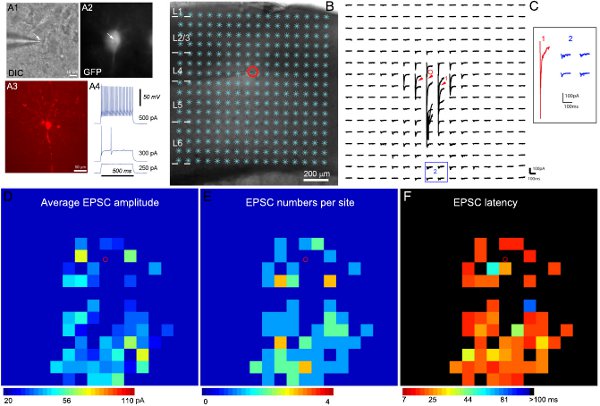
図2。マウス一次感覚皮質の層4におけるGFP発現速いスパイク介在ニューロンへの興奮性局所回路の接続をマッピングし 、A1、A2は60倍で、標的細胞のDICとGFP蛍光の画像を表示生きている脳切片における客観的、A3はポスト記録、固定スライス内ビオシチン染色により明らかになった細胞形態を示している。 A4は異なる強度のintrasomatic電流注入に応答して、速いスパイク抑制性介在ニューロンの特性、記録されたGFPの細胞の発火パターンを示しています。 B 16×16光刺激のサイト(*)が重畳されたスライス画像を表示します。セルの位置は、小さな赤い丸で示されます。 Cは、細胞を内側に興奮性電流を検出するために-70 mVに保持しながら、Bに示すように、刺激の場所から光刺激誘発応答トレースの配列を示しています。光刺激応答の異なる形式が拡張され、別々に挿入に示されている1と2の位置でトレースで示されている。トレース1は、細胞体と樹状突起上promximalアンケージンググルタミン酸に直接応答の例(赤い矢印で示されている)です。 2の他のトレースは、興奮性シナプスでの典型的な例です応答(青)をつけて下さい。ダイレクトレスポンスとシナプス入力は、振幅と応答待ち時間によって区別することができる。生データは、Cでそれぞれの平均入力振幅を示したマップは、D、E、Fは、それぞれ、平均EPSC振幅、EPSC番号、サイトごとに最初に検出されたEPSC待ち時間の色分けされたマップ(16×16サイト)です刺激部位は、同じサイトの光刺激応答から減算基線自発的な応答で、分析ウィンドウ内EPSCSの平均振幅である。 EPSCSとサイトごとに最初に検出されたEPSCの到着時間や待ち時間の数も測定してプロットされます。詳細については、(Shi ら 、2010)を参照してください。
ディスカッション
光刺激ベースのマッピング技術が効果的に皮質の回路を解析するために適用されています。多くの異なる場所でのシナプス前ニューロンのクラスターの光刺激によるシナプス後ニューロンからの同時記録が興奮の空間分布の定量的尺度を提供するため、全細胞記録と組み合わせるレーザ走査光刺激は、単一のニューロンへのシナプス前の入力ソースの層分布の高分解能マッピングが可能また?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は彼らの技術支援のためのトランHuynhとアンドリューサンアントニオ、ジェリー·リンに感謝します。この作品は、XXに健康助成DA023700とDA023700-04S1の国立研究所によって資金を供給された
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| トランスジェニックマウス系統 | ジャクソンラボや他の情報源 | Xuさんとキャロウェイ(2009)を参照してください | |
| GFPのゴーグル | BLS(株)、ハンガリー | ||
| ビブラトーム | ライカシステムズ | VT1200S | |
| MNIケージドグルタミン酸(4 - メトキシ-7 - nitroindolinyl-ケージL-グルタミン酸) | バイオサイエンスTocris、エリスビル、ミズーリ | カタログ番号1490 | |
| ビオシチン | B4261 | ||
| 電極プラー | サッター楽器、ノヴァト、カリフォルニア | P-97 | |
| 電極を作るためのガラス管 | BF150-86から10 | ||
| 700BアンプをMulticlamp | Molecular Devices社、カリフォルニア州サニーベール | Multiclamp 700B | |
| デジタルCCDカメラ | Q-イメージング、オースティン、テキサス州 | Retiga 2000 | |
| リサーチ顕微鏡 | オリンパス、東京、日本 | BW51X | |
| UVレーザユニット | DPSSレーザー、カリフォルニア州サンタクララ | モデル3501 | |
| レーザー走査phostimulation他の機器 | Xu らを参照してください。(2010) |
ソリューション:
- スクロース含有スライス切断用人工脳脊髄液(ACSF)(mMで:85のNaCl、75スクロース、2.5のKCl、25グルコース、1.25のNaH 2 PO 4、4のMgCl 2、0.5 CaCl 2、および24のNaHCO 3)。
- 記録ACSF(mMで:126のNaCl、2.5 KClを、26のNaHCO 3、2のCaCl 2、2のMgCl 2、1.25のNaH 2 PO 4、10グルコース)
- 電極内部液(mMで:126 K-グルコン酸、4のKCl、10mMのHEPES、4 ATP-Mgの、0.3 GTP-Na、および10クレアチンリン酸、pHは7.2、300 mOsm)。
参考文献
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved