需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
钙调蛋白结合蛋白的下拉
摘要
钙调蛋白(CAM)下拉实验调查与各种蛋白质的CaM的相互作用的有效途径。此方法使用效率和具体分析CaM结合蛋白钙调素琼脂糖珠。这提供了一个重要的工具,探索细胞功能的CAM信号。
摘要
钙( 钙离子)离子通过多种机制调节细胞功能的重要。大部分的Ca 2 +信号是通过介导的钙结合蛋白称为钙调蛋白(CAM) 1,2。 CAM是涉及多层次的,在几乎所有的细胞过程,包括细胞凋亡,代谢,平滑肌收缩,突触可塑性,神经生长,炎症和免疫反应。的蛋白质,帮助调节与CAM的互动关系,通过这些途径。许多这些相互作用依赖于CaM的构象,这是明显不同的CA 2 +(的Ca 2 + - CAM)作为反对它的Ca 2 +自由状态(ApoCaM)3时,势必。
虽然大多数靶蛋白结合的Ca 2 + - CAM,某些蛋白质只能绑定到ApoCaM。有的通过他们的智商域绑定CAM,包括neuromodulin的NG(NG)5,4,和一定的肌球蛋白8,和肌肉的收缩9发挥的重要作用。他们的结合能力,并释放钙的缺乏或存在的 CAM +是在其功能的关键。相比之下,许多蛋白质结合的Ca 2 + - CAM,并要求其激活这个约束力。例子包括肌球蛋白轻链激酶10的Ca 2 + / CaM依赖的蛋白激酶(CaMKs)11和磷酸酶(如钙调磷酸酶)12,和血影蛋白激酶13,其中有各种直接和下游的影响14。
这些蛋白质对细胞功能的影响往往依赖于自己的能力结合到CAM中的Ca 2 +依赖性。例如,我们测试的NG - CAM约束力的突触功能的相关性和不同的基因突变如何影响这个约束力。我们生成一个GFP标记的吴CON结构与特定的突变,在IQ域会改变伍CAM中的Ca 2 +依赖性的结合能力。这些不同的基因突变的研究给了我们很大的启示,为参与突触功能的8,15的重要进程。然而,在这些研究中,它是必不可少的证明突变的蛋白质有约束力凸轮预期改变。
在这里,我们目前为检测蛋白质的能力绑定到CAM的Ca 2 +的存在或缺乏,作为例子使用CaMKII和NG方法。这种方法是一种亲和层析的形式简称为CAM的下拉检测。它使用的CaM -琼脂糖珠测试蛋白质结合CAM与此绑定的Ca 2 +的影响。这是相当多的时间效率和需要较少的蛋白质相柱层析及其他实验。总之,这提供了一个宝贵的工具,以探索的Ca 2 + / CaM的信号和蛋白质,在teract与CAM。
研究方案
一个过程的开始与匀浆的基本原理,请参考图1。估计,从细胞中提取的准备钙调素结合蛋白洗脱的时间是6至7小时。
1。组织编制
- 注入病毒包含利益的重组蛋白(在这个例子中,绿色荧光蛋白(GFP)标记伍),并允许组织一夜之间表达蛋白表达质粒器官海马。
- 病毒注射后约12至18小时(取决于病毒表达时间),准备收集组织。加入1ml清扫缓冲区(10MM葡萄糖,4mm的氯化钾,碳酸氢钠26MM,233mM蔗糖,2 5毫米氯化镁,1毫米氯化钙2,和0.1%酚红,供气5%CO 2 95%,O 2的)培养皿。培养组织/插入转移到培养皿中,加入2ml夹层缓冲插入淹没组织。
- 收集吨器官海马组织(5至10片)轻轻刮组织免费使用手术刀插入膜。特别是消除利益的特定区域(如CA1区)也是一种选择。暂停组织转移到1.5ml离心管中,用一个倒置的巴斯德吸管。
- 1500 RCF 1分钟离心样品分开组织解剖缓冲区。小心取出上清液吸。确保不扰乱沉淀。
- 用于每个切片,加30至60μL同质化的缓冲区(氯化钠150MM,20MM三pH值7.5,1mm的数码地面电视,1μg/mL亮肽素,1μg/mLchemostatin,1μg/mLantipain,1μg/mL胃酶抑素及1%TRITON X -100)组织和同质化彻底与杵。
- 为了去除细胞碎片,离心10分钟在1100 RCF其余匀浆和吸小心取出上清液,同时避免颗粒污染。
- 以10%作为输入的样品(样品1)上清。储存期间准备在第3步使用凸轮琼脂糖珠上冰的剩余上清。
注:这里所用的组织器官的海马。然而,人们可以使用分离的神经元或任何其他的细胞培养系统。在这种情况下,以适当的方式收集您的组织后,开始在步骤1.4。
2。下拉珠的制备
在处理珠,重要的是要打捞珠的反应效率,最大限度地防止干燥管双方的珠。要做到这一点,最好是旋转你管,就在自己身边,让解决方案,以湿管的墙壁上的珠子,立即离心前。
- 对于每个上拉下来,加入400μL悬浮的钙调蛋白琼脂糖凝胶珠成2 ml离心管具有相对FLAT -底部,最大限度地在您的孵化珠您的解决方案的比表面积和互动。
- 30秒21,000 RCF离心珠,小心取出上清液吸。确保不打扰珠。
- 洗珠,添加100μL含有2个毫米氯化钙2正在使用下拉的Ca 2 + - CAM为珠蛋白和2毫米EDTA(已知的Ca 2 +螯合剂)拉低各自的同质化缓冲区ApoCaM约束力的蛋白质。 1500 RCF 1分钟,轻轻拍打管重悬珠和离心机。小心取出吸上清,确保不打扰珠。
注:对于所有的愿望步骤,建议使用吸头,拥有良好的开放(如凝胶加载提示)允许不拆除的解决方案,消除珠。
3。 CAM -琼脂糖结合的蛋白质
- 拆分成两个同等体积的条件下上清液。根据你的病情,添加适量的氯化钙或EDTA您上清2毫米为每个浓度。
- 从步骤1.7中添加的上清液洗净,在相应的同质化缓冲区的珠子。轻轻拍打管组合。
- 在4 ° C孵育3小时在摇床样品。重新暂停珠每30分钟左右,以增加有约束力的效率。
- 含3分钟1500 RCF离心管样品和珠子。
- 未结合的蛋白质样品(样品2)取上清液50μL,并仔细清除愿望和丢弃剩余的上清。
- 洗珠如在步骤2.3中使用各自的同质化液100μL中所述的三倍。
4。洗脱
- 加入50μL洗脱缓冲液(50毫米的Tris - HCl pH值为7.5,和150mm氯化钠)含有相反的条件(10MM彗星ACL 2或10mm EDTA)珠。例如,样品匀浆和约束缓冲含Ca 2 +被洗脱洗脱含有EDTA反之亦然的缓冲。
可选:升温洗脱缓冲至37 ° C之前加入珠,可提高产量。
- 孵育珠在室温下在摇床30分钟的解决方案。混合轻轻拍打约每5分钟管珠。
- 3分钟,在1500 RCF离心珠和愿望结合蛋白(样品3)小心取出上清液50μL。确保不打扰珠。
- 所有样品(即匀浆,束缚和结合蛋白,以及那些仍然绑定到珠)加入蛋白上样缓冲液。
注:为了最大限度洗脱(尤其是在效率低下的洗脱的情况下),添加相应的洗脱缓冲液50μL(例如加入EDTA含BUFFER来约束氯化钙2)加热前的样本,以帮助洗脱任何剩余的结合蛋白和4.3中描述的重复步骤,以消除剩余的结合蛋白的珠子珠。
5。 SDS - PAGE和免疫印迹
进行SDS - PAGE和分析你的兴趣和探针蛋白探测已知绑定在相反的条件作为阳性对照CAM一种蛋白质,用Western blot。
6。代表性的成果
图2B显示一个凸轮下拉检测测试的GFP标记的吴CAM约束力相比,内源性吴的例子。要做到这一点,在我们的器官海马过度表达GFP - NG隔夜和组织匀浆。匀浆孵育与CAM -琼脂糖珠在任的Ca 2 +或EDTA存在。匀浆输入显示,除了内源性吴和Ca 2 + / CaM依赖的蛋白激酶Ⅱ表达GFP - NG(CaMKII)。正如预期的基础上已知的具有约束力的内源性NG(图2a所示),GFP标记吴洗脱的Ca 2 +(EDTA的结合蛋白)的情况下存在的Ca 2 +绑定(图2B) 。相比之下,控制,CaMKII,洗脱的Ca 2 +结合蛋白的存在,并在其缺席(EDTA)的未绑定。这表明,凸轮珠的正常运行和洗脱是有效率的。最重要的,这表明,GFP - NG ApoCaM内源性的形式以类似的方式结合,这表明绿色荧光蛋白标记并没有改变我们的重组蛋白的功能。
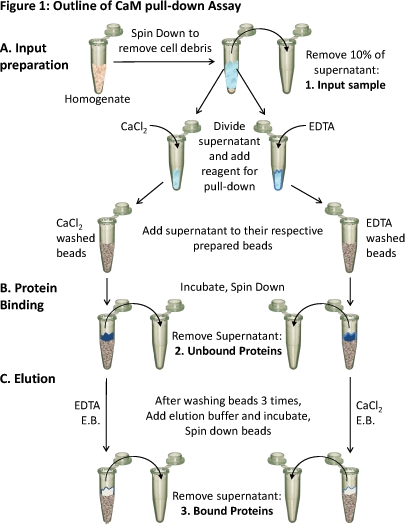
图1。CAM下拉试验大纲
(一)组织匀浆降速去除细胞碎片。约10%的上清液作为输入(1)样本。为不同的平分剩余的上清被添加到测试在这些条件的约束条件和适当的试剂(氯化钙或EDTA) 。每个上清(含要么氯化钙或EDTA)装上分别编写的CaM - Sepharose树脂和(二)培养允许绑定。未绑定的蛋白质被删除(2),(三)结合蛋白(3)使用洗脱缓冲液(EB)载有约束力相反的条件珠的洗脱。使用SDS - PAGE和Western blot分析,可以分析这三种蛋白质样品的蛋白质组成。
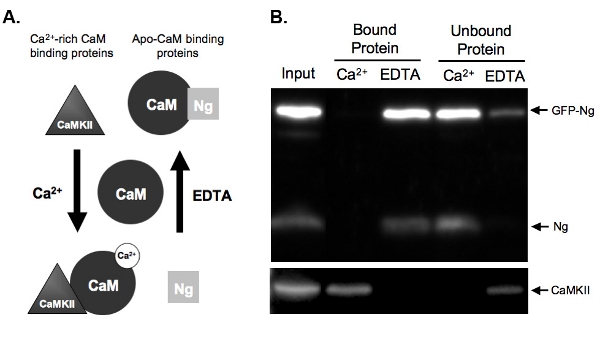
图2。A.)原理的Ca 2 +依赖的CAM约束力和洗脱下拉检测的例子是两种类型的蛋白质结合在CA 2 CAM +依赖性。神经颗粒素(NG)表示,绑定的apo - CaM和CaMKII代表绑定的Ca 2 +丰富的蛋白质,蛋白质CAM。 CAM是在其分离状态,孵化前的匀浆蛋白。一旦培养高的Ca 2 +浓度(2毫米)的条件下,或存在的CA 2 +螯合剂EDTA(2毫米),蛋白质将绑定到CAM相应。吴在EDTA条件结合CAM,因为几乎没有CA +目前,将洗脱的Ca 2 +的存在凸轮琼脂糖珠。 CaMKII,但是,将绑定到CAM中存在高含量的Ca 2 +,将游离的Ca 2 +螯合后。
B)例如CAM下拉检测结果。这个数字表明,预计最终结果的CAM -琼脂糖拉吴和CaMKII探测与样品。内源性吴和GFP - NG是目前在EDTA存在必然凸轮的蛋白质车道。没有吴是必然样品时,培养与CAM的Ca 2 +的存在,这表明了N克只绑定APO - CAM。另一方面,我们积极的控制,CaMKII,只约束中存在的 Ca 2 CAM + 。
讨论
提供的协议利用CaM的琼脂糖珠调查的Ca 2 +依赖CaM结合蛋白。许多蛋白质结合CAM中的Ca 2 +依赖性。这些相互作用CaM结合蛋白的数量和他们的许多信号通路中的关键作用给予高度重视。在这个协议中,CAM - Sepharose树脂用于组织匀浆中的Ca 2 +的存在或缺乏独立于CaM结合蛋白。这个简单的方法的结果将进一步了解蛋白质如何与CAM中的Ca 2 +依赖的方式进行交互。这种方?...
披露声明
没有利益冲突的声明。
致谢
作者想感谢她的帮助下,在优化这个协议蒂芙尼樱桃。这项工作是由国家衰老研究所(AG032320)以及推进健康威斯康星州。
材料
| 产品 | 公司 | 目录编号 | 注释 |
| 钙调蛋白的琼脂糖珠 | GE医疗集团 | 17-0529-01 | |
| 反CamKII阿尔法 | Sigma - Aldrich公司 | C6974 | |
| 抗- NG含量 | Millipore公司 | 07-425 | |
| 凝胶载入中吸取技巧 | 费舍尔 | 02-707-138 | 使用上清愿望 |
| 离心管(2.0毫升) | 费舍尔 | 05-408-146 | 使用所有涉及钙调蛋白的琼脂糖珠的步骤 |
参考文献
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。